多巴胺纳米材料在调控巨噬细胞极化上的应用的制作方法
1.本发明属于纳米医学领域,涉及一种多巴胺纳米材料在调控巨噬细胞极化上的应用。
背景技术:
2.肿瘤相关巨噬细胞(tumor-associated macrophages,tams)是肿瘤微环境中最多的免疫细胞,约占肿瘤间质免疫细胞总数的50%以上,是浸润在肿瘤组织中的巨噬细胞,是影响肿瘤进展、转移和复发的关键因素之一,诱导t细胞功能失调,在恶性肿瘤的发生发展、侵袭转移、免疫逃逸及其血管和淋巴管生成等过程中发挥重要作用。
3.根据其分子表型与功能特征,活化的巨噬细胞可分成m1型巨噬细胞和m2型巨噬细胞两大类型。m1型巨噬细胞能分泌产生il-1、tnf-α、il-6、ifn-γ及inos等多种促炎因子,抵御病原体入侵,保持抗原呈递能力,是一种监视肿瘤病变功能、参与th1型免疫应答的巨噬细胞。但当肿瘤微环境中存在il-13、il-4或tgf-β等因子时,会诱导m1型巨噬细胞向m2型分化。m2型巨噬细胞通过分泌表皮细胞生长因子、趋化因子等促进肿瘤细胞生长,限制免疫反应、诱导血管生成和组织修复方面起着关键作用,参与肿瘤免疫逃逸,加剧了免疫抑制微环境的形成。这两类巨噬细胞可因组织微环境的改变而相互转化。因此,逆转m1向m2型巨噬细胞转化,提高m1/m2型巨噬细胞比例,有利于改善肿瘤免疫抑制微环境,促进免疫细胞对肿瘤的识别,提高免疫治疗及联合治疗疗效,具有重要的意义。
4.目前,针对tams极化转变的研究已取得了重大进展。单核细胞在集落刺激因子诱导下可发育成m2型巨噬细胞;应用干扰素ifn-γ和脂多糖lps可诱导m1型巨噬细胞高表达;m1型巨噬细胞通过抑制nf-κb细胞通路逆转m2型巨噬细胞进而诱导肿瘤上皮间质转化;胸腺肽α-1可通过参与调控巨噬细胞迅速识别和清除凋亡细胞,促使m2型转变为m1型,从而增强抗癌疗效。然而这些调控因子或药物作用局限,没有肿瘤靶向性,无法实现可视化;为了提高疗效,反复多次给药会增加机体系统毒性,影响其进一步应用。
5.到目前为止尚无多巴胺纳米材料在调控tams极化的研究及应用的相关文献报道。
技术实现要素:
6.发明目的:本发明所要解决的技术问题是针对现有技术的不足,提供多巴胺纳米材料在调控巨噬细胞极化上的应用。
7.为了解决上述技术问题,本发明公开了多巴胺纳米材料在调控巨噬细胞极化上的应用,其中,所述多巴胺纳米材料调控巨噬细胞极化、提高m1/m2巨噬细胞比例;所述多巴胺纳米材料通过如下方法制备得到:
8.(1)将1.0-2.0g的表面活性剂f127和0.5-1g的盐酸多巴胺溶解于100-200ml的水和无水乙醇的混合液中,水和无水乙醇的体积比为1:1;室温搅拌,待混合液澄清,将2-4ml的三甲苯加入到搅拌的混合液中,低速搅拌30-40min,形成乳白色纳米溶液,随后5-10ml的氨水加入到混合液中,诱导多巴胺聚合并继续搅拌30-60min,形成树突状多巴胺纳米材料;
9.(2)用10-20ml无水乙醇洗涤聚合物,洗涤3-4次,离心,去除上清液,留黑色沉淀,用5-10ml无水乙醇溶解沉淀,将沉淀溶液在60-80℃下水浴萃取,搅拌条件为500-600转/min,每次萃取时间为3-5个小时,萃取结束后离心,萃取结束即留沉淀,无水乙醇溶解沉淀,重复萃取步骤,共萃取、离心若干次,得到多巴胺纳米材料(polydopamine nanoparticles,pda)储备液。
10.优选地,步骤(1)中,室温搅拌的搅拌条件为:1100-1200转/min,低速搅拌的条件为500-600转/min。
11.步骤(1)中,氨水加入到混合液中的滴速为65-75滴/min。
12.步骤(2)中,洗涤后离心条件为14000-15000rpm,时间为20-30min。
13.步骤(2)中,萃取结束后离心条件为14000-15000rpm,离心20-30min。
14.有益效果:与现有技术相比,本技术具有如下优点:
15.(1)现有技术仅可调节巨噬细胞极化,若联合其他治疗方式,需反复、多次给予其他药物配合治疗,增加了多药带来的潜在风险或耐药性,本发明的技术是依靠材料本身即可逆转巨噬细胞极化,可同时实现光热治疗。因纳米材料的表面特性可装载其他药物,实现一次性给药及多模态联合治疗;
16.(2)现有技术使用的免疫调控药物没有肿瘤靶向性,而纳米材料具有在肿瘤部位的高选择通透性和滞留效应,使得纳米材料及其负载的药物具有被动靶向肿瘤的作用。
17.(3)现有技术不具有可视化功能,本发明的多巴胺纳米材料具有磁共振成像和光声成像的特性,可以同时实现治疗过程中的可视化监测。
附图说明
18.图1为实施例1制备的多巴胺纳米材料(polydopamine nanoparticles,pda),图1为pda的透射电镜照片(左)及在(模拟)肿瘤酸性条件下(ph 6.0 pbs中)pda降解的透射电镜照片(右);
19.图2为pda体外磁共振成像和光声成像结果图;
20.图3为pda体内靶向肿瘤、磁共振成像和光声成像结果图;
21.图4为高效液相色谱仪检测pda降解成分结果;
22.图5为pda对巨噬细胞raw264.7极性影响的pcr结果;
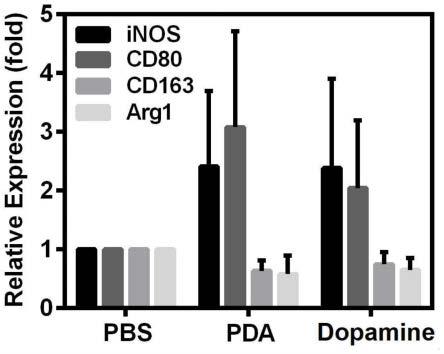
23.图6为本发明在实施工艺条件下制得的pda孵育巨噬细胞raw264.7,提取细胞总蛋白,进行western blot检测的结果图;
24.图7 western blot各条带的灰度值的结果图。
具体实施方式
25.下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述和/或其他方面的优点将会变得更加清楚。
26.实施例1多巴胺纳米材料(polydopamine nanoparticles,pda)的制备。
27.将1.0g的表面活性剂f127和0.5g的盐酸多巴胺溶解于100ml的水和无水乙醇的混合液中,水和无水乙醇的体积比为1:1。室温用力搅拌至澄清溶液,搅拌条件为1200转/min。将2ml的三甲苯加入到搅拌后的混合液中,低速搅拌30分钟,搅拌条件为500转/min,形成肉
眼可见的乳白色纳米溶液;随后5ml的氨水(28wt%-30wt%)在10s内逐滴加入到乳白色纳米溶液中,诱导多巴胺聚合,继续搅拌30分钟,形成树突状聚多巴胺纳米球聚合物。用10ml无水乙醇洗涤聚合物,洗涤三次,洗涤条件离心14000rpm,时间是20分钟。去除上清液,留黑色沉淀,用5ml无水乙醇溶解沉淀。将沉淀溶液在60℃下水浴萃取,搅拌条件为500转/min,每次萃取时间为3个小时,萃取结束即14000rpm离心20分钟,留沉淀,无水乙醇溶解沉淀,重复萃取步骤。共萃取、离心3次,得到用无水乙醇溶解的多巴胺纳米材料pda储备液,经过测算浓度为4mg/ml。图1为制备的pda的透射电镜照片,从电镜图片上可以提示pda粒径在80nm左右(图标100nm),具有良好的分散性和均一的尺寸。将合成的pda置于ph 6.0pbs(模拟肿瘤酸性微环境)溶液下搅拌24-48小时,搅拌结束后对其进行透射电镜拍摄,发现pda发生了降解,因此多巴胺纳米材料具有可降解性。
28.实施例2 pda具有靶向肿瘤、进行磁共振成像和光声成像的作用。
29.我们将pda材料配成1mg/ml的溶液,将其装满置于2ml的小离心管中,水为正常对照组。将样品分别进行磁共振和光声成像,材料组与正常组对比显示出高信号,证实材料具有双模态成像特性(图2)。
30.进一步培养乳腺癌4t1细胞,建立乳腺癌皮下瘤动物模型。将100μl pda(4mg/ml)溶液尾静脉注射入荷瘤小鼠体内,并在不同时间点对肿瘤进行磁共振和光声成像。随着时间的延长,材料逐渐在肿瘤处富集,信号强度逐渐增强,并在尾静脉注射6小时后达到高峰。进一步证实pda能够通过被动靶向运输作用到达肿瘤,且能同时进行磁共振和光声成像(图3)。
31.(1)pda用于体外磁共振成像(magnetic resonance imaging,mri)及光声成像(photoacoustic imaging,pai)
32.将1ml(1mg/ml)的pda溶液放入2ml的试管中,水为正常对照,分别用7.0t微型mri仪和多光谱光声层析成像系统在808nm波长下进行扫描并拍摄图像。
33.(2)乳腺癌细胞培养
34.三阴性乳腺癌细胞4t1细胞(american type culture collection,atcc)在含有1%青霉素/链霉素和10%胎牛血清的培养基中培养,胰酶消化4-5min,传代比率是1:3,细胞放置在37℃的5%co2细胞培养箱中培养。
35.(3)乳腺癌皮下瘤动物模型构建
36.取6周龄的雌性小白鼠,在白鼠右侧皮下注射约5
×
106个三阴性乳腺癌细胞4t1,建立三阴性乳腺癌皮下瘤动物模型。待肿瘤大小约为100mm3后,将白鼠随机分组。
37.(4)体内磁共振及光声成像
38.在建立上述乳腺癌肿瘤动物模型后,选择6只荷瘤小鼠,每只小鼠尾静脉注射100μl 4mg/ml的pda。在尾静脉注射0、2、4、6、8及12小时后,分别用7.0t mri和多光谱光声断层成像系统对小鼠肿瘤进行mri和pai。利用相应成像软件对每只小鼠的成像信号进行捕获和分析,拍摄磁共振成像或光声成像图片。
39.实施例3 pda在调控巨噬细胞极化上的应用。
40.我们进一步将纳米材料降解后的溶液进行高效液相色谱分析,经过成分比对和多巴胺标准曲线定量检测,发现pda纳米材料降解后有多巴胺成分释放,进一步证实材料具有良好的降解性,且降解成分含有多巴胺(图4)。
41.已有文献报到研究,多巴胺可通过抑制pka/p38信号通路的激活,进而阻断m2型巨噬细胞极化,降低tams的促瘤炎症特性。因此我们将pda及单纯多巴胺孵育巨噬细胞,检测其在基因及蛋白水平对巨噬细胞极化的影响。
42.(1)细胞培养
43.巨噬细胞raw264.7(中国科学院细胞库,目录号scsp-5036)在含有1%青霉素/链霉素和10%胎牛血清的dmem培养基中分裂生长,待细胞汇合度达到90%以上,用刮刀或外力吹打处理消化,避免胰酶消化造成的不良影响,传代比率是1:2,并放置在37℃、5%的co2的细胞培养箱中培养。
44.(2)pcr检测
45.为观察巨噬细胞raw264.7经过pda处理后目标基因的表达,将raw264.7细胞培养在6孔板中,待细胞汇合度达到70%-80%后,添加30-50μg/ml浓度的pda及单纯多巴胺,正常对照组不添加材料。
46.吸出每个孔中的培养基,加入1-2ml预冷的pbs,洗涤后移除pbs。每孔加入1-2ml的rna提取液,枪头吹打破碎细胞,并将液体转移到1.5ml离心管中,加入250-300μl三氯甲烷,混匀静置3-5min。4℃条件下,离心10-15min,转速为12000-13000rpm。将上清转移到新的1.5ml离心管中,加入0.8-1倍体积的异丙醇,充分混匀。吸除液体,用1.5-2ml 75%乙醇洗涤沉淀,4℃条件下,离心10-15min,转速为12000-13000rpm。离心留沉淀,并在超净台上吹干3-5min,加入15-20μl的water nuclease-free溶解rna,55℃孵育5-10min。使用nanodrop 2000检测rna浓度及纯度,使rna终浓度为100-500ng/μl。
47.随后进行逆转录,配置20μl反应体系:5
×
reaction buffer(4μl),oligo(dt)18primer(100μm,0.5μl),random hexamer primer(100μm,0.5μl),rt enzyme mix(1μl),total rna(10μl),rnase free water补足体积到20μl。逆转录程序25℃5min,42℃30min,85℃5s。
48.进一步进行定量pcr,将2
×
qpcr mix(7.5μl),2.5μm基因引物(上游+下游,1.5μl)(对应如表1所示),反转录产物(cdna,2.0μl),water nuclease-free(4.0μl)加入到pcr管中。pcr扩增95℃,30s预变性,95℃,15s变性,60℃,30s退火/延伸,重复40个循环,溶解曲线从65℃到95℃,每升温0.5℃,采集一次荧光信号。
49.实时定量pcr检测时根据实验需求设计的引物信息如表1所示:
50.表1
51.引物名称引物序列(5'-3')片段长度(bp)m-gapdh-scctcgtcccgtagacaaaatg133m-gapdh-atgaggtcaatgaaggggtcgt
ꢀꢀꢀꢀ
m-cd80-sgaccctcctgatagcaagaacac163m-cd80-acgaaggtaaggctgttgtttgtt
ꢀꢀꢀꢀ
m-inos(1)-sagctcgggttgaagtggtatg245m-inos(1)-acacagccacattgatctccg
ꢀꢀꢀꢀ
m-arg1(4)-sctggggattggcaaggtgat93m-arg1(4)-acagcccgtcgacatcaaag
ꢀꢀꢀꢀ
m-cd163(3)-saggaaaccaatcccagacacta135m-cd163(3)-acgaccacctccacctaccaa 52.结果处理使用δδct法:a=ct(目的基因,待测样本)-ct(内标基因,待测样本),b=ct(目的基因,对照样本)-ct(内标基因,对照样本),k=a-b,表达倍数=2-k
。
53.图5为pda孵育巨噬细胞raw264.7,提取细胞总rna,进行pcr分析的结果。结果显示相对于pbs对照组,pda处理组inos和cd80均高表达(m1巨噬细胞引物),cd163和arg1均低表达(m2巨噬细胞引物),进一步证明pda可以在基因水平影响巨噬细胞的极性表达变化。
54.(3)western blot检测
55.为观察巨噬细胞raw264.7经过pda处理后目标蛋白的表达,将raw264.7细胞培养在6孔板中,待细胞汇合度达到70%-80%后,添加30-50μg/ml浓度的pda及单纯多巴胺,正常对照组不添加材料。pda与细胞共孵育12-24h后,用刮刀或外力吹打细胞消化2-3min,用pbs洗涤三次,转速为1000-1200rpm,离心3-5min。离心后的细胞沉淀加入100-150μl的细胞裂解液,混匀,在细胞超声仪上将细胞超碎,12000-13000rpm低温离心20-30min取上清。
56.下一步进行蛋白定量,采用bca蛋白定量分析法,按照说明书以标准品牛血清白蛋白为参考做标准曲线,然后将10-20μl待测的细胞样品转移进96孔板,加入150-200μl bca工作液,充分混匀后在37℃培养箱中孵育20-30min。酶标仪测量每个样品在562nm处的吸光值,根据标准品牛血清白蛋白的标准曲线计算待测样品的蛋白浓度。用细胞裂解液调至蛋白浓度一致,并加入总体积1/5的上样缓冲液。将待测样品放置于100℃水浴锅中煮5-10min使蛋白变性。
57.接着进行sds-page电泳,取出一块胶,放置入电泳槽中,加入电泳缓冲液,将煮过的蛋白样品分别上样,并在空白孔里加入2-3μl的蛋白marker,100v恒压电泳30-40min左右。接着进行转膜,将胶取出转印至疏水性聚偏二氟乙烯膜上,低温恒流转膜1.5-2h。转膜结束后,将膜取出并用清洗液洗涤3-4次,每次3-5min,然后浸没于10-15ml含5%脱脂奶粉的缓冲液中室温缓慢震荡,封闭1-2小时。接着用清洗液洗涤3-4次,每次3-5min。洗涤后孵育一抗,抗体用一抗稀释液稀释,抗体为抗inos、cd80、cd163及arg1,稀释1000倍,β-actin设为内参蛋白,稀释1000倍,4℃孵育过夜。
58.次日,将膜取出,清洗液洗涤3-4次,每次3-5min,孵育与辣根过氧化物偶联的二抗,二抗稀释1000倍,室温缓慢震荡1-2小时。二抗孵育结束后,用清洗液洗涤膜3-4次,滴加发光液,用全自动化学发光/荧光图像分析系统进行曝光成像,用imagej软件对免疫反应条带进行定量分析。图6为pda孵育巨噬细胞raw264.7,提取细胞总蛋白的western blot检测结果。结果显示相对于pbs对照组,pda和多巴胺处理组inos和cd80均高表达(m1巨噬细胞标志物),cd163和arg1均低表达(m2巨噬细胞标志物),进一步证明pda可以在蛋白水平影响巨噬细胞的极性表达变化。进一步分析western blot各条带的灰度值,如图7所示,结果与图6一致,pda和多巴胺处理组较之pbs对照组inos和cd80呈高表达,cd163和arg1呈低表达,证实经pda处理刺激后,m1巨噬细胞表达提高,m2巨噬细胞表达降低,pda可逆转m1/m2极性比例。
59.本发明设计的多巴胺纳米材料可提高m1型巨噬细胞表达,抑制m2型巨噬细胞转化,提示在材料合成过程中仍然保留了部分多巴胺的生理功能;另外,多巴胺纳米材料可在肿瘤微环境中解聚,也可以在一定程度上释放多巴胺,发挥其在抑制巨噬细胞极化方面的作用。
60.本发明的研究意义在于利用纳米载体自身特性即可重塑tams极化,逆转肿瘤微环境中m1/m2巨噬细胞比例,改善巨噬细胞功能,提高免疫应答,避免免疫逃逸。此外,纳米载体具有良好的生物相容性和可降解性,可被动靶向肿瘤、同时实现磁共振和光声成像等功能,一药多用,兼具多种功能,有望推广到其他免疫抑制型恶性肿瘤的调控中,实现联合靶向治疗或可视化监控。
61.本发明提供了一种多巴胺纳米材料调控巨噬细胞极化的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1