新型替比培南匹伏酯速释和调释口服剂型的制作方法
新型替比培南匹伏酯速释和调释口服剂型
1.本技术是申请日为2017年12月15日的题为“新型替比培南匹伏酯速释和调释口服剂型”的中国专利申请号201780077794.3的分案申请。
2.相关申请的引证
3.本专利申请要求2016年12月15日提交的美国临时申请no.62/434,643和2016年12月22日提交的美国临时申请no..62/438,071的优先权,这两篇申请据此全文以引用方式并入。
技术领域
4.本公开提供了速释和调释替比培南匹伏酯口服剂型芯和口服剂型。还包括用本公开的速释和调释口服剂型治疗患者的尿路感染的方法。
背景技术:
5.替比培南匹伏酯是替比培南的口服施用的新戊酰氧基甲基前药,一种来自β-内酰胺类抗生素的碳青霉烯亚群的抗生素:
6.替比培南匹伏酯
7.替比培南匹伏酯被开发用于治疗对常用抗感染药物具有获得性抗生素抗性的严重细菌感染。口服施用后,前药的酯键和缩醛键被裂解以释放活性替比培南。
8.虽然前药在胃肠(gi)模拟流体中具有高溶解度,但它在ph 1和ph 9下易于分解并且对氧化条件敏感。
9.因此,需要具有一致且理想的物理和化学性质的稳定替比培南匹伏酯剂型。本公开提供了满足该需求并具有本公开中描述的额外优点的剂型。
技术实现要素:
10.本公开提供了替比培南匹伏酯的速释和调释口服剂型。本公开提供了包含剂型芯的速释和调释固体口服剂型,其中剂型芯包含:替比培南匹伏酯或其可药用盐和赋形剂,所述赋形剂包括粘合剂、润滑剂、任选的稀释剂。
11.本公开提供了速释固体口服替比培南匹伏酯剂型,当通过usp桨法在37℃下在900ml 50mm乙酸盐缓冲液(ph 5.0)中以50rpm测量时,其在15分钟内提供多于85%的替比培南匹伏酯的体外释放。
12.本公开还提供了一种调释固体口服替比培南匹伏酯剂型,当通过usp桨法在37℃
下在900ml 50mm乙酸盐缓冲液(ph 5.0)中以50rpm测量时,其在30分钟后提供nmt(不多于)50%的替比培南匹伏酯的体外释放。在某些实施方案中,当通过usp桨法在37℃下在900ml 50mm乙酸盐缓冲液(ph 5.0)中以50rpm测量时,该调释剂型在4小时后释放nlt(不少于)85%的总替比培南匹伏酯。
13.本公开还提供了一种短调释固体口服替比培南匹伏酯剂型,当通过usp桨法在37℃下在900ml 50mm乙酸盐缓冲液(ph 5.0)中以50rpm测量时,其在30分钟后提供nmt(不多于)50%的替比培南匹伏酯的体外释放。在某些实施方案中,当通过usp桨法在37℃下在900ml 50mm乙酸盐缓冲液(ph 5.0)中以50rpm测量时,该调释剂型在2小时后释放nlt(不少于)85%的总替比培南匹伏酯。
14.本公开还提供了一种治疗患者的细菌感染的方法,该方法包括向患者施用本公开的口服剂型。在某些实施方案中,细菌感染是尿路感染,包括复杂尿路感染。
附图说明
15.通过参考附图详细描述本公开的示例性实施方案,本公开的上述和其他方面和特征将变得更加显而易见,其中:
16.图1示出了500mg速释替比培南匹伏酯未包衣片剂芯在ph 5下的溶出曲线。片剂芯的配方在实施例1中提供。
17.图2示出了500mg替比培南匹伏酯调释未包衣片剂芯在ph 5下的溶出曲线。调释剂型的配方在实施例3中提供。
18.图3示出了500mg肠溶包衣速释片剂在ph 6.8下的溶出曲线。片剂芯的组成在实施例1中提供,并且肠溶包衣的组成在实施例2、表3中提供。
19.图4是浓度(毫克每升,ug/ml)和质量(毫克,mg)对比模拟时间(小时,h)的曲线图。该曲线图是500mg替比培南匹伏酯片剂的人口服(po)剂量的模拟药代动力学曲线。
20.图5是调释替比培南匹伏酯hbr盐(表12a)和调释替比培南匹伏酯游离碱(表7)在ph 5.0下的溶出曲线比较。
21.图6是调释替比培南匹伏酯hbr盐(表12a)和调释替比培南匹伏酯游离碱(表7)在ph 6.8下的溶出曲线比较。
22.图7示出了300mg替比培南匹伏酯速释未包衣片剂芯在ph 5下的溶出曲线。调释剂型的配方在表11b中提供。
23.图8示出了300mg替比培南匹伏酯调释未包衣片剂芯在ph 5下的溶出曲线。调释剂型的配方在表12b中提供。
24.图9示出了300mg替比培南匹伏酯短调释未包衣片剂芯在ph 5下的溶出曲线。调释剂型的配方在表13中提供。
具体实施方式
25.除非本文另外指明,否则所述值范围仅旨在充当单独指出该范围内每个独立值的一种简便方法,并且每个独立值就像在本文中单独引用那样包括在说明书中。所有范围的端点都包括在该范围内并且可单独组合。除非本文另外指明或者与上下文明显矛盾,否则本文所述所有方法都可以按照合适的顺序进行。除非另外说明,否则任何和全部实例或表
示实例的语言(例如,“诸如”)的使用仅仅旨在用于说明,并且不会对本发明的范围构成限制。说明书中的任何语言都不应理解为表示任何不受权利要求书保护的要素是实施本发明所必需的。
26.术语“一个”和“一种”不表示数量的限制,而是表示存在至少一个所引用项。
27.术语“约”与术语“大约”同义使用。如本领域普通技术人员将理解的那样,“约”的确切范围将取决于组合物的组分。举例来讲,术语“约”的使用表示略微超出所引用值(即正或负0.1%至10%)的同样有效且安全的值包括在该值中。因此,略微超出所引用范围的组合物也包括在本发明权利要求的范围内。
28.术语“包括”、“包含”和“含有”是非限制性的。在通过这些过渡短语要求保护的实施方案中可存在其他未列举的要素。在使用“包括”、“包含”或“含有”作为过渡短语的情况下,其他要素也可包括在内并且仍然构成权利要求范围内的实施方案。开放式过渡短语“包括”涵盖中间过渡短语“基本上由...组成”和封闭式短语“由...组成”。
29.术语“速释”是指在口服施用后立即释放活性成分替比培南匹伏酯的固体剂型。
30.术语“调释”是指允许相对于速释制剂释放活性剂的时间在一段更长的时间内释放活性成分替比培南匹伏酯以保持治疗有效的血浆水平的固体口服剂型。调释制剂可以是控释制剂,其表现出基本上零级释放动力学。它也可以是表现出一级动力学的缓释制剂。
[0031]“可药用盐”包括替比培南匹伏酯的衍生物,其中替比培南匹伏酯通过制备其酸或碱加成盐来修饰,并且还指此类化合物和此类盐的可药用溶剂化物(包括水合物)和共晶体。可药用盐的实例包括但不限于碱性残基(例如胺)的无机或有机酸加成盐;酸性残基的碱或有机加成盐等,以及包含一种或多种前述盐的组合。可药用盐包括活性剂替比培南匹伏酯的无毒盐和季铵盐。例如,无毒酸盐包括衍生自无机酸诸如盐酸、氢溴酸、硫酸、氨基磺酸、磷酸、硝酸等的那些;其他可接受的无机盐包括金属盐,诸如钠盐、钾盐、铯盐等;以及碱土金属盐,诸如钙盐、镁盐等,以及包含一种或多种前述盐的组合。可药用有机盐包括由有机酸制备的盐,所述有机酸诸如乙酸、丙酸、琥珀酸、乙醇酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、双羟萘酸、马来酸、羟基马来酸、苯乙酸、谷氨酸、苯甲酸、水杨酸、甲磺酸、乙磺酸、苯磺酸、对氨基苯磺酸、2-乙酰氧基苯甲酸、富马酸、甲苯磺酸、甲磺酸、乙烷二磺酸、草酸、羟乙基磺酸、hooc-(ch2)n-cooh(其中n为0-4)等;有机胺盐,诸如三乙胺盐、吡啶盐、甲基吡啶盐、乙醇胺盐、三乙醇胺盐、二环己胺盐、n,n
’‑
二苄基乙二胺盐等;以及氨基酸盐,诸如精氨酸盐、天冬氨酸盐、谷氨酸盐等;以及包含一种或多种前述盐的组合;有机胺盐,诸如三乙胺盐、吡啶盐、甲基吡啶盐、乙醇胺盐、三乙醇胺盐、二环己胺盐、n,n
’‑
二苄基乙二胺盐等;以及氨基酸盐,诸如精氨酸盐、天冬氨酸盐、谷氨酸盐等;以及包含一种或多种前述盐的组合。所有形式的替比培南匹伏酯都包括在本公开中,包括所有结晶、无定形和多晶型形式。
[0032]
当给予可呈盐形式的替比培南匹伏酯的重量时,该值是指替比培南匹伏酯的量,而不是替比培南匹伏酯的重量。例如,500mg替比培南匹伏酯(其中替比培南匹伏酯是氢溴酸盐)表示存在581.2g替比培南匹伏酯氢溴酸。除非从上下文中明确看出旨在替比培南匹伏酯游离碱或特别指定替比培南匹伏酯游离碱,否则术语“替比培南匹伏酯”包括替比培南匹伏酯游离碱和替比培南匹伏酯的可药用盐,例如替比培南匹伏酯hbr。
[0033]
剂型组成
[0034]
已开发出新的替比培南匹伏酯速释和调释固体剂型。剂型可以是胶囊剂、颗粒剂、片剂芯、粉末,但不限于此。剂型具有包含作为活性成分的替比培南匹伏酯和一种或多种赋形剂的芯。虽然替比培南匹伏酯剂型可含有一系列替比培南匹伏酯,例如100至1,200毫克(mg)或100至600mg替比培南匹伏酯,但例示的是含有100mg、300mg和500mg替比培南匹伏酯的片剂。
[0035]
本公开提供了包含剂型芯的速释或调释固体口服剂型,其中剂型芯包含:替比培南匹伏酯或其可药用盐和赋形剂,所述赋形剂包括粘合剂、润滑剂、任选的稀释剂。芯中替比培南匹伏酯(游离碱形式)与赋形剂的重量与重量比为30:60至60:30,或在一些实施方案中为30:45至45:30,或约50:50,或约30:40。
[0036]
本公开包括替比培南匹伏酯速释和调释口服剂型,例如片剂剂型。
[0037]
本公开的替比培南匹伏酯剂型具有许多期望的性质。例如,某些新调释剂型能保持有效至少6小时,允许比速释形式更低频率施用,并且在一些实施方案中允许每天施用两次。调释替比培南匹伏酯剂型表现出比先前剂型更低的血浆c
max
和更高的血浆c
min
,导致与速释剂型相比,有效浓度的持续时间延长,功效增加,作用持续时间延长。一旦释放,调释剂型提供消化道对替比培南匹伏酯的高吸收。本公开的调释替比培南匹伏酯剂型在口服施用后1至4小时达到血浆c
max
,在某些实施方案中,本公开的调释替比培南匹伏酯剂型在口服施用后2至4小时达到血浆c
max
,并且在其他实施方案中,本公开的调释替比培南匹伏酯剂型在口服施用后1至2.5小时达到血浆c
max
。
[0038]
新速释替比培南匹伏酯剂型可快速溶于水或水溶液中,并且还可以提供消化道对替比培南匹伏酯的高吸收。因此,速释剂型提供药物作用的快速起效和快速治疗有益效果。本公开的速释替比培南匹伏酯剂型在口服施用后0.5-2小时或0.5至1.5小时内达到血浆c
max
。当使用hbr盐时,本公开的速释剂型在不到1.5小时内达到血浆c
max
。
[0039]
速释和调释替比培南匹伏酯剂型在室温下具有至少12个月、优选至少24个月的储存稳定性。
[0040]
速释和调释替比培南匹伏酯剂型具有与100至1000mg替比培南匹伏酯的剂量强度无关的溶出曲线。
[0041]
在某些实施方案中,调释替比培南匹伏酯剂型提供施用后3至8、3至6或3至4小时的体内血浆t
max
。在某些实施方案中,短调释替比培南匹伏酯剂型提供施用后0.5至4、1至3或1至2.5小时的体内血浆t
max
。
[0042]
本公开包括替比培南匹伏酯片剂制剂,其中按重量计片剂的至少30%、至少40%、至少45%、至少50%、至少55%、至少60%或至少65%是替比培南匹伏酯。本公开包括其中替比培南匹伏酯占片剂芯的30重量%至70重量%或40重量%至60重量%并且赋形剂占片剂芯的70重量%至30重量%或60重量%至40重量%的替比培南匹伏酯剂型。在某些实施方案中,替比培南匹伏酯占片剂芯的45重量%至55重量%,并且赋形剂占片剂芯的55重量%至45重量%。在一些其他实施方案中,替比培南匹伏酯占片剂芯的50%,并且赋形剂占片剂芯的50%。在一些实施方案中,替比培南匹伏酯占片剂芯的40%。
[0043]
赋形剂包括但不限于粘合剂、释放控制剂、崩解剂、稀释剂或润滑剂中的一种或多种。赋形剂还可包括助流剂、溶剂、粘度剂、乳化剂、缓冲剂、增量剂、着色剂、味道改善剂、流平剂、吸收剂,但不限于此。
[0044]
本公开包括含有粘合剂的剂量芯和包衣片剂。例如,粘合剂可以是微晶纤维素、硅化微晶纤维素、乙基纤维素、乳糖、淀粉、明胶或前述任意两种的任何组合。粘合剂可以1%至50%或5%至40%,或10%至20%,或15%的量(重量%)存在于片剂芯或包衣片剂中。在某些实施方案中,avicel ph102(一种微晶纤维素)是粘合剂。
[0045]
本公开包括调释口服剂型,其包括含有释放控制剂的剂量芯和包衣片剂。释放控制剂是有助于在所需时间段内递送活性成分的试剂。释放控制剂可以1%至50%或5%至40%,或10%至20%,或15%的量(重量%)存在于片剂芯或包衣片剂中。在某些实施方案中,羟丙基甲基纤维素(hpmc)包括在内作为释放控制剂。k级hpmc产品的甲氧基取代度为1.4,甲氧基含量为约22%,并且羟丙基含量为约8.1%。e级hpmc产品的甲氧基取代度为1.9,甲氧基含量为约29%,并且羟丙基含量为约8.5%。hpmc k4m在本公开的一些调释替比培南匹伏酯剂型中用作释放控制剂。在某些实施方案中,hpmc k4m是羟丙基甲基纤维素,其粒度范围为170至250微米,粘度范围在40℃下为2700至5050cps,或在20℃下的2%水溶液中为约4000mpa
·
s。在本公开的一些实施方案中,hpmc e50 lv和hpmc e3也用作释放控制剂。hpmc e50 lv的粘度在40℃下为35-65cps,在20℃下的2%水溶液中为约50mpa
·
s,并且hpmc e3的粘度在20℃下的2%水溶液中为约3mpa
·
s。在某些实施方案中,诸如2小时调释剂型,合适的释放控制剂是聚乙烯吡咯烷酮,例如pvp k12,其平均分子量为3500-6000并且微溶于水(5%)。其他合适的释放控制剂包括羟丙基甲基纤维素、羟丙基纤维素、醋酸琥珀羟丙甲纤维素、聚乙烯吡咯烷酮和共聚维酮。
[0046]
本公开包括含有稀释剂的剂量芯和包衣片剂。例如,稀释剂可以是淀粉、蔗糖、一水乳糖、甘露醇、山梨醇或前述任意两种的任何组合。稀释剂可以1%至50%或5%至40%,或10%至20%,或15%的量(重量%)存在于片剂芯或包衣片剂中。在一些实施方案中,稀释剂是一水乳糖和甘露醇。
[0047]
本公开包括剂型,其包括含有崩解剂的剂型芯和包衣片剂。例如,崩解剂可以是交联羧甲基纤维素钠、交聚维酮(也称为共聚维酮)、羟基乙酸淀粉钠或者前述任意两种或更多种的任何组合。崩解剂可以1%至50%或5%至40%,或10%至20%,或15%的量(重量%)存在于片剂芯或包衣片剂中。在一些实施方案中,pvpp xl-10(一种交聚维酮)是崩解剂。pvpp xl-10是平均粒度为30μm的交联聚乙烯吡咯烷酮。其他合适的崩解剂包括交联羧甲基纤维素钠、预胶凝淀粉、羟基乙酸淀粉钠、甘露醇、玉米淀粉、马铃薯淀粉、海藻酸和小麦淀粉。
[0048]
本公开包括含有润滑剂的剂量芯和包衣片剂。润滑剂的种类和量不受限制,只要在可药用范围内即可。例如,润滑剂可以是脂肪酸酯、硬脂酸、硬脂酸镁、山嵛酸甘油酯、硬脂酸钙、硬脂酰富马酸钠、月桂基硫酸钠、月桂基硫酸镁、苯甲酸钠、滑石、氢化油、巴西棕榈蜡或者前述任意两种的任何组合。润滑剂可以0.1%至5%、0.1%至2.0%或0.1%至1.0%,或0.25%至0.5%,或0.375%的量(重量%)存在于片剂芯或包衣片剂中。在某些实施方案中,润滑剂是硬脂酸镁。
[0049]
在一个实施方案中,片剂芯可以是调释片剂芯,其包括作为活性成分的替比培南匹伏酯、作为释放控制剂的羟丙基甲基纤维素、作为稀释剂的甘露醇、作为粘合剂的微晶纤维素和作为润滑剂的硬脂酸镁。例如,片剂芯可包含40重量%至60重量%的替比培南匹伏酯、10重量%至30重量%的羟丙基甲基纤维素、10重量%至20重量%的甘露醇、10重量%至
chemical-co.,ltd.)。pharmacoat 603是具有取代类型2910且标记粘度为3mpa-s的羟丙甲纤维素等级,其适合用作膜包衣。opadry商品名用于各种药物包衣,并且包括速释包衣,其主要由hpmc(羟丙基甲基纤维素或羟丙甲纤维素)或pva(聚乙烯醇)和peg(聚乙二醇)组成。peg可用作opadry包衣中的增塑剂。eudragit(例如eudragit l 100-55)是另一类合适的包衣。eudragit是衍生自丙烯酸和甲基丙烯酸的酯的共聚物,在某些情况下具有额外的官能团。
[0058]
包衣可包含另外的赋形剂,例如成膜剂、印刷油墨、缓冲剂、ph调节剂、防腐剂、染料和风味剂。在一些情况下,单一材料将包含任何前述赋形剂中的任意两种或更多种。
[0059]
未包衣片剂中的替比培南匹伏酯的量可为100mg,并且未包衣片剂重量可为200mg。在另一个实例中,未包衣片剂中的替比培南匹伏酯的量可为500mg,并且未包衣片剂重量可为1,000mg。在另一个实例中,未包衣片剂中的替比培南匹伏酯hbr的重量可为348.9mg,未包衣片剂中的替比培南匹伏酯的重量可为300mg,并且未包衣片剂的总重量可为750mg。500mg片剂的厚度可为5.00至8.00毫米(mm)、或6.00至7.00mm、或6.50至7.00mm、或6.75至7.00mm。片剂的包衣的量为片剂总重量的1重量%至5重量%,例如,片剂总重量的2重量%至3重量%。
[0060]
只要固体制剂或其芯结果稳定,可以组合实施方案。“任何前述的组合”仅包括得到稳定的片剂或片剂芯的组合。
[0061]
治疗方法
[0062]
本公开内容包括一种通过向具有细菌感染风险或患有细菌感染的受试者施用本公开的剂型来治疗受试者的细菌感染的方法。
[0063]
特别设想了对人类患者的治疗。然而,对非人类受试者(例如家畜或伴侣动物)的治疗也在本公开的范围内。
[0064]
在一些实施方案中,细菌感染或抗生素耐受性或抗生素抗性感染由革兰氏阴性细菌引起。
[0065]
本公开的延释替比培南匹伏酯口服剂型可以单独施用,使得替比培南匹伏酯是施用于受试者的唯一活性剂,或者剂型可以与一种或多种另外的活性剂组合施用。组合施用包括同时或顺序施用活性剂。
[0066]
在本公开的任一方法的一个实施方案中,微生物感染是病原性细菌感染的结果。病原性细菌的实例包括但不限于气杆菌属(aerobacter)、气单胞菌属(aeromonas)、不动杆菌属(acinetobacter)、农杆菌属(agrobacterium)、芽孢杆菌属(bacillus)、拟杆菌属(bacteroides)、巴尔通氏体属(bartonella)、博代氏杆菌属(bordetella)、布鲁氏菌(brucella)、伯克氏菌属(burkholderia)、鞘杆菌属(calymmatobacterium)、弯曲菌属(campylobacter)、柠檬酸杆菌属(citrobacter)、梭菌属(clostridium)、棒状杆菌属(corynebacterium)、肠杆菌属(enterobacter)、肠球菌属(enterococcus)、埃希氏杆菌属(escherichia)、弗朗西斯氏菌属(francisella)、梭杆菌属(fusobacterium)、嗜血杆菌属(haemophilus)、哈夫尼菌属(hafnia)、螺杆菌属(helicobacter)、克雷白氏杆菌属(klebsiella)、军团菌属(legionella)、李斯特菌属(listeria)、摩根氏菌属(morganella)、莫拉氏菌属(moraxella)、卟啉单胞菌属(porphyromonas)、变形杆菌属(proteus)、普罗维登斯菌属(providencia)、假单胞菌属(pseudomonas)、沙门氏菌属
(salmonella)、沙雷氏菌属(serratia)、志贺氏菌属(shigella)、葡萄球菌属(staphylococcus)、链球菌属(streptococcus)、密螺旋体属(treponema)、黄单胞菌属(xanthomonas)、弧菌属(vibrio)和耶尔辛氏菌属(yersinia)的细菌。此类细菌的具体实例包括哈氏弧菌(vibrio harveyi)、霍乱弧菌(vibrio cholerae)、副溶血性弧菌(vibrio parahemolyticus)、溶藻弧菌(vibrio alginolyticus)、发光假单胞菌(pseudomonas phosphoreum)、铜绿假单胞菌(pseudomonas aeruginosa)、小肠结肠炎耶尔森氏菌(yersinia enterocolitica)、大肠杆菌(escherichia coli)、鼠伤寒沙门氏菌(salmonella typhimurium)、流感嗜血杆菌(haemophilus influenzae)、幽门螺杆菌(helicobacter pylori)、枯草芽孢杆菌(bacillus subtilis)、伯氏疏螺旋体(borrelia burgdorferi)、脑膜炎奈瑟菌(neisseria meningitidis)、淋病奈瑟菌(neisseria gonorrhoeae)、鼠疫耶尔森菌(yersinia pestis)、空肠弯曲杆菌(campylobacter jejuni)、结核分枝杆菌(mycobacterium tuberculosis)、粪肠球菌(enterococcus faecalis)、肺炎链球菌(streptococcus pneumoniae)、酿脓链球菌(streptococcus pyogenes)、肺炎克雷伯菌(klebsiella pneumoniae)、洋葱伯克氏菌(burkholderia cepacia)、鲍氏不动杆菌(acinetobacter baumannii)、表皮葡萄球菌(staphylococcus epidermidis)和金黄色葡萄球菌(staphylococcus aureus)。
[0067]
在一些实施方案中,革兰氏阴性细菌是假单胞菌属(如铜绿假单胞菌(p.aeruginosa))、伯克氏菌属或不动杆菌属(如鲍氏不动杆菌(a.baumannii))。
[0068]
在一些实施方案中,革兰氏阴性细菌是肠杆菌科(enterobacteriaceae),例如肺炎克雷伯菌,例如大肠杆菌,例如阴沟肠杆菌(enterobacter cloacae),例如粘质沙雷氏菌(serratia marcescens),例如鼠伤寒沙门氏菌,例如痢疾志贺氏菌(shigella dysenteriae),例如奇异变形杆菌(proteus mirabilis),例如弗氏柠檬酸杆菌(citrobacter freundii),例如鼠疫耶尔森菌。
[0069]
在一些实施方案中,感染是多种细菌感染,例如包含多于一种生物的感染。在一些实施方案中,感染包含上文列出的生物中的至少一种,例如假单胞菌属(如铜绿假单胞菌)、克雷伯菌属(例如肺炎克雷伯菌)和/或不动杆菌属(如鲍氏不动杆菌)中的一种或多种。
[0070]
在一些实施方案中,所述方法还包括将另外的活性剂与本公开的调释固体剂型联合施用,例如选自但不限于:β-内酰胺类如青霉素类、头孢菌素类、碳头孢烯类、头霉素类、碳青霉烯类、单内酰环类、喹诺酮类(包括氟喹诺酮和类似的dna合成抑制剂)、四环素类、氨基糖苷类、大环内酯类、糖肽类、氯霉素类、甘氨环素类、林可酰胺类、脂肽类、脂缩肽类(如达托霉素)和恶唑烷酮类的抗生素。
[0071]
在一些实施方案中,细菌感染是上呼吸道感染和下呼吸道感染、肺炎、菌血症、全身感染、败血症和败血性休克、尿路感染、胃肠道感染、心内膜炎、骨感染、中枢神经系统感染(例如脑膜炎)或皮肤和软组织的感染。本公开包括一种通过向需要这种治疗的患者施用本公开的剂型来治疗艰难梭菌(c.difficile)的方法。本公开具体地讲包括一种治疗患者的复杂尿路感染的方法。“复杂尿路感染”是一种临床综合征,其特征为脓尿以及尿液血培养的记录微生物病原体,伴有局部和全身体征和症状,包括在存在尿路的功能性或解剖学异常或存在导管插入术的情况下发生的发烧(即,口腔或鼓室温度高于38摄氏度)、畏寒、不适、侧腹疼痛、背痛和/或肋椎角疼痛或压痛。患有肾盂肾炎的患者无论尿道是否存在潜在
异常,都被认为是患有cuti的患者的亚群。
[0072]
在一些实施方案中,受试者是哺乳动物,例如人或非人哺乳动物。在一些实施方案中,所述方法包括处理一种或多种细胞,例如培养皿中的细胞。
[0073]
在一个方面,本公开涉及一种治疗受试者的革兰氏阴性感染的方法,该方法包括向需要这种治疗的所述受试者施用治疗有效量的本文所述化合物。
[0074]
在一些实施方案中,革兰氏阴性感染由铜绿假单胞菌引起。
[0075]
在其他实施方案中,本公开包括治疗由革兰氏阳性细菌引起的感染,例如表皮葡萄球菌和金黄色葡萄球菌。
[0076]
在一些实施方案中,受试者是创伤患者或者患有烧伤或皮肤伤口的烧伤患者。
[0077]
在另一方面,本公开涉及一种降低受试者的细菌耐受性的方法,该方法包括向所述受试者施用治疗有效量的本文所述化合物。
[0078]
在一些实施方案中,该方法还包括鉴定患有抗微生物疗法抗性细菌感染的所述受试者。
[0079]
实施例
[0080]
片剂制造
[0081]
替比培南匹伏酯片剂使用经由干法制粒(例如碾压,然后研磨)制备的普通共混物。使用常规的共混/研磨和压片设备和方法。常规的膜包衣设备和方法可用于对片剂芯进行包衣。
[0082]
替比培南匹伏酯共混物可通过各种制粒方法制备,包括喷雾干燥、溶剂湿法制粒、水性湿法制粒和使用辊压的干法制粒;然而,使用辊压的干法制粒有效地产生具有期望堆积密度和流动性质的替比培南匹伏酯片剂共混物。
[0083]
通过评估共混物和片剂的物理性质,包括堆积和振实密度测量、流动分析、筛孔分析和共混物的均匀性;片剂芯和片剂的重量、厚度、硬度、脆碎度、效力、崩解、溶出和含量均匀性测试,优化了替比培南匹伏酯片剂的制造过程。
[0084]
实施例1.替比培南匹伏酯速释片剂芯
[0085]
称量替比培南匹伏酯、交聚维酮(pvpp xl-10)、一水乳糖和微晶纤维素(avicel ph102)并置于容器中。然后将这些成分通过30目筛子筛分。
[0086]
使用单臂固定料斗混合机将筛分的成分以20rpm共混10分钟。
[0087]
向共混成分的所得混合物中,在混合机中加入硬脂酸镁,将混合物以20rpm进一步共混5分钟。
[0088]
使用单冲压片机通过9mm直径圆形冲头将混合物压制成片剂。
[0089]
500mg和100mg速释片剂芯的组成分别列于表1和表2中。500mg速释替比培南匹伏酯片剂在ph 5.0下的溶出曲线示于图1中。
[0090][0091][0092][0093]
实施例2.速释包衣配方和工艺
[0094]
速释替比培南匹伏酯片剂芯(例如表1和表2中公开的那些)可以用表3和表4中列出的包衣配方进行包衣。500mg肠溶包衣速释替比培南匹伏酯的溶出曲线提供于图3中。片剂芯的配方在实施例1中提供,并且肠溶包衣的配方在表3中提供。所得的肠溶包衣剂型可在ph 6.8下在45分钟内释放100%的替比培南匹伏酯,但在ph 1.2下在45分钟内释放少于5%的替比培南匹伏酯。使用以下缩写:gms(甘油单硬脂酸酯)和tec(柠檬酸三乙酯)。
[0095][0096][0097][0098]
eudragit分散体(a)如下制备。称量eudragit l100-55,并在搅拌下缓慢加入水中,形成涡旋。将混合物搅拌10分钟以使聚合物完全润湿。在5分钟内将4%氢氧化钠水溶液滴加到所得分散体中,并将所得混合物再搅拌30分钟。
[0099]
eudragit分散体(b)如下制备。将吐温80、tec和gms的混合物加入加热至80℃的水中,并将所得混合物以5,000rpm的速度均化10分钟。在搅拌下将另外的水(初始量的25%)加入分散体中。将所得混合物冷却至环境温度。然后将制备的分散体在搅拌下加入如上所述制备的eudragit分散体(a)中。搅拌10分钟后,将所得混合物通过80目筛子。
[0100]
根据表5中列出的参数,所得分散体可用于对替比培南匹伏酯速释片剂芯(重量增加7%)进行包衣。未包衣替比培南匹环速释片剂芯(实施例1中的制剂)和肠溶包衣替比培南匹伏酯的溶出曲线。
[0101][0102]
实施例3.替比培南匹伏酯调释片剂芯组成
[0103]
表6和表7的调释替比培南匹伏酯片剂芯如下制备。首先,将半份羟丙基甲基纤维
素(hpmc e50 lv)装入共混机(例如v型共混机或料筒共混机)中,然后加入替比培南匹伏酯,再加入剩余半份羟丙基甲基纤维素,然后共混材料。
[0104]
可对硬脂酸镁进行筛分以破碎任何附聚物,例如通过20目筛网进行筛分。将筛过的硬脂酸镁加入到含有替比培南匹伏酯/释放控制剂共混物的共混机中并共混数分钟。从共混机中排放出替比培南匹伏酯/释放控制剂/硬脂酸镁共混物。
[0105]
从共混机排放出的材料经过辊压,形成辊压的带或压块。然后使经辊压的材料通过研磨机,例如振荡研磨机、冲击研磨机或筛分研磨机。例如,可使用配备有20目筛网的quadro comil(quadro engineering,ontario,canada)。收集研磨的材料,然后装入共混机中。加入微晶纤维素(avicelph102)和甘露醇(甘露醇200sd)并共混材料。
[0106]
可对硬脂酸镁进行筛分以破碎任何附聚物,例如通过20目筛网筛入共混机中,并共混数分钟。
[0107]
然后将搅拌器的内容物排放到适当标记的容器中,即双层衬里聚乙烯袋,在两层袋之间具有干燥剂。
[0108]
然后在旋转式压片机上形成片剂芯。片剂芯可以在膜包衣机中进行包衣。
[0109]
500mg(总重量1000mg)和100mg(总重量200mg)调释片剂芯的组成分别列于表6和表7中。
[0110][0111][0112]
通过直接压制制备片剂。工具尺寸为18.9
×
11.0mm。片剂的厚度为6.83至6.90mm。
[0113]
实施例4.溶出
[0114]
溶出方法参数列于表8中。
[0115][0116][0117]
实施例5.替比培南匹伏酯速释剂型的模拟人类药代动力学参数
[0118]
表9和表10中所示的药代动力学参数是从500mg速释替比培南匹伏酯片剂的人口服(po)剂量的模拟研究中获得的。该片剂芯的配方在实施例1中提供。该模拟假设替比培南匹伏酯片剂的体内溶出与所测量的体外溶出相似。
[0119]
500mg替比培南匹伏酯片剂的人口服(po)剂量的模拟药代动力学曲线示于图4中。该模拟示出静脉回流中的替比培南(游离形式)的血浆浓度,即静脉室或全身循环中的替比培南的血浆浓度。
[0120][0121]
[0122][0123]
实施例6.速释替比培南匹伏酯hbr片剂
[0124]
通过实施例1中给出的方法制备速释替比培南匹伏酯hbr片剂。替比培南匹伏酯游离碱替换为hbr盐。替比培南匹伏酯盐的较大重量可通过较少的乳糖和avicel ph102来解释。未包衣速释型替比培南匹伏酯hbr片剂的组成在表11a和表11b中给出。据发现,当通过usp桨法在37℃下在900ml 50mm乙酸盐缓冲液(ph 5.0)中以50rpm测量时,表11b中公开的750mg(总重量)片剂芯在5分钟内释放95.0%的替比培南匹伏酯,并且在15分钟内释放约95.2%的替比培南匹伏酯。溶出曲线在图7中提供。表11b中的片剂芯含有300mg替比培南匹伏酯。
[0125][0126][0127][0128]
实施例7.调释替比培南匹伏酯hbr片剂
[0129]
通过实施例2中给出的方法制备调释替比培南匹伏酯hbr片剂。替比培南匹伏酯游
离碱替换为hbr盐。替比培南匹伏酯盐的较大重量可通过较少的乳糖和avicel ph102来解释。未包衣调释替比培南匹伏酯hbr片剂的实施例的组成在表12a和表12b中给出。将表12a中的未包衣调释替比培南匹伏酯片剂在ph 5.0和ph 6.8下的溶出曲线与图5和图6的游离碱的溶出曲线进行比较。hbr盐在ph 5.0下表现出比游离碱略慢的释放,并且在ph 6.8下表现出比游离碱略快的释放。
[0130][0131][0132]
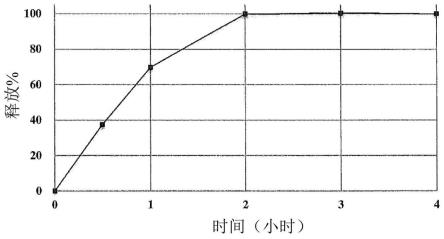
据发现,当通过usp桨法在37℃下在900ml 50mm乙酸盐缓冲液(ph5.0)中以50rpm测量时,表12b中公开的750mg片剂芯在30分钟内释放21.9%的替比培南匹伏酯,在1小时内释放40.9%的替比培南匹伏酯,在2小时内释放70.7%的替比培南匹伏酯,在3小时内释放88.7%的替比培南匹伏酯,并且在4小时内释放100%的替比培南匹伏酯。溶出曲线在图8中提供。
[0133]
实施例8.调释替比培南匹伏酯hbr配方
[0134]
通过实施例2中给出的方法制备短调释替比培南匹伏酯hbr片剂。当通过usp桨法在37℃下在900ml 50mm乙酸盐缓冲液(ph 5.0)中以50rpm测量时,该制剂在2小时内从剂型芯释放不少于85%的替比培南匹伏酯。替比培南匹伏酯游离碱替换为hbr盐。未包衣调释替比培南匹伏酯片剂的实施例的组成在表13中给出。据发现,当通过usp桨法在37℃下在900ml50mm乙酸盐缓冲液(ph 5.0)中以50rpm测量时,表13中公开的750mg片剂芯在30分钟内释放37.5%的替比培南匹伏酯,在1小时内释放69.8%的替比培南匹伏酯,在2小时内释放99.9%的替比培南匹伏酯,并且在3小时内释放100.0%的替比培南匹伏酯。短调释替比培南匹伏酯hbr片剂的溶出曲线在图9中给出。
[0135][0136]
实施例9.猴子口服施用的pk参数
[0137]
将实施例1和6的100mg速释替比培南匹伏酯游离碱(游离碱ir)和hbr(hbr ir)片剂以及实施例7的100mg调释替比培南匹伏酯hbr片剂(hbr mr)口服施用于猕猴(n=4只动物/测试剂型)。每只动物在下一次给药之前接受一周洗脱,并且每只动物作为其自身对照。将血液样品收集到k2edta管中,再处理至血浆。在施用后15分钟、30分钟、1小时、2小时、4小时、6小时、8小时、10小时、12小时、16小时和24小时获取样品。经由串联lc-ms方法分析血浆样品的前药、替比培南匹伏酯和替比培南。使用phoenix winnonlin 6.4版对每个剂量水平进行用于得到复合时间对浓度曲线的药代动力学参数的非隔室分析。通过hplc测定每个时间点的替比培南的血浆浓度。速释和延释剂型的pk参数列于表14中。
[0138]
在游离碱和hbr速释组中,在约1.5-2小时观察到替比培南的最大浓度。与速释(游离碱和hbr)制剂相比,用调释制剂降低c
max
,但制剂之间的auc
all
相对恒定。由于最终消除曲线的可变性,无法计算auc
inf
。使用先前生成的iv数据(13.06ug*h/ml用于10mg/kg剂量),估计替比培南的生物利用率范围为39-50%。延释制剂中的平均停留时间增加。
[0139][0140]
本发明构思已根据示例性原理和实施方案进行了描述,但本领域的技术人员将认识到,在不脱离由以下权利要求书定义的本公开的范围和实质的情况下,可对所述内容进行变化和等效替换。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1