一种体内细胞捕获线和捕获器
1.本发明医疗器械领域,具体涉及一种体内细胞捕获线和捕获器。
背景技术:
2.丝素纤维作为高分子天然蛋白材料,具有良好的生物相容性和承载力,是最为理想的生物材料之一。丝素纤维直径约为10μm,与循环肿瘤细胞(ctc)直径10-50μm相当,甚至还小于一些ctc。ctc捕获是通过固载在载体丝上的捕获配体(如核酸适体apt、抗体)与ctc表面受体形成“配体-受体”复合物而实现的。相对于配体或者受体这类分子的尺度,丝素纤维直径(约10μm)仍然是极其大的,对“配体-受体”复合物的形成仍然具有较大的空间位阻,通常需要在载体丝上接枝大分子(如聚丙烯酸paa、肝素hpr、透明质酸等多羧基大分子)作为间臂spacer来降低空间位阻。众所周知,丝素纤维的活性基团和接枝大分子的活性基团之间的连接,因大分子较大的分子量和纤维极大的直径而造成的较大空间位阻,大分子的接枝效率也就极低。为了提高大分子的接枝效率,必须降低来自于纤维的空间位阻。
3.申请号为cn201810321288.0的发明专利公开了一种以功能化蛋白丝线为载体的体内细胞捕获器,该功能化蛋白丝线包括蛋白丝线以及与蛋白丝线表面固定连接的功能物质,并具体公开了分别用二缩水甘油醚(包括聚乙二醇二缩水甘油醚或1,4-丁二醇二缩水甘油醚)和聚丙烯酸(paa),或者分别用二缩水甘油醚(包括聚乙二醇二缩水甘油醚或1,4-丁二醇二缩水甘油醚)、多胺化合物(乙二胺、丙二胺、丁二胺或pei)和paa在60℃的水浴中反应6小时。之后,用蒸馏水清洗多次,得到表面功能化的蛋白丝。第二种方式中,二缩水甘油醚与多胺化合物发生缩合反应,在纤维表面也就构建了α-羟基胺缩合物支架,再在支架上接枝大分子paa,最后在paa上固载ctc的捕获配体,从而实现ctc捕获。利用此α-羟基胺缩合物支架构建的体内细胞捕获线存在2方面的缺陷:第一,在纤维表面首先接枝二缩水甘油醚时,其中一端的环氧基既可以接枝到纤维表面的氨基残基上,又可以接枝到羧基残基上,前者形成α-羟基胺,后者形成α-羟基酯,即α-羟基胺缩合物支架分别以c-n键、和酯键固载到纤维表面。众所周知,酯键容易水解,因此,支架结构也就不很稳定,自然也就导致了体内细胞捕获线的结构不很稳定。第二,α-羟基胺缩合物支架仅仅由1个α-羟基胺缩合物构成,支架高度较低,这就导致了基于支架去降低空间位阻的能力非常有限,从而导致了ctc捕获效率的提升率被限制。
技术实现要素:
4.本发明旨在解决现有技术中α-羟基胺缩合物支架结构不稳定,捕获效率的提升率被限制,从而导致了体内细胞捕获线的结构不很稳定、以及ctc捕获效率的提升率被限制的问题,提供了一种体内细胞捕获线和捕获器,在蛋白丝线的表面构建类小肽支架结构,可以根据需要在丝素纤维表面构建不同高度的支架,这种支架既有良好的稳定性,又有捕获效率的显著提升。
5.按照本发明的技术方案,所述体内细胞捕获线,其特征在于,包括蛋白丝线,修饰
在所述蛋白丝线表面的类小肽支架,接枝在所述类小肽支架顶端的氨基上的多羧基大分子,以及固载在所述多羧基大分子上的若干细胞捕获配体;所述类小肽支架是由若干类氨基酸依次修饰在所述蛋白丝线表面构建而成的支架结构,所述类氨基酸由有机二酸和有机二胺缩合形成。
6.进一步的,所述蛋白丝线来源于桑蚕丝、柞蚕丝或蜘蛛丝。
7.进一步的,所述类小肽支架由1-5个类氨基酸依次修饰在所述蛋白丝线表面构建而成,优选为2-5个,进一步优选为2-3个。
8.进一步的,所述有机二酸选自乙二酸、丙二酸、丁二酸、戊二酸及其同分异构体、己二酸及其同分异构体、庚二酸及其同分异构体中的一种或多种;所述有机二胺选自乙二胺、1,3-丙二胺及其同分异构体、1,4-丁二胺及其同分异构体、1,5-戊二胺及其同分异构体中的一种或多种。
9.进一步的,所述类氨基酸在依次修饰到蛋白丝线表面时,有机二酸和有机二胺的修饰顺序不限。具体来说,类氨基酸在依次修饰到蛋白丝线表面时,可以先有机二酸后有机二胺、或者先有机二胺后有机二酸,即类氨基酸利用有机二酸或有机二胺修饰在所述蛋白丝线表面。
10.具体的,修饰1个类氨基酸形成类单肽支架,修饰2个类氨基酸形成类二肽支架,修饰3个类氨基酸形成类三肽支架,以此类推。
11.进一步的,所述类小肽支架顶端的氨基为顶端类氨基酸自身的氨基、或修饰在顶端类氨基酸的羧基上的有机二胺的氨基。
12.进一步的,所述类小肽支架的修饰在水相或非水相中进行。
13.进一步的,非水相中时,有机二酸和有机二胺的修饰均在羧基活化剂的作用下进行,所述羧基活化剂为n,n-二异丙基碳二亚胺(dic)或二环己基碳二亚胺等。
14.进一步的,水相中时,有机二酸和有机二胺的修饰均在羧基活化剂和活化稳定剂的作用下进行,所述羧基活化剂为1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(edc
·
hcl)、1-(3-二甲基氨丙基)-3-乙基碳二亚胺甲碘盐、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(edc)等,所述活化稳定剂为n-羟基丁二酰亚胺(nhs)或n-羟基硫代琥珀酰亚胺等。
15.具体的,以乙二酸(da)和乙二胺(ed)为例,构建类单肽,乙二酸的用量为7-35mg/80根
×
2cm长的蛋白丝线,优选为28-35mg/80根
×
2cm长的蛋白丝线;乙二胺的用量为35-175μl/80根
×
2cm长的蛋白丝线,优选为140-175μl/80根
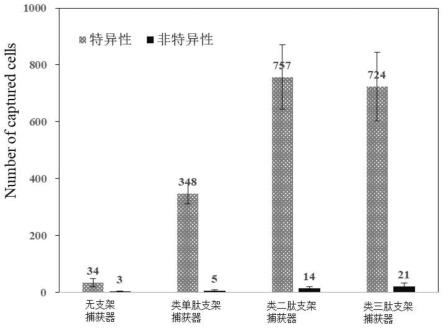
×
2cm长的蛋白丝线;
16.构建类小肽支架中第二及以上类氨基酸时,乙二酸的用量为14-42mg/80根
×
2cm长的蛋白丝线,优选为14-35mg/80根
×
2cm长的蛋白丝线;乙二胺的用量为35-175μl/80根
×
2cm长的蛋白丝线,优选为140-175μl/80根
×
2cm长的蛋白丝线。
17.进一步的,所述多羧基大分子选自肝素、透明质酸和聚丙烯酸中的一种或多种。
18.进一步的,所述细胞捕获配体为特异性抗体、特异性核酸适体和多肽适体中的一种或多种。
19.本发明的另一方面提供了一种体内细胞捕获器,包括上述体内细胞捕获线。
20.进一步的,所述体内细胞捕获器包括体内细胞捕获线、固定管、导针和导丝杆,所述体内细胞捕获线利用水凝胶固定在固定管内,导针设在固定管外,在导针和固定管之间设有密封塞,固定管远离导针针头的一端连接导丝杆。
21.具体的,体内细胞捕获器包括10-120根体内细胞捕获线,推动导丝杆,体内细胞捕获线的前端伸出导针,伸出长度约1.5-3cm;优选的,体内细胞捕获器包括40-120根体内细胞捕获线,进一步优选为60-100根。
22.本发明的技术方案相比现有技术具有以下优点:本发明在蛋白丝线表面构建类小肽支架,利用类小肽支架接枝多羧基大分子并固载细胞捕获配体,组建成体内细胞捕获器,通过类小肽支架的构建,实现了体内细胞捕获线的结构稳定、以及ctc捕获效率的显著提升。
附图说明
23.图1为丝素纤维表面类二肽支架的结构稳定性表征,其中为在37℃水中浸泡(24、36、72h)后,进行表面氨基比色时测定的比色液在237nm处的紫外相对吸光度(n=3,mean
±
sd)。
24.图2为丝素纤维的结构稳定性表征,以此作为类二肽支架结构稳定性的对照,其中为在37℃水中浸泡(24、36、72h)后,进行表面氨基比色时测定的比色液在237nm处的紫外相对吸光度(n=3,mean
±
sd)。
25.图3为丝素纤维表面α-羟基胺缩合物支架的结构稳定性表征,其中为在37℃水中浸泡3h后,进行表面氨基比色时测定的比色液在237nm处的紫外相对吸光度(n=3,mean
±
sd)。
26.图4为相同条件下类二肽支架捕获丝与α-羟基胺缩合物支架捕获丝的特异性和非特异性肿瘤细胞捕获(n=3,mean
±
sd)。
27.图5为相同条件下类小肽支架高度对捕获丝的特异性和非特异性捕获肿瘤细胞的影响(n=3,mean
±
sd)。
28.图6为各制备工艺下制备样本的表面氨基比色(n=3,mean
±
sd)。
29.图7为丝素纤维表面交替修饰二酸和二胺构建类二肽支架的红外光谱表征,包括丝素纤维(sf,中线)、修饰二酸(sf-da,上线)、修饰二胺(sf-da-ed,下线)。
30.图8为类二肽支架接枝多羧基大分子后的捕获丝在不同视野下的扫描电镜图,其中a、b和c的标尺为100μm,d的标尺为20μm。
31.图9为体外模拟静脉血管的循环捕获系统的实体图(a)和示意图(b),其中管内径3mm,管流量20ml/min。
具体实施方式
32.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
33.实施例1含类单肽支架的体内细胞捕获器
34.在此实施中构建类单肽支架的类氨基酸是“先有机二酸、后有机二胺”缩合形成,再通过支架顶端“自身的氨基”直接接枝多羧基大分子,最后,在多羧基大分子上固载捕获配体。具体步骤如下所述。
35.1、蚕丝固定
36.用0.6
×
0.9mm的聚四氟乙烯毛细管作为蚕丝纤维的固定管,将含有40根丝素纤维
的蚕丝对折挂在对折的0.1mm的不锈钢丝上,将不锈钢丝及其蚕丝引入固定管中,使未引入的蚕丝(即管外部分)约25-30mm,向管内加注水凝胶固定不锈钢丝和蚕丝,最后,保留未引入的蚕丝长度为20mm(丝素纤维80根),剪去多余部分,即得蚕丝固定管。
37.2、丝素纤维的制备
38.取100ml的烧杯,加入80ml的碱性脱胶液,放在电磁炉上加热至微沸,将蚕丝固定管放入其中进行脱胶1h,每隔20min加入单蒸水至80ml。碱脱胶结束后,将其放入微沸的单蒸水中,洗涤20min,重复两次。之后进行酸脱胶,即取100ml的烧杯,加入80ml的丁二酸溶液,放在电磁炉上加热至微沸,将洗涤后的蚕丝固定管放入其中再次脱胶1h,每隔20min加入单蒸水至80ml。酸脱胶结束后,将其放入微沸的单蒸水中,洗涤20min,重复两次,制得丝素纤维,风干,即得丝素纤维固定管,密封保存备用。
39.3、类单肽支架构建
40.修饰da:取1ml乙二酸溶液至10ml干燥的圆底烧瓶中,之后加入100μl dic,混匀,加塞。将其放入水浴恒温振荡器中振荡活化30min。将丝素纤维固定管放入圆底烧瓶中,同时确认丝素完全浸入活化液。再次将圆底烧瓶放入水浴恒温振荡器中振荡反应6h。反应结束后,洗涤。
41.修饰ed:向10ml圆底烧瓶中加入1ml的dmf,150μl的乙二胺,和100μl的dic,振荡混匀。将表面修饰乙二酸的丝素纤维放入其中,加塞。将圆底烧瓶放入水浴恒温振荡器中振荡反应6h。之后,洗涤。
42.4、接枝多羧基大分子肝素(hpr)
43.向10ml圆底烧瓶中分别加入1ml肝素钠溶液(10mg/ml)、0.5ml的edc溶液(10mg/ml)和0.5ml的nhs溶液(20mg/ml),加塞,放入37℃水浴恒温振荡器中活化30min。之后,将修饰类小肽支架的丝素纤维放入溶液中,加塞,放入水浴恒温振荡器中振荡反应6h。之后,洗涤。
44.5、固载捕获配体核酸适配体(apt)
45.向10ml圆底烧瓶中分别加入0.5ml的edc溶液、0.5ml的nhs溶液、和75μl的apt溶液(1od/ml),振荡混匀,再将接枝肝素的丝素纤维浸入液体中,加塞,放入水浴恒温振荡器中振荡培养反应6h。之后,洗涤,得含类单肽支架的捕获管。
46.6、体内细胞捕获器的组建
47.在捕获管外设置密封塞并插入导针,固定管远离导针针头的一端连接导丝杆,得到体内细胞捕获器(捕获器)。当导针进入血管后,推动导丝杆时,捕获丝的前端伸出导针,伸出长度约2cm,即可实施体内细胞捕获。
48.实施例2含类二肽支架的体内细胞捕获器
49.在此实施中构建类二肽支架的类氨基酸是“先有机二酸、后有机二胺”缩合形成,再通过支架顶端“自身的氨基”直接接枝多羧基大分子,最后,在多羧基大分子上固载捕获配体。具体步骤为:在实施例1的基础上,其中的步骤3实施之后,再重复1次步骤3,其它步骤相同,即得含类二肽支架的细胞捕获器。
50.实施例3含类三肽支架的体内细胞捕获器
51.在此实施中构建类三肽支架的类氨基酸是“先有机二酸、后有机二胺”缩合形成,再通过支架顶端“自身的氨基”直接接枝多羧基大分子,最后,在多羧基大分子上固载捕获
配体。具体步骤为:在实施例1的基础上,其中的步骤3实施之后,再重复2次步骤3,其它步骤相同,即得含类三肽支架的细胞捕获器。
52.实施例4含类二肽支架的体内细胞捕获器
53.在此实施中构建类二肽支架的类氨基酸是“先有机二胺、后有机二酸”缩合形成,在类二肽支架顶端修饰有机二胺,再通过支架顶端“修饰的有机二胺的氨基”接枝多羧基大分子,最后,在多羧基大分子上固载捕获配体。具体步骤为:
54.在实施例1的基础上,将步骤3中“先修饰da、后修饰ed”的顺序更换,即“先修饰ed、后修饰da”,并重复1次此步骤3,之后,在类二肽支架顶端再单独修饰1次da,其它步骤相同,即得含类二肽支架的细胞捕获器。
55.实施例5含类单肽支架(水相制备)的体内细胞捕获器
56.在此实施中构建类单肽支架的类氨基酸是“先有机二酸、后有机二胺”缩合形成,再通过支架顶端“自身的氨基”直接接枝多羧基大分子,最后,在多羧基大分子上固载捕获配体,其中的类单肽支架制备由“非水相dmf”更换为“水相”。具体步骤如下所述。
57.在实施例1的基础上,其中的步骤3更改为“水相制备类单肽支架”,其它步骤相同,即得含类单肽支架(水相制备)的体内细胞捕获器。步骤3“类单肽支架构建”的详情如下。
58.修饰da:向10ml的圆底烧瓶中加入1ml乙二酸溶液和70μl 0.6m naoh溶液,振荡均匀。再加入0.5ml edc溶液(8mg/ml)和0.5mlnhs溶液(10mg/ml),混匀,加塞,将其放入水浴恒温振荡器中振荡活化30min。将丝素纤维固定管放入圆底烧瓶中,同时确认丝素完全浸入活化液。再次将圆底烧瓶放入水浴恒温振荡器中振荡反应6h。反应结束后,洗涤。
59.修饰ed:向10ml圆底烧瓶中加入0.5ml edc溶液(4mg/ml)和0.5mlnhs溶液(5mg/ml),振荡混匀,将表面修饰乙二酸的丝素纤维放入其中,加塞,将圆底烧瓶放入水浴恒温振荡器中振荡活化30min。之后,向瓶中加入150μl的乙二胺,继续反应6h。之后,洗涤。
60.结果分析
61.1、对在丝素表面构建的类二肽支架(实施例2)进行了稳定性考察,通过浸泡24h,36h,72h(模拟支架在血液的近中性水溶性环境)后对表面氨基进行比色分析,评价经过浸泡后的氨基下降的相对吸光度(图1)。丝素纤维同步进行稳定性考察作为基底对照(图2)。同时,构建申请号为cn201810321288.0的发明专利中的丝素纤维表面α-羟基胺缩合物支架,浸泡3h后进行稳定性考察作为对比(图3)。
62.结果显示构建类二肽支架后的降低量随浸泡时间的延长不断减小,降低的趋势与丝素纤维一致(图2),表明该结构在浸泡情况下是稳定的,同时,构建其他类小肽支架结构的稳定性结果与构建类二肽支架相当。而丝素纤维表面α-羟基胺缩合物支架仅仅浸泡3h就出现了大幅下降(图3),表明该结构稳定性欠佳。
63.2、采用上述实施例中体内细胞捕获器以及cn201810321288.0中的α-羟基胺缩合物支架捕获器进行肿瘤细胞捕获。如图9所示:肿瘤细胞捕获所采用的体外模拟静脉血管(管内径3mm,管流量20ml/min)的循环捕获系统由内径3mm的连接管将各组件连接形成一个细胞液的循环流动系统,包括注射器(向模拟静脉血管加注细胞悬液)、带有夹层的玻璃瓶(存放细胞悬液)、固定捕获器的t型三通管、控制细胞液单向流动的单向阀。除此之外,还有固定各组件的亚克力板和匀速推拉注射剂的电机。玻璃瓶夹层内是37℃的恒温循环水;固定捕获器的亚克力板有2块,每块板有6个固定捕获器的t型三通管,最多可同时有12个捕获
器平行捕获;匀速推拉注射器的电机带有速度控制旋钮,可改变运行速度。如图9b所示,深色箭头是细胞悬液从注射器推出最终流入玻璃瓶的液体流动方向,浅色箭头是在注射器吸取液体时,细胞悬液从玻璃瓶中流出时的液体流动方向,而在放置捕获器的管路中流动方向终究是一致的,这样不仅可以提高捕获效率,也可以避免先捕获到的细胞由于反向的液体的冲力而脱落。最终的捕获参数如下,捕获时间为1h,流经捕获器的流速为20ml/min,循环系统内细胞悬液的总量约为68ml。对于染色后的细胞的捕获,将在捕获系统外侧罩上实验室自制的黑色亚克力罩,防止光对细胞捕获的影响。
64.对于捕获丝在细胞捕获后,放入96孔板内进行消化,将消化后的细胞静置1h,使捕获细胞平铺于96孔板底部,之后将该孔置于显微镜10
×
倍镜下,将该孔在显微镜下等分为上、中、下三个计数条带。首先对上条带进行细胞计数,此时轻轻水平移动镜头进行各个视野下的细胞计数;当上条带计数完毕后,再分别计数中条带和下条带内各个视野中的细胞数。当一个细胞在一个视野中不能完全显示时,将遵循“数上不数下,数左不数右”的原则,即在一个视野的边缘处出现的跨视野的细胞仅仅计数上边缘和左边缘的细胞。
65.如图4所示,在相同条件下,类二肽支架捕获丝(实施例2)与α-羟基胺缩合物支架捕获丝的非特异性捕获数量相当,类二肽支架捕获丝的特异性捕获数量远高于α-羟基胺缩合物支架捕获丝。
66.如图5所示,分别以丝素纤维表面氨基残基、类单肽(实施例1)、类二肽(实施例2)和类三肽(实施例3)支架结构顶端的氨基为基础构建相应的捕获器,它们对应的捕获到的靶细胞分别为34、348、757和724个。由此表明,随着支架高度的增加,即按丝素纤维本身(没有支架)、类单肽支架、类二肽支架、类三肽支架的顺序,靶细胞捕获数随之增加。当支架高度达到2个循环(即类二肽)之后,被捕获的细胞数没有统计学差异,说明类二肽支架是一个最优支架。同时也证明了支架高度对捕获器的捕获效率提升具有显著的贡献。在被捕获的靶细胞增加的同时,各捕获器的非特异性捕获并没有明显的差异,也没有表现出统计学差异,说明类多肽支架高度的增加也仅仅是贡献于特异性的靶细胞捕获效率的显著提升。
67.3、如图6所示:在捕获管(实施例2)的制备过程中,为了质量的可控,以表面氨基比色法对其进行了过程质量控制,其中比色的吸光度越高表明表面的氨基越多。首先,捕获管中丝素纤维自身的表面氨基仅仅是丝素蛋白的氨基残基,相对较少,比色值较低(0.136)。当在表面氨基残基上接枝二酸da(具体为乙二酸)之后,表面氨基被封蔽,氨基显著减少,比色值也就显著降低(0.019),表明da被接枝到表面氨基上,实现了表面的羧基化;当在该类羧基上接枝二胺ed(具体为乙二胺)后,表面氨基数量显著增加,相应的比色值也显著增加(0.250),由此表明ed被接枝到表面羧基上,实现了表面的再次氨基化。至此完成了类一肽的表面构建。另外,类一肽的氨基比色0.250明显大于丝素纤维本身的氨基比色,这是由于在接枝二胺ed时,既用了接枝二酸da的羧基,也用了丝素纤维表面的羧基残基。对于类二肽支架构建过程中的质量控制与类一肽类似,即接枝二酸时比色值降至0.088,再接枝二胺时比色值又升至0.273。当在类二肽支架的顶端氨基上接枝多羧基大分子hpr时,氨基又被封蔽,氨基比色值又明显降低,说明hpr已经被接枝。由于大分子羧基的反应效率低,降低幅度自然也就较低。
68.4、通过红外对丝素表面修饰da和ed进行表征,当修饰第一个da时,如图7所示,峰全部变小,且在1701cm-1
出现羧酸的c=o信号,由于1500cm-1
附近有两个大的酰胺峰,因此
影响其在1701cm-1
处出峰,但结合氨基比色值的明显下降,可以确定da是连接成功的。当继续修饰ed后,在1334cm-1
出现仲胺c-n键特征峰,说明ed连接成功。
69.5、如图8所示,对类二肽支架接枝多羧基大分子后的捕获丝(实施例2)进行了在不同视野(图a、b、c、d)下的扫描电镜(sem)表征,从标尺为20μm(图a、b、c)的大视野下可以看出捕获丝的各个部分均是表面光滑的,在标尺为100μm(图d)的放大图中也没有发现表面有不光滑的问题。由此说明,在纤维表面构建分子支架之后,表面并没有出现宏观的堆积型支架,预示着捕获效率的增加应该是类小肽的分子支架的贡献。同时,这也为捕获丝的结构稳定性提供了辅助证明。
70.显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1