一种可注射性水凝胶材料及其制备与应用方法
1.本发明属于再生医学、生物材料学领域,尤其涉及一种可注射性水凝胶材料及其制备方法与应用。
背景技术:
2.毛囊是皮肤的重要附属物,它是在皮肤形态发生过程中,根据来自真皮层的信号而形成的。头发源于毛囊,对人体很重要,包含体温调节、身体保护、感觉活动、社会交往等功能。由环境、遗传、压力等各种原因引起的脱发(alopecia)在世界范围内越来越普遍,影响着个人的生理、心理和社会幸福感。治疗脱发的主要方法有药物治疗和毛囊移植。毛囊移植是一种有效的治疗方法,它改变了头皮毛囊的分布,而不增加头发的数量。但毛囊移植也存在一些问题,比如毛囊移植需要有毛囊捐赠者,而现实情况是毛囊捐赠者寥寥;又由于脱发治疗往往是渐进的,这就需要持续获得毛囊捐赠才能达到最终的治疗效果。基于现实矛盾,所以现阶段毛囊移植往往不能达到最优的治疗效果。所以实现脱发患者自身的毛囊再生,才是最根本的解决办法。
3.水凝胶材料因其良好的生物相容性,被作为一种生物修复材料广泛应用于皮肤修复领域。但现有的水凝胶材料大都是与药物结合后用于皮肤的愈合,而皮肤的愈合并不必然会使损坏的毛囊再生。特别是诸如人体头皮等毛囊丰富的区域,常规的皮肤愈合药物外加水凝胶并不能有效使毛囊再生恢复到原有水平。现有技术中也有通过在水凝胶中加入毛囊再生因子以促进毛囊再生的方案,但是由于毛囊再生因子毕竟需要一定的生物活性,水凝胶种类的选择组配就显得非常重要。而现有的添加有毛囊再生因子水凝胶要么是由于组分不匹配导致毛囊再生效果不好,要么是由于材料性质导致使用不方便。因此现有技术方案制备的水凝胶材料依然不能够满足人体毛囊再生的要求。所以开发出一种能够应用于人体毛囊再生的水凝胶材料具有显著的现实意义。
技术实现要素:
4.本发明的目的是针对背景技术中存在的技术问题,提供一种可注射性水凝胶材料及其制备与应用方法。
5.本发明采取的技术方案如下:
6.一种可注射性水凝胶材料,包含水凝胶组分a和水凝胶组分b;所述水凝胶组分a包括纤维蛋白原和皮肤干细胞,所述水凝胶组分b包括凝血酶溶液;所述水凝胶组分a为溶液,每毫升水凝胶组分a溶液中含有纤维蛋白原50-100毫克,每毫升水凝胶组分a溶液中含有皮肤干细胞10
6-109个;所述凝血酶溶液的浓度为5-25u/ml。
7.进一步优选的,上述皮肤干细胞包括表皮干细胞与真皮干细胞;所述表皮干细胞与真皮干细胞的个数含量比例为1:(1-2)。
8.进一步优选的,上述凝血酶溶液中还包括浓度范围为35-50mm的游离钙离子。在水凝胶组分中增加适当浓度的钙离子,有利于水凝胶的最终成型。
9.进一步优选的,上述水凝胶组分a还包括浓度0.9%的氯化钠溶液。将水凝胶组分a中液态环境设置成类似生理盐水环境,更利于皮肤干细胞的存活,利于延长可注射性水凝胶材料的使用期限。
10.进一步优选的,上述水凝胶组分a和水凝胶组分b的体积比为(1-2):1。将水凝胶组分a和水凝胶组分b的比例进行优选,可以制备出具有良好孔隙的水凝胶材料,利于皮肤干细胞的附着。
11.进一步优选的,上述水凝胶组分a中还包含促进毛囊增殖的活性因子;所述活性因子为bmp4、bmp6以及fgf7中的至少一种。
12.基于同一技术思路,本发明还提供一种上述可注射性水凝胶材料的制备方法,包括以下步骤:
13.(1)从皮肤组织上剪切分离出表皮干细胞、真皮干细胞进行培养,分离培养好后重悬于pbs中,离心后收集细胞;弃上清液,取离心后的细胞沉淀,得到皮肤干细胞组分;
14.(2)将纤维蛋白原溶于氯化钠溶液制得纤维蛋白原溶液,将皮肤干细胞组分按比例与纤维蛋白原溶液混合均匀制得水凝胶组分a;将凝血酶溶于氯化钙溶液中制得包含凝血酶溶液的水凝胶组分b。
15.进一步优选的,上述表皮干细胞是皮肤组织经过剪切分离后再通过用蛋白分散酶、胶原酶消化后过筛收集细胞,再用cnt-07或者keratinocyte-sfm表皮角质细胞培养基进行贴壁培养得到的表皮干细胞。
16.进一步优选的,上述真皮干细胞是皮肤组织经过剪切分离后再通过用蛋白分散酶、胶原酶消化后过筛收集细胞,并用含b27、egf和bfgf的dmem/f12培养基中培养得到。
17.基于同一技术思路,本发明还提供一种上述可注射性水凝胶材料的应用方法,将上述可注射性水凝胶材料应用在制备用于促进毛囊再生修复材料中。
18.进一步优选的,将所述水凝胶材料用于制备皮下注射剂、软膏或皮肤贴剂。
19.与现有技术相比,本发明的有益效果为:
20.(1)本发明的可注射性水凝胶材料选择纤维蛋白原与凝血酶作为基体材料,其生物相容性高,具有可注射性,可以作为皮肤损伤修复及毛囊再生的支持材料。水凝胶材料组分中的纤维蛋白原能够与皮肤干细胞配合促进皮肤干细胞的干性提高,更利于皮肤的修复与毛囊的再生。本发明通过将皮肤干细胞及水凝胶混合,可以制备用于皮肤修复和毛囊再生的材料;可使得能够修复皮肤的同时实现毛囊的再生,并且具有成胶快,操作方便等特点,适合皮肤的快速修复尤其是在毛囊再生方面的应用。同时由于该水凝胶是a、b两种组分进行混合的,没有进行混合之前是流体,不仅可以与细胞进行很好的混合,同时可以很好的与皮肤伤口贴合,在双管注射器的前端进行混合到达伤口处时可以快速交联。
21.(2)选用了表皮干细胞与真皮干细胞的混合物作为种子细胞。两种细胞能够更好地模拟皮肤的真实结构,来源更广、分离方法更容易,可以很好的再生出毛囊。
22.(3)本发明在不同的水凝胶组分中分别添加钙离子与钠离子,实现了既模拟出生物体液平衡环境以保持生物材料的活性,又进一步增强了水凝胶的胶结效果。
23.(4)本发明通过分别制备出水凝胶的组分a与组分b,在使用时再将两种组分进行混合,避免了水凝胶成分过早混合导致的提前胶结而不利于注射应用。
附图说明
24.图1:纤维蛋白水凝胶成胶性能试验过程图,(a)纤维蛋白水凝胶a/b组分成胶图,(b,c)不同浓度的纤维蛋白水凝胶的电镜图;
25.图2:可注射性纤维蛋白水凝胶中的细胞生长情况检测结果图,(a)真皮干细胞在纤维蛋白水凝胶中培养1天和4天后的生长图,(b)为真皮干细胞在纤维蛋白水凝胶中培养1天和4天后的活死染色图,(c)真皮干细胞在纤维蛋白水凝胶中的细胞活率统计结果图,(d)为真皮干细胞在纤维蛋白水凝胶的中的细胞增殖实验结果图;
26.图3:可注射性纤维蛋白水凝胶中的细胞基因表达情况检测结果图;(a,b)真皮干细胞的表征性蛋白检测结果图,(c)真皮干细胞的ap染色结果图,(d)实时荧光定量pcr结果图,(e)实时荧光定量pcr结果图;
27.图4:(a)纤维蛋白水凝胶用于小鼠伤口毛囊再生后的毛囊再生图,(b,c,d)he染色及免疫荧光染色检测结果图;
28.图5:(a,b)biotin免疫荧光结果图,(c,d)cd31免疫荧光结果图;
29.图6:(a)细胞移植后6个月的小鼠毛囊再生形貌图,(b)、(c)分别为细胞移植后4周及6个月的小鼠毛囊再生解剖图,(d)细胞移植后6个月的小鼠毛囊再生组织he染色结果图。
具体实施方式
30.为了便于理解本发明,下文将本发明做更全面、细致地描述,但本发明的保护范围并不限于以下具体实施例。
31.除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
32.除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到。
33.实施例1:
34.1、皮肤干细胞的培养:
35.表皮干细胞的提取、培养及收集:
36.将生后1-3天c57新生小鼠用碘酒和酒精消毒后,剪取出背部皮肤,然后将皮肤组织剪成6-10mm2大小的小块,用蛋白分散酶(dispase ii)37℃消化60-90min。用无菌镊子将表皮与真皮分开。用无菌剪刀将表皮充分切碎,用胶原酶(collagenase i)37℃消化60min后过40μm的细胞筛。1300rpm离心5min收集细胞,用cnt-07或者keratinocyte-sfm表皮角质细胞培养基进行贴壁培养,在37℃,5%co2培养箱中培养1h后除去非贴壁细胞,贴壁的细胞即为表皮干细胞。
37.真皮干细胞的提取、培养及收集:
38.真皮干细胞的分离是用蛋白分散酶(dispase ii)将真皮与表皮分开后,取真皮组织用无菌剪刀充分切碎,用胶原酶(collagenase i)37℃消化40-60min后过40μm的细胞筛。1300rpm离心5min收集细胞,并用dmem/f12洗细胞一次,用细胞计数板进行计数。将分离的真皮细胞种于10cm表面未处理的细胞培养皿中,加入10ml含b27的dmem/f12培养基,并添加egf和bfgf,于37℃、5%co2的培养箱中悬浮培养;b27与培养基按质量比1:50加入,egf的终
浓度为20ng/ml,bfgf终浓度为40ng/ml。
39.2、可注射性水凝胶的制备:
40.(1)将培养好的表皮干细胞与真皮干细胞消化后重悬于pbs中,离心后收集细胞;取离心后的细胞沉淀,弃上清液得到皮肤干细胞组分;
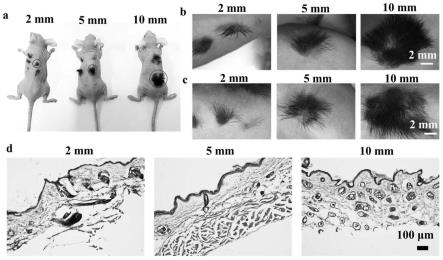
41.(2)将100mg纤维蛋白原溶于1ml0.9%氯化钠溶液形成100mg/ml的纤维蛋白原溶液,将步骤(1)中得到皮肤干细胞组分按照比例与纤维蛋白原溶液混合均匀制得水凝胶组分a;用0.9%氯化钠溶液对水凝胶组分a的浓度进行调控,使水凝胶组分a中的纤维蛋白原浓度为80mg/ml;调控浓度使水凝胶组分a中每毫升溶液含10
6-109个表皮干细胞,10
6-109个真皮干细胞,表皮干细胞与真皮干细胞的比例为1:2。
42.将500u凝血酶溶于50ml 42.1mm的氯化钙溶液中形成水凝胶成分b。
43.本发明在制备包含皮肤干细胞的可注射性水凝胶之前,还进行了成胶性能试验。分别采用20mg/ml、40mg/ml、80mg/ml浓度的纤维蛋白原溶液与同一浓度的凝血酶溶液进行混合,并加入了相应的氯化钙与氯化钠,观察所得到的纤维蛋白水凝胶胶体的结构情况。本试验做了两组检测,试验结果如图1所示,从纤维蛋白水凝胶的电镜图可以看出,本试验所采用的原料均能够形成胶体,胶体具有孔洞,便于皮肤干细胞的附着,为细胞提供支撑。此外,在80mg/ml浓度的纤维蛋白原溶液情况下制备的纤维蛋白水凝胶的孔洞均匀性明显更好,在此种浓度下,加入皮肤干细胞后,皮肤干细胞分布均匀,对制备的用于毛囊再生材料的性能更有帮助。在成胶性能试验中,本发明发现纤维蛋白原溶液与凝血酶溶液混合后在较短的时间内就会形成凝胶,因此在利用时有两种操作方法:一种是采取非常快的移植,还没有形成凝胶前快速移植到伤口上。另一种方法是在体外形成凝胶,以凝胶的形式移植,由于有一定的形状,这种无法和伤口进行非常好的吻合。因而本发明中通过采取形成a/b液的方法既不要求非常快的速度,同时在应用时可以对伤口进行很好的覆盖。
44.本发明对制备的可注射性水凝胶中的细胞生长情况进行了检测,结果如图2所示。图中(a)为真皮干细胞在纤维蛋白水凝胶中培养1天和4天后的生长图,从图中可以看出真皮干细胞在纤维蛋白水凝胶中可以伸展,细胞活性较好。图中(b)为真皮干细胞在纤维蛋白水凝胶中培养1天和4天后的活死染色图,图中显示真皮干细胞可以在纤维蛋白水凝胶中有很好的细胞活率。图中(c)显示真皮干细胞在纤维蛋白水凝胶中的细胞活率统计其细胞活率约为80%。图中(d)为真皮干细胞在纤维蛋白水凝胶的中的细胞增殖实验显示真皮干细胞在纤维蛋白水凝胶中可以增殖。图2中的各类检测结果说明纤维蛋白水凝胶具有很好的生物相容性,适于真皮干细胞的生长与增殖。
45.本发明对制备的可注射性水凝胶中的细胞基因表达情况进行检测,结果如图3所示,图中skp表示正常培养的真皮干细胞skp-f表示纤维蛋白原水凝胶培养的真皮干细胞。图中(a,b)显示真皮干细胞在纤维蛋白水凝胶培养后仍高表达其表征性蛋白nestin,bmp6及fibronectin;图中(c)真皮干细胞ap染色结果显示纤维蛋白原水凝胶可以很好地维持真皮干细胞的干性;图中(d)实时荧光定量pcr结果显示纤维蛋白水凝胶可以提升真皮干细胞的干性。sox2,nanog,c-myc的表达均有升高,只有oct4的表达稍降低,但无显著性差异。图中(e)实时荧光定量pcr结果显示真皮干细胞在纤维蛋白水凝胶培养后,其毛囊诱导基因a-sma、col-ii表达降低,akp2、nestin升高,其他的基因变化不明显。
46.3、建立毛囊再生模型:
47.以在小鼠上开展毛囊再生实验为实例。在裸鼠的背部做全层伤口(直径分别为2mm,5mm,10mm),通过双管注射器将制备的水凝胶组分a及水凝胶组分b以1:1的比例注射到小鼠损伤处。注射完成后用3m膜覆盖、绑带包扎。然后在不同的时间取伤口皮肤固定染色检测伤口愈合及毛囊再生情况,检测结果如图4、图5以及图6所示。
48.图4:(a)纤维蛋白水凝胶用于小鼠伤口毛囊再生后的毛囊再生图,显示不同伤口程度的皮肤毛囊均能够实现皮肤愈合及毛囊再生;(b,c,d)he染色及免疫荧光染色检测结果显示伤口得到了很好的修复,不仅有表皮、真皮,并且有毛囊、皮脂腺等附属器官结构。
49.图5:(a,b)biotin免疫荧光结果显示再生的皮肤含皮脂腺(c,d)cd31免疫荧光结果显示再生的皮肤含血管。
50.图6:(a)细胞移植后6个月的小鼠毛囊再生形貌图。(b)、(c)分别为细胞移植后4周及6个月的小鼠毛囊再生解剖图。(d)细胞移植后6个月的小鼠毛囊再生组织he染色结果显示毛囊仍存在,且无畸胎瘤等形成,生物相容性好。
51.对比例1:
52.其它步骤与实施例1相同,但可注射性水凝胶的制备过程中,在水凝胶组分a中只加入表皮干细胞。对制备的可注射性水凝胶建立毛囊再生模型,检测伤口愈合及毛囊再生情况。检测结果显示制备的可注射性水凝胶可以使伤口进行愈合,但是无法实现毛囊再生。
53.对比例2:
54.其它步骤与实施例1相同,但可注射性水凝胶的制备过程中,在水凝胶组分a中只加入真皮干细胞。对制备的可注射性水凝胶建立毛囊再生模型,检测伤口愈合及毛囊再生情况。检测结果显示制备的可注射性水凝胶可以使伤口进行愈合,但是无法实现毛囊再生。
55.上述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例。对于本技术领域的技术人员来说,在不脱离本发明技术构思前提下所得到的改进和变换也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1