一种通过分子动力学模拟不同超声环境并在该环境下分析蛋白结构的方法
1.本发明涉及分子动力学领域,具体涉及一种通过分子动力学模拟不同超声环境并在该环境下解析蛋白结构的方法。
背景技术:
2.分子动力学是一种分析系统中原子和分子物理运动的计算机模拟方法,也是分子力学中最重要也是应用最广泛的一种方法。此方法推动了生物大分子动态模型的进程,表明了生物大分子内部原子的相对运动以及对应的生物大分子形态变化对生物大分子的功能特性的影响。目前,由于实验过程中条件的限制,往往难以在原子水平上直接观察生物大分子的动态变化。使用分子动力学(md)模拟来模拟生物大分子的相关行为,可以揭示否则可能无法获得的结构和动力学细节。并且通过将实验室据和模拟数据进行对比分析,可以更将准确的验证实验猜想以及推动实验进程。现在,md模拟已成为一种强大且通用的基于物理的方法,用于了解生物分子的结构和动力学。
3.超声作为一种新颖的、绿色的、创新的和可持续的技术,已被各个领域广泛关注。已有研究表明,超声波技术可以改变多种植物蛋白的空间结构并提高其功能性质,如乳化性、起泡性和凝胶性等,但是超声波对于根茎类作物的储藏蛋白的影响鲜有报道。
4.本发明利用分子动力学模拟不同超声环境,本且分析在不同环境下山药蛋白结构的改变情况进而分析分析山药蛋白功能特性的变化情况。
技术实现要素:
5.为了更加深入理解超声波对蛋白质结构的影响,本发明提供了一种通过分子动力学模拟不同超声环境并在该环境下解析蛋白结构的方法。
6.为解决上述技术问题,本发明采用的技术方案为:
7.一种通过分子动力学模拟不同超声环境并在该环境下分析蛋白结构的方法,包括如下步骤:
8.1)从蛋白质数据库获取一种蛋白质的晶体构型。
9.2)选择力场,创建盒子。
10.3)在所创立的盒子中添加离子中和系统,为了消除不合理的能量势垒,进行能量最小化。
11.4)对上述建立的体系进行预平衡。
12.5)预平衡结束后使用gromacs软件对不同超声波条件下的提取的蛋白质进行模拟。
13.6)通过不同的软件对模拟之后得到的轨迹文件进行处理,再结合可视化软件得到有关蛋白结构的数据图像。
14.步骤2)中,使用opls-aa全原子力场,将提取的蛋白质置于周期性八面体盒子中,
且提取的蛋白质与盒子之间的最小距离设置为1.0nm,并将tip3p水模型添加到盒子中进行溶剂化。
15.步骤3)中,添加适当数量的na+和cl-离子以中和系统,离子强度保持在0.10 mol/l。使用最陡下降算法对系统进行8000步的能量最小化。远程相互作用使用粒子网格 ewald(pme)方法进行处理,范德华作用使用cut-off法来处理,并将距离截断值设置为使用v-rescale恒温器来控制系统温度为300k,使用berendsen恒压器控制压力。
16.步骤4)中对系统进行预平衡的具体方法为:在nvt系综下,保持原子数目、系统体积和温度恒定,系统压力改变对系统进行100ps的平衡,步长设置为2fs;在npt系综下,保持原子数目、系统压力和温度恒定,系统体积改变,对系统同样进行100ps的平衡,步长设置为2fs。
17.步骤5)中,利用正负方波的压力变化来模拟超声波环境,通过改变方波的周期来改变超声波的频率,通过berendsen恒压器控制压力来改变超声波功率。
18.所述的蛋白结构为dioscorin蛋白结构。
19.本发明通过一种通过分子动力学模拟不同超声环境并在该环境下解析蛋白结构的方法,具有以下优点:
20.1、本发明提供了一种模拟超声波条件的方法,通过改变方波的周期来改变超声波的频率,通过berendsen恒压器控制压力来改变超声波功率。
21.2、本发明提供的模拟超声波的方法,方法易懂,且模拟结果与接近于实验结果。
22.3、本发明利用分子动力学模拟更加深入探究了超声波对dioscorin结构及理化性质的影响。
附图说明
23.图1a为本发明方法中50mpa下的周期性方波示意图;
24.图1b为本发明方法中100mpa下的周期性方波示意图;
25.图2a为本发明方法中400mhz频率的周期性方波示意图;
26.图2b为本发明方法中250mhz频率的周期性方波示意图;
27.图3a为本发明方法中不同超声功率下dioscorin本征荧光发射光谱;
28.图3b为本发明方法中不同超声功率下dioscorin紫外-可见光谱;
29.图4a为本发明方法中不同超声频率下dioscorin本征荧光发射光谱;
30.图4b为本发明方法中不同超声频率下dioscorin紫外-可见光谱;
31.图5a为本发明方法中不同超声功率下dioscorin的sds-page图;
32.图5b为本发明方法中不同超声功率下dioscorin的sds-page图;
33.图6a为本发明方法中不同超声频率下dioscorin的sds-page图;
34.图6b为本发明方法中不同超声频率下dioscorin的sds-page图;
35.图7为本发明方法中不同超声波功率处理后dioscorin的扫描电子显微镜图;
36.图8为本发明方法中不同超声波频率处理后dioscorin的扫描电子显微镜图;
37.图9a为本发明方法中不同方波频率条件下dioscorin的rmsd;
38.图9b为本发明方法中不同方波压力条件下dioscorin的rmsd;
39.图10a为本发明方法中不同方波频率条件下dioscorin的rmsf;
40.图10b为本发明方法中不同方波压力条件下dioscorin的rmsf;
41.图11a为本发明方法中不同方波频率条件下dioscorin的rg;
42.图11b为本发明方法中不同方波压力条件下dioscorin的rg;
43.图12a为本发明方法中不同方波频率条件下dioscorin的氢键数量;
44.图12b为本发明方法中不同方波压力条件下dioscorin的氢键数量;
45.图13a为本发明方法中不同方波频率下dioscorin的sasa;
46.图13b为本发明方法中不同方波压力下dioscorin的sasa;
47.图14a为本发明方法中在空白条件下dioscorin的fel二维图;
48.图14b为本发明方法中在空白条件下dioscorin的fel三维图;
49.图14c为本发明方法中在250mhz、50mpa条件下dioscorin的fel二维图;
50.图14d为本发明方法中在250mhz、50mpa条件下dioscorin的fel三维图;
51.图14e为本发明方法中在400mhz、50mpa条件下dioscorin的fel二维图;
52.图14f为本发明方法中在400mhz、50mpa条件下dioscorin的fel三维图;
53.图14g为本发明方法中在250mhz、100mpa条件下dioscorin的fel二维图;
54.图14h为本发明方法中在250mhz、100mpa条件下dioscorin的fel三维图;
55.图15为本发明方法中不同方波条件下dioscorin结构与原始结构叠合;
56.图16a为本发明方法中在空白条件下dioscorin的二级结构含量;
57.图16b为本发明方法中在250mhz、50mpa条件下dioscorin的二级结构含量;
58.图16c为本发明方法中在400mhz、50mpa条件下dioscorin的二级结构含量;
59.图16d为本发明方法中在250mhz、100mpa条件下dioscorin的二级结构含量。
具体实施方式
60.一种通过分子动力学模拟不同超声环境并在该环境下分析蛋白结构的方法,包括如下步骤:
61.1)从蛋白质数据库获取一种蛋白质的晶体构型,蛋白结构为dioscorin蛋白结构。
62.2)选择力场,创建盒子:使用opls-aa全原子力场,将提取的蛋白质置于周期性八面体盒子中,且提取的蛋白质与盒子之间的最小距离设置为1.0nm,并将tip3p水模型添加到盒子中进行溶剂化。
63.3)在所创立的盒子中添加离子中和系统,为了消除不合理的能量势垒,进行能量最小化;步骤3)中,添加适当数量的na+和cl-离子以中和系统,离子强度保持在0.10 mol/l。使用最陡下降算法对系统进行8000步的能量最小化。远程相互作用使用粒子网格 ewaldpme方法进行处理,范德华作用使用cut-off法来处理,并将距离截断值设置为off法来处理,并将距离截断值设置为使用v-rescale恒温器来控制系统温度为300k,使用berendsen恒压器控制压力。
64.4)对上述建立的体系进行预平衡:对系统进行预平衡的具体方法为:在nvt系综下,保持原子数目、系统体积和温度恒定,系统压力改变对系统进行100ps的平衡,步长设置为2fs;在npt系综下,保持原子数目、系统压力和温度恒定,系统体积改变,对系统同样进行100ps的平衡,步长设置为2fs。
65.5)预平衡结束后使用gromacs软件对不同超声波条件下的提取的蛋白质进行模拟:利用正负方波的压力变化来模拟超声波环境,通过改变方波的周期来改变超声波的频
率,通过 berendsen恒压器控制压力来改变超声波功率。
66.6)通过不同的软件对模拟之后得到的轨迹文件进行处理,再结合可视化软件得到有关蛋白结构的数据图像。
67.实施例1:
68.(一)dioscorin的提取、干燥与超声波处理
69.1)dioscorin的提取:使用碱提酸沉的方法对山药中的dioscorin进行提取,使用喷雾干燥将蛋白液进行干燥。其工艺流程如下所示:
70.山药
→
清洗、去皮
→
称量、切块
→
1%亚硫酸氢钠溶液护色
→
料液比1:2打浆
→
浆液ph 调为8.5
→
磁力搅拌
→
离心保存上清液
→
上清液ph调为3.5
→
磁力搅拌
→
离心分离蛋白质
→
蛋白加水回融并将蛋白液ph调为7.0
→
喷雾干燥
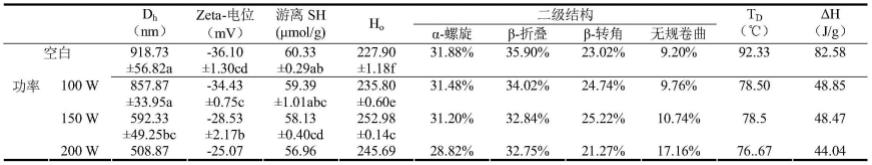
71.2)超声波处理dioscorin:将提取的dioscorin溶于去离子水,配置成浓度为1%的蛋白溶液,并在25℃的条件下磁力搅拌2h。山药蛋白溶液添加0.01%的山梨酸钾,以防止微生物生长引起腐败变质。蛋白溶液的ph值用1mol/l的naoh调整为7.0。将16ml蛋白液放于25ml的烧杯中,进行超声波处理。设定超声波功率200w、超声波频率25khz、超声波处理时间30min为固定值,分别在不同超声条件下对蛋白液进行超声处理:超声波功率:100、150、200、250、300w;和超声波频率:25、33、40、59khz。超声波处理过程控制温度在30℃以下。
72.(二)超声条件的模拟
73.1)从蛋白质数据库pdb id:4twm中获取dioscorin的晶体构型。
74.2)选择力场,创建盒子:用opls-aa全原子力场,将dioscorin置于周期性八面体盒子中,且dioscorin与盒子之间的最小距离设置为1.0nm,并将tip3p水模型添加到盒子中进行溶剂化。
75.3)添加离子中和系统,进行能量最小化:添加适当数量的na+和cl-离子以中和系统,离子强度保持在0.10mol/l。为了消除不合理的能量势垒,使用最陡下降算法对系统进行 8000步的能量最小化。远程相互作用使用粒子网格ewald方法进行处理,范德华作用使用 cut-off法来处理,并将距离截断值设置为使用v-rescale恒温器来控制系统温度为 300k,使用berendsen恒压器控制压力为50mpa和100mpa。
76.4)对体系进行预平衡:使用两步步骤对系统进行预平衡,在nvt系综下,保持原子数目、系统体积和温度恒定,系统压力改变对系统进行100ps的平衡,步长设置为2fs。在 npt系综下,保持原子数目、系统压力和温度恒定,系统体积改变,对系统同样进行100ps 的平衡,步长设置为2fs。
77.5)用gromacs软件对不同超声波条件下的dioscorin进行模拟:利用正负方波的压力变化来模拟超声波环境,通过改变方波的周期来改变超声波的频率,通过berendsen恒压器控制压力来改变超声波功率,图1和2为不同方波条件的示意图。
78.(二)实验结果
79.dioscorin的sasa的影响较小,在不同方波压力大小下的模拟中未能发现sasa具有显著性差异,但是可以观察到在50mpa时,sasa略高于为施加方波压力的空白,压力提升到 100mpa时,sasa值与空白的几乎一致。模拟结果与实验测得的ho数据较为一致。
96.(6)自由能形貌图fel
97.dioscorin的fel的2d和3d图片如图14a、14b、14c、14d、14e、14f、14g、14h所示。从图中可以清楚的发现未施加方波的dioscorin的fel具有的低能区最大,模拟过程中 dioscorin的主链原子主要处于低能结构,模拟过程中dioscorin的结构更加稳定。相比于在较高方波频率和压力下,在低的方波频率和压力下的dioscorin的fel图具有低能区最少,表明在低的方波频率和压力下体系更加不稳定,dioscorin的主链原子能量更高,结构更容易发生变化。这一结果与前边动力学结果一致。
98.(7)dioscorin主链变化
99.如图15所示,对应的rmsd分别为:250mhz、50mpa/空白=0.927nm,400mhz、 50mpa/空白=0.815nm和250mhz、100mpa/空白=0.640nm。可以发现在不同方波条件下进行,dioscorin的结构均发生改变。随着方波的频率从250mhz增加到400mhz时,与空白dioscorin结构叠合的rmsd从0.927nm降低为0.815nm。随着方波压力从50mpa增加至100mpa时,与空白dioscorin结构叠合的rmsd从0.927nm降低至0.640nm。表明在低频率和压力下,对dioscorin的结构改变更大。随着频率的增加,减轻了压力对结构的影响。而随着压力的增加,导致许多残基的灵活性降低,dioscorin的流动性降低,所以结构变化较小。这一结果与前边实验及模拟结果相一致。此外,在图中圈出的位置,可以发现在 250mhz、100mpa的方波条件下,结构发生明显变化,α-螺旋结构转化为无规卷曲。这与 dssp程序分析的二级结构变化一致。
100.(8)模拟过程中二级结构的变化
101.图16a、16b、16c、16d显示了不加方波和在不同方波条件模拟下二级结构随模拟时间的变化。从图中可以发现,与不加方波的模拟相比,施加方波后dioscorin的二级结构均发生变化,表明模拟过程中方波可以dioscorin的二级结构产生影响。在较低的方波频率和方波压力下,dioscorin的二级结构变化明显。从图中可以发现,残基10-20和残基20-45的α
‑ꢀ
螺旋结构变化为β-转角结构,残基50-60的β折叠结构变化为无规卷曲,残基135-155和残基162-167的α-螺旋有向无规卷曲转变的趋势。随着方波频率增加到400mhz时, dioscorin的二级结构波动明显减少,仅发现在残基50-60有一些β-折叠结构转变为无规卷曲结构。随着方波压力增加100mpa后,dioscorin的二级结构的波动同样减少,可以看出50
‑ꢀ
60红色β-折叠结构变化为无规卷曲结构,另外,残基135-155的α-螺旋结构可能有向β-转角转变的趋势。表明在低频率和压力下,对dioscorin的二级结构的波动更大。随着方波频率的增加,有效的减轻了压力对结构的影响,所以二级结构变化减少。而随着压力的增加,导致许多残基的灵活性降低,dioscorin的流动性降低,所以二级结构变化较小。dioscorin 的二级结构随着方波频率和压力的变化同前边模拟数据及实验数据基本一致。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1