纳米银在制备抗猪繁殖与呼吸综合征病毒药物中的应用
1.本发明涉及纳米银应用技术领域,具体涉及纳米银在制备抗猪繁殖与呼吸综合征病毒药物中的应用。
背景技术:
2.纳米材料作为新型材料因其独特性质在抗微生物方面得到广泛应用,其中纳米银(silver nanoparticles,agnps)结合了银和纳米材料的特性,表现出较强的抗微生物潜力,受到了广泛的关注和研究,已经在药物递送、诊断以及抗癌、抗菌等方面得到应用。纳米银以其较小的体积和较大的比表面积,降低银固有毒性的同时提高了与微生物的有效接触和作用。纳米银用于抗微生物的另一个优势在于不易产生耐药性,不仅作用位点多,且在微生物生长以及感染机体的多个过程中均可发挥作用。已有研究表明,纳米银对多种病毒具有抗性作用,包括新冠病毒(severe acute respiratory syndrome 2,sars-cov2)、艾滋病毒(human immunodeficiency virus,hiv)、单纯疱疹病毒(herpes simplex type,rsv)、新城疫病毒(newcastle disease virus,ndv)以及猪流行性腹泻病毒(porcine epidemic diarrhea virus,pedv)等。在抗蓝耳病毒药物方面还没有被提出和发现。
3.猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,prrsv),是猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,prrs)的病原。该病感染范围广泛,是一种高度接触性、高死亡率的传染病。此外,受感染猪免疫系统受损,易发生继发感染,给生猪健康养殖带来巨大困难。该病最早于1987年美国报道,现已遍及全球生猪养殖国家和地区,给全球养猪业造成巨大损失,我国也未能幸免。该病毒变异大,易发生重组,且一直在进行演化,从早期分离到经典美洲株和欧洲株,到2006年出现的高致病性蓝耳毒株,2008年报道的nadc30毒株以及2014年报道的类nadc30毒株,毒株多样性和复杂性,给蓝耳病毒防控带来了极大的障碍。
4.对于蓝耳病毒的防控以疫苗为主,针对不同流行株已研发了灭活苗、弱毒苗以及基因工程苗,疫苗防控特异性强。目前市面上多种药物表现出抗蓝耳病毒作用,包括etrahydroaltersolanol c、二氧化氯、25-羟基胆固醇、茶多酚、甘草甜素、表没食子儿茶素没食子酸酯、参虎败毒颗粒等。但是现有的药物交叉保护性较弱,需要探索新的抗蓝耳病毒药物,以期弥补疫苗的不足。
技术实现要素:
5.本发明的目的是提供纳米银在制备抗猪繁殖与呼吸综合征病毒药物中的应用,以解决技术中的上述不足之处。
6.为了实现上述目的,本发明提供如下技术方案:
7.纳米银在制备抗猪繁殖与呼吸综合征病毒药物中的应用。
8.作为本发明的优选方案,所述猪繁殖与呼吸综合征病毒为引起猪繁殖与呼吸综合征的病原。
9.作为本发明的优选方案,所述纳米银对猪繁殖与呼吸综合征病毒直接灭活作用。
10.作为本发明的优选方案,所述纳米银对猪繁殖与呼吸综合征病毒有抑制病毒粘附细胞的作用。
11.作为本发明的优选方案,纳米银对猪繁殖与呼吸综合征病毒有抑制入侵以及抑制病毒增殖的作用。
12.纳米银在制备抗猪繁殖与呼吸综合征病毒药物中的应用。
13.作为本发明的优选方案,所述纳米银制备药物为纳米银原液。
14.作为本发明的优选方案,所述纳米银原液浓度为30000μg
·
ml-1
,纳米银粒径大小为5-7nm,纳米银原液密度为1.01g
·
cm-3,纳米银原液ph为8.0;
15.上述药物在使用时进行稀释至对marc145细胞的安全浓度。
16.作为本发明的优选方案,所述纳米银在marc145细胞上的安全浓度≤1.5μg
·
ml-1
。
17.作为本发明的优选方案,所述纳米银在marc145细胞上的使用浓度≥0.375μg
·
ml-1
。
18.在上述技术方案中,本发明提供的技术效果和优点:
19.通过cck8法评估纳米银对marc145细胞的毒性效应,选取安全浓度进行后续抗病毒实验,使用安全浓度范围纳米银预处理细胞后感染prrsv,通过显微观察、间接免疫荧光、滴度测定、qrt-pcr方法评估纳米银对病毒感染细胞的抑制效果,通过评估纳米银对病毒直接灭活作用以及在病毒感染细胞繁殖周期包括粘附、入侵和增殖中的作用,进一步分析纳米银抗病毒的机制,证明低浓度纳米银对细胞无影响,安全浓度范围内具有良好体外抗prrsv活性,纳米银抗prrsv主要表现为对prrsv毒株的灭活作用,抑制毒株对细胞粘附、入侵以及抑制病毒的增殖,能够应用于抗猪繁殖与呼吸综合征病毒。
附图说明
20.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,还可以根据这些附图获得其他的附图。
21.图1为本发明纳米银对marc145细胞毒性效应检测结果图;
22.图2为本发明纳米银预处理marc145细胞对prrsv感染的影响显示图;
23.图3为本发明纳米银灭活prrsv效果显示图;
24.图4为本发明纳米银对prrsv粘附细胞的影响显示图;
25.图5为本发明纳米银对prrsv进入marc145细胞的影响显示图;
26.图6为本发明纳米银对prrsv增殖的影响显示图。
具体实施方式
27.为了使本领域的技术人员更好地理解本发明的技术方案,下面将结合附图对本发明作进一步的详细介绍。
28.本发明提供如下技术方案:
29.纳米银在制备抗猪繁殖与呼吸综合征病毒药物中的应用。
30.进一步的,在上述技术方案中,猪繁殖与呼吸综合征病毒为引起猪繁殖与呼吸综
合征的病原。
31.进一步的,在上述技术方案中,纳米银对猪繁殖与呼吸综合征病毒直接灭活作用。
32.进一步的,在上述技术方案中,纳米银对猪繁殖与呼吸综合征病毒有抑制病毒粘附细胞的作用。
33.进一步的,在上述技术方案中,纳米银对猪繁殖与呼吸综合征病毒毒株的抗性发挥抑制入侵以及抑制病毒增殖的作用。
34.纳米银在制备抗猪繁殖与呼吸综合征病毒药物中的应用。
35.进一步的,在上述技术方案中,纳米银制备药物为纳米银原液。
36.进一步的,在上述技术方案中,纳米银原液浓度为30000μg
·
ml-1
,纳米银粒径大小为5-7nm,纳米银原液密度为1.01g
·
cm-3
,纳米银原液ph为8.0;
37.上述药物在使用时进行稀释至对marc145细胞的安全浓度。
38.进一步的,在上述技术方案中,纳米银在marc145细胞上的安全浓度≤1.5μg
·
ml-1
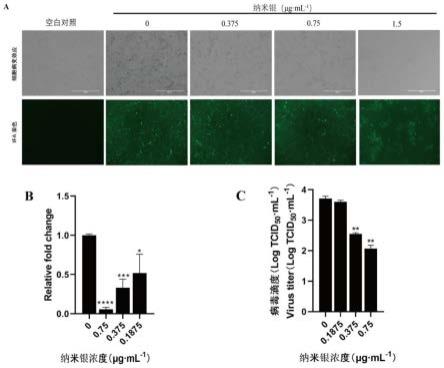
。
39.进一步的,在上述技术方案中,纳米银在marc145细胞上的使用浓度≥0.375μg
·
ml-1
。
40.本方案中还进行实验初步分析纳米银的抗病毒作用机制,实验中使用到由广东省农业科学动物卫生研究所猪病研究室分离保存的prrsv毒株和由广东省农业科学动物卫生研究所猪病研究室保存的marc145细胞系,纳米银原液采购自广东顺德正善川生物科技有限公司;
41.除上述内容外还有购自广东顺德正善川生物科技有限公司;购自gibco公司的胎牛血清、胰酶及1640基础培养基;购自median diagnostics公司的免疫荧光用抗prrsv n蛋白一抗;购自碧云天生物技术有限公司的cck8试剂盒、fitc偶联二抗;购自magen公司的病毒dna/rna提取试剂盒;购自南京诺唯赞生物科技股份有限公司的one step qrt-pcr sybr green试剂盒;最后引物合成由生工生物工程(上海)股份有限公司完成。
42.方法实现为通过cck8法评估纳米银对marc145细胞的毒性效应,选取安全浓度进行后续抗病毒实验,使用安全浓度范围纳米银预处理细胞后感染prrsv,通过显微观察、间接免疫荧光、滴度测定、qrt-pcr方法评估纳米银对病毒感染细胞的抑制效果,通过评估纳米银对病毒直接灭活作用以及在病毒感染细胞繁殖周期包括粘附、入侵和增殖中的作用,进一步分析纳米银抗病毒的机制,具体如下:
43.prrsv培养和滴度测定:
44.将prrsv病毒液接种于marc145细胞培养板,置于细胞培养箱中培养1h,弃上清,补加维持液,继续培养至病变达80%以上,于-80℃反复冻融3次,收毒;
45.将病毒液做10倍梯度稀释,共8个梯度(10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8),依次加入marc145细胞96孔板,每个梯度设10个重复,100μl/孔,置于细胞培养箱中培养1h,弃上清,补加维持液,200μl/孔,继续培养至病变完全,滴度使用reed-muench两氏法进行计算,表示为细胞半数致死量(tcid50/ml);
46.间接免疫荧光实验(ifa):
47.将感染了prrsv的marc145细胞使用4%多聚甲醛进行固定,30min后使用0.2%tritonx100通透,15min后使用1%bsa室温下封闭,30min后加入抗n蛋白的一抗(1:1000稀
释)于4℃孵育过夜,加入二抗(1:100稀释)室温孵育1h,pbs洗去未结合的二抗,补加少量pbs,于荧光显微镜下观察并拍照记录;
48.实时荧光定量反转录聚合酶链式反应(qrt-pcr):
49.提取prrsv感染的marc145细胞总rnas,qrt-pcr检测prrsv n基因的表达水平以分析prrsv的水平。体系20μl(2
×
缓冲液10μl,酶1μl,上游引物(10μm)0.4μl,下游引物(10μm)0.4μl,模板2μl,补加去离子水至20μl)。程序为:反转录(50℃3min),预变性(95℃30sec),45个循环(95℃10sec,60℃30sec),溶解曲线(95℃15sec,60℃60sec,95℃15sec);
50.引物序列参考(liu z h.et.al),具体如下:prrsv n基因上游引物:5
’‑
a-gatcatcatcgcccaacaaaac-3’,prrsv n下游引物:5
’‑
gacacaattg-ccgctcacta-3’;βactin上游引物:5
’‑
tccctggagaagagctacga-3’,βact-in下游引物:5
’‑
agcactgtgttggcgtacag-3’。使用2-δδct相对法分析基因表达量。
51.纳米银对marc145细胞毒性作用:
52.1640培养基将纳米银原液稀释成7个浓度(12、6、3、1.5、0.75、0.375、0.1875μg
·
ml-1
),依次加入marc145细胞96孔板,每个浓度设4个重复,同时设置空白对照,100μl/孔,置于细胞培养箱中培养2h,弃上清,补加维持液,100μl/孔,继续培养48h,加入cck8溶液,孵育1h,450nm测定吸光度;纳米银灭活prrsv效果分析:
53.不同浓度纳米银(0.75、0.375、0.1875μg
·
ml-1
)与0.01moi prrsv混合,置于37℃作用1h,接于长至单层且状态良好的marc145细胞,继续培养48h后,进行间接免疫荧光,或者收获培养物冻融3次测定滴度。
54.纳米银对prrsv粘附marc145细胞的影响:
55.marc145细胞铺24孔板于4℃预冷,纳米银(浓度0.75μg
·
ml-1
)与不同浓度prrsv(0.0001-0.1moi)混匀,接入预冷的marc145细胞,4℃孵育2h,弃上清,pbs洗板,加入维持液,置于细胞培养箱中继续培养48h,收获培养物,提取总rnas,qrt-pcr检测prrsv n基因表达水平;
56.纳米银对prrsv入侵marc145细胞的影响:
57.marc145细胞铺24孔板于4℃预冷,不同浓度prrsv(0.0001-0.1moi)感染细胞,4℃孵育2h,弃上清,pbs洗板,加入含纳米银(浓度0.75μg
·
ml-1
)的维持液,置于细胞培养箱中培养3h,弃上清,pbs洗板,加入维持液,继续培养48h,收获培养物,提取总rnas,qrt-pcr检测prrsv n基因表达水平;
58.纳米银对prrsv增殖的影响:
59.marc145细胞铺24孔板,感染prrsv,培养箱中孵育1h,弃上清,pbs洗板,加入维持液置于细胞培养箱中继续培养,3h、6h、12h、18h以及24h后更换为含纳米银(浓度0.75μg
·
ml-1
)的维持液,置于细胞培养箱中继续培养48h,收获培养物,提取总rnas,qrt-pcr检测prrsv n基因表达水平。数据处理和分析:
60.microsoft office excel 2016软件对试验数据进行初步处理,graphpad prism 8.0软件对试验数据进行统计学分析(two-tailed studen’s t test或two-way anova)和作图,其中p《0.05表示差异显著,用*表示,p《0.01,表示差异极显著,用**表示。
61.研究纳米银对marc145细胞毒性效应:
62.由图1可知,纳米银对marc145细胞有一定毒性,随着浓度降低,毒性逐渐减弱,至
无毒,12μg
·
ml-1
、6μg
·
ml-1
、3μg
·
ml-1
纳米银处理,细胞活率显著下降(p《0.05),1.5μg
·
ml-1
、0.75μg
·
ml-1
、0.375μg
·
ml-1
、0.1875μg
·
ml-1
纳米银处理,细胞活率与对照组无显著差异(p》0.05),选择低于1.5μg
·
ml-1
浓度纳米银为安全浓度进行后续实验。
63.纳米银预处理marc145细胞抗prrsv感染:
64.参照图2,且图中a:间接免疫荧光;b:prrsv n基因表达;c:病毒滴度测定,以不同浓度纳米银预处理marc145细胞1h,prrsv毒株感染处理后的细胞,48h后进行间接免疫荧光染色,结果如图2a所示,与无纳米银处理相比,纳米银处理细胞,prrsv病变细胞数有所减少,且随着纳米银浓度升高,病变细胞数逐渐减少,呈一定浓度依赖性;
65.为进一步验证纳米银预处理细胞抗prrsv感染效果,收集48h后感染培养物,进行prrsv n基因表达水平检测和prrsv病毒滴度测定,结果如图2b和2c所示,与无纳米银处理相比,纳米银处理细胞,prrsv n基因表达水平显著降低,随着纳米银浓度升高,n基因表达水平逐渐降低,滴度测定得到类似结果,0.1875μg
·
ml-1
纳米银预处理细胞病毒滴度与未处理细胞无差异,但随着纳米银浓度升高,病毒滴度显著逐渐降低;
66.综上所述,纳米银预处理marc145细胞对prrsv感染有一定抗性。
67.纳米银对prrsv颗粒灭活作用:
68.参照图3,且图中a:间接免疫荧光;b:病毒滴度测定,不同浓度纳米银与prrsv病毒共孵育2h,随后混合液感染marc145细胞,48h后进行间接免疫荧光染色,结果如图3a所示,与未处理prrsv相比,纳米银处理后再感染细胞,病变细胞数显著减少,且随着纳米银浓度升高,病变细胞数逐渐减少,呈浓度依赖性,1.5μg
·
ml-1
纳米银处理组无病变细胞;
69.为进一步验证纳米银对prrsv的灭活作用,收获48h感染培养物,测定病毒滴度,结果如图3b所示,与未处理prrsv相比,纳米银处理后再感染细胞,病毒滴度显著降低,且随着纳米银浓度升高,滴度逐渐降低,1.5μg
·
ml-1
纳米银处理未观察到细胞病变产生;
70.综上所述,纳米银对prrsv有抑制作用,其抑制效果随纳米银浓度升高而增强,直至完全灭活,纳米银浓度≥0.375μg
·
ml-1
。
71.纳米银对prrsv粘附marc145细胞的影响:
72.参照图4,为进一步明确纳米银抗prrsv机制,我们验证了纳米银对prrsv粘附marc145细胞的影响,结果如图4所示,纳米银处理显著降低了prrsv n基因的表达水平,感染复数为0.1时,n基因表达水平稍有下降,随着感染复数逐渐降低,n基因表达水平随着逐渐降低,呈现浓度依赖性,感染复数为0.0001时,n基因表达水平最低。
73.纳米银对prrsv入侵marc145细胞的影响:
74.参照图5,进一步验证纳米银对prrsv入侵步骤的影响,结果如图5所示,与未经纳米银处理组相比,纳米银处理显著降低了prrsv n基因的表达水平,即使较高感染复(0.1moi),n基因表达水平依然有较大幅度降低,随着感染复数逐渐降低,n基因表达水平随之降低,呈现浓度依赖性,0.001moi和0.0001moi,n基因表达水平相当,低于其他感染复数。
75.纳米银对prrsv增殖的影响:
76.参照图6,prrsv入侵细胞后,进行增殖,产生更多病毒颗粒进而扩大感染,因此进一步分析纳米银对prrsv增殖的影响,结果如图6所示,3h、6h、12h、18h、24h加入纳米银对毒株增殖均有一定抑制作用,且随着时间推后,抑制作用降低,24h接入纳米银抑制作用最弱。
77.通过上述实验从体外探索纳米银抗prrsv的效果,以及抗病毒机制,由于纳米银的
大小、形态、表面、颗粒分布以及浓度决定了纳米银的特性,同时也影响着纳米银的毒性。高浓度纳米银对细胞具有毒性效应,引起细胞死亡,随着浓度降低,毒性逐渐减小。纳米银抗病毒的前提要对细胞无毒,在安全浓度范围内分析其抗病毒效果。上述实验比对分析后纳米银对marc145细胞的毒性,选择对细胞无毒性作用的1.5μg
·
ml-1
及以下对细胞无影响的浓度为安全浓度,进行后续实验。
78.纳米银抗蓝耳病毒效果通过使用纳米银预处理marc145细胞后感染prrsv进行评价。纳米银预处理细胞后,病变细胞数可见性减少,prrsv n基因的表达量显著降低,培养物滴度同样降低,从而表明,纳米银具有良好体外抗prrsv活性。
79.prrsv的感染过程大致包括粘附、入侵和增殖,抗病毒药物的研究主要包括直接灭活病毒以及对病毒感染过程的影响。prrsv经纳米银处理后再感染marc145细胞,病变细胞数可见性减少,且培养物滴度显著性降低,由此可见,纳米银对prrsv具有一定灭活作用,此外,通过纳米银对prrsv粘附和入侵细胞过程影响的分析发现,纳米银可抑制prrsv对marc145细胞的粘附和入侵,随着感染复数降低,抑制作用逐渐增强。随后,分析了纳米银对prrsv感染marc145后增殖的影响,结果表明,感染后不同时间加入纳米银均对prrsv的增殖有一定影响,且前期加入抑制效果优于后期。以上结果与纳米银抗病毒的多靶点特性一致。
80.以上只通过说明的方式描述了本发明的某些示范性实施例,毋庸置疑,对于本领域的普通技术人员,在不偏离本发明的精神和范围的情况下,可以用各种不同的方式对所描述的实施例进行修正。因此,上述附图和描述在本质上是说明性的,不应理解为对本发明权利要求保护范围的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1