美洲大蠊在制备提高免疫力药物上的应用的制作方法
1.本发明属于美洲大蠊新应用技术领域,具体地说,涉及美洲大蠊在制备提高免疫力药物上的应用。
背景技术:
2.美洲大蠊(periplaneta americana)俗称“蟑螂”、“偷油婆”等,为蜚蠊目蜚蠊科大蠊属昆虫。中医四大经典著作之一《神农本草经》中就有记载其入药使用。谓“味咸寒;主血瘀,症坚,寒热,破积聚,喉咽痹,内寒,无子”。有研究表明美洲大蠊在地球上的进化已经超过了三亿多年,具有极强的生命力和适应能力,能够适应地球环境的变化。还能抵御外界各种恶劣的环境存活下来,因此可以判定其体内必有某些特殊的生物活性物质。
3.美洲大蠊的化学成分是药物发挥各种药理作用的物质基础,已知的美洲大蠊中化学成分主要有蛋白质、脂肪酸、核酸、多糖、信息素、昆虫神经肽、异黄酮、异香豆素等。目前市场上有许多以美洲大蠊为原料的药物被应用到临床,并取得良好的效果。
4.免疫系统是人体最重要的防御系统,正常的免疫应答赋予人体抵抗和防御感染,识别自我与非我,及时清除体内衰老、变性的细胞,监视突变细胞并将之消灭。免疫系统以网络调节形式发挥作用,免疫细胞、组织及器官的局部损害,必然会引发其他统功能紊乱。脾脏和胸腺是机体重要的淋巴器官,是各类免疫细胞的居住场所,也是对肿瘤抗原产生免疫效应的重要基地,其状态变化具有初步衡量机体免疫能力的作用。目前认为脾脏在肿瘤的早期具有正性免疫作用,抑制肿瘤的生长。也有许多动物实验表明,荷瘤宿主的胸腺常出现萎缩,胸腺细胞大量减少。目前,美洲大蠊在制备提高免疫力药物上的应用报道较少。
技术实现要素:
5.针对现有技术中上述的不足,本发明的目的在于提供美洲大蠊在制备提高免疫力药物上的应用。
6.为了达到上述目的,本发明采用的解决方案是:
7.美洲大蠊及其提取物在制备提高免疫力药物上的应用。
8.进一步地,在本发明较佳的实施例中,美洲大蠊提取物的制备包括:取美洲大蠊鲜虫并加入8倍美洲大蠊鲜虫重量的乙醇提取2次,滤过得到第一滤液;第一滤液回收乙醇并浓缩至相对密度为1.05(70℃)的稀浸膏,加入8倍浸膏量的纯水,混匀,静置,取上清液滤过得到第二滤液;第二滤液通过活性炭柱,用纯水洗脱至流出液茚三酮反应呈阴性;流出液70℃减压浓缩至相对密度为1.02(70℃)的稀浸膏,滤过得到第三滤液;第三滤液分装后灭菌即得。
9.进一步地,在本发明较佳的实施例中,乙醇的浓度为75%。
10.进一步地,在本发明较佳的实施例中,静置条件为10℃静置20h。
11.本发明提供的美洲大蠊在制备提高免疫力药物上的应用的有益效果是:研究结果表明,美洲大蠊具有抗肿瘤活性,且在抑制肿瘤生长的同时,不损伤机体,维护淋巴细胞和
t/b淋巴细胞比例,保护和增强荷瘤小鼠机体的免疫功能。
具体实施方式
12.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
13.以下结合实施例对本发明的特征和性能作进一步的详细描述。
14.实施例1
15.本实施例提供了一种美洲大蠊提取物,其制备方法包括:取美洲大蠊鲜虫并加入8倍美洲大蠊鲜虫重量的浓度为75%的乙醇提取2次,滤过得到第一滤液;第一滤液回收乙醇并浓缩至相对密度为1.05(70℃)的稀浸膏,加入8倍浸膏量的纯水,混匀,10℃静置20h,取上清液滤过得到第二滤液;第二滤液通过活性炭柱,用纯水洗脱至流出液茚三酮反应呈阴性;流出液70℃减压浓缩至相对密度为1.02(70℃)的稀浸膏,滤过得到第三滤液;第三滤液分装后灭菌即得。
16.实验例1:
17.1.实验过程:
18.(1)受试药及主要试剂:
19.实施例1提供的美洲大蠊提取物,以及注射用环磷酰胺(ctx,江苏盛迪医药有限公司,生产批号:16032225)、cd3-fitc(货号:553042,bd公司)、cd45r-pe(货号:553090,bd 公司)、cd4-pe(货号:553049,bd公司)、cd8-percp(货号:553036,bd公司)、igg、igm、 iga elisa试剂盒(瑞典mabtech公司)。
20.(2)受试药及主要试剂:
21.48只6-8周龄spf级balb/c小鼠,雌雄各半,(18
±
2)g[湖南克莱克景达实验动物有限公司,syxk(湘)2013-0004]。小鼠急性淋巴细胞白血病细胞株l1210(中国科学院上海细胞生物所)。
[0022]
(3)动物模型建立及实验分组给药:
[0023]
采用含10%fbs的deme培养液培养l1210细胞至对数生长期,用pbs将细胞调整为 1
×
107个
·
ml-1
,0.2ml
·
只-1
接种于balb/c小鼠腹腔,1周后取小鼠腹腔液,调细胞至1
×
107个
·
ml
-1
,0.2ml
·
只-1
接种于实验组小鼠右侧腋下,正常组除外。
[0024]
48只小鼠,随机分4组,每组12只。模型组及正常组给予生理盐水灌胃,20ml
·
kg-1
·
d-1
;美洲大蠊提取物组给予300mg
·
ml-1
灌胃,20ml
·
kg-1
·
d-1
;阳性组给予环磷酰胺45mg
·
kg-1
, 10ml
·
kg-1
,隔日1次腹腔注射,连续10d。
[0025]
2.检测指标项目:
[0026]
(1)胸腺指数及脾指数的测定:
[0027]
末次给药24h后,测量小鼠体重,颈椎脱臼处死。常规消毒后解剖小鼠,迅速剥离瘤体,取出胸腺和脾脏分别称重。计算抑瘤率、胸腺指数和脾指数。抑瘤率%=(1-实验组瘤重/ 模型组瘤重)
×
100%;脾(胸腺)指数=脾重(胸腺)质量(mg)/体重(g)。
[0028]
(2)外周血免疫细胞数量检测:
[0029]
小鼠末次给药24h后,经眼眶静脉取血,取20μl全血加入1.6ml血细胞稀释液(v-28d, 2015120601)中,混匀,用全血细胞仪检测小鼠外周血免疫细胞数量。
[0030]
(3)流式细胞术分析脾淋巴细胞:
[0031]
取荷瘤小鼠脾脏,用细胞网筛(cell strainer,bdfalcon)研磨制成单细胞悬液,加红细胞裂解液(新鲜配制:取nh4cl 41.5g和khco35g,溶于400ml去离子水中,用hcl调ph至7.3,定容至500ml,滤过除菌)裂解红细胞,3%fbs-pbs洗涤细胞,调细胞至1
×
107个
·
ml-1
,每个染色用1
×
106细胞,按说明书进行cd3-fitc/cd45r-pe及cd3-fitc/cd4-pe/ cd8-percp染色,facs calibur分析。
[0032]
(4)双抗体夹心elisa法测定血清免疫球蛋白水平:
[0033]
双抗体夹心elisa法测定血清免疫球蛋白水平从小鼠眼眶静脉取血,分离血清。双抗体夹心elisa法测定血清igg、igm、iga水平。操作按说明书进行。简单地说,将单克隆抗小鼠igg、igm、iga稀释至igg质量浓度1μg
·
ml-1
、igm质量浓度1μg
·
ml-1
和iga质量浓度2μg
·
ml-1
,每孔100μl加至反应板,4℃孵育过夜。经洗涤后,每孔加200μl%脱脂牛奶-pbst 封闭1h,洗涤。加入1:10000稀释的待测小鼠血清100μl,同时加入(0.5、1、10、100、500、 1000ng
·
ml-1
)的igg、igm和iga标准品,每孔100μl,置室温孵育2h,pbst洗涤。每孔加入100μl 1:500稀释的iga-alp(alkaline phosphatase,碱性磷酸酶)抗体、igg-alp抗体、 igm-alp抗体,室温放置1h,pbst洗涤。加底物pnpp(sigma)每孔100μl,室温避光30min,于各反应孔加入3mol
·
l-1
naoh 50μl终止反应。用酶标仪于405nm处测od值。使用 elisacalc软件分别拟合出小鼠血清抗体iga、igg、igm的标准曲线及拟合方程,od值经拟合方程分别换算出小鼠血清抗体含量。
[0034]
(5)统计学处理应用:
[0035]
spss17.0软件进行统计学分析,实验数据以均数
±
标准差表示,用单因素方差分析,组间比较采用lsd检验,p<0.05认为差异具有统计学意义。
[0036]
3.试验结果:
[0037]
(1)美洲大蠊提取物对小鼠l1210肿瘤的抑制作用及免疫器官的影响,结果见表1:
[0038]
表1 美洲大蠊提取物对l1210抑瘤作用及小鼠免疫器官的影响.n=12,
[0039]
组号体重/g瘤块质量/mg抑瘤率/%脾脏指数胸腺指数空白组20.12
±
0.48
‑‑
39.12
±
5.0210.12
±
3.49模型组20.22
±
0.210.45
±
0.33-36.12
±
2.787.48
±
2.98阳性组20.01
±
0.690.19
±
0.02b57.7828.46
±
6.426.28
±
2.48a美洲大蠊提取物组20.14
±
0.710.15
±
0.21b66.6740.52
±
7.43
b,c
11.96
±
5.11
b,c
[0040]
注:与正常组比较,ap<0.05;与模型组比较,bp<0.05;与阳性组比较,cp<0.05。
[0041]
表1结果表明,与模型组比,阳性组和美洲大蠊提取物组的瘤块质量均下降(p<0.05),其中美洲大蠊提取物组的抑瘤效果最为显著,高于阳性组;与模型组与阳性组比,美洲大蠊提取物组的荷瘤小鼠脾脏指数和胸腺指数增加(p<0.05)。本实验研究表明,模型组的荷瘤小鼠由于肿瘤导致机体免疫力降低进而引发脾脏指数和胸腺指数的下降,而美洲大蠊提取物能增加荷瘤小鼠脾脏和胸腺指数。
[0042]
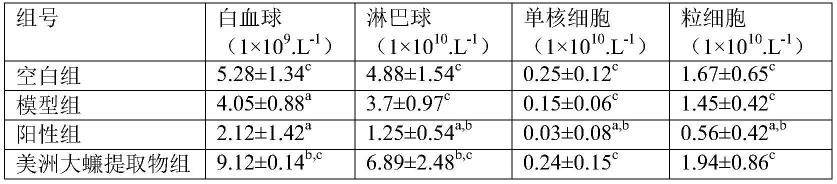
(2)美洲大蠊提取物对荷瘤小鼠外周血免疫细胞的影响,结果见表2:
[0043]
表2 美洲大蠊提取物对小鼠外周血免疫细胞的影响.n=12,
[0044][0045]
注:与正常组比较,ap<0.05;与模型组比较,bp<0.05;与阳性组比较,cp<0.05。
[0046]
表2结果表明,美洲大蠊提取物组的白细胞总数、淋巴细胞、单核细胞和粒细胞数明显高于阳性组(p<0.05)。淋巴细胞亚群的检测是评估机体细胞免疫功能状态的重要方法。实验结果显示,阳性组使外周血免疫细胞明显减少,说明对外周血具有明显的抑制作用,但美洲大蠊提取物组能促进荷瘤小鼠外周血白细胞、淋巴细胞、单核细胞及粒细胞数量的增加,提示美洲大蠊提取物能促进外周血免疫细胞增多,这可能对荷瘤小鼠的预后有积极作用。
[0047]
(3)美洲大蠊提取物对脾脏淋巴细胞的影响,结果见表3:
[0048]
表3 美洲大蠊提取物对脾脏淋巴细胞的影响.n=12,
[0049]
组号cd3
+
cd45r
+
空白组68.24
±
6.6835.28
±
7.28c模型组50.92
±
10.2441.68
±
9.88c阳性组66.89
±
12.4815.80
±
5.86
a,b
美洲大蠊提取物组58.44
±
8.5032.76
±
7.11
b,c
[0050]
注:与正常组比较,ap<0.05;与模型组比较,bp<0.05;与阳性组比较,cp<0.05。
[0051]
表3结果显示,与模型组相比,美洲大蠊提取物组的t细胞升高,但差异不具有统计学意义(p>0.05);与阳性组比较,美洲大蠊提取物组的b细胞升高(p<0.05)。说明美洲大蠊提取物组有调节t、b细胞比例的作用,使其利于抗肿瘤。
[0052]
(4)美洲大蠊提取物对小鼠血清免疫球蛋白产生的影响,结果见表4:
[0053]
表4 美洲大蠊提取物对各组小鼠血清ig含量的影响.μg
·
ml-1
,n=12,
[0054]
组号igaiggigm空白组125.88
±
12.76245.55
±
75.22
b,c
120.56
±
52.76模型组150.37
±
40.18
a,c
146.20
±
40.12a108.48
±
25.58c阳性组105.28
±
15.24122.45
±
30.74a75.68
±
12.55a美洲大蠊提取物组198.48
±
76.88
a,c
180.28
±
32.55
a,c
186.28
±
22.04
b,c
[0055]
表4结果表明,与阳性组比,美洲大蠊提取物组的iga、igg、igm升高,差异有统计学意义(p<0.05);与模型组比,美洲大蠊提取物组的igm、igg升高,差异有统计学意义(p< 0.05);阳性组的血清iga、igg、igm的含量均低。免疫球蛋白是介导体液免疫的免疫分子,在肿瘤抗原的刺激下,b淋巴细胞转化为浆细胞产生免疫球蛋白。正在使用的抗肿瘤药物损伤免疫功能的表现之一为使免疫球蛋白产生降低。本实验结果显示,阳性组的免疫球蛋白明显下降,说明阳性组对免疫球蛋白有抑制作用。模型组可从一定程度上反应机体本身抗肿瘤的体液免疫应答水平。美洲大蠊提取物组上调了iga、igg、igm含量,说明美洲大蠊提取物可能通过促进荷瘤小鼠产生抗体来发挥抗肿瘤作用。
[0056]
综上所述,通过试验数据证实,本发明提供的美洲大蠊具有抗肿瘤活性,且在抑制肿瘤生长的同时,不损伤机体,维护淋巴细胞和t/b淋巴细胞比例,保护和增强了荷瘤小鼠机体的免疫功能。
[0057]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1