一种药物制剂质量评价方法
1.本发明涉及药物评价技术领域,具体为一种药物制剂质量评价方法。
背景技术:
2.药物制剂的溶出度及溶出曲线测定是其质量评价的重要部分,许多药物制剂尤其是口服固体制剂,其溶出度及溶出曲线的快慢速度直接影响药物的治疗效果,因而通过仿制药与原研药的溶出曲线对比,是现代药物制剂疗效一致性评价的重要手段。
3.现有的药物制剂质量评价方法在使用的过程中存在着一些不足,比如准确性较低,且操作复杂,效率低,为此我们提出一种新型的药物制剂质量评价方法。
技术实现要素:
4.本部分的目的在于概述本发明的实施方式的一些方面以及简要介绍一些较佳实施方式。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
5.鉴于现有技术中存在的问题,提出了本发明。
6.因此,本发明的目的是提供一种药物制剂质量评价方法,能够实现为化瘀醒脑特效验方二次开发提供有效性和安全性的研究基础和技术支撑,具有客观的经济效益和安全健康意义。
7.为解决上述技术问题,根据本发明的一个方面,本发明提供了如下技术方案:
8.一种药物制剂质量评价方法,其包括如下步骤:
9.步骤1:受试药剂的选取与制备,选取麝香化瘀醒脑浸膏为受试药剂,每克相当于原药材5.01g,三七粉与麝香粉末;称量水提干浸膏粉19.28g,三七粉与麝香粉末6.36g,加适量水混合研磨,定容至105ml,作为原液;
10.步骤2:对照药物的选取与制备,对照药物选取辛伐他汀片;配制方法:取辛伐他汀片6片,在乳钵中研磨成细粉,加入适量0.5%cmc-na研磨制成混悬液,定容至60ml,用前振摇混匀,浓度为0.1%,给药剂重为10mg/kg;
11.步骤3:实验动物的选取以及实验环境的搭建,选取sd大鼠为实验动物,室温20~24c,日温差不超过4c,相对湿度40-70%,日光灯照明,12小时明暗相间,自动定时过滤通风换气,换气频度10次/小时;
12.步骤4:急性脑出血模型的建立,使用6%的水合氯醛(5mi/kg)对大鼠腹腔注射麻醉后,将大鼠以俯卧位固定在脑立体定位仪上,调整立体定位仪,使门齿沟的水平面比耳间线水平面低2.4mm;使前后囟处于同一水平面,剪去头顶被毛,皮肤消毒,在前囟附近沿头皮正中纵行切开1.5cm,暴露颅骨,无菌操作暴露前囟和矢状缝,以前囟为中心,于前囟前0.5mm,中线向右旁开3mm处钻一直径为0.8mm的小孔;将大鼠胸前区消毒,用微量注射器取心脏血约60μl,迅速将微量注射器通过颅骨钻孔垂直进针至尾状核部(进针深度6mm),用微
量泵按照25μl/min的速度,将大鼠自体血50μl注入至尾状核内,注血完成留针10min后再缓慢地退针,用骨蜡对颅骨钻孔进行封闭后缝合手木切口,进行常规消毒后将大鼠侧卧位放置于单独独鼠笼;
13.步骤5:分组及给药,取大鼠一批,先按体重分层后,按均衡随机法取10只作为正常对照组,10只作为假手术组,其余大鼠按照步骤4方法进行造模手术;按照体重和随机数字表将造模成功的大鼠分成5组,即模型组、麝香化瘀醒脑颗粒低剂量组、麝香化瘀醒脑颗粒中剂量组、麝香化瘀醒脑颗粒高剂量组和辛伐他汀10mg/kg组;假手术组手术操作同给药组,只行进针,不注入自体血;
14.步骤6:检测指标以及脑组织病理形态学检查;
15.神经学功能评分:造模结束后1天~3天,均参照bedersoa评分法评估神经功能损伤程度,bederson评分:轻抓大鼠尾巴,提起高于桌面10cm,正常大鼠两个前爪伸向桌面,脑损伤大鼠,其对侧前肢屈曲,姿势变化从轻度屈腕、伸肘、肩外展,到严置的腕肘屈曲、肩内旋外展,提起大鼠尾部,用手轻推大鼠肩部,直到前肢滑动几公分,不同方向重复数次;
16.脑组织病理形态学检查:给药7天后,各组大鼠麻醉后用10%甲醛灌注固定脑组织,开颅取脑组织固定液中固定,沿造模注射针孔做垂直冠状切面,分别沿额叶和枕叶方向每间隔1.5mm做垂直冠状面取材至无瘀血处,正常对照和假手术组做同部位取材;脑组织片梯度乙醇脱水,二甲苯透明、浸蜡,包埋、切片,he染色,光学显微镜下4倍物镜照相,用imageproplus5.1图像分析系统分别测量每个脑组织片尾状核区域瘀血面积,计算每只动物脑组织瘀血总面积。
17.作为本发明所述的一种药物制剂质量评价方法的一种优选方案,其中:所述步骤1中的麝香化瘀醒脑浸膏制备方法具体为:
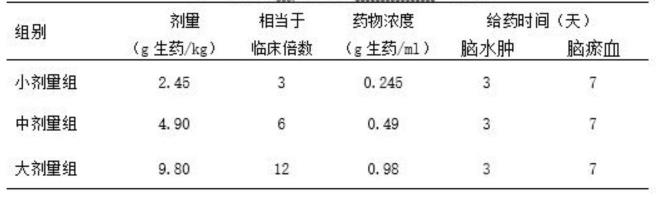
18.称量水提干浸膏粉19.28g,三七粉与麝香粉末6.36g,加适量水混合研磨,定容至105ml,作为原液;取原液60ml作为麝香化瘀醒脑颗粒高剂量组用药(溶液浓度为0.98g生药/ml,相当于临床用药量的12倍);取原液30ml加水稀释成60ml作为麝香化瘀醒脑颗粒中剂量组用药(溶液浓度为0.49g生药/ml,相当于临床用药量的6倍);取原液15ml加水稀释成60ml作为麝香化瘀醒脑颗粒低剂量组用药(溶液浓度为0.245g生药/ml,相当于临床用药量的3倍)。
19.作为本发明所述的一种药物制剂质量评价方法的一种优选方案,其中:所述步骤3中垫料选择辐照灭菌玉米芯垫料,饲料选择辐照灭菌维持饲料,喂养方式为自由摄取。
20.作为本发明所述的一种药物制剂质量评价方法的一种优选方案,其中:所述步骤5中各组大鼠灌胃给药,正常对照组、假手术组、模型组均予以等量纯水,灌胃容积均为10ml/kg,每日1次,共7次,进行神经学功能评分和脑组织病理形态学检测。
21.作为本发明所述的一种药物制剂质量评价方法的一种优选方案,其中:所述步骤6中神经学功能评分标准为:0分:无神经功能缺损;1分:前肢出现屈曲成分,不伴其他不正常;2分:侧推抵抗力下降,伴前肢屈曲,无转圈行为;3分:同2级行为,伴自发性旋转。
22.作为本发明所述的一种药物制剂质量评价方法的一种优选方案,其中:所述步骤三中,实验动物每笼5只分笼饲养,自由饮水,常规全价饲料,定时定量喂养。
23.作为本发明所述的一种药物制剂质量评价方法的一种优选方案,其中:所述步骤4中假手术组只行进针,不注入自体血,手术操作同其余各组。
24.作为本发明所述的一种药物制剂质量评价方法的一种优选方案,其中:所述步骤5还包括另取大鼠一批:分组及造模方法同上,每组6只,给药3天;用来测定脑组织含水量和sod、mda和cat水平的检测。
25.与现有技术相比,本发明的有益效果是:采用自体血液注入法复制大鼠急性脑出血模型,参照bederson评分法评估神经功能损伤程度;用苏木精-伊红(he)染色观察脑组织病理形态学变化;用干-湿重法测定各组大鼠的脑组织含水量;用生化法测定脑组织内sod、mda和cat含量,为化瘀醒脑特效验方二次开发提供有效性和安全性的研究基础和技术支撑,具有客观的经济效益和安全健康意义。
具体实施方式
26.为使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明。
27.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施方式的限制。
28.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的实施方式作进一步地详细描述。
29.实施例1
30.一种药物制剂质量评价方法,其包括如下步骤:
31.步骤1:受试药剂的选取与制备,选取麝香化瘀醒脑浸膏为受试药剂,每克相当于原药材5.01g,三七粉与麝香粉末;称量水提干浸膏粉19.28g,三七粉与麝香粉末6.36g,加适量水混合研磨,定容至105ml,作为原液;
32.步骤2:对照药物的选取与制备,对照药物选取辛伐他汀片;配制方法:取辛伐他汀片6片,在乳钵中研磨成细粉,加入适量0.5%cmc-na研磨制成混悬液,定容至60ml,用前振摇混匀,浓度为0.1%,给药剂重为10mg/kg;
33.步骤3:实验动物的选取以及实验环境的搭建,选取sd大鼠为实验动物,室温20~24c,日温差不超过4c,相对湿度40-70%,日光灯照明,12小时明暗相间,自动定时过滤通风换气,换气频度10次/小时。实验动物每笼5只分笼饲养,自由饮水,常规全价饲料,定时定量喂养;
34.步骤4:急性脑出血模型的建立,使用6%的水合氯醛(5mi/kg)对大鼠腹腔注射麻醉后,将大鼠以俯卧位固定在脑立体定位仪上,调整立体定位仪,使门齿沟的水平面比耳间线水平面低2.4mm;使前后囟处于同一水平面,剪去头顶被毛,皮肤消毒,在前囟附近沿头皮正中纵行切开1.5cm,暴露颅骨,无菌操作暴露前囟和矢状缝,以前囟为中心,于前囟前0.5mm,中线向右旁开3mm处钻一直径为0.8mm的小孔;将大鼠胸前区消毒,用微量注射器取心脏血约60μl,迅速将微量注射器通过颅骨钻孔垂直进针至尾状核部(进针深度6mm),用微量泵按照25μl/min的速度,将大鼠自体血50μl注入至尾状核内,注血完成留针10min后再缓慢地退针,用骨蜡对颅骨钻孔进行封闭后缝合手木切口,进行常规消毒后将大鼠侧卧位放置于单独独鼠笼;假手术组只行进针,不注入自体血,手术操作同其余各组;
35.步骤5:分组及给药,取大鼠一批,先按体重分层后,按均衡随机法取10只作为正常
对照组,10只作为假手术组,其余大鼠按照步骤4方法进行造模手术;按照体重和随机数字表将造模成功的大鼠分成5组,即模型组、麝香化瘀醒脑颗粒低剂量组、麝香化瘀醒脑颗粒中剂量组、麝香化瘀醒脑颗粒高剂量组和辛伐他汀10mg/kg组;假手术组手术操作同给药组,只行进针,不注入自体血。
36.另取大鼠一批:分组及造模方法同上,每组6只,给药3天;用来测定脑组织含水量和sod、mda和cat水平的检测;
37.步骤6:检测指标以及脑组织病理形态学检查;
38.神经学功能评分:造模结束后1天~3天,均参照bedersoa评分法评估神经功能损伤程度,bederson评分:轻抓大鼠尾巴,提起高于桌面10cm,正常大鼠两个前爪伸向桌面,脑损伤大鼠,其对侧前肢屈曲,姿势变化从轻度屈腕、伸肘、肩外展,到严置的腕肘屈曲、肩内旋外展,提起大鼠尾部,用手轻推大鼠肩部,直到前肢滑动几公分,不同方向重复数次;
39.脑组织病理形态学检查:给药7天后,各组大鼠麻醉后用10%甲醛灌注固定脑组织,开颅取脑组织固定液中固定,沿造模注射针孔做垂直冠状切面,分别沿额叶和枕叶方向每间隔1.5mm做垂直冠状面取材至无瘀血处,正常对照和假手术组做同部位取材;脑组织片梯度乙醇脱水,二甲苯透明、浸蜡,包埋、切片,he染色,光学显微镜下4倍物镜照相,用image pro plus5.1图像分析系统分别测量每个脑组织片尾状核区域瘀血面积,计算每只动物脑组织瘀血总面积。
40.表1麝香化瘀醒脑颗粒大鼠给药剂量设计表
[0041][0042]
其中:所述步骤1中的麝香化瘀醒脑浸膏制备方法具体为:
[0043]
称量水提干浸膏粉19.28g,三七粉与麝香粉末6.36g,加适量水混合研磨,定容至105ml,作为原液;取原液60ml作为麝香化瘀醒脑颗粒高剂量组用药(溶液浓度为0.98g生药/ml,相当于临床用药量的12倍);取原液30ml加水稀释成60ml作为麝香化瘀醒脑颗粒中剂量组用药(溶液浓度为0.49g生药/ml,相当于临床用药量的6倍);取原液15ml加水稀释成60ml作为麝香化瘀醒脑颗粒低剂量组用药(溶液浓度为0.245g生药/ml,相当于临床用药量的3倍)。
[0044]
其中:所述步骤3中垫料选择辐照灭菌玉米芯垫料,饲料选择辐照灭菌维持饲料,喂养方式为自由摄取。
[0045]
其中:所述步骤5中各组大鼠灌胃给药,正常对照组、假手术组、模型组均予以等量纯水,灌胃容积均为10ml/kg,每日1次,共7次,进行神经学功能评分和脑组织病理形态学检测。
[0046]
其中:所述步骤6中神经学功能评分标准为:
[0047]
0分:无神经功能缺损;1分:前肢出现屈曲成分,不伴其他不正常;2分:侧推抵抗力下降,伴前肢屈曲,无转圈行为;3分:同2级行为,伴自发性旋转。
[0048]
虽然在上文中已经参考实施方式对本发明进行了描述,然而在不脱离本发明的范围的情况下,可以对其进行各种改进并且可以用等效物替换其中的部件。尤其是,只要不存在结构冲突,本发明所披露的实施方式中的各项特征均可通过任意方式相互结合起来使用,在本说明书中未对这些组合的情况进行穷举性的描述仅仅是出于省略篇幅和节约资源的考虑。因此,本发明并不局限于文中公开的特定实施方式,而是包括落入权利要求的范围内的所有技术方案。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1