铁死亡抑制剂在制备防治橙黄决明素引起的肝毒性损伤药物中的应用
1.本发明涉及生物医药技术领域,更具体地,铁死亡抑制剂在制备防治橙黄决明素引起的肝毒性损伤药物中的应用。
背景技术:
2.决明子是我国常用的中药材和保健食品原料,已被列入中国卫生部发布的“药与食品同源性”清单,截至2017年含有以决明子为原料的保健食品就有400多种。近年来,由于中药和膳食补充剂的滥用,中药引起的肝毒性副作用日益突出。然而,决明子中诱发肝毒性的主要蒽醌类成分及其导致肝毒性的发生机制目前尚不明确。尤其是决明子中的蒽醌类成分本身和/或其代谢产物/或由于受试者的特殊体质对药物的超敏感性/或耐受性降低所导致的肝脏损伤作用未明。蒽醌类化合物是决明子的主要功效物质,具有降脂,抗菌、抗病毒、抗肿瘤、降血压、增加免疫功能、润肠通便,抑制血小板聚集,抗氧化、抗过氧化、抗诱变以及抗肝毒、保肝等功能。现有研究提示,蒽醌作为决明子中的主要功效物质,已被发现具有潜在的肝毒性作用,先前研究学者通过相关的实验研究表明橙黄决明素(aurantio-obtusin,ao)具有潜在的肝毒性,但具体毒作用机制未明(xul,zhangz,haof,etal.acomparativestudyofaurantio-obtusinmetabolisminnormalandliver-injuredratsbyultraperformanceliquidchromatographyquadrupoletime-of-flightmassspectrometry[j].journalofpharmaceuticalandbiomedicalanalysis,2021,196:113896;xul,lij,tangx,etal.metabolomicsofaurantio-obtusin-inducedhepatotoxicityinratsfordiscoveryofpotentialbiomarkers[j].molecules,2019,24(19):3452;xul,wangy,maz,etal.urinemetabolomicsstudyonpotentialhepatoxicbiomarkersidentificationinratsinducedbyaurantio-obtusin[j].frontiersinpharmacology,2020,11:1237.)。
[0003]
目前,凋亡是最常见的蒽醌类化合物诱导肝损伤的机制。然而,关于橙黄决明素诱导肝损伤的研究未明。因此亟需进一步开发探讨决明子致肝毒性发生的作用机制,为特殊人群安全服用决明子提供有效的肝毒性预防措施。
技术实现要素:
[0004]
本发明的目的在于克服现有技术中存在的上述缺陷和不足,提供铁死亡抑制剂在制备预防和/或治疗由橙黄决明素或决明子引起的肝毒性损伤药物中的应用。
[0005]
本发明的第二个目的在于提供铁死亡抑制剂在制备缓解由橙黄决明素或决明子引起的肝毒性损伤的产品中的应用。
[0006]
本发明的第三个目的在于提供一种药物组合物。
[0007]
本发明的上述目的是通过以下技术方案给予实现的:本发明研究发现,铁死亡抑制剂ferrostatin-1(fer-1)可显著逆转ao诱导的细胞
脂质过氧化物(lipid peroxide,lpo)水平的升高,提示ao可通过引起ros的升高,继而引起lpo的蓄积引起肝细胞的铁死亡,且铁死亡抑制剂fer-1可显著逆转ao对细胞活性的抑制。本发明揭示了橙黄决明素的肝毒性作用机制为肝细胞铁死亡方式,而铁死亡抑制剂可以有效逆转由橙黄决明素导致的肝毒性损伤。铁死亡(ferroptosis)是一种铁依赖性的,是一种由于谷胱甘肽依赖性抗氧化防御系统的失调引起细胞内lpo累积而导致的程序性细胞死亡,不同于凋亡、坏死、自噬等其他死亡途径。由此可以辅以铁死亡抑制剂,从而减少因服用决明子带来的肝毒性副作用,为特殊人群或敏感人群在服用以橙黄决明素为主要成分的决明子产品时,提供有效的肝毒性预防措施,即铁死亡抑制剂可有效预防/治疗/缓解由橙黄决明素或决明子引起的肝毒性损伤。
[0008]
因此,本发明提供铁死亡抑制剂在制备预防和/或防治由橙黄决明素或决明子引起的肝毒性损伤药物中的应用。
[0009]
铁死亡抑制剂在制备缓解由橙黄决明素或决明子引起的肝毒性损伤的产品中的应用。
[0010]
优选地,所述铁死亡抑制剂为ferrostatin-1。
[0011]
具体地,所述应用为逆转橙黄决明诱导的细胞脂质过氧化物水平升高,抑制细胞脂质过氧化物蓄积引起的肝细胞铁死亡。
[0012]
优选地,所述产品为药物或保健品。
[0013]
进一步优选地,所述药物的剂型包括注射剂、片剂、胶囊剂、口服液体剂、颗粒剂。
[0014]
本发明还提供一种药物组合物,包含橙黄决明素或决明子为活性成分,铁死亡抑制剂为辅助成分。所述药物组合物是以橙黄决明素或决明子为活性成分,发挥其具有的降脂,抗菌、抗病毒、抗肿瘤、降血压、增加免疫功能、润肠通便,抑制血小板聚集,抗氧化、抗过氧化、抗诱变以及抗肝毒、保肝等功能,同时辅以铁死亡抑制剂,从而减少因服用决明子或橙黄决明素带来的肝毒性副作用。
[0015]
优选地,所述药物组合物还包含药学上可接受的辅料。
[0016]
与现有技术相比,本发明具有以下有益效果:本发明提供了铁死亡抑制剂在制备预防和/或治疗由橙黄决明素或决明子引起的肝损伤药物中的应用。本发明揭示了橙黄决明素的肝毒性作用机制为肝细胞铁死亡方式,而铁死亡抑制剂可以有效逆转由橙黄决明素导致的肝毒性损伤。可以辅以铁死亡抑制剂,从而减少因服用决明子带来的肝毒性副作用,为特殊人群或敏感人群在服用以橙黄决明素为主要成分的决明子产品时,提供有效的肝毒性预防措施。
附图说明
[0017]
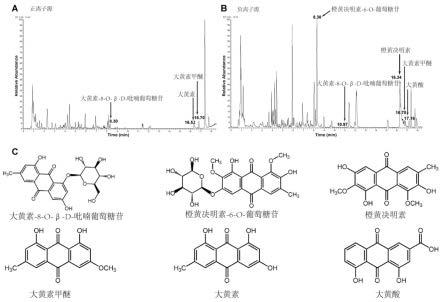
图1为决明子中主要蒽醌类成分的定性、定量分析图。其中图1中的a为在正离子模式下q-tof定性分析图,b为在负离子离子模式下q-tof定性分析图,c为鉴别出的6种蒽醌类物质的化学结构图。
[0018]
图2为ao处理肝细胞后对肝细胞的影响图。其中图2中的a为ao对hepg 2肝细胞的细胞活性影响图,b为ao对l-02肝细胞的细胞活性影响图,c为ao对wrl68肝细胞的细胞活性影响图,d为ao对hepg 2肝细胞的alt、ast和ldh水平影响图,e为ao对l-02肝细胞alt、ast和ldh水平影响图,f为ao对wrl68肝细胞alt、ast和ldh水平影响图。
[0019]
图3为ao及ao+铁死亡抑制剂fer-1处理肝细胞对肝细胞lpo及细胞活性的影响图。其中图3中的a为ao及ao+铁死亡抑制剂处理hepg 2肝细胞后的细胞染色图,b为ao及ao+铁死亡抑制剂处理l-02肝细胞后的细胞染色图,c为ao及ao+铁死亡抑制剂处理wrl68肝细胞后的细胞染色图,d为ao及ao+铁死亡抑制剂fer-1处理hepg 2肝细胞后对肝细胞lpo的影响图,e为ao及ao+铁死亡抑制剂fer-1处理l-02肝细胞后对肝细胞lpo的影响图,f为ao及ao+铁死亡抑制剂fer-1处理wrl68肝细胞后对肝细胞lpo的影响图,g为ao及ao+铁死亡抑制剂处理hepg 2肝细胞后对肝细胞活性的影响图,h为ao及ao+铁死亡抑制剂处理l-02肝细胞后对肝细胞活性的影响图,i为ao及ao+铁死亡抑制剂处理wrl68肝细胞后对肝细胞活性的影响图。
具体实施方式
[0020]
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0021]
除非特别说明,以下实施例所用试剂和材料均为市购。
[0022]
实施例1 决明子水提液中主要蒽醌类成分的定性、定量分析(1)称取250.0 g决明子,加入3 l超纯水,加热保沸30 min,经无纺布过滤后,收集得到提取液1;(2)向过滤后的决明子再次加入3 l超纯水,加热保沸30 min,经无纺布过滤收集得到提取液2;(3)合并提取液1和2,减压蒸馏(60 ℃,0.1 mp),得到108 g决明子水提液,即每克决明子水提液相当于2.3 g决明子。
[0023]
(4)将决明子水提液稀释50倍后,经过0.22 μm滤头过滤,14000 g离心10 min后取上清;(5)采用lc-ms/ms,相色谱柱为hypersil gold(100
×
2.1 mm,1.9 μm),柱温45℃,流动相为a相0.1 %甲酸水和b相乙腈,每次进样量为20 μl;(6)扫描结果与thermo公司数据库中化合物数据进行比对,筛选出决明子浓缩液中所含的蒽醌类化合物。
[0024]
结果如图1所示,通过实验,经筛选,其中蒽醌类化合物共6种,分别为橙黄决明素-6-o-葡萄糖苷、橙黄决明素、大黄素甲醚、大黄素、大黄素-8-o-β-d-吡喃葡萄糖苷、大黄酸,图1中a为在正离子模式下q-tof定性结果,图1中b为在负离子模式下q-tof定性结果,图1中c为6种蒽醌类化合物的化学结构。进一步对决明子浓缩液中橙黄决明素-6-o-葡萄糖苷、橙黄决明素、大黄素甲醚、大黄素、大黄素-8-o-β-d-吡喃葡萄糖苷、大黄酸这六种蒽醌类化合物定量分析,其结果如表1所示,橙黄决明素在6种蒽醌类化合物中含量最高,可达42.72μg/ml。
[0025]
表1 决明子浓缩液中蒽醌类物质的含量蒽醌类化合物含量(μg/ml)橙黄决明素42.72橙黄决明素-6-o-葡萄糖苷37.13
大黄酸0.81大黄素-8-o-β-d-吡喃葡萄糖苷0.08大黄素《0.01大黄素甲醚小于检测限实施例2 橙黄决明素致肝细胞的毒性作用探索橙黄决明素(aurantio-obtusin,ao)致肝损伤作用和机制包括如下步骤:体外培养hepg 2、l-02和wrl68三种细胞系,将ao加入到所述的细胞系中,得到肝损伤细胞系模型。具体步骤如下所示:(1)细胞培养:hepg 2和wrl68细胞系使用高糖dmem完全培养基培养,l-02细胞系用rpmi-1640完全培养基培养。完全培养基按每500 ml基础培养基、55 ml胎牛血清和5.5 ml双抗(青霉素、链霉素)混合。
[0026]
(2)细胞活性检测(mts实验):取对数生长期细胞接种于96孔板内,接种数量为6000每孔,每孔含100 μl完全培养基。经过夜贴壁,将ao在dmso中溶解,配制为400 μm浓度进行梯度染毒,共有1.6,3.1,6.3,12.5,25,50,100,200,400 μm共9个剂量组,同时设置阴性对照组,每组6个副孔。染毒48小时后,弃上清,100 μl pbs清洗细胞,加入100 μl mts应用液(每5份体积完全培养基加入1份体积mts),继续培养3小时。最后用酶标仪测定450 nm处各孔吸光值(absorbance,a),计算出细胞活力。计算公式为:细胞活力(%)=[a(处理组)-a(培养基组)]/[a(阴性对照组)-a(培养基组)]
×
100 %,同时对各细胞的剂量-活性关系进行拟合,得出受试物对各细胞的半数抑制浓度(ic
50
)。
[0027]
结果如图2中a-c所示,ao对各细胞的半数抑制浓度(ic
50
)分别为hepg 2细胞:24 h(ic
50
=480 μm)、48 h(ic
50
=240 μm)、72 h(ic
50
=540 μm);l-02细胞:24h(ic
50
=500μm)、48h(ic
50
=120μm)、72 h(ic
50
=140 μm);wrl68细胞:24h(ic
50
=480 μm)、48 h(ic
50 =200 μm)、72 h(ic
50 =500 μm)。
[0028]
(3)取对数生长期,状态良好的hepg 2、l-02和wrl68细胞制成细胞悬液,按1.5
×
105每孔的数量接种于6孔板中,于5% co2细胞培养箱中37 ℃培养12 h以上,待细胞贴壁后,根据步骤(2)的ic
50
结果,以3种肝细胞系以各自对应的1/4 ic
50
、1/8 ic
50
、1/16 ic
50
剂量进行染毒,处理时间48 h。
[0029]
(4)肝细胞生化指标(alt、ast、ldh)检测:经步骤(3)处理的细胞,收集细胞上清,1000 rpm离心5 min,收集离心后的上清液用于生化检测。
[0030]
结果如图2中d-f所示,其对应的ao染毒浓度分别为hepg 2细胞:0、15、30、60 μm;l-02细胞:0、7.5、15、30 μm;wrl68细胞:0、12.5、25、50 μm;ao染毒48 h,可显著诱发hepg 2、l-02和wrl68细胞的alt、ast、ldh水平升高,ao的染毒浓度与三个肝细胞系的ldh、ast和alt水平的增加呈剂量反应趋势,表明了ao可诱导肝细胞的损伤。
[0031]
实施例3 橙黄决明素诱导肝细胞损伤检测(1)细胞脂质过氧化物(lipid peroxide,lpo)水平检测:a、将灭菌后的盖玻片置于6孔板内。取对数生长期,状态良好的hepg 2、l 02和wrl68细胞制成细胞悬液,按2
×
105每孔的数量接种于6孔板中,于5% co2细胞培养箱中37 ℃培养12 h以上,待细胞贴壁后用pbs轻柔冲洗三遍,洗去培养基中。将1支liperfluo染料用dmso充分溶解后,用pbs稀释至60 ml(实际浓度为1 μm),于细胞培养箱中用liperfluo染
液孵育细胞30 min。孵育结束后以无血清培养基洗去染液待用。
[0032]
b、ao处理细胞,浓度分别为hepg 2细胞:0、15、30、60 μm;l-02细胞:0、7.5、15、30 μm;wrl68细胞:0、12.5、25、50 μm。另设ao+铁死亡抑制剂(fer-1,1 μm)处理组。处理2 h后,冷pbs清洗细胞爬片3次,加20 μl的dapi后倒扣在载玻片上,避光孵育5 min后于524 nm激发波长下采集图像,用imagej软件计算胞内lpo水平。
[0033]
(2)细胞活性检测:浓度分别为hepg 2细胞:0、15、30、60 μm;l-02细胞:0、7.5、15、30 μm;wrl68细胞:0、12.5、25、50 μm。另设ao+铁死亡抑制剂(fer-1,1 μm)处理组。处理48 h后,mts法检测细胞活性。
[0034]
结果如图3所示,ao的染毒浓度与三种肝细胞的lpo水平的升高呈剂量反应趋势,且铁死亡抑制剂fer-1可显著逆转ao诱导的lpo水平的升高,提示ao可通过引起ros的升高,继而引起lpo的蓄积引起肝细胞的铁死亡(图3中a-f)。ao的染毒浓度与三种肝细胞的活性抑制呈剂量反应趋势,且铁死亡抑制剂fer-1可显著逆转ao对细胞活性的抑制(图3中g-i)。
[0035]
本发明揭示了ao的肝毒性作用机制为肝细胞铁死亡方式,而铁死亡抑制剂可以有效逆转由ao导致的肝毒性损伤,这为特殊人群或敏感人群在服用以ao为主要成分的决明子产品时,可以辅以铁死亡抑制剂,从而减少因服用决明子带来的肝毒性副作用,为特殊人群安全服用决明子提供有效的肝毒性预防措施。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1