一种β-大马烯酮的新用途
一种
β-大马烯酮的新用途
技术领域
1.本发明属于免疫学技术领域,涉及一种β-大马烯酮(da)的新用途,尤其涉及一种da在制备炎症性疾病药物或在制备抑制nlrp3炎症小体活化的药物中的应用。
背景技术:
2.nlrp3炎症小体是先天免疫系统的重要组成部分之一,在痛风性关节炎、ⅰ型糖尿病以及炎症性肠病等多种炎症相关疾病的发生起重要作用。nlrp3能够识别病原相关分子模式(pamps)或宿主来源的危险信号分子(damps)而发生活化。nlrp3炎症小体的激活需要两个信号,分别发生在转录和转录后水平:第一个信号来源于细胞外刺激(例如病原菌来源的脂多糖lps),该信号诱导nlrp3,pro-il-1β和pro-il-18的表达并使其处于适当的修饰状态;第二信号是触发nlrp3炎症小体激活的关键机制,能诱发这个信号的因素有多种,例如孔隙的形成和钾离子的外流,溶酶体的不稳定,以及线粒体活性氧(ros)的生成等。细胞内nlrp3对特定配体(如damps)的感知导致了关键适配器蛋白asc的招募和寡聚化,asc通过其caspase激活和招募域(card)促进了caspase-1随后的招募形成蛋白复合体,称为炎症小体。炎症小体的形成为pro-caspase-1的激活提供一个平台使其自活化,活化的caspase-1随后促进细胞因子il-1β和il-18前体的成熟和分泌,同时导致caspase-1依赖形式的细胞程序性死亡,称为细胞焦亡。nlrp3炎症小体活化产生的il-1β等细胞因子以及其所介导的细胞焦亡已经被证实在抗感染以及多种炎症性疾病的发病机制中起着至关重要的作用。一方面,nlrp3炎症小体的活化介导的免疫反应能有效抑制病原微生物的侵入,另一方面,炎症小体过度活化能引发机体持续的免疫反应而造成组织损伤,从而参与多种炎症性疾病的发生。因此,在非感染调节下,有效调控组织内nlrp3炎症小体的多种激活和抑制因素的平衡是避免炎症发展的关键因素。
3.目前针对nlrp3炎症小体及其下游信号通路的治疗药物,如il-1β单克隆抗体也已经被证明对结肠炎等疾病患者有效。在动物模型的研究中,多种遗传突变引发的炎症也与nlrp3炎症小体的活化有关。近年来的研究表明,包括吴茱萸碱在内的多种天然化合物能够通过抑制nlrp3炎症小体而起到抑制炎症性疾病的作用,而这些化合物大多还没有实现临床应用,同时其具体的作用机制和毒副作用还需要进一步评估。寻找对nlrp3炎症小体有抑制作用的天然化合物也成为目前炎症性疾病治疗领域的研究热点。
技术实现要素:
4.有鉴于此,本发明目的在于提供一种da在制备炎症性疾病药物中的应用,β-大马烯酮通过抑制nrf2的降解和核转位实现对nlrp3炎症小体活化的抑制,为痛风性关节炎和ⅰ型糖尿病等nlrp3炎症小体介导的炎症性疾病的治疗提供了新的候选药物。
5.da是一种芳香类化合物,是大马士革玫瑰精油中香气的主要成分之一,具有浓郁花香和果香气味,是一种天然香料。研究发现da在各种茶叶以及一些水果中广泛存在,也是酒水中重要香气化合物的主要成分。目前da主要用于配制高档日化用品和食用香精,也可
以用于烟草的调香,是一种安全的天然香料。
6.本发明提供了da在制备炎症性疾病药物中的应用,所述炎症性疾病药物为用于治疗炎症性疾病的药物,所述炎症性疾病为nlrp3炎症小体介导的炎症性疾病。该药物为通过抑制nlrp3炎症小体活化治疗炎症性疾病的药物。
7.本发明还提供了da在制备抑制nlrp3炎症小体活化的药物中的应用。该药物为通过抑制nrf2的降解和核转位抑制nlrp3炎症小体活化的药物。
8.与现有技术相比,本发明中da通过抑制nrf2的降解和核转位实现对nlrp3炎症小体活化的的抑制,为痛风性关节炎和ⅰ型糖尿病等nlrp3炎症小体介导的炎症性疾病的治疗提供了新的候选药物。
附图说明
9.图1是本发明实施例2中pma-thp-1细胞中nlrp3炎症小体活化引起的il-1β、il-18和il-6分泌情况图:其中,图1a是a-f组pma-thp-1细胞il-1β分泌情况图;图1b是a-f组pma-thp-1细胞il-18分泌情况图;图1c是a-f组pma-thp-1细胞il-6分泌情况图;
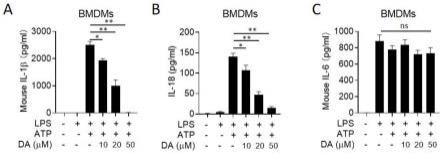
10.图2是本发明实施例3中bmdm细胞中nlrp3炎症小体活化引起的il-1β、il-18和il-6分泌情况图:其中,图2a是a-f组bmdm细胞il-1β分泌情况图;图2b是a-f组bmdm细胞il-18分泌情况图;
11.图2c是a-f组bmdm细胞il-6分泌情况图;
12.图3是本发明实施例4中bmdm细胞中da对nrf2降解、核转位以及nrf2调控的抗氧化因子nqo1、gclmm和ho-1表达的影响情况图:其中,图3a是a-d组bmdm细胞中da对nrf2降解和核转位的影响情况图;图3b是a-c组bmdm细胞中da对nrf2介导的抗氧化因子nqo1、gclmm和ho-1表达的影响情况图。
13.图4是本发明实施例4中nrf2敲减对da抑制nlrp3炎症小体作用的影响情况图:其中,图4a是nrf2敲减后da对a-d组pma-thp-1细胞中il-1β分泌的影响情况图;图4b是nrf2敲减后da对a-d组pma-thp-1细胞中il-6分泌的影响情况图;图4c是nrf2敲减对a-d组pma-thp-1细胞中nrf2表达的影响情况图;图4d是nrf2敲减后da对a-d组bmdm细胞中il-1β分泌的影响情况图;图4e是nrf2敲减后da对a-d组bmdm细胞中il-6分泌的影响情况图;图4f是nrf2敲减对a-d组bmdm细胞中nrf2表达的影响情况图。
具体实施方式
14.根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
15.实施例1:制备用于nlrp3炎症小体活化实验的细胞
16.本发明选取人类单核细胞株thp-1细胞诱导分化的巨噬细胞(pma-thp-1)或小鼠骨髓来源巨噬细胞(bmdm)用于nlrp3炎症小体活化模型的建立。
17.(1)pma-thp-1人类巨噬细胞的诱导
18.人类单核细胞株thp-1细胞计数后用新鲜rpmi1640培养液重悬,培养液中加入pma使终浓度为20ng/ml,37℃孵育30min,然后用pbs洗细胞1次,重悬细胞并调整细胞悬液为
1x106/ml,铺入12孔板,每孔1ml,将细胞移至37℃培养箱静息36h,中间更换新鲜培养液1次,静息结束的细胞(后简称pma-thp-1)可用于nlrp3炎症小体活化实验。
19.(2)小鼠bmdm巨噬细胞的制备
20.选取野生型及其同窝基因缺陷小鼠,co2法处死小鼠,置于解剖板上,用70%乙醇进行腹部和后腿皮肤消毒;用解剖器械取出小鼠股骨和胫骨,在70%乙醇中浸泡5-6秒后置于10cm培养皿中;用手术剪去除股骨和胫骨两端使骨髓腔充分暴露;用10cm注射器吸取dmem培养液,将骨髓腔中骨髓冲出;将冲出的骨髓吸入注射器中然后吹出,反复几次使骨髓破碎释放出骨髓细胞;使骨髓细胞悬液通过100μm滤器去除大颗粒杂质;常温1000g,离心5分钟收集细胞;加入10ml红细胞裂解液,37℃孵育10min;加入2倍体积细胞培养液后常温1000g离心5分钟收集细胞;用10ml细胞培养液重悬细胞并计数;将107细胞置入10cm培养皿中,加入m-csf(20ng/ml)诱导细胞分化;取第6天的细胞(后简称bmdm)用于nlrp3炎症小体的活化实验。
21.实施例2:da显著抑制人类巨噬细胞nlrp3炎症小体的活化
22.(1)实验方法:
23.将pma-thp-1铺12孔板,每孔1x106细胞,37℃培养箱培养过夜后分为a-f六组,针对各组进行如下处理(对照组加入的dmso是da的溶剂,a-c组加入的dmso的体积与d-f组加入的da体积相等):
24.a.对照组:静息6h后,加dmso,1h后收集细胞上清液;
25.b.lps处理组:加入lps(500ng/ml)刺激细胞6h后,加dmso,1h后收集细胞上清液;
26.c.lps+atp组:加入lps(500ng/ml)刺激细胞6h,加dmso,30min后,加入atp(5mm)刺激30min,收集细胞上清液;
27.d.lps+atp+da(10μm)组:加入lps(500ng/ml)刺激细胞6h后,加入da(10μm)刺激30min,然后加入atp(5mm)刺激30min,收集细胞上清液;
28.e.lps+atp+da(20μm)组:加入lps(500ng/ml)刺激细胞6h后,加入da(20μm)刺激30min,然后加入atp(5mm)刺激30min,收集细胞上清液;
29.f.lps+atp+da(50μm)组:加入lps(500ng/ml)刺激细胞6h后,加入da(50μm)刺激30min,然后加入atp(5mm)刺激30min,收集细胞上清液;
30.细胞因子检测:将a-f组收集到的细胞上清液用elisa方法检测其中il-1β和il-18的分泌情况,以il-6为对照,判断nlrp3炎症小体的活化情况。
31.(2)实验结果
32.a-f组pma-thp-1细胞中,nlrp3炎症小体活化引起的il-1β、il-18和il-6分泌情况如图1所示;其中,从图1a可以看出,与空白对照组和lps单独刺激组相比,lps和atp刺激使pma-thp-1细胞分泌il-1β的量显著增加,而da预刺激能够显著抑制pma-thp-1细胞il-1β的分泌,且呈浓度依赖性(da10μm时,p《0.05;da20μm和50μm时,p《0.01);图1b表明,与空白对照组和lps单独刺激组相比,lps和atp刺激使pma-thp-1细胞分泌il-18的量显著增加,da预刺激显著抑制该细胞il-18的分泌,且呈浓度依赖性(da10μm时,p《0.05;da20μm和50μm时,p《0.01);图1c表明,与空白对照组相比,lps刺激使pma-thp-1细胞分泌il-6的量显著增加,atp刺激对il-6的分泌没有影响。da预刺激和atp对il-6的分泌没有影响(ns:各组间没有统计学差异)。
33.综上,从图1可以看出,da能够显著抑制pma-thp-1细胞中nlrp3炎症小体的两个标志细胞因子il-1β和il-18的分泌,证明da对人类巨噬细胞nlrp3炎症小体的活化有显著的抑制作用。
34.实施例3:da显著抑制小鼠巨噬细胞nlrp3炎症小体的活化
35.(1)实验方法:
36.首先将bmdm细胞铺12孔板,每孔1x106细胞,37℃培养箱培养过夜后分为a-f六组,针对各组进行如下处理:
37.a.对照组:静息6h后,加dmso,1h后收集细胞上清液;
38.b.lps处理组:加入lps(500ng/ml)刺激细胞6h后,加dmso,1h后收集细胞上清液;
39.c.lps+atp组:加入lps(500ng/ml)刺激细胞6h,加dmso,30min后,加入atp(5mm)刺激30min,收集细胞上清液;
40.d.lps+atp+da(10μm)组:加入lps(500ng/ml)刺激细胞6h后,加入da(10μm)刺激30min,然后加入atp(5mm)刺激30min,收集细胞上清液;
41.e.lps+atp+da(20μm)组:加入lps(500ng/ml)刺激细胞6h后,加入da(20μm)刺激30min,然后加入atp(5mm)刺激30min,收集细胞上清液;
42.f.lps+atp+da(50μm)组:加入lps(500ng/ml)刺激细胞6h后,加入da(50μm)刺激30min,然后加入atp(5mm)刺激30min,收集细胞上清液;
43.细胞因子检测:将a-f组收集到的细胞上清液用elisa方法检测其中il-1β和il-18的分泌情况,以il-6为对照,判断nlrp3炎症小体的活化情况。
44.(2)实验结果
45.a-f组bmdm细胞中,nlrp3炎症小体活化引起的il-1β、il-18和il-6分泌情况如图2所示;从图2a可以看出,与空白对照组和lps单独刺激组相比,lps和atp刺激使bmdm细胞分泌il-1β的量显著增加,而da预刺激能够显著抑制bmdm细胞il-1β的分泌,且呈浓度依赖性(da10μm时,p《0.05;da20μm和50μm时,p《0.01);图2b表明,与空白对照组和lps单独刺激组相比,lps和atp刺激使bmdm细胞分泌il-18的量显著增加,da预刺激显著抑制该细胞il-18的分泌,且呈浓度依赖性(da10μm时,p《0.05;da20μm和50μm时,p《0.01);图2c表明,与空白对照组相比,lps刺激使bmdm细胞分泌il-6的量显著增加,atp刺激对il-6的分泌没有影响,da预刺激和atp对il-6的分泌没有影响(ns:各组间没有统计学差异)。
46.从图2可以看出,da能够显著抑制bmdm细胞中il-1β和il-18的分泌,证明da对小鼠巨噬细胞nlrp3炎症小体的活化有显著的抑制作用。
47.实施例4:nrf2敲减阻断da对nlrp3炎症小体的抑制
48.(1)检测da对nrf2降解和核转位的影响
49.首先将bmdm细胞铺12孔板,每孔1x106细胞,37℃培养箱培养过夜后分为a-d四组,针对各组进行如下处理:
50.a.lps处理组:,加入lps(500ng/ml)刺激细胞6h后,加dmso,1h后收集细胞;
51.b.lps+atp组:加入lps(500ng/ml)刺激细胞6h,加dmso,30min后,加入atp(5mm)继续刺激30min,最后收集细胞;
52.c.lps+atp+da(10μm)组:首先加入lps(500ng/ml)刺激细胞6h后,接下来加入da(10μm)刺激30min,然后加入atp(5mm)刺激30min,最后收集细胞;
53.d.lps+atp+da(20μm)组:首先加入lps(500ng/ml)刺激细胞6h后,接下来加入da(20μm)刺激30min,然后加入atp(5mm)刺激30min,最后收集细胞
54.细胞蛋白检测:将a-d组收集到的细胞提取胞浆蛋白和核蛋白,然后用westernblot方法检测nrf2在各处理组细胞胞浆和细胞核中的表达,以此判断da对nrf2降解和核转位的影响。检测结果如图3a所示。
55.根据图3a可知,与lps处理组相比,lps+atp刺激诱导了bmdm胞浆(cytosol)中nrf2的降解,而da预刺激显著抑制了bmdm胞浆中nrf2的降解;与lps处理组相比,lps+atp刺激对nrf2的核转位(nucleus)没有显著影响,而da预刺激显著促进了nrf2的核转位。
56.(2)检测da对nrf2介导的抗氧化因子表达的影响
57.首先将bmdm细胞铺12孔板,每孔1x106细胞,37℃培养箱培养过夜后分为a-c三组,针对各组进行如下处理:
58.a.lps+atp对照组:加入lps(500ng/ml)刺激细胞6h,加dmso,30min后,然后加入atp(5mm)刺激30min,最后收集细胞;
59.b.lps+atp+da(10μm)组:首先加入lps(500ng/ml)刺激细胞6h后,接下来加入da(10μm)刺激30min,然后加入atp(5mm)刺激30min,最后收集细胞;
60.c.lps+atp+da(20μm)组:首先加入lps(500ng/ml)刺激细胞6h后,接下来加入da(20μm)刺激30min,然后加入atp(5mm)刺激30min,最后收集细胞
61.细胞nrf2介导的抗氧化因子检测:将a-c组收集到的细胞提取总rna并进行反转录,然后用实时荧光定量pcr方法检测nrf2介导的抗氧化分子nqo1、gclmm和ho-1在各处理组细胞中的表达,以此判断da对nrf2介导的抗氧化因子表达的影响。
62.a-c组bmdm细胞中,da对nrf2介导的抗氧化因子nqo1、gclmm和ho-1表达的影响情况如图3b所示。与lps+atp对照组相比,da预刺激显著促进了nqo1(图3b左)、gclmm(图3b中)和ho-1(图3b右)的表达(p《0.01)。图3b所示结果证明,da能够显著促进小鼠巨噬细胞中nrf2介导的抗氧化因子nqo1、gclmm和ho-1的表达。
63.(3)检测nrf2敲减对da抑制nlrp3炎症小体作用的影响
64.首先将pma-thp-1细胞和bmdm细胞分别铺12孔板,每孔1x106细胞,37℃培养箱培养过夜后,均分为a-d四组,针对各组进行如下处理:
65.a:lps+atp+sictrl组:转染sictrl使终浓度为50nm,48h后加入lps(500ng/ml)刺激细胞6h,然后加入atp(5mm)刺激30min,最后收集细胞和细胞培养上清液;
66.b:lps+atp+sictrl+da组:转染sictrl使终浓度为50nm,48h后加入lps(500ng/ml)刺激细胞6h,接下来加入da(10μm)刺激30min,然后加入atp(5mm)刺激30min,最后收集细胞和细胞培养上清液;
67.c:lps+atp+sinrf2组:转染sinrf2使终浓度为50nm,48h后加入lps(500ng/ml)刺激细胞6h,然后加入atp(5mm)刺激30min,最后收集细胞和细胞培养上清液;
68.d:lps+atp+sinrf2+da组:转染sinrf2使终浓度为50nm,48h后加入lps(500ng/ml)刺激细胞6h,接下来加入da(10μm)刺激30min,然后加入atp(5mm)刺激30min,最后收集细胞和细胞培养上清液;
69.细胞因子和nrf2敲减效率检测:将a-d组收集到的细胞通过elisa方法检测细胞培养上清液中il-1β的分泌情况,并用il-6作为对照,以此判断nrf2在da抑制nlrp3炎症小体
活化中的作用。通过western blot方法检测细胞裂解液中nrf2的表达情况判断sirna对nrf2的敲减效率。
70.a-d组pma-thp-1细胞中,转染nrf2敲减对da抑制nlrp3炎症小体作用的影响情况如图4a-c所示。图4a是nrf2敲减后da对a-d组pma-thp-1细胞分泌il-1β的影响情况:转染sictrl的两组细胞中,与lps+atp+sictrl组相比,da预刺激能够显著抑制细胞中il-1β的分泌(p《0.01);而转染sinrf2的两组细胞中,与lps+atp+sinrf2组相比,da预刺激对细胞il-1β的分泌没有影响(ns:各组间没有统计学差异)。图4b是nrf2敲减后da对a-d组pma-thp-1细胞分泌il-6的影响情况:转染sictrl和转染sinrf2的四组细胞中,da预刺激对细胞il-6的分泌都没有影响(ns:各组间没有统计学差异)。图4c是nrf2敲减对a-d组pma-thp-1细胞中nrf2表达的影响情况:转染sictrl的两组细胞中,与lps+atp+sictrl组相比,da预刺激能够促进了细胞中nrf2的表达;而转染sinrf2的两组细胞中,与lps+atp+sinrf2组相比,da预刺激对细胞nrf2的表达也有一定促进作用,然而与转染sictrl的细胞相比,da对nrf2的促进作用显著降低。可见,sinrf2的转染对nrf2有显著的敲减效果。图4a-c的结果证明,nrf2的敲减阻断了da对pma-thp-1细胞中nlrp3炎症小体的抑制作用。
71.a-d组bmdm细胞中,转染nrf2敲减对da抑制nlrp3炎症小体作用的影响情况如图4d-f所示。图4d是nrf2敲减后da对a-d组bmdm细胞分泌il-1β的影响情况:转染sictrl的两组细胞中,与lps+atp+sictrl组相比,da预刺激能够显著抑制细胞中il-1β的分泌(p《0.01);而转染sinrf2的两组细胞中,与lps+atp+sinrf2组相比,da预刺激对细胞il-1β的分泌没有影响(ns:各组间没有统计学差异)。图4e是nrf2敲减后da对a-d组bmdm细胞分泌il-6的影响情况:转染sictrl和转染sinrf2的四组细胞中,da预刺激对细胞il-6的分泌都没有影响(ns:各组间没有统计学差异)。图4f是nrf2敲减对a-d组bmdm细胞中nrf2表达的影响情况:转染sictrl的两组细胞中,与lps+atp+sictrl组相比,da预刺激能够促进了细胞中nrf2的表达;而转染sinrf2的两组细胞中,与lps+atp+sinrf2组相比,da预刺激对细胞nrf2的表达也有一定促进作用,然而与转染sictrl的细胞相比,da对nrf2的促进作用显著降低。可见,sinrf2的转染对nrf2有显著的敲减效果。图4d-f的结果证明,nrf2的敲减阻断了da对bmdm细胞中nlrp3炎症小体的抑制作用。
72.综上所述,da对pma-thp-1和bmdm细胞中nlrp3炎症小体的抑制作用是通过nrf2实现的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1