一种利多卡因衍生物在制备防治肠道屏障损伤产品中的应用的制作方法
1.本发明涉及生物医药领域,具体涉及一种利多卡因衍生物在制备防治肠道屏障损伤产品中的应用。
背景技术:
2.肠道是人体消化系统的重要功能性器官,起着消化吸收营养的作用,同时具有屏障功能,由肠上皮细胞和胞间连接复合体组成,形成的机械屏障具有高度选择性和致密性,是机体对抗细菌和毒素的第一道防线。肠道亦是全身应激反应的重要靶器官,肠道屏障破坏是全身炎症反应综合征、多器官功能障碍综合征的重要诱因。在诸多疾病中均会有肠屏障功能受损的困扰,如肝硬化、创伤、炎性肠炎、失血性休克、急性胰腺炎及肠易激综合征等,最终导致肠屏障通透性增加,继而可引发肠功能衰竭、腹部高敏反应、细菌移位,严重者可诱发多脏器官衰竭。
3.临床上多使用糖皮质激素以及抗生素治疗,长时间使用这些药物会产生极大的毒性且容易产生耐药性。目前,预防和修复肠屏障损伤的药物研究已成为相关疾病的关注热点,例如营养补充、肥大细胞抑制剂、粘膜保护剂和外泌体调节因子等,但是尚在药物开发的早期阶段。所以,针对肠粘膜屏障保护为目标的药物研发,俨然成为治疗这类疾病的重要方向。
4.利多卡因是临床上常用的酰胺类局部麻醉药,除镇痛作用外,现代研究发现其还具有抗心律失常、抗肿瘤、抗炎及治疗支气管哮喘和脑保护等作用。2-(二乙氨基)-n-(2,5-二甲基苯基)乙酰胺,又名jm25-1,或利多卡因杂质j,作为利多卡因同分异构体,具有弱于利多卡因的麻醉作用,但存在强于利多卡因的抗炎活性。已被证明其具有抗支气管痉挛的疗效,但其在肠道屏障中的作用尚未可知。
5.在中国专利cn200580024685.2,有提到利多卡因衍生的化合物、药学组合物及其治疗、预防或抑制疾病的用途和方法,但是该专利中更多强调的是包括哮喘,鼻炎,过敏性荨麻疹和与嗜酸性细胞增多有关的慢性肺炎,以及特应性哮喘和慢性肠炎,例如结肠炎中的用途,并且在专利中提到利多卡因及其衍生物抑制致敏实验动物的肠非横纹肌(回肠)的过敏收缩;结果显示了在过敏性收缩和组胺刺激引起的收缩的情况下,对利多卡因衍生物处理的主要敏感性,主要作用部位是回肠,所以针对结肠炎症会有一定的作用;但是该专利未对利多卡因衍生物是否能够影响肥大细胞(mast cell,mc)而对肠道屏障损伤起到作用,也未对利多卡因衍生物是否能够影响腹部不适做出研究。
技术实现要素:
6.为此,本发明提供一种利多卡因衍生物在制备防治肠道屏障损伤产品中的应用,以提供一种新型的利用利多卡因衍生物进行防治肠道损伤疾病中的应用。
7.研究表明促肾上腺皮质释放激素(corticotropin releasing hormone,crh)和mc介导了肠道屏障功能障碍。比如,应激反应通过脑-肠轴,促进肠道神经细胞等分泌crh。crh
则激活肠道mc,使之释放多种预先形成的颗粒(其中包含蛋白酶、细胞因子、生长因子、花生四烯酸、趋化因子等),释放的各种活性介质会影响粘膜屏障中的跨细胞和细胞间连接,从而影响肠粘膜屏障通透性。所以,调控mc的分泌可能是调节肠道屏障的关键点。
8.本发明发现jm25-1能通过影响mc调节上皮细胞通透性。激活后的mc会破坏上皮细胞间紧密连接蛋白zo-1的表达,jm25-1干预后的mc能有效抑制紧密连接的损伤。且jm25-1能通过影响mc抑制细胞旁通透性,包括跨膜电阻和跨膜流量。另外,jm25-1能有效抑制mc脱颗粒和细胞因子tnfα、il-1β和il-18的释放。且jm25-1能显著抑制crh特异性受体crhr1,并促进crhr2的表达。
9.进一步,利用避水应激大鼠造成肠道屏障损伤模型,再腹腔注射jm25-1后,体重有一定程度的恢复,且指示肠道通透性的指标二胺氧化酶、d-乳酸和细菌内毒素都有减少。jm25-1对大鼠肠组织中紧密连接zo-1的破坏具有恢复作用,抑制肠组织中crhr1、tnfα、il-6、il-1β和il-18的表达,促进crhr2的表达。在机制方面,我们利用mtor抑制剂证实了jm25-1通过促进pi3k/akt/mtor通路影响mc的脱颗粒及crhr的表达来调控肠道屏障损伤。最后,在临床采集了具有肠道屏障损伤特点的肠易激综合征病人的肠液,将肠液移植至大鼠,再在移植后的大鼠注射jm25-1,验证了jm25-1能有效恢复紧密连接zo-1的表达,抑制血清中d-乳酸的增高,且能抑制mc的数量。总之,jm25-1能通过调控pi3k/akt/mtor通路抑制mc激活,从而恢复肠道屏障损伤。
10.为了实现上述目的,本发明提供如下技术方案:
11.根据本发明的提供一种利多卡因衍生物在制备防治肠道屏障损伤产品中的应用,所述利多卡因衍生物为利多卡因同分异构体。
12.进一步的,所述利多卡因衍生物为2-(二乙氨基)-n-(2,5-二甲基苯基)乙酰胺,也就是jm25-1。
13.进一步的,所述防治肠道屏障损伤的机理为通过调节crh受体抑制mc激活从而调节炎症因子释放;
14.进一步的,所述jm25-1能够防治应激状态引起的腹部不适。
15.本发明中jm25-1能通过调节mc抑制上皮屏障损伤;
16.本发明中jm25-1能恢复避水应激大鼠体重及血清中二胺氧化酶、d-乳酸和细菌内毒素的分布;
17.本发明中jm25-1能促进避水应激大鼠肠道紧密连接蛋白表达;
18.本发明中jm25-1促进避水应激大鼠肠组织crhr2和il-22的表达、抑制肠组织中crhr1、tnfα、il-1β、il-6和il-18的表达;
19.本发明中jm25-1促进mc中pi3k/akt/mtor通路转导;
20.本发明中jm25-1通过pi3k/akt/mtor通路调控crhr1/2,进而调控mc脱颗粒;
21.本发明中jm25-1抑制ibs肠液灌注大鼠肠组织紧密连接损伤;
22.本发明中jm25-1抑制ibs肠液灌注大鼠肠组织mc分布。
23.进一步的,所述防治肠道屏障损伤产品为药物或保健品。
24.进一步的,所述药物是利多卡因衍生物与药学常用辅料制备而成。
25.进一步的,所述药物还包括药学上可接受的载体。
26.进一步的,所述药物剂型为口服制剂、注射剂或喷雾剂。
27.进一步的,所述口服制剂为胶囊剂、片剂、丸剂、颗粒剂、口服液体制剂或微囊剂。
28.进一步的,所述药物用于皮下注射、静脉注射、肌肉注射或经鼻给药。
29.本发明具有如下优点:
30.jm25-1作为临床上常用局部麻醉药物的同分异构体,具有极微弱麻醉作用,但存在强于利多卡因的抗炎活性。本发明发现jm25-1通过稳定mc的活化从而恢复肠道屏障损伤方面有显著疗效,且其没有强烈的依赖性,安全性高,可以用于长期肠道屏障损伤的治疗;而且本发明发现jm25-1对肠道屏障损失的预防也有一定的作用;在恢复肠道屏障损伤的同时,能够有效治疗压力应激状态下的腹部不适。
附图说明
31.为了更清楚地说明本发明的实施方式或现有技术中的技术方案,下面将对实施方式或现有技术描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是示例性的,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图引伸获得其它的实施附图。
32.本说明书所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。
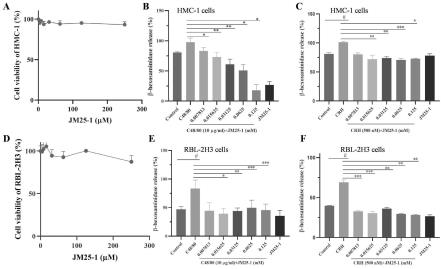
33.图1为本发明实施例1提供的一种安全浓度下的jm25-1抑制mc脱颗粒;
34.其中,图1a为梯度浓度jm25-1(0,3.9,7.8,15.6,31.2,62.5,125,250μm)干预hmc-1细胞24小时后,cck-8检测细胞活力;
35.图1b为jm25-1预处理10分钟后,hmc-1在c48/80诱导的脱颗粒作用;
36.图1c为jm25-1预处理10分钟后,hmc-1在crh诱导的脱颗粒作用;
37.图1d为梯度浓度jm25-1(0,3.9,7.8,15.6,31.2,62.5,125,250μm)干预rbl-2h3细胞24小时后,cck-8检测细胞活力;
38.图1e为jm25-1预处理10分钟后,rbl-2h3在c48/80诱导的脱颗粒作用;
39.图1f为jm25-1预处理10分钟后,rbl-2h3在ecrh诱导的脱颗粒作用。
40.图2为本发明实施例1提供的jm25-1通过crhr1/2调节细胞因子的产生。
41.其中,图2a为jm25-1(31.25μm)在crh诱导的hmc-1细胞中处理24小时,通过westernblot检测tnfα、crhr1和crhr2的蛋白水平;柱状图显示目标蛋白与gapdh的比值;
42.图2b为jm25-1后,采用实时荧光定量pcr方法分析tnfα、crhr1、crhr2、il-1β、il-18和il-22的mrna水平;
43.图2c为hmc-1中crhr1和crhr2的免疫荧光染色。
44.标尺:50μm,放大400倍。
45.图3为本发明实施例1提供的一种jm25-1通过mc降低上皮细胞的细胞旁通透性;hmc-1细胞与caco2共培养,caco2已分化成单层上皮样细胞;
46.其中,图3a为jm25-1作用于crh预处理后的hmc-1细胞24小时,通过zo-1的免疫荧光染色测定细胞旁通透性;
47.标尺:50μm,放大400倍;
48.图3b为跨上皮电阻值;
49.图3c为fitc-葡聚糖的通量;
50.图3d为zo-1的mrna;
51.图3e为caco2细胞单层中zo-1的蛋白质水平。
52.图4为本发明实施例2提供的一种jm25-1修复慢性应激诱导大鼠的肠道通透性;
53.其中,图4a为jm25-1治疗后大鼠的体重;
54.图4b为血清二胺氧化酶、d-乳酸和细菌内毒素水平;
55.图4c为肠道中zo-1的免疫荧光染色;
56.标尺:20μm,放大200倍。
57.图5为本发明实施例2提供的一种避水应激诱导大鼠肠组织中mrna的相对表达,
58.其中,图5a为zo-1、图5b为crhr1、图5c为crhr2、图5d为tnfα、图5e为il-1β、图5f为il-22、图5g为il-6和图5h为il-18。
59.图6为本发明实施例2提供的一种jm25-1对避水应激诱导大鼠肠组织中crhr1和tnfα表达的影响。
60.其中,图6a为tryptase标记的mc中crhr1的免疫荧光染色。柱状图统计crhr1阳性细胞数、tryptase阳性细胞数以及crhr1与tryptase共定位细胞数,
61.放大倍数:200倍;比例尺:50μm;
62.图6b为肠组织中tnfα的免疫荧光染色,黄色箭头表示tnfα的分布;
63.放大倍数:200倍。
64.图7为本发明实施例3提供的jm25-1通过pi3k/akt/mtor/crhr信号通路调节脱颗粒和细胞因子的释放;
65.其中,图7a为连续浓度的jm25-1处理hmc-1细胞24小时,使用western bolt法检测p-pi3k、pi3k、p-akt、akt、p-mtor、mtor和gapdh的表达;
66.图7b为用jm25-1(31.25μm)、rapamycin(400nm)和dscg(1mm)处理crh(1μm)诱导的hmc-1,检测β-氨基己糖苷酶的释放;
67.图7c为hmc-1细胞用jm25-1处理或与rapamycin共处理24小时,通过westernblot分析tryptase、tnfα、il-1β和gapdh的蛋白水平;
68.图7d为相同处理条件下,实时荧光定量pcr检测crhr1和crhr2的mrna水平;
69.图8为实施例4提供的临床ibs病人标本对大鼠肠道屏障及mc分布的影响;
70.其中,图8a为ibs病人肠液对wistar大鼠结肠灌肠后1小时,注射或不注射jm25-1,24小时后,检测外周血中二胺氧化酶、d-乳酸和细菌内毒素的表达水平;
71.图8b为ibs病人肠液对wistar大鼠结肠灌肠后1小时,注射或不注射jm25-1,24小时后,收集结肠组织并通过免疫组化法观察两组紧密连接蛋白zo-1的分布;
72.图8c为ibs病人肠液对wistar大鼠结肠灌肠后1小时,注射或不注射jm25-1,24小时后,收集结肠组织并通过免疫荧光法观察两组mc标志物-tryptase的分布。
73.图9为本发明实施例5提供的jm25-1能抑制避水应激大鼠腹部高敏感性(腹部不适);
74.其中,图9a为0ml,0.8ml,1.2ml气囊压力下,jm25-1对避水应激7天后的大鼠腹部肌电位的影响,右方为肌电图积分后峰面积统计直方图;
75.图9b为苏木素-伊红染色法观察jm25-1对肠组织形态的影响。
具体实施方式
76.以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
77.jm25-1水溶液的配制:
78.体外实验使用二甲基亚砜配制成50μm母液,再使用培养基稀释成目的梯度浓度;
79.体外实验jm25-1标准品首先用5%(体积)二甲基亚砜,再用95%生理盐水进行配制为20mg/ml。
80.实施例1
81.本实施例提供一种体外探索jm25-1通过mc对肠粘膜屏障的保护作用。
82.步骤1、cck-8法摸索jm25-1对mc增殖的影响。
83.将对数生长期的人肥大细胞hmc-1和大鼠来源肥大细胞rbl-2h3,以1*104个/孔细胞密度种板于96孔板,将梯度浓度的jm25-1(3.9-250μm,具体为0,3.9,7.8,15.6,31.2,62.5,125,250μm)干预细胞。每个样品设置三个平行组,孵育24小时后,弃去含药培养基,每孔加入100μl含有10%cck-8的imdm培养基溶液,孵育1小时。使用酶标仪在450nm下测量溶液的吸光度值。使用以下公式计算细胞存活率的百分比:
84.细胞存活率(%)=药物处理组/对照组
×
100(%)
85.步骤2、jm25-1对mc脱颗粒的影响
86.将hmc-1细胞和rbl-2h3细胞用台氏液清洗后种板,孵育半小时脱敏,而后弃去上清用台氏液重悬,按照1
×
105个/孔种板至96孔板,加入梯度浓度jm25-1(7.8,15.6,31.2,62.5,125μm),干预半小时后加入crh或mc激活剂compound48/80(c48/80)。半小时后,将上清收集加入等体积底物1mm氨基己糖苷酶,37℃孵育1.5小时,再加入0.1mna2co3/nahco3缓冲液终止反应,酶标仪检测405nm处的吸光度。
87.通过cck-8实验,250μm及更低浓度下的jm25-1对hmc-1细胞抑制率小于10%,如图1a所示;安全浓度下的jm25-1显著抑制c48/80(如图1b所示)和crh(如图1c所示)激活后的hmc-1细胞中β-氨基己糖苷酶的释放率。同样地,jm25-1(3.9-250μm)对大鼠来源的rbl-2h3的细胞活性没有明显影响(如图1d所示),安全浓度下的jm25-1能显著抑制c48/80(如图1e所述)和crh(如图1f所示)激活后的hmc-1细胞中β-氨基己糖苷酶的释放率。结果表明,安全浓度下的jm25-1能显著抑制mc的脱颗粒作用。
88.步骤3、jm25-1对mc分泌的影响
89.mc是免疫系统的第一反应者,mc脱颗粒能释放大量炎症因子。为了研究jm25-1对mc分泌的影响,分为四组:对照组、crh组、crh+jm25-1组和jm25-1组。干预24小时后取上清,检测细胞中tnfα、crhr1和crhr2的蛋白表达。另外,将收集的细胞提取rna,检测细胞中受体crhr1、crhr2以及tnfα、il-1β、il-22和il-18因子mrna的变化。
90.压力应激下的mc会通过激活crhr1但抑制crhr2来调节脱颗粒效应,本发明发现chr刺激下的mc中,tnfα和crhr1蛋白水平明显增高,crhr2蛋白显著下调,而jm25-1能逆转
crh对mc中crhr1、crhr2和tnfα的蛋白表达水平(如图2a所示)。同样地,在mrna水平上也证实了jm25-1能抑制crhr1、tnfα、il-1β、il-18的表达,而促进crhr2、il-22的表达(如图2b所示)。另外,通过免疫荧光结果表明,jm25-1能抑制crh激活后的hmc-1细胞中crhr1表达、促进crhr2表达(如图2c所示)。
91.步骤4、跨膜电阻的检测(teer)
92.将对数生长期的caco2细胞以2*105个/孔接种于transwell孔板中(购自corning公司,孔径0.4μm),每两天换一次液。细胞分化为致密层结构后,将mc分为对照组、crh组、crh+jm25-1组和jm25-1组,与上皮细胞共培养,在0、1、2、3小时时间点分别检测跨膜电阻值的变化。
93.步骤5、屏障渗透性观察
94.待检teer检测结束后,将细胞用pbs润洗两遍,在37℃平衡半小时,然后将1mg/ml的荧光素异硫氰酸酯-葡聚糖(fitc-dextran4000,fd4)加入到transwell孔板中,下室加入pbs。待37℃孵育两小时后,吸取下室液体至96孔板中,每个样本三个副孔,使用酶标仪在激发波长492nm、发射波长520nm处检测荧光。
95.步骤6、wb检测jm25-1通过mc对肠上皮屏障损伤的影响
96.按照本实施例步骤5中的共培养及分组方式干预上皮细胞24小时。而后,用预冷的pbs润洗细胞,除去残余的培养基及细胞碎片。再用不含edta而含有蛋白酶抑制剂的1
×
ripa裂解缓冲液裂解细胞20分钟,整个过程在冰上操作。将细胞裂解物收集至ep管中,放置于4℃离心机,12000rpm/min离心10分钟。再弃去沉淀收集上清,转移至新的ep管中,并使用quick starttm bradford 1
×
dye reagent定量测定蛋白质浓度。再加入5
×
上样缓冲液充分包裹蛋白溶液,95℃金属浴10分钟,使蛋白变性。
97.将30μg蛋白加入10%聚丙烯酰胺凝胶电泳槽中,上样结束后,80v电压,电泳30分钟,目的是将样品压平,再调整为120v电压电泳。电泳完成后,将蛋白转移到pvdf膜上,在250ma电流,转膜液介质中转膜2.5小时,然后用10%脱脂奶粉,室温封闭1小时。封闭完成后,tbst润洗干净残余的牛奶,然后加入一抗zo-1,膜与一抗在4℃孵育过夜。回收一抗,tbst洗膜三次,每次5分钟。然后加入hrp偶联的二抗,室温孵育1小时。使用ultrasignaltm ecl蛋白质印迹显影试剂成像,并通过bio-rad chemidoc mp全能型成像系统检测。使用image j软件定量分析成像条带强度,并计算目的蛋白与gapdh的灰度值的比值。
98.步骤7、免疫荧光法观察肠粘膜上皮细胞间紧密连接蛋白分布
99.将对数生长期的caco2细胞以5
×
105个/孔的密度,接种到六孔板中的预处理过的盖玻片上。盖玻片预先泡在酸(重铬酸钾与硫酸)中12h,先用超纯水洗净后,泡入95%乙醇中,使用时用镊子和针辅助挑起玻片,火焰中燃净乙醇,再放入六孔板中,待冷却后加入细胞悬液。待细胞贴壁后,将预先干预24小时的hmc-1细胞(对照组、crh组、crh+jm25-1组和jm25-1组)分离上清,干预至caco2细胞的爬片。12小时后,弃去上清,并用tbs洗涤细胞,并在室温下用4%多聚甲醛(paraformaldehyde,pfa)固定15分钟。tbs浸洗三次,每次三分钟,吸水纸吸干tbs,在玻片上滴加正常山羊血清,室温封闭30min。吸水纸吸掉封闭液,不洗,每张玻片滴加足够量的稀释好的一抗(zo-1)并放入湿盒,4℃孵育过夜。滴加dapi避光孵育5min,对标本进行染核,tbs 5min
×
4次洗去多余的dapi;将盖玻片用tbs洗涤三次,并取出立于空气中进行干燥,用fluorsavetm防荧光猝灭封片剂进行封片。
100.hmc-1细胞与caco2共培养,caco2已分化成单层上皮样细胞;通过mc与上皮细胞共培养,发现hmc-1细胞被crh激活后,上皮细胞间紧密连接zo-1有明显的破坏,但是jm25-1能恢复细胞间紧密连接zo-1蛋白的表达(如图3a所示),不仅在免疫荧光上体现,在qpcr中和western blot结果中mrna(如图3d所示)和蛋白水平(如图3e所示)表达也一致。检测上皮细胞的跨膜电阻,发现crh激活后的mc在三小时内teer值持续降低,但是jm25-1能明显抑制teer的降低(如图3b所示)。另外,通过荧光素渗透实验发现,crh激活后的hmc-1细胞与上皮细胞共培养后,上皮细胞的fd4荧光素渗透与对照相比明显增多,但是jm25-1干预后却有显著下调(如图3c所示)。
101.实施例2
102.本实施例提供一种jm25-1体内肠道屏障损伤实验验证。
103.步骤1、大鼠避水应激造模
104.成都达硕购买wistar大鼠180-220g,室温22-24℃,适应性饲养七天,自由进食水。而后称取大鼠体重,进行分组,平均每组7只,分成三组(对照组、模型组和jm25-1组)。每天早上同一时间,将模型组和jm25-1组的大鼠进行避水实验。在约65*47*41cm的容器中注入25℃的水,中央倒扣放置直径8.9cm*高11.7cm的有机玻璃烧杯,水平面要低于玻璃板1cm。动物在玻璃板上被限制活动,将大鼠放置于平台1(30min)小时,一只大鼠放一个平台。对照组也放在平台中,但是盆中不加水。下午随机施压,在避水实验6小时以后随机的时间里,进行以下一项实验:1)与天敌待5min;2)24小时断水;3)模拟腹部注射;4)倾斜鼠笼45
°
12小时;5)晒衣夹夹2min;6)24小时不进食。造模七天后,开始给药,对照组与模型组给与生理盐水,药物组通过腹腔注射jm25-1(15mg/kg)。连续给药三天,给药期间持续造模施压。
105.步骤2、肠屏障功能生化指标检测
106.给药结束后,尾静脉取血,1.5mg/ml肝素钠(用生理盐水配制,4℃避光保存)提前加入ep管中润洗、将毛细管和采血管也提前浸泡,取血后立即4℃,3000rpm/min离心10min,收集上层血浆,而后将试剂盒从4℃取出,平衡至室温开始使用,将id卡插入仪器中。撕掉铝箱包装,取出反应装置,将20μl血清加入每个反应孔反面,仪器自动孵育30min,结束后把反应槽正面朝上插入进行检测,肠道屏障功能生化指标分析仪(北京中生金域)自动读数。检测出血浆中内毒素、d-乳酸和二胺氧化酶的浓度。
107.步骤3、免疫荧光检测jm25-1对避水应激大鼠肠组织mc、受体crhr1及tnfα的影响
108.将大鼠进行安乐死,并将结肠取出用冰的无菌生理盐水进行清洗,而后放入4%多聚甲醛中固定,固定24小时后,将组织进行脱水包埋,切片后烘烤30分钟。而后,石蜡切片置于二甲苯洗缸中脱蜡,再依次浸入100%乙醇5min,95%,90%,80%乙醇中各2min梯度水化,纯水洗涤2min,洗三次。再在0.01m柠檬酸盐缓冲液(ph=6.0)中高火修复15分钟,待修复液自然冷却至室温后,取出切片,加入封闭液37℃孵育40分钟。再加入一抗zo-1、crhr1和tnfα在湿盒中4℃过夜。次日,pbs缓冲液中洗五次,每次5分钟,加入二抗后室温孵育一小时,pbs洗涤五次后加入dapi染5分钟,最后洗涤五次滴加防荧光淬灭封片剂进行封片,显微镜下观察所检测蛋白的表达情况。
109.步骤4、jm25-1对避水应激大鼠肠组织中mrna的影响
110.将收集的大鼠肠组织加入1毫升trizol进行匀浆,反复吹打至溶液透明,将200微升氯仿加入ep管中,剧烈震荡15秒,室温放置3分钟后,4℃12000rpm离心10min,样品会分成
三层:黄色的有机相,中间层和无色的水相,rna主要在水相中,水相的体积约为0.5ml。把水相转移到新管中,加入等体积的异丙醇,涡旋震荡后静置五分钟,4℃12000rpm离心10min。弃上清,加入500μl无水乙醇,洗涤后4℃12000rpm离心10min收集沉淀。待液体挥发后,加入无酶水溶解沉淀获得mrna。然后使用反转录试剂盒chamq universal sybr qpcr master mix逆转录为cdna,设计引物并进行qpcr实验检测组织中zo-1、crhr1、crhr2、tnfα、il-1β、il-22、il-6和il-18的表达。
111.与对照组相比,造模后的大鼠体重增长缓慢,但是在第七天,注射jm25-1的大鼠(每天腹腔注射,15mg/kg,n=7)与模型组老鼠相比,体重有明显增长(如图4a所示)。为了评估肠道通透性,检测血清中二胺氧化酶、d-乳酸和细菌内毒素的表达,发现d-乳酸在模型大鼠中有显著增高,d-乳酸和细菌内毒素也有一定的升高,但是jm25-1都能使造模大鼠的三种指标含量降低(如图4b所示)。通过免疫荧光染色,与对照组相比,模型组大鼠肠组织中紧密连接蛋白zo-1有明显破坏,但是注射jm25-1后肠组织中zo-1有明显恢复(如图4c所示)。另外,提取肠组织mrna,发现避水应激大鼠肠组织中zo-1的表达水平明显下降,而jm25-1组大鼠却有明显的恢复(如图5a所示)。说明jm25-1有保护避水应激大鼠肠道屏障的作用。
112.通过qpcr实验,在避水应激大鼠肠组织中紧密连接蛋白zo-1的mrna有明显降低,crhr2受体表达也下降显著。而细胞因子tnfα、il-1β、il-6和il-18的mrna水平明显增高,il-22表达下调。jm25-1注射治疗后,肠组织中zo-1的mrna水平明显恢复表达,crhr1与模型大鼠相比显著下调,crhr2与模型大鼠相比显著上调。肠组织中细胞因子tnfα、il-1β、il-6和il-18的mrna水平有明显地抑制,免疫调节因子il-22显著上调。jm25-1能恢复避水应激所造成的表达异常(如图5所示)。通过免疫荧光染色,给与jm25-1的大鼠肠组织中crhr1表达明显减少和tryptase标记的mc也减少,同时表达crhr1的mc数量(如图6a所示)和肠组织中的tnfα(如图6b所示)也显著减少。说明jm25-1可以通过crhr1/2调节避水应激大鼠肠组织中炎症因子的释放。
113.实施例3
114.本实施例提供一种jm25-1在肠道屏障中的机制研究。
115.步骤1、jm25-1对pi3k/akt/mtor通路蛋白的影响
116.将对数生长期的hmc-1细胞按照密度5
×
105个/孔接种至六孔板,梯度浓度的jm25-1(7.8125、15.625、31.25μm)干预细胞24小时后,按照实施例1步骤6中蛋白提取及westernblot方法,检测细胞中p-pi3k、pi3k、p-akt、akt、p-mtor、mtor蛋白的表达。
117.步骤2、利用通路抑制剂验证jm25-1通过pi3k/akt/mtor对crhr1/2及分泌的影响。
118.将hmc-1细胞按照密度5
×
105个/孔接种至六孔板,分为对照组、rapamycin组(mtor抑制剂)、rapamycin+jm25-1组、jm25-1组。而后按照实施例1中步骤6中中蛋白提取及westernblot方法,检测细胞中crhr1、crhr2、tnfα和il-1β蛋白的表达。同时按照实施例2的步骤4中mrna检测方法观察细胞中crhr1和crhr2的表达。另外,利用crh激活mc,通过使用rapamycin按照实施例1的步骤2方法观察jm25-1对细胞脱颗粒的影响。
119.jm25-1能促进p-pi3k、p-akt和p-mtor的蛋白水平表达,且存在浓度依赖性(如图7a所示)。通过使用mtor抑制剂rapamycin,与对照组相比,crhr1蛋白和mrna水平明显上调,crhr2明显下调,且tnfα、il-1β蛋白也存在显著上调(如图7c-7d所示)。jm25-1的干预能明显逆转rapamycin对mc的crhr1/2、tnfα、il-1β的表达。另外,crh能激活mc促进脱颗粒,
jm25-1能抑制crh所致mc脱颗粒,rapamycin的加入同样有促进mc脱颗粒的作用,jm25-1的加入却能抑制β-氨基己糖苷酶的释放(如图7b所示)。说明jm25-1可以通过调控mc中pi3k/akt/mtor通路调节crhr1/2从而影响mc激活
120.实施例4
121.本实施例提供一种jm25-1在ibs肠液移植大鼠中的应用
122.根据罗马iv标准,纳入ibs患者。将乙酰半胱氨酸洗液(nac洗液)通过肠镜管道注入结肠,冲洗三分钟后收集洗液,bca检测试剂盒检测洗液中总蛋白浓度。wistar大鼠断食不断水两天后,将大鼠麻醉,每只大鼠灌注1mg蛋白量的洗液至结肠。继续断食不断水12小时后尾静脉取血,根据实施例2步骤2检测二胺氧化酶、d-乳酸和细菌内毒素的表达。而后,安乐死大鼠获得结肠组织,通过多聚甲醛固定后按照实施例2步骤3的方法进行脱蜡复水、edta修复组织后,过氧化氢孵育15分钟封闭内源性过氧化酶,再孵育zo-1一抗4℃过夜。然后,滴加增强子在室温孵育半小时,再加入酶标二抗孵育半小时,最后滴加dab显色。最后,脱蜡至水封片。另外,采用实施例2步骤3的方法免疫荧光法观察mc的分布。
123.如图8所示,ibs病人肠液灌注至大鼠后,免疫组化法观察到结肠组中紧密连接蛋白zo-1明显受损,但是在jm25-1注射组,zo-1蛋白显著恢复。免疫荧光观察到tryptase标记的mc数明显在jm25-1注射组大鼠结肠组织中明显减少。
124.实施例5
125.本实施例提供一种jm25-1对大鼠腹部高敏反应的影响。
126.1、大鼠提前12小时断食不断水,异氟烷麻醉后的大鼠固定在大鼠固定器上,暴露出腹外斜肌,将两根银针勾在腹外斜肌上,间隔1厘米,另外一根银针勾在大鼠胸上作为地线。正极、负极和地线与生物技能测定系统相连,然后将测试后不漏气的气囊用石蜡油润滑后,插入肛门直肠内,气囊远端拒肛门1cm,并将外露导管用胶带固定于鼠尾根部。待大鼠苏醒后适应30分钟,开始加压。向内注气,0ml,0.4ml,0.8ml,1.2ml。每个体积持续三分钟,观察肌电图变化。
127.2、苏木素-伊红染色法(he)观察jm25-1对肠组织形态的影响
128.电生理结束后,将大鼠脱颈处死,收集结肠组织,4%多聚甲醛固定24小时后,进行脱水包埋切片。再将切片脱蜡至水,用苏木素染色5分钟。用水洗5分钟
×
3次,再用5%乙酸分化1分钟,再用流水冲洗。再使用伊红染色1分钟,流水冲洗后用70%、80%、90%、100%酒精浸泡各10秒脱水。最后,用二甲苯脱蜡风干滴上中性树胶封片,镜下观察。
129.结果:
130.jm25-1对避水应激大鼠肠道腹部高敏反应的影响:
131.腹部不适而组织又无器质性病变是肠易激综合征的一大特点,急慢性避水应激能够诱导大鼠内脏敏感性增高,如图9a所示,在大鼠直肠给与0.8ml和1.2ml气囊时,大鼠肌电位有收缩频率和强度有显著增高,而jm25-1药物治疗组受气囊影响较小。而如图9b所示的he染色结果可以看出,各组大鼠结肠粘膜并无器质性病变。
132.因此,jm25-1可能在肠易激综合征中发挥降低腹部不适的作用,即jm25-1可能在肠易激为代表的功能性胃肠疾病中存在治疗作用。
133.虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,
在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1