含灵芝孢子粉枸杞茯苓的护肝组合物的制备方法与流程
1.本发明属于植物活性物质提取,具体涉及一种含灵芝孢子粉枸杞茯苓的护肝组合物的制备方法。
背景技术:
2.肝脏是机体解毒和调节糖、脂代谢平衡的主要器官;能够防御、分解外来和代谢产生的毒素,对维持机体平衡和健康起着至关重要的作用。化学物质通过体循环或胃肠道门静脉进入人体的肝脏进行转化,代谢产生的化学毒性物质极易造成化学性肝损伤。
3.化学性肝损伤是由多种因素造成的,如受污染的空气、水、食物以及日常生活中所用到的药品、酒精等均可使人体产生大量自由基,造成肝细胞损伤,最终引起化学性肝损伤。一些亲肝毒物与其他非毒性化学物质结合,可增加毒性,如脂肪醇类(甲醇、乙醇、异丙醇等)能增强卤代烃类(四氯化碳、氯仿等)的毒性。这些化学物质也包括酒精及某些药物引起的肝损伤,而且酒精肝损伤也是目前最常见的。
4.护肝药物本身也具有潜在的肝损害问题。目前开发的保肝药以合成药物为主,这些药物虽然护肝效果明显,但是其不良反应同样明显,限制了其应用范围。
5.碧生源牌灵芝孢子粉枸杞茯苓茶(国食健注g20080562)是以灵芝孢子粉、枸杞子、茯苓、绞股蓝、黄芪、当归、干姜作为原料;生产工艺为加水煎煮提取后浓缩干燥而成的保健食品;具有一定辅助保护化学性肝损伤的保健食品。
6.但是此产品问世已经十余年,其生产工艺较为原始,对温度敏感和易氧化的有效成分容易流失;同时对于脂溶性、醇溶性的有效成分没有对应的有效提取措施;其配方和生产工艺都具有一定的改进空间。
技术实现要素:
7.本发明提供了一种含灵芝孢子粉枸杞茯苓的护肝组合物的制备方法,基于碧生源牌灵芝孢子粉枸杞茯苓茶进行改进,主要通过提取原材料中的多糖成分和其它有效成分达到保护肝脏,减少化学性肝损伤的效果。
8.为了实现上述目的,本发明采用以下技术方案:
9.含灵芝孢子粉枸杞茯苓的护肝组合物的制备方法,包括以下步骤:
10.(1)取灵芝孢子粉、枸杞、茯苓、绞股蓝、黄芪、当归、干姜混合后研磨成粉末,并加入抗氧化剂组,得原料组;
11.(2)原料组内加入无水乙醇醇沉,离心;得到沉淀物和初次醇提取液;
12.(3)沉淀物加入溶有生物酶的醋酸钠-醋酸缓冲溶液混合搅拌后静置一段时间;加热灭酶后超声波提取;得水提取液和原料渣;
13.(4)原料渣加入无水乙醇醇沉,离心;取二次醇提取液;
14.(5)将初次醇提取液、水提取液、二次醇提取液合并,混合提取液浓缩、喷雾造粒;
15.步骤(1)中,灵芝孢子粉、枸杞、茯苓、绞股蓝、黄芪、当归、干姜的质量比为1:2-3:
1-1.5:2-4:0.5:0.3:0.56;
16.步骤(1)中,抗氧化剂组为维生素c、维生素e、阿魏酸的组合;维生素c、维生素e、阿魏酸的质量比为26-32:1.6-2.4:1;抗氧化剂组的添加量为原料组总质量的0.2-0.35%;
17.步骤(2)和步骤(4)中,醇沉的温度为12-30℃;时间为8-10h;
18.步骤(3)中,溶有生物酶的醋酸钠-醋酸缓冲溶液的ph为4-5.5;
19.步骤(3)中,加热的温度为65-80℃;
20.步骤(3)中,生物酶为纤维素酶、果胶酶、木聚糖酶中的至少一种,加入量为原料组质量的0.08-0.15%。
21.特别地,步骤(1)中,原料组的过筛目数≥40目。
22.特别地,步骤(2)和步骤(4)中,无水乙醇的加入量为原料组质量的3-5倍。
23.特别地,步骤(3)中,溶有生物酶的醋酸钠-醋酸缓冲溶液的添加量为原料组体积的4-6倍;静置时间为8-12h。
24.特别地,步骤(3)中,超声波功率为300-450w,间歇比为2s/1s;超声时间为40-50min。
25.本发明的醇沉,主要目的在于提取醇溶性多糖以及其他醇溶性物质,如皂苷等;采用两次醇沉提取的目的在于,在经过添加有生物酶的醋酸钠-醋酸缓冲溶液的水提取后,部分原料会酶解,水溶性的被提取出,而醇溶性的仍留在原料内部,故需要二次提取,避免造成浪费。
26.本发明的原料均为植物,植物的细胞壁由纤维素、半纤维素、木质素和果胶等组成。本发明在水提前采用酶解的方式除了有助于溶解细胞壁释放出植物内部的物质有助于提取外;由于纤维素等不溶于水、也不溶于乙醇,在酶解后变成可溶,尽可能保留原料的成分。
27.与现有技术相比,本发明的有益效果为:
28.(1)本发明通过三段提取方法,尽可能保留多糖类、皂苷类等不同类型的活性有效成分。
29.(2)本发明通过在提取过程中加入适量的抗氧化剂,能够有效防止易氧化物质在提取过程中变质失去功能;且加入的抗氧化剂组合属于无毒物质,即使有残留也能作为对人体有益的成分被吸收。
30.(3)本发明提取过程全程使用的溶剂以及过程中使用的必要物质均为无毒或低毒物质,且挥发后无残留;保证了对人体的安全性。
31.(4)本发明最后得到的组合物,经试验证明对化学性肝损伤有统计学意义上的治疗作用。
附图说明
32.图1为标准曲线。
具体实施方式
33.为了更好地理解本发明,下面结合具体实施例对本发明作进一步的描述,其中实施例中使用的术语是为了描述特定的具体实施方案,不构成对本发明保护范围的限制。
34.本发明中:
35.灵芝孢子粉为多孔菌科真菌赤芝ganoderma lucidum(leyss.ex fr.)karst.或紫芝ganoderma sinense zhao,xu et zhang的干燥子实体的孢子粉末。
36.枸杞为茄科植物宁夏枸杞lycium barbarum l.的干燥成熟果实。
37.茯苓为多孔菌科真菌茯苓poria cocos(schw.)wolf的干燥菌核。
38.绞股蓝为葫芦科绞股蓝gynostemma pentaphyllum(thunb.)makino的干燥地上部分。
39.黄芪为豆科植物蒙古黄芪astragalus membranaceus(fisch.)bge.var.mongholicus(bge.)hsiao的干燥根。
40.当归为伞形科植物当归angelica sinensis(oliv.)diels的干燥根。
41.干姜为姜科植物姜zingiber officinale rosc.的干燥根茎。
42.实施例一原料中多糖含量的测定
43.一、方法原理:多糖经乙醇沉淀分离后,去除其他可溶性糖及杂质的干扰,糖与硫酸反应生成羟甲基呋喃甲醛,再与蒽酮缩合成蓝绿色化合物,其呈色强度与溶液中糖的浓度成正比,在625nm波长下比色定量。
44.实验目的:对碧生源牌灵芝孢子粉枸杞茯苓茶中七种原料进行粗多糖检测。
45.实验材料
46.1.实验仪器
47.hws28型电热恒温水浴锅,tu-1901双光束紫外可见分光光度计,ml204电子天平,奥豪斯十万分之一电子天平,sigma 3-16p离心机,玻璃回流装置。
48.2.实验试剂
49.硫酸,蒽酮,无水乙醇,d-无水葡萄糖(c0009181,北京曼哈格生物科技有限公司,纯度≥99.5%),灵芝孢子粉枸杞茯苓茶样品。
50.3.试剂配制
51.硫酸蒽酮溶液:精密称取蒽酮0.2g,加硫酸溶液200ml使溶解,摇匀,置于棕色瓶。
52.4.实验过程
53.4.1.标准曲线的制备
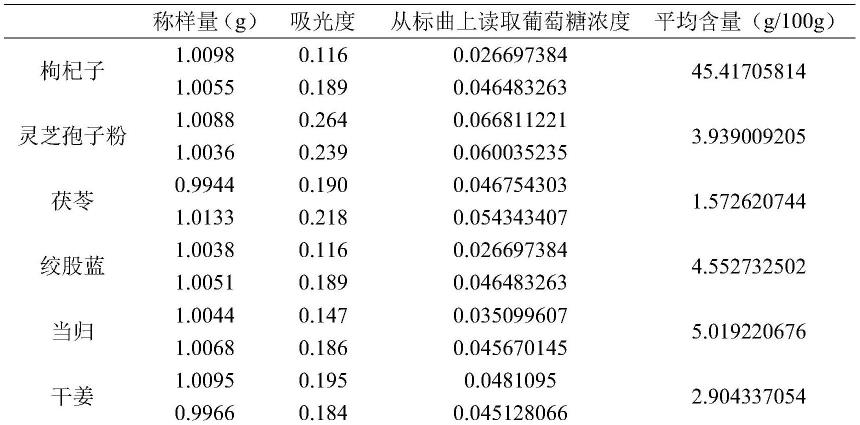
54.取d-无水葡萄糖对照品适量,精密称定加水制成每1ml含0.12mg的溶液,即得。
55.精密量取对照品溶液0.2、0.4、0.6、0.8、1.0、1.2ml,分别置于10ml的具塞试管中,各加水至2.0ml,迅速精密加入硫酸蒽酮溶液6ml,立即摇匀,放置15min,立即置冰水浴中冷却15min,取出,以相应的试剂为空白,在625nm处测定吸光度,以吸光度为纵坐标,绘制标准曲线,如图1所示。
56.二、供试品溶液的制备
57.取原料粉末1.0g,精密称定,置锥形瓶中,加水50ml,静置1h,加热回流4h,趁热过滤,用少量热水洗涤滤器和滤渣,将滤纸和滤渣置圆底烧瓶中,加水30ml,加热回流3h,趁热过滤,合并滤液,置水浴锅上蒸干,残渣用水溶解,转移至50ml量瓶中,定容,摇匀,精密称取2ml边搅拌边缓慢加入无水乙醇30ml,摇匀,在4℃放置12h,4000r/min离心10min,弃去上清液,沉淀物用热水溶解并转移至50ml容量瓶,冷却,加水至刻度,摇匀,即得。
58.三、测定
59.精密量取供试品溶液1ml,置10ml具塞试管中,照标准曲线制备项下的方法,自“迅速精密加入硫酸蒽酮溶液6ml”起,同法操作,测定吸光度,从标准曲线上读出供试品溶液中无水葡萄糖的含量,计算即得。
60.四、结果计算
[0061][0062]
式中:
[0063]
w-多糖的含量,g/100g;
[0064]
c-从标准曲线上查的样品的多糖浓度,mg;
[0065]
m-样品质量,g;
[0066]
四、实验结果
[0067]
结果如下表1所示。
[0068]
表1
[0069][0070][0071]
实施例二提取实验
[0072]
按以下步骤制备实验品。
[0073]
(1)按表2所示取灵芝孢子粉、枸杞、茯苓、绞股蓝、黄芪、当归、干姜混合后研磨成粉末,并加入抗氧化组;得原料组;原料组的过筛目数≥40目。
[0074]
(2)原料组内加入无水乙醇醇沉,离心;得到沉淀物和初次醇提取液;
[0075]
醇沉的温度、时间、无水乙醇的加入量如表2所示。
[0076]
(3)沉淀物加入溶有生物酶的醋酸钠-醋酸缓冲溶液混合搅拌后静置一段时间;加热灭酶后超声波提取;得水提取液和原料渣;
[0077]
溶有生物酶的醋酸钠-醋酸缓冲溶液的ph、生物酶的种类和加入量、静置时间、加热灭酶的温度和时间、超声波提取的功率、时间如表2所示。超声波间歇比为间歇比为2s/1s。
[0078]
(4)原料渣加入无水乙醇醇沉,离心;取二次醇提取液;
[0079]
醇沉的温度、时间、无水乙醇的加入量如表2所示。
[0080]
(5)将初次醇提取液、水提取液、二次醇提取液合并,混合提取液浓缩、喷雾造粒;颗粒水分≤8%。
[0081]
表2
[0082][0083][0084]
分别对本实施例序号一、二、三、四的成品,根据实施例一方法,取制备前的原料;以相同的方法单独提取每个序号中不同的原料经过提取后的制品进行比较结果如下表3所示。
[0085]
更具体的,相同的方法单独提取每个序号中不同的原料经过提取后的制品含义为,如以上表2中步骤(2)至步骤(4)的参数,分别对灵芝孢子粉、枸杞、茯苓、绞股蓝、黄芪、当归、干姜进行提取。
[0086]
同时为了方便比较,对应序号原料的含量与前述步骤中所有的原料量相同,而不是与制品的原料量相同。如枸杞子的原料粉末称取量为1g,则制备的枸杞子原料用量也为1g。
[0087]
综上所述,整个对比过程以序号一为例:
[0088]
1.称取1g原料粉末制备成7个不同的标准曲线
[0089]
2.称取对应1g的灵芝孢子粉、枸杞、茯苓、绞股蓝、黄芪、当归、干姜。
[0090]
3.利用序号一中不同的步骤参数,制备对应的7个单独含有唯一植物原料的成品;此时的原料组的量即为对应唯一植物原料的质量。
[0091]
4.成品以实施例1相同的方法对多糖含量的对比。
[0092]
表3
[0093][0094][0095]
实施例三动物实验
[0096]
针对不同配比下的组合物的动物实验结果。
[0097]
1)材料与方法
[0098]
受试物:表2序号一至三的样品,加水稀释至125mg/ml备用,序号继续沿用。
[0099]
动物:雄性wistar大鼠88只,体重180-220g,由四川大学华西医学实验动物中心提供。实验前检疫一周,整个实验过程中,动物自由摄食和饮水,室温20-23℃,相对湿度50-75%。
[0100]
试验方法:
[0101]
大鼠按体重随机分为11个组,每组8只,根据人体推荐剂量设三个受试物剂量组和肝损伤模型对照组和阴性对照组。受试物剂量组分别为500mg/kg、1250mg/kg、2500mg/kg。用前述受试物用水稀释成对应剂量。各组动物均按2ml/100g.bw分别灌胃给予受试物或蒸馏水,每日一次,连续30日。受试物组和模型组动物隔夜禁食16小时后于实验第31日均按5ml/kg.bw剂量单次灌胃2%四氯化碳,4小时后继续给予受试物。给予四氯化碳后48小时股静脉放血处死动物,收集血液,分离血清,测定丙氨酸氨基转移酶(alt)、天冬氨酸氨基转移酶(ast)活性,每只动物取肝组织固定,按常规做肝组织病理切片检查。
[0102]
2)结果
[0103]
动物体重:由表4可见,整个实验期间和实验结束时体重各组间均无显著性差异(p》0.05)。表明受试物对大鼠生长发育无不良影响。
[0104]
血清生化检验结果:从表5可知,阴性对照组alt和ast均处于正常值范围;而四氯
化碳肝损伤模型对照组动物血清alt和ast活性水平均较阴性对照组显著增高(p《0.01),说明化学性肝损伤模型造模成功。从该表中可见,受试物alt活性和ast活性均较模型对照组显著降低(p《0.05),表明受试物具有对抗化学性肝损伤所致转氨酶升高的作用。
[0105]
病理检查结果:阴性对照组肝脏结构基本正常,四氯化碳所造成的大鼠肝损伤主要为肝小叶中心性肝细胞的气球样变、脂肪变性、胞浆凝聚和坏死四种病变类型。
[0106]
根据病变的有无和损伤程度,均按评价标准评分,结果见表6;坏死平均积分和病变总积分均明显较模型对照组降低,差异有显著性(p《0.05)。表明该受试物对四氯化碳所致的肝损伤有保护作用。
[0107]
表4实验动物体重
[0108]
组别动物数(只)实验初始体重(g)实验中期体重(g)试验结束体重(g)阴性对照组8206.2
±
14.8275.3
±
22.2341.8
±
25.6模型对照组8201.9
±
9.98291.8
±
18.9343.3
±
16.5序号一低剂量组8202.5
±
12.3295.6
±
27.3346.0
±
22.9序号一中剂量组8213.8
±
10.7293.6
±
26.7356.6
±
38.2序号一高剂量组8207.5
±
18.5288.3
±
24.3348.8
±
30.5序号二低剂量组8212.4
±
10.6294.1
±
24.8358.7
±
32.6序号二中剂量组8203.8
±
14.6289.5
±
26.3345.8
±
23.4序号二高剂量组8205.2
±
13.8289.6
±
22.4345.3
±
32.1序号三低剂量组8209.3
±
12.6295.1
±
25.5349.3
±
23.2序号三中剂量组8211.1
±
13.4288.4
±
26.3356.1
±
18.9序号三高剂量组8206.8
±
16.7279.9
±
19.9349.9
±
26.4
[0109]
表5实验动物血清生化检验结果
[0110]
组别动物数(只)alt(u/l)ast(u/l)阴性对照组840.13
±
12.9113.0
±
29.5模型对照组8130.7
±
58.6*444.1
±
204.9*序号一低剂量组885.88
±
37.8
△
260.8
±
120.3
△
序号一中剂量组872.37
±
20.1
△
236.1
±
101.8
△
序号一高剂量组865.15+16.1
△
212.8
±
82.6
△
序号二低剂量组884.12
±
36.8
△
262.8
±
115.8
△
序号二中剂量组871.15
±
21.2
△
232.2
±
98.2
△
序号二高剂量组865.15
±
15.8
△
211.9
±
86.6
△
序号三低剂量组886.12
±
38.1
△
268.1
±
116.2
△
序号三中剂量组873.12
±
21.1
△
229.9
±
84.5
△
序号三高剂量组866.12
±
17.2
△
212.6
±
85.4
△
[0111]
注:与阴性对照组相比:*,p《0.01
[0112]
与模型对照组相比:
△
,p《0.05;
[0113]
表6实验动物病理检查结果
[0114][0115][0116]
注:与模型对照组相比:
△
,p《0.05;
[0117]
总积分=四种病例变化积分之和(其中坏死分数加倍)。
[0118]
上述详细说明是针对本发明其中之一可行实施例的具体说明,该实施例并非用以限制本发明的专利范围,凡未脱离本发明所为的等效实施或变更,均应包含于本发明技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1