抑制ZNF32基因表达在制备结直肠癌药物中的应用的制作方法
抑制znf32基因表达在制备结直肠癌药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及抑制znf32基因表达在制备结直肠癌药物中的应用。
背景技术:
2.crc(colorectal cancer,结肠直肠癌)是全球第三大常见的恶性肿瘤,其死亡率居全球恶性肿瘤的第四位。近年来,结直肠癌发病率呈逐年上升趋势。目前,结直肠癌的治疗方式包括外科手术、放疗、全身化疗、靶向治疗和免疫治疗。近年来,尽管结直肠癌的辅助化疗取得了长足的发展,肿瘤细胞仍不可避免地发生耐药从而导致治疗的失败,最终出现转移和复发。迄今为止,已经研究证实的肿瘤耐药机制主要有如下几点:(1)抑制抗肿瘤药物的累积和滞留,增加药物的外排;(2)抗肿瘤药物靶点和信号转导分子发生突变;(3)药物诱导的dna损伤发生修复;(4)肿瘤微环境:在多种分子信号通路的介导下,损伤的肿瘤细胞从周围微环境中得到代偿和修复,并改变了原来的生物学特性。据统计,结直肠癌患者对全身化疗的反应率接近50%,但几乎所有患者均会产生耐药性。因此,发现和确定新型的药物靶点对有效治疗结直肠癌和克服其放化疗耐药有极其重要的意义。
3.znf32(zinc fingerprotein 32,锌指蛋白32)定位于10q23-q24染色体上[24],具有cys2-his2锌指结构,是klf(kruppel-like factor,kr
ü
ppel样转录因子)家族重要成员之一,其具有维持线粒体膜电位并增强对氧化应激的细胞防御作用。此外,多项研究发现znf32在正常的生物学过程和恶性肿瘤的发生发展至关重要,也有研究表明znf32影响肿瘤耐药,但znf32是否参与结直肠癌发生发展中的作用以及耐药的分子机制尚未被揭示。
技术实现要素:
[0004]
为了证实znf32是否参与结直肠癌发生发展以及耐药的过程,本发明涉及抑制znf32基因表达在治疗结直肠癌中的应用,为结直肠癌带来新的治疗靶点及治疗手段。
[0005]
为了实现上述目的,本发明通过以下技术方案实现:
[0006]
本发明的第一方面,提供了抑制znf32基因表达在制备结直肠癌治疗药物中的应用。
[0007]
本发明第二方面,提供抑制znf32基因表达在制备诱导结直肠癌细胞凋亡药物中的应用。
[0008]
本发明第三方面,提供抑制znf32基因表达在制备抑制结直肠癌细胞的干性药物中的应用。
[0009]
本发明第四方面,提供抑制znf32基因表达在制备结直肠癌化疗药物敏感性促进剂中的应用。
[0010]
在一个优选的实施方案中,所述结直肠癌化疗药物包括奥沙利铂或卡培他滨。
[0011]
本发明第五方面,提供抑制znf32基因表达在制备结直肠癌化疗药物耐药性逆转剂中的应用。
[0012]
在一个优选的实施方案中,所述结直肠癌化疗药物包括奥沙利铂或卡培他滨。
[0013]
本发明第六方面,提供抑制znf32基因表达在制备抑制结直肠癌细胞的增殖药物中的应用。
[0014]
本发明第七方面,提供抑制znf32基因表达在制备抑制结直肠癌细胞的克隆形成药物中的应用。
[0015]
在一个优选的实施方案中,抑制znf32基因表达的方式/方法包括znf32的抗体、sirna、shrna、znf32的活性抑制剂以及敲除或敲低znf32基因的小分子物质。
[0016]
本发明第八方面,提供一种结直肠癌治疗药物,包含对znf32基因表达具有抑制作用的因子。
[0017]
本发明第九方面,提供一种结直肠癌治疗药物,为对znf32基因表达具有抑制作用的因子与至少一种结肠癌化疗药物的组合,所述结肠癌化疗药物包括奥沙利铂或卡培他滨。
[0018]
本发明收集12例接受新辅助化疗的敏感和耐药结直肠癌新鲜组织,进行rna转录组测序,筛选出耐药组织中显著高表达的基因znf32,进一步在公共数据库中进行验证了这一结论。通过蛋白印迹、实时定量pcr实验检测znf32基因在结直肠癌细胞系中的表达;cck-8、细胞干性形成、克隆形成、细胞流式等手段检测敲低znf32对结直肠癌细胞发生发展以及耐药的影响,证明znf32促进结直肠癌的生长增殖、干性形成、克隆形成,并从增殖、干性形成的角度证明其促进奥沙利铂和卡培他滨化疗耐药。
[0019]
本发明的有益效果如下:
[0020]
本技术发现znf32在结直肠癌中表达量较高,且与患者的不良预后有关,抑制znf32基因表达能够明显抑制结直肠细胞的生长繁殖、干性形成、克隆形成,并促进细胞凋亡,此外抑制znf32基因还能提高结直肠癌细胞的化疗敏感性,使化疗药物对结直肠癌细胞的dna损伤作用更强。znf32不仅结直肠癌的基因治疗提供新的靶标和肿瘤治疗提供新的策略,而且能作为化疗后复发或手术后转移的结肠癌的预后标志物。
附图说明
[0021]
图1为znf32在结直肠癌中表达结果与预后相关的结果图;
[0022]
图2为znf32在结直肠癌细胞系中的表达结果图;
[0023]
图3为敲低znf32后肿瘤细胞增殖和克隆形成的结果图;
[0024]
图4为敲低znf32后细胞干性形成的结果图;
[0025]
图5为敲低znf32后诱导结直肠癌细胞凋亡的结果图;
[0026]
图6为敲低znf32后结肠癌细胞的化疗敏感性的结果图;
[0027]
图7为敲低znf32后化疗药物对结肠癌细胞的dna损伤的结果图。
具体实施方式
[0028]
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0029]
此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
[0030]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示意性实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本公开的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
[0031]
实验材料
[0032]
(1)临床病例组织:收集12例接受xelox(capecitabine+oxaliplatin,卡培他滨+奥沙利铂)方案新辅助化疗的i-iii期结肠癌患者的新鲜组织,其中6例患者化疗达到完全缓解(定义为化疗敏感),6例患者未缓解(定义为化疗耐药)。本研究中所有患者样本的采集方案通过了伦理审查委员会的批准,所有患者均已签署知情同意书。
[0033]
(2)细胞:结直肠癌细胞系sw480、sw620、lovo、hct15、ht29、thc8307、dld和rko(来源于美国atcc细胞库);正常结直肠细胞系hcoepic(atcc);人源肾上皮细胞系293t(atcc);所有细胞保种于液氮中长期储存,-80℃环境中短期储存。
[0034]
(3)过表达质粒与sirna:均合成于中国上海吉玛公司,序列信息在表1。
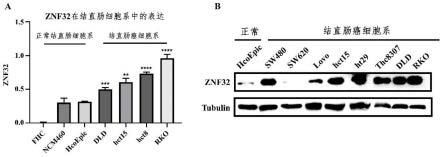
[0035]
表1
[0036][0037]
通用实验方法
[0038]
一、细胞培养
[0039]
1.贴壁细胞冻存
[0040]
选择生长状态良好、密度达到80%-90%的细胞进行冻存。弃掉原培养基,pbs清洗两次后,加入0.5-1ml胰蛋白酶,放入5%co237℃培养箱消化细胞1-3分钟,置于显微镜下观察,当细胞收缩变圆悬浮后,加入含有血清的培养基终止消化。收集细胞至离心管,1,000rpm离心2分钟。弃掉上清液,加入1ml无血清细胞冻存液至冻存管中,详细标记细胞名称、细胞来源、细胞代数、冻存时间和实验员姓名,置于-80℃冰箱中过夜后,移至液氮罐中
长期储存。
[0041]
2.贴壁细胞复苏
[0042]
液氮罐或-80℃冰箱中取出细胞,快速置于37℃水浴锅中。待冻存管中的混合液融化后,1,000rpm离心3分钟,弃掉上清液,加入1ml培养基重悬细胞,移至培养瓶或培养皿中,继续加入培养基,摇晃混匀后,置于5%co237℃培养箱中过夜。
[0043]
3.贴壁细胞传代
[0044]
当细胞生长密度达到80%-90%时,需要对细胞进行传代处理。弃掉原培养基,pbs清洗两次后,加入0.5-1ml胰蛋白酶,放入5%co237℃培养箱消化细胞1-3分钟,置于显微镜下观察,当细胞收缩变圆悬浮后,加入含有血清的培养基终止消化。收集细胞至离心管,1,000rpm离心2分钟。弃掉上清液,加入培养基重悬细胞,移至新的培养瓶或培养皿中继续培养。
[0045]
4.细胞转染
[0046]
细胞密度为70%时可进行转染,准备如下:以六孔板为例,a液:优化液100μl+lipo 30006μl,混匀后室温放置5min;b液:优化液100μl+片段100pmol,混匀后室温放置5min。将a液和b液混匀,室温放置20min。将混合液缓慢滴入细胞中,并不断轻轻震荡,细胞置于37℃5%co2培养箱中培养。4-6小时后换成新鲜培养基继续培养,48-72h收细胞进行检测。
[0047]
5.cck-8细胞增殖实验
[0048]
96孔板中每孔加入100μl混匀的细胞悬液,在培养箱中预培养细胞过夜。向每孔加入10μl cck-8溶液,在培养箱中培养2小时,用酶标仪检测在450nm处的吸光度值。
[0049]
6.流式细胞仪检测细胞凋亡
[0050]
消化各组细胞进行细胞计数,收集1-5
×
105个细胞混合液至15ml离心管中,1,000rmp离心5min。弃上清,加入500μl缓冲液重悬细胞,加入5μl annexin v-fitc充分混匀后,再加入5μl碘化丙啶细胞染色剂,室温避光反应15min。立即进行流式检测。
[0051]
7.流式细胞仪检测细胞周期
[0052]
离心收集细胞并用pbs洗涤,小心吸除上清液。加入70%乙醇,4℃固定2h或过夜。将固定后的细胞1,000rpm离心3min,弃上清液,pbs清洗2次。加入提前配置好的500μl pi/rnasea染色工作液,室温避光30-60min。立即进行流式检测。
[0053]
8.免疫荧光实验
[0054]
将细胞爬片固定于4%多聚甲醛中15min后,清除4%多聚甲醛,将爬片浸泡在pbs液中5min
×
3次。滴加0.1%tritionx-100至完全覆盖细胞室温孵育30min后,清除该液体,pbs清洗5min
×
3次。滴加山羊血清至完全覆盖细胞,室温15min。用pbs按1:400比例稀释一抗,4℃过夜孵育。清除一抗,pbs清洗5min
×
3次。滴加稀释比例为1:200的荧光二抗(注意避光操作),室温孵育60min。清除二抗,pbs清洗5min
×
3次。滴加抗荧光淬灭剂于载玻片上,最后封片镜检拍照。
[0055]
9.彗星实验
[0056]
6cm培养皿中加入1.5ml的0.5%正常熔点琼脂糖,置于4℃冰箱中待凝固。收集各组细胞分别与2%低熔点琼脂糖1:1混合后,加至培养皿中待凝固。在制备好的样本中加入预冷的裂解液,4℃裂解2h,用预冷的双蒸水清洗20min
×
3次。在预冷的电泳缓冲液中孵育45min,60v电压下电泳40min,电泳完成后进入中和缓冲液中和1h。用eb染色15min,pbs清洗
5min
×
3次,用荧光显微镜观察并拍照。
[0057]
10、克隆形成:
[0058]
将结直肠癌细胞(1
×
103个细胞)接种到6孔板中,并孵育24小时;然后,根据实验要求做不同的处理然后,在恒温细胞培养箱中培养2周,直到细胞生长成肉眼可见的细胞集落;最后,弃培养基,pbs清洗3次,用固定液固定十分钟后,用0.1%结晶紫染液进行染色;照相,用软件计克隆形成数。
[0059]
11、成球实验:
[0060]
将不同处理的贴壁的结直肠癌细胞用胰酶消化成单细胞;计数2000-4000个细胞分别接种在低粘附的培养器皿中,配置成球培养基(5ml):b27补充剂(100μl)、n2补充剂(50μl)、fgf(2μl)、egf(1μl)、1μg/ml奥沙利铂和5ml dmem/f12培养基(hyclone)中培养,待形成肉眼可见的球状体,大约需要两周;用倒置显微镜拍摄形成的结肠癌肿瘤球,并选取直径大于50μm的肿瘤球进行计数。按照肿瘤体积和大小进行归一化处理。
[0061]
二、westernblotting实验
[0062]
配置分离胶和浓缩胶;所有蛋白样品调制等浓度后上样,样品两侧的泳道用等体积的1
×
loadingbuffer上样。以100v的电压进行恒压电泳。当目的蛋白泳动距胶下缘1cm以上结束电泳。将pvdf膜在甲醇中浸泡约15sec,放置于转膜液中浸泡。装配转膜三明治:海绵—3层滤纸—胶—pvdf膜—3层滤纸—海绵,每层放置好后,赶去气泡。电转槽加入1000ml电转液,置于冰浴中,连接电极,电流350ma恒流转膜1h-2h。将膜从电转槽中取出,pbst稍加漂洗,放入5%脱脂牛奶中室温缓慢摇荡1h或4℃环境中过夜。加入提前稀释好的一抗,室温下轻摇孵育1小时或4℃静置过夜。一抗孵育结束后,pbst清洗10min
×
3次。加入提前稀释好的二抗,室温轻摇1小时。二抗孵育结束后,pbst清洗10min
×
3次。将发光a、b液以1:1比例混合,混合液均匀滴于膜上,应用凝胶成像仪发光成像。
[0063]
三、实时定量rt-pcr实验
[0064]
1、细胞系rna的抽提:应用rna提取试剂盒抽提rna后,进行rna浓度和质量测定。
[0065]
2、cdna的合成:在无rna酶离心管中加入1pg
–
1μg rna和4μl 4
×
gdna wiper mix溶液,加无酶水补齐至16μl,置于42℃水浴锅中2min。在混合液中继续加入4μl 5
×
hiscript iii qrt supermix溶液。以37℃15min和85℃5sec的条件进行逆转录合成,产物保存于-20℃冰箱中。
[0066]
3、实时定量pcr:在qpcr管中配置如下混合液:10μl 2
×
sybr qpcr mater mix、0.8μl引物混合液、模板cdna、ddh2o共20μl。随后,上机进行qpcr反应,反应条件如下表2所示:
[0067]
表2
[0068][0069]
实施例1
[0070]
znf32在结直肠癌中高表达且与不良预后相关。
[0071]
本实施例收集12例接受xelox方案(capecitabine+oxaliplatin,卡培他滨+奥沙利铂)新辅助化疗的i-iii期结直肠癌患者的新鲜组织,其中6例患者化疗达到完全缓解(pcr,定义为化疗敏感),6例患者未完全缓解(non-pcr,定义为化疗耐药)。裂解新鲜组织并提取rna,进行全转录组高通量测序,我们通过分析发现znf32基因在6例耐药结直肠癌组织中的mrna表达显著高于敏感组,结果如图1a所示。进一步在ncbi geo数据库中分析发现,与癌旁正常组织相比,znf32 mrna的表达水平在结直肠癌中显著增高,结果如图1b所示;与非转移结直肠癌组织相比较,转移组织中znf32 mrna表达升高,结果如图1c所示;与未复发结直肠癌相比较,复发性结直肠癌组织中znf32表达升高,结果如图1d所示。此外,kaplan-meir生存分析发现znf32高表达的结直肠癌患者预后较差,结果如图1e所示。因此推测znf32在结直肠癌的发生发展及化疗耐药方面起着重要作用。
[0072]
实施例2
[0073]
znf32在结直肠癌细胞系中高表达。
[0074]
为了明确在结直肠癌细胞中的znf32表达情况,本实施例通过real-time qpcr检测了4个结直肠癌细胞株(dld、hct15、hct8、rko)和3个正常结直肠上皮细胞株(fhc、ncm460、hcoepic)中znf32的表达水平。结果显示,相比正常细胞,肿瘤细胞中znf32 mrna的表达水平明显升高,结果如图2a所示。此外,本实施例还通过蛋白免疫印迹检测了8个结直肠癌细胞株(sw480、sw620、lovo、hct15、hct29、thc8307、dld、rko)和1个正常结直肠上皮细胞株(hcoepic)中znf32蛋白表达水平。结果显示,相比正常细胞,除sw620之外其它肿瘤细胞中znf32的表达水平明显升高,结果如图2b所示。上述结果说明,znf32在结直肠癌细胞株高水平表达。
[0075]
实施例3
[0076]
敲低znf32抑制肿瘤细胞增殖和克隆形成。
[0077]
本实施例研究znf32对结直肠癌细胞增殖的影响。首先,在dld和rko肿瘤细胞中转染sirna(sirna1和sirna2)敲低znf32的表达,转染48小时后收细胞,并通过wb和qrt-pcr验证znf32被成功敲低,结果如图3a所示。接下来,采用cck-8技术检测了细胞增殖活性的变
化,结果发现,在dld和rko肿瘤细胞中敲低了znf32的表达,可以明显降低肿瘤细胞增殖,结果如图3b和3c所示。同样地,本实施例还采用平板克隆实验,结果表明在结直肠癌细胞中敲低znf32的表达可以抑制肿瘤细胞克隆形成,结果如图3d和3e所示。
[0078]
实施例4
[0079]
敲低znf32可抑制细胞干性形成。
[0080]
本实施例研究了znf32对结直肠癌细胞干性形成的影响。通过成球实验检测了肿瘤细胞干性形成的情况,结果发现,在dld和rko肿瘤细胞中用2条sirna敲低znf32的表达,可以明显抑制肿瘤细胞干性形成,结果如图4a和4b所示,图片为不同组间200倍放大球体成像图同时,本实施例也检测到敲低znf32后,细胞干性指标c-kit和cd44蛋白表达明显降低,结果如图4c所示。
[0081]
实施例5
[0082]
敲低znf32可诱导结直肠癌细胞凋亡并诱导细胞g0/g1期阻滞。
[0083]
为检测znf32对结直肠癌细胞凋亡和周期的影响,本实施例采用流式技术检测肿瘤细胞凋亡和细胞周期的变化情况。结果发现在dld和rko肿瘤细胞中,sirna敲低znf32的表达可以明显诱导结直肠癌细胞的凋亡,结果如图5a和5b所示。同时,本实施例还检测到敲低znf32后,凋亡蛋白片段化的caspase-3和片段化的parp蛋白表达明显升高,结果如图5c所示。此外,本实施例进一步通过流式技术检测发现,在结直肠癌细胞系rko和dld中sirna敲低znf32的表达可诱导细胞阻滞在g0/g1期,结果如图5d所示。因此,上述实验结果提示znf32可能保护结直肠癌细胞抗凋亡能力,并可能成为结直肠癌基因治疗的靶标。
[0084]
实施例6
[0085]
敲低znf32提高结肠癌细胞的化疗敏感性。
[0086]
本实施例研究了znf32对结直肠癌细胞耐药性的影响。采用cck-8试验和成球实验分别检测肿瘤细胞在奥沙利铂和卡培他滨药物作用下的细胞活性和干性形成情况。结果发现,在rko和dld肿瘤细胞中敲低了znf32的表达,可以明显提高肿瘤细胞对奥沙利铂和卡培他滨的化疗敏感性,结果如图6a-6d所示。通过成球实验探究在化疗药物作用下的结直肠癌细胞中,敲低znf32对干性形成作用的影响,结果如图6e所示,图片为不同组间200倍放大球体成像图。通过wb检测药物作用下的dld和rko细胞系中,对照和敲低znf32组的细胞干性指标c-kit、cd44蛋白的表达,结果如图6f所示,结果表明,znf32敲低组中,奥沙利铂和卡培他滨药物对结直肠癌细胞干性形成抑制作用更强。
[0087]
实施例7
[0088]
敲低znf32使化疗药物对结肠癌细胞的dna损伤作用更强。
[0089]
由于奥沙利铂和卡培他滨都是介导dna损伤过程的化疗药物,本实施例通过彗星实验和免疫荧光实验观察znf32对化疗药物诱导的dna损伤作用的影响。首先包装含有shrnaznf32质粒的慢病毒,并转染到结直肠癌细胞系中,适当浓度的puromycin药筛2周,待细胞长到90%后,收细胞提取rna和蛋白,通过qrt-pcr和wb鉴定znf32被成功敲低且稳定表达。通过彗星实验,我们观察到与对照组rko和dld细胞相比,znf32敲低的稳转细胞系中在化疗药物的作用下dna损伤更强,结果如图7a和7b)。此外,免疫荧光实验结果表明,在奥沙利铂和卡培他滨药物的影响下,znf32稳定敲低组细胞的γ-h2ax染色增多,提示着dna损伤作用更强,结果如图7c-d所示。
[0090]
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只限于这些说明。对于本发明所属领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1