一种凝胶组合物及其制备方法和应用与流程
1.本发明涉及医药技术领域,具体涉及一种凝胶组合物及其制备方法和应用。
背景技术:
2.妇科炎症是女性的常见疾病之一,主要是指女性生殖器官的炎症,具体包括女性外阴炎、阴道炎、宫颈炎以及盆腔炎等。引起妇科炎症的原因往往是病原体导致身体炎症,随后继发支原体感染。因此,解决女性妇科炎症的问题还应该从抑制病原菌及支原体的繁殖入手。
3.现有的妇科用抗菌凝胶产品大多采用单一银离子溶液进行抗菌,杀菌、抑菌效果不佳,另外,还会使用一些单价比较贵的组分,经济成本较高。
技术实现要素:
4.因此,本发明要解决的技术问题在于克服现有技术中的抗菌效果不佳、经济成本高等缺陷,从而提供一种凝胶组合物及其制备方法和应用。
5.本发明提供一种凝胶组合物,包括如下质量百分含量的组分:
6.洗必泰0.10-0.20%;
7.防腐剂0.02-0.15%;
8.ph调节剂0.4-1.2%;
9.增稠剂0.8-2.5%;
10.保湿剂1.5-2.5%;
11.银离子抗菌剂,其中,以银离子计,银离子抗菌剂在凝胶组合物中的浓度为0.0019-0.011%。
12.可选的,所述凝胶组合物中,余量为水。
13.可选的,所述水为纯化水。
14.可选的,所述防腐剂为kf-88、山梨酸、苯甲酸盐、羟苯甲酯、羟苯乙酯中的一种或多种,
15.优选地,所述防腐剂为kf-88。
16.可选的,所述ph调节剂为选自三乙醇胺、氢氧化钠、碳酸钠中的一种或多种,优选地,所述ph调节剂为三乙醇胺;和/或,所述增稠剂为卡波姆、羟乙基纤维素、羟甲基纤维素中的一种或多种,优选地,所述增稠剂为卡波姆。
17.可选的,所述保湿剂为甘油、丙二醇、山梨醇中的一种或多种,优选地,所述保湿剂为甘油。
18.可选的,所述银离子抗菌剂为硝酸银,醋酸银、银氨络合物或氟化银中的一种或多种,优选地,所述银离子抗菌剂为0.5%硝酸银溶液。
19.本发明还提供一种上述凝胶组合物的制备方法,包括如下步骤:
20.s1,将洗必泰用水溶解,与保湿剂和ph调节剂混合,得到第一备用液;
21.s2,将增稠剂用水溶解,搅拌均质,与第一备用液混合,得到呈透明凝胶状的第二备用液;
22.s3,将银离子抗菌剂和防腐剂与第二备用液混合,得到所述凝胶组合物。
23.可选的,所述凝胶组合物的制备方法,还包括对所述第二备用液进行真空脱泡处理的步骤;
24.可选的,真空脱泡处理的温度为70-80℃;
25.可选的,真空脱泡处理的时间为30分钟-60分钟。
26.可选的,所述真空脱泡处理之后还包括降温和破真空的步骤;
27.可选的,降温至40℃以下。
28.可选的,步骤s1中将洗必泰用50-60℃的水溶解。
29.本发明还提供一种上述凝胶组合物或上述制备方法制备得到的凝胶组合物在妇科中的应用;
30.可选的,所述凝胶组合物在制备治疗妇科炎症药物中的应用。
31.本发明还提供一种上述凝胶组合物或上述制备方法制备出的凝胶组合物在妇科炎症抗菌方面的应用。
32.本发明技术方案,具有如下优点:
33.1.本发明提供的凝胶组合物,通过组分之间的配合以及用量的调整,所得凝胶组合物稳定性和抗菌效果好,且成本低。特别是,银离子抗菌剂和洗必泰两种原料的协同配合,通过二者复配进行抗菌、消毒,相较于采用单一银离子的抗菌凝胶,抗菌效果得到显著提高。另外,该凝胶组合物中并未使用价格昂贵的原料成分,因此,成本较低。
34.2.本发明提供的凝胶组合物的制备方法,该方法操作规范,通过该方法制备的凝胶组合物在抗菌和防腐性能方面较为稳定,使用感较好。特别是加入银离子时机的限定,第二备用液呈凝胶状后再加入银离子,避免了银离子与第二备用液中的ph调节剂发生络合或其他反应而降低银离子的有效浓度,保证了抗菌性能。加入防腐剂时机的限定能够避免或减少与其他物料发生反应的几率,以免受ph值、温度等因素的影响而使防腐性能下降。
35.3.本发明提供的凝胶组合物的制备方法中,真空脱泡处理工序使得物料分布更均匀,灌装过程更方便,使用过程更高效,产品更美观。
具体实施方式
36.提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
37.实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
38.以下实施例和对比例中使用的化妆品级的kf-88均购自广东鼎辉控股有限公司。
39.实施例1
40.本实施例提供一种凝胶组合物的制备方法,包括如下步骤:
41.(1)取10g纯化水,加热至55℃,加入0.12g洗必泰搅拌至溶解,加入2g甘油搅拌均匀,加入1g三乙醇胺搅拌均匀,得到透明的第一备用液;
42.(2)取82.58g纯化水,加入1g卡波姆,搅拌均质25分钟,加入所述第一备用液,搅拌25分钟,得到呈透明凝胶状的第二备用液;
43.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为80℃,真空脱泡处理时间为35分钟;真空脱泡处理之后降温至40℃以下;
44.(4)向所述第二备用液中加入3.2g 0.5%硝酸银,搅拌20分钟,加入0.1gkf-88,进行破真空处理,搅拌25分钟,降温冷却后制得所述抗菌凝胶组合物。
45.实施例2
46.本实施例提供一种凝胶组合物的制备方法,包括如下步骤:
47.(1)取10g纯化水,加热至50℃,加入0.10g洗必泰搅拌至溶解,加入1.5g甘油搅拌均匀,加入0.8g三乙醇胺搅拌均匀,得到透明的第一备用液;
48.(2)取86.12纯化水,加入0.8g卡波姆,搅拌均质20分钟,加入所述第一备用液,搅拌21分钟,得到呈透明凝胶状的第二备用液;
49.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为70℃,真空脱泡处理时间为31分钟;真空脱泡处理之后降温至40℃以下;
50.(4)向所述第二备用液中加入0.6g 0.5%硝酸银,搅拌20分钟,加入0.08gkf-88,进行破真空处理,搅拌21分钟,降温冷却后制得所述抗菌凝胶组合物。
51.实施例3
52.本实施例提供一种凝胶组合物的制备方法,包括如下步骤:
53.(1)取20g纯化水,加热至60℃,加入0.20g洗必泰搅拌至溶解,加入2.5g甘油搅拌均匀,加入1.2g三乙醇胺搅拌均匀,得到透明的第一备用液;
54.(2)取71.58g纯化水,加入1.2g卡波姆,搅拌均质30分钟,加入所述第一备用液,搅拌29分钟,得到呈透明凝胶状的第二备用液;
55.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为80℃,真空脱泡处理时间为39分钟;真空脱泡处理之后降温至40℃以下;
56.(4)向所述第二备用液中加入3.2g 0.5%硝酸银,搅拌20分钟,加入0.12gkf-88,进行破真空处理,搅拌29分钟,降温冷却后制得所述抗菌凝胶组合物。
57.实施例4
58.本实施例提供一种凝胶组合物的制备方法,包括如下步骤:
59.(1)取12g纯化水,加热至52℃,加入0.11g洗必泰搅拌至溶解,加入1.7g山梨醇搅拌均匀,加入0.9g三乙醇胺搅拌均匀,得到透明的第一备用液;
60.(2)取83.34g纯化水,加入0.9g卡波姆,搅拌均质22分钟,加入所述第一备用液,搅拌23分钟,得到呈透明凝胶状的第二备用液;
61.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为72℃,真空脱泡处理时间为33分钟;真空脱泡处理之后降温至40℃以下;
62.(4)向所述第二备用液中加入0.96g 0.5%银氨溶液硝酸银,搅拌20分钟,加入0.09g kf-88,进行破真空处理,搅拌23分钟,降温冷却后制得所述抗菌凝胶组合物。
63.实施例5
64.本实施例提供一种凝胶组合物的制备方法,包括如下步骤:
65.(1)取18g纯化水,加热至58℃,加入0.18g洗必泰搅拌至溶解,加入2.3g甘油搅拌均匀,加入1.1g三乙醇胺搅拌均匀,得到透明的第一备用液;
66.(2)取72.89g纯化水,加入2.5g羟甲基纤维素,搅拌均质28分钟,加入所述第一备用液,搅拌27分钟,得到呈透明凝胶状的第二备用液;
67.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为78℃,真空脱泡处理时间为37分钟;真空脱泡处理之后降温至40℃以下;
68.(4)向所述第二备用液中加入2.88g 0.5%硝酸银,搅拌20分钟,加入0.05g羟苯甲酯和0.1g的羟苯乙酯,进行破真空处理,搅拌27分钟,降温冷却后制得所述抗菌凝胶组合物。
69.实施例6
70.本实施例提供一种凝胶组合物的制备方法,包括如下步骤:
71.(1)取10g纯化水,加热至55℃,加入0.12g洗必泰搅拌至溶解,加入2g甘油搅拌均匀,加入1g三乙醇胺搅拌均匀,加入3.2g 0.5%硝酸银溶液搅拌均匀,得到透明的第一备用液;
72.(2)取82.58g纯化水,加入1g卡波姆,搅拌均质25分钟,加入所述第一备用液,搅拌25分钟,得到呈透明凝胶状的第二备用液;
73.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为80℃,真空脱泡处理时间为35分钟;真空脱泡处理之后降温至40℃以下;
74.(4)向所述第二备用液中加入0.1g kf-88,进行破真空处理,搅拌25分钟,降温冷却后制得所述抗菌凝胶组合物。
75.实施例7
76.本实施例提供一种凝胶组合物的制备方法,包括如下步骤:
77.(1)取10g纯化水,加热至55℃,加入0.12g洗必泰搅拌至溶解,加入2g甘油搅拌均匀,加入1g三乙醇胺搅拌均匀,加入0.1g kf-88,搅拌25分钟,得到透明的第一备用液;
78.(2)取82.58g纯化水,加入1g卡波姆,搅拌均质25分钟,加入所述第一备用液,搅拌25分钟,得到呈透明凝胶状的第二备用液;
79.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为80℃,真空脱泡处理时间为35分钟;真空脱泡处理之后降温至40℃以下;
80.(4)向所述第二备用液中加入3.2g 0.5%硝酸银,搅拌20分钟,进行破真空处理,搅拌25分钟,降温冷却后制得所述抗菌凝胶组合物。
81.实施例8
82.本实施例提供一种凝胶组合物的制备方法,包括如下步骤:
83.(1)取10g纯化水,加热至55℃,加入0.12g洗必泰搅拌至溶解,加入2g甘油搅拌均匀,加入1g三乙醇胺搅拌均匀,得到透明的第一备用液;
84.(2)取82.58g纯化水,加入1g卡波姆,搅拌均质25分钟,加入所述第一备用液,搅拌25分钟,得到呈透明凝胶状的第二备用液;
85.(3)向所述第二备用液中加入3.2g 0.5%硝酸银,搅拌20分钟,加入0.1gkf-88,搅拌25分钟,降温冷却后制得所述抗菌凝胶组合物。
86.实施例9
87.本对比例提供一种凝胶组合物的制备方法,包括如下步骤:
88.(1)取10g纯化水,加热至55℃,加入0.12g洗必泰搅拌至溶解,加入2g甘油搅拌均匀,加入0.4g三乙醇胺搅拌均匀,得到透明的第一备用液;
89.(2)取83.18g纯化水,加入1g卡波姆,搅拌均质25分钟,加入所述第一备用液,搅拌25分钟,得到呈透明凝胶状的第二备用液;
90.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为80℃,真空脱泡处理时间为35分钟;真空脱泡处理之后降温至40℃以下;
91.(4)向所述第二备用液中加入3.2g 0.5%硝酸银,搅拌20分钟,加入0.1gkf-88,进行破真空处理,搅拌25分钟,降温冷却后制得所述抗菌凝胶组合物。
92.实施例10
93.本对比例提供一种凝胶组合物的制备方法,包括如下步骤:
94.(1)取10g纯化水,加热至55℃,加入0.12g洗必泰搅拌至溶解,加入2g甘油搅拌均匀,加入1g三乙醇胺搅拌均匀,得到透明的第一备用液;
95.(2)取82.66g纯化水,加入1g卡波姆,搅拌均质25分钟,加入所述第一备用液,搅拌25分钟,得到呈透明凝胶状的第二备用液;
96.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为80℃,真空脱泡处理时间为35分钟;真空脱泡处理之后降温至40℃以下;
97.(4)向所述第二备用液中加入3.2g 0.5%硝酸银,搅拌20分钟,加入0.02gkf-88,进行破真空处理,搅拌25分钟,降温冷却后制得所述抗菌凝胶组合物。
98.对比例1
99.本对比例提供一种凝胶组合物的制备方法,包括如下步骤:
100.(1)取10g纯化水,加热至55℃,加入0.12g洗必泰搅拌至溶解,加入2g甘油搅拌均匀,加入1g三乙醇胺搅拌均匀,得到透明的第一备用液;
101.(2)取85.73g纯化水,加入1g卡波姆,搅拌均质25分钟,加入所述第一备用液,搅拌25分钟,得到呈透明凝胶状的第二备用液;
102.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为80℃,真空脱泡处理时间为35分钟;真空脱泡处理之后降温至38℃;
103.(4)向所述第二备用液中加入0.05g醋酸氯已定搅拌20分钟,加入0.1gkf-88,进行破真空处理,搅拌25分钟,降温冷却后制得所述抗菌凝胶组合物。
104.对比例2
105.本对比例提供一种凝胶组合物的制备方法,包括如下步骤:
106.(1)取10g纯化水,加热至55℃,加入0.1g壳聚糖搅拌至溶解,加入2g甘油搅拌均匀,加入1g三乙醇胺搅拌均匀,得到透明的第一备用液;
107.(2)取82.60g纯化水,加入1g卡波姆,搅拌均质25分钟,加入所述第一备用液,搅拌25分钟,得到呈透明凝胶状的第二备用液;
108.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为80℃,真空脱泡处理时间为35分钟;真空脱泡处理之后降温至38℃;
109.(4)向所述第二备用液中加入3.2g 0.5%硝酸银,搅拌20分钟,加入0.1gkf-88,进
行破真空处理,搅拌25分钟,降温冷却后制得所述抗菌凝胶组合物。
110.对比例3
111.本对比例提供一种凝胶组合物的制备方法,包括如下步骤:
112.(1)取10g纯化水,加热至55℃,加入0.12g洗必泰搅拌至溶解,加入2g甘油搅拌均匀,加入1g三乙醇胺搅拌均匀,得到透明的第一备用液;
113.(2)取85.48g纯化水,加入1g卡波姆,搅拌均质25分钟,加入所述第一备用液,搅拌25分钟,得到呈透明凝胶状的第二备用液;
114.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为80℃,真空脱泡处理时间为35分钟;真空脱泡处理之后降温至40℃以下;
115.(4)向所述第二备用液中加入0.3g 0.5%硝酸银,搅拌20分钟,加入0.1g kf-88,进行破真空处理,搅拌25分钟,降温冷却后制得所述抗菌凝胶组合物。
116.对比例4
117.本对比例提供一种凝胶组合物的制备方法,包括如下步骤:
118.(1)取10g纯化水,加热至55℃,加入0.01g洗必泰搅拌至溶解,加入2g甘油搅拌均匀,加入1g三乙醇胺搅拌均匀,得到透明的第一备用液;
119.(2)取82.69g纯化水,加入1g卡波姆,搅拌均质25分钟,加入所述第一备用液,搅拌25分钟,得到呈透明凝胶状的第二备用液;
120.(3)对所述第二备用液进行真空脱泡处理,直至无气泡状态,其中,真空脱泡处理的温度为80℃,真空脱泡处理时间为35分钟;真空脱泡处理之后降温至40℃以下;
121.(4)向所述第二备用液中加入3.2g 0.5%硝酸银,搅拌20分钟,加入0.1g kf-88,进行破真空处理,搅拌25分钟,降温冷却后制得所述抗菌凝胶组合物。
122.实验例
123.对实施例1-8和对比例1-6制备出的凝胶组合物,进行杀菌效果实验;并对实施例1-6制备出的凝胶组合物进行阴道黏膜刺激实验。
124.实验仪器:
125.游标卡尺、生物安全柜、生化培养箱、游标卡尺、可调式微量移液器(5μl~50μl)、电动混合器、放大镜、电子天平、自动组织脱水剂、石蜡包埋机、轮转机切片机、病理图文摄像系统(购自:背景瑞科中仪科技有限公司;motican2506)、压力蒸汽灭菌器、自动细胞计数仪(购自:北京科誉兴业科技发展有限公司,型号:ic1000)、恒温培养摇床、二氧化碳培养箱、倒置生物显微镜(购自:深圳市华显光学仪器有限公司;型号:ae31)、数显冷冻水浴恒温振荡器、全自动酶标仪(购自:上海珂淮仪器有限公司;型号:elx800)
126.1.抗菌效果实验
127.试验菌种:金黄色葡萄球菌atcc6538,大肠杆菌8099,白色念珠菌atcc10231,以上菌种代数均为第5代,均从北京三药购买。
128.实验试剂:营养琼脂培养基、沙堡琼脂培养基、抑菌剂载体(5mm直径;新华一号定性滤纸片)。
129.实验具体方法:
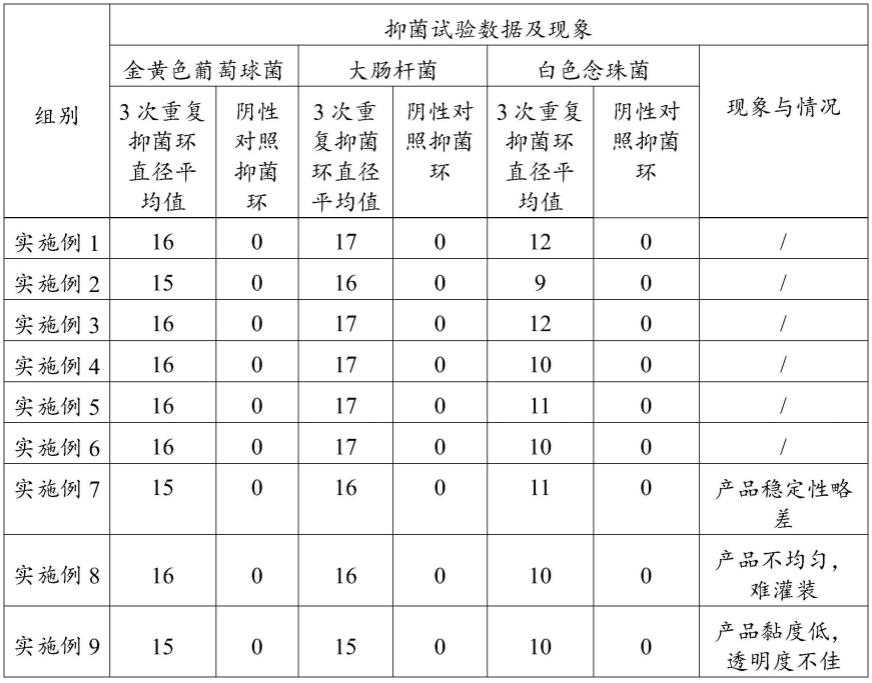
130.(1)试验样片的制备:每片滴加浓度为0.003%-0.016%的抑菌剂(即:实施例1-8和对比例1-6制备出的凝胶组合物)溶液20μl,然后将滤纸片平放于清洁的无菌平皿内,开
盖置室温下自然干燥后备用。溶出性抗菌产品,制成直径为5mm,厚度为3mm圆片,每4片一组。
131.(2)阴性对照组样片的制备:取无菌干燥滤纸片,每片滴加无菌蒸馏水20μl,干燥后备用。阴性对照组取同种材质不含抑菌成份的样品,制成与试验组大小相同的样片。
132.(3)试验菌的接种:用无菌棉拭子蘸取浓度为5
×
105cfu/ml试验菌悬液,在营养琼脂培养基平板表面均匀涂抹3次。每涂抹1次,平板应转动60
°
,最后将棉拭子绕平板边缘涂抹一周。盖好平皿,置室温干燥5min。
133.(4)抑菌剂样片的贴放:每次试验贴放1个染菌平板,每个平板贴放4片试验样片,1片阴性对照样片,共5片。用无菌镊子取样片贴放于平板表面。各样片中心之间相距25mm,与平板的周缘相距15mm。贴放好后,用无菌镊子轻压样片,使其紧贴于平板表面。盖好平皿,置37℃温箱,培养18h观察结果。用游标卡尺测量抑菌环的直径并记录。试验重复3次。
134.1)检测依据:《消毒技术规范》(2002年版)2.1.8.2抗(抑)菌试验抑菌环试验;2)检测条件:环境温度:20℃~22℃,相对湿度:49%~51%。实验结果如下表1所示。
135.表1
136.[0137][0138]
以上不同实施例和对比例提供的产品对金黄色葡萄球菌、大肠杆菌和白色念珠菌均有不同程度的抑菌作用,在金黄色葡萄球菌和大肠杆菌的抑菌性能强弱方面,实施例1、实施例3、实施例4、实施例5、实施例6>实施例8>实施例7、实施例2>实施例9和实施例10;在白色念珠菌的抑菌性能强弱方面,实施例1和实施例3>实施例5、实施例7和实施例10>实施例4、实施例6、实施例8和实施例9>实施例2,综合来看,实施例1和实施例3的抑菌性能最优。对比例1、对比例2、对比例3和对比例4中除对比例2的白色念珠菌的抑菌性能略好以外,金黄色葡萄球菌和大肠杆菌的抑菌性能均比实施例1-10的要差。
[0139]
其中,在实施例6中,银离子的加入时机使其与三乙醇胺发生络合反应,因此,抗菌效果相较于实施例1有所降低。实施例7中防腐剂kf-88的加入时机增大了其与其他物料发生反应可能性,实施例10中加入的防腐剂浓度过小,在做稳定性试验时,产品的质量略微下降,利用高效气相色谱仪器检测到料液中kf-88的含量有所下降,二者的稳定性相对略差,抗菌性也受到一定的影响。实施例8中未进行真空脱泡处理,导致产品外观不佳且灌装不易,气泡中的氧气可能会带来产品被氧化的风险。实施例9中的三乙醇胺的投料量不足,使得产品黏度低和透明度不佳。对比例1中没有添加银离子而抗菌性能整体较弱,尤其是,白色念珠菌的抑菌性能;实施例2中没有添加洗必泰而添加壳聚糖,在金黄色葡萄球菌和大肠杆菌的抑菌性能方面略弱;对比例3中的银含量偏低而导致对白色念珠菌的抑菌性能略弱;对比列4中的洗必泰含量偏低而导致对金黄色葡萄球菌和大肠杆菌的抑菌性能略弱。综合得出,洗必泰和银离子复配使用,产品的抗菌能力更全面、显著增强,符合日常和工业化使用。
[0140]
2.阴道黏膜刺激实验
[0141]
实验动物:体重在2.0kg~2.5kg的健康且阴道无损伤、初成年的雌性家兔。试验前检查动物阴道口有无分泌物、充血、水肿和其他损伤情况。
[0142]
实验试剂:实施例1-6制备的凝胶组合物的样品原液、对照组采用生理盐水。检测条件:环境温度:22℃~26℃,相对湿度:40%-70%。
[0143]
实验具体方法:将长度为8cm左右的钝头软管与2ml的注射器连接。注射器和导管注满待注射液备用。将动物分为染毒组(注射样品原液)和对照组(注射同等剂量生理盐水),每组3只。将动物仰面固定,暴露出会阴和阴道口。将导管用待注射液湿润后轻柔地插入染毒组动物的阴道(4cm~5cm),并用注射器缓慢注入2ml受试液,抽出导管,完成染毒。每隔24h重复染毒一次,连续5天。对照组动物用生理盐水作同样处理。末次染毒后无痛处死动物,取出完整的阴道,纵向切开,供病理取材时参考。然后将阴道放入10%的福尔马林溶液中固定24h以上,选取阴道的两端和中央3个部位的组织制片,he染色后,做病理组织学检查。具体方法依据《消毒技术规范》(2002年版)2.3.5“阴道黏膜刺激试验”。3个试验组和3个
对照组的一次阴道黏膜刺激试验数据如下表2所示。
[0144]
表2
[0145][0146][0147]
备注:1)评分标准及刺激强度分级参照《消毒技术规范》(2002年版)2.3.5“阴道黏膜刺激试验”中表2-16和表2-17。2)表2中的x+y+z表示组织病理试验中雌性家兔的前段、中段和后段三个部位的阴道黏膜刺激的反应评分。3)每个部位反应评分为4个反应评分之和;4)阴道黏膜刺激指数=试验组平均积分减去对照组平均积分。
[0148]
由表2可知,本技术的实施例2、对比例4的阴道黏膜刺激指数大于1,其阴道黏膜刺激反应强度为极轻;其余的阴道黏膜刺激指数均小于1,阴道黏膜刺激反应强度为无。
[0149]
3.豚鼠皮肤致敏实验
[0150]
实验动物:体重在0.25
±
0.05kg的健康豚鼠,购自长沙市天勤生物技术有限公司。
[0151]
实验试剂:0.9%氯化钠注射液,购自江西科伦药业有限公司。
[0152]
实验具体方法:按照《消毒技术规范》(2002年版)2.3.3.3.1一次完整皮肤刺激试验的方法进行。1)每组3只豚鼠,每只豚鼠的脊柱左右两侧分为试验区(施以样品原液)和对照区(施以0.9%氯化钠注射液)。2)在试验前24h,用剔毛器剔除豚鼠背部脊柱两侧被毛,不得损伤皮肤。去毛范围为左、右各3cm
×
3cm。3)次日将样品原液0.5ml直接滴于面积为2.5cm
×
2.5cm的一侧去毛完整皮肤上,然后用一层无刺激塑料膜覆盖,再用无刺激胶布固定;并将相同剂量的0.9%氯化钠注射液滴于另一侧去毛皮肤作为对照区,然后用一层无刺激塑
料膜覆盖,再用无刺激胶布固定。敷贴时间为4h,试验结束后,用温水或无刺激性溶剂除去残留受试物。4)分别于去除受试物后1h、24h和48h观察皮肤局部反应。实验结果如下表3所示:
[0153]
表3
[0154][0155]
备注:1)每个部位反应评分为2个反应(红斑形成和水肿形成)评分之和;2)表3中的x+y表示一次完整皮肤刺激反应(红斑形成和水肿形成)的皮肤刺激反应评分数值(参照《消毒技术规范》(2002年版)表2-11皮肤刺激反应的评分标准评分);3)皮肤刺激指数=皮肤刺激反应评分之和/动物数量。
[0156]
由表3可知,实施例1、实施例2、实施例4、实施例6、对比例3和对比例4的皮肤刺激指数均为0,对应的刺激强度级别为无刺激性,实施例3和实施例5的皮肤刺激指数均为1,对应的刺激强度级别为轻刺激性。
[0157]
4.体外细胞毒性实验
[0158]
实验细胞株以及来源:小鼠成纤维细胞(l-929),由中国科学院上海生命科学研究院细胞资源中心提供。
[0159]
试验试剂:
[0160]
培养基:mem(1
ⅹ
)培养基(购自gibco公司)
[0161]
血清:胎牛血清(购自gibco公司)
[0162]
浸提介质:含10%胎牛血清的mem培养液
[0163]
供试液制备:取凝胶,按凝胶:浸提介质为0.2g:1ml的浸提比例,37℃放置24h,浸提液稀释4倍,即得25%供试液。
[0164]
空白对照液:同批浸提介质,37℃放置24h,作为空白对照液。
[0165]
阴性对照液:取高密度聚乙烯,用超纯水洗净晾干,紫外线照射过夜,按0.2g/ml的比例加入同批浸提介质37℃浸提24h,作为阴性对照液。
[0166]
阳性对照液:取0.8ml dmso加入到7.2ml同批浸提介质中即得10%dmso,37℃放置24h,即为阳性对照液。
[0167]
实验具体方法:1)将已培养48h~72h生长旺盛的细胞用消化液(胰蛋白酶或与
edta混合液)消化后加入细胞培养基,吹打混匀计数后将细胞悬液配制成密度1
×
105个/ml接种于96孔板,在96孔板试验区外围(如第1列和第7列、第1行和第8行)每孔加入0.1ml无细胞的含10%胎牛血清培养液,剩余中间每孔接种0.1ml上述制备好的细胞悬液。置co2培养箱培养24h(37℃,5%co2);2)24h后,弃去加入细胞孔的原培养液,其中12孔加入空白对照液作为空白对照,6孔加入阴性对照液,6孔加入阳性对照液,其余6孔加入供试液,置co2培养箱继续培养24h,(布版情况见下表4);3)24h后,显微镜下观察,记录细胞形态学改变。然后弃去测试孔培养液,每孔加入50μi 1mg/ml的mtt溶液(用mem新鲜配制,0.22μm过滤后使用),37℃孵育2h后弃去所有孔内液体,加入0.1ml异丙醇,置振荡器上振荡10min,在酶标仪上双波长(570nm,630nm)测定吸光度(见表6),计算细胞存活率。其中,存活率(%)=od570e/od570b
×
100,od570e为各试样样品浸提液光密度平均值;od570b为空白光密度平均值。
[0168]
表4
[0169]
bbbbbbb
ꢀꢀꢀꢀꢀ
bbncpccibb
ꢀꢀꢀꢀꢀ
bbncpccibb
ꢀꢀꢀꢀꢀ
bbncpccibb
ꢀꢀꢀꢀꢀ
bbncpccibb
ꢀꢀꢀꢀꢀ
bbncpccibb
ꢀꢀꢀꢀꢀ
bbncpccibb
ꢀꢀꢀꢀꢀ
bbbbbbb
ꢀꢀꢀꢀꢀ
[0170]
备注:1)b为空白对照孔;nc为阴性对照孔;pc为阳性对照孔;ci为供试液;b为不含细胞孔。
[0171]
按照gb/t 14233.2-2005细胞毒性试验标准进行分级,标准见下表5。
[0172]
表5
[0173]
级别相对增值率(细胞存活率)/%0≥100180-99250-79330-4940-29
[0174]
表6
[0175]
[0176][0177]
评价标准
[0178]
以下条件均满足时,试验成立:1)空白对照组平均od≥0.2;2)左/右两边空白对照组存活率之差≤15%;3)阴性对照组和阳性对照组均出现预期效果。
[0179]
通过存活率的计算公式计算可知,实施例1、实施例2、实施例3、实施例4、实施例5、实施例6、对比例3和对比例4中的25%供试液细胞存活率分别为79%、79%、74%、79%、75%、78%、79%和79%,按照gb/t 14233.2-2005细胞毒性试验标准进行分级,以上8组条件的供试品细胞毒性均为2级,相对较安全。
[0180]
对以上四个试验的数据与现象进行汇总,如下表7:
[0181]
表7
[0182][0183]
[0184]
实施例1和实施例3的综合抗菌效果最好,但是实施例3的皮肤致敏和细胞毒性存活率较差,实施例1相对较好。综合考虑可得,最佳方案为实施例1,最佳配比范围为:洗必泰0.10%-0.20%,防腐剂0.02%-0.15%,ph调节剂0.4%-1.2%,增稠剂0.8%-2.5%,保湿剂1.5%-2.5%,银离子0.0019%-0.011%。
[0185]
综合上述结果,洗必泰与银离子这两种抗菌剂的复合使用可达到抗菌效果增强的效果,并且凝胶组合物中未使用昂贵成分,因此,成本较低。另外,本发明的凝胶组合物的刺激性、致敏性和毒性较小,对于私处使用的安全性相对较高。
[0186]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1