一种miR-3131抑制剂在制备药物中的应用
一种mir-3131抑制剂在制备药物中的应用
技术领域
1.本发明涉及生物医药领域,更具体地,涉及mir-3131抑制剂在制备药物中的应用。
背景技术:
2.脑动静脉畸形(brain arteriovenous malformations,bavms)是一种少见的血管病变,主要病理特征为动脉与静脉之间没有正常毛细血管床,动脉与静脉直接相通,使得动脉血液没有经过毛细血管床而是直接流入引流静脉。脑动静脉畸形通常发生在年轻人身上,表现为癫痫发作、神经功能缺损、头痛或破坏性自发性颅内出血。
3.目前,临床上对于脑动静脉畸形的主要治疗方法包括显微神经外科手术治疗、血管内介入栓塞以及复合手术治疗。上述方法均为手术治疗手段,相比药物治疗,手术治疗对患者的身体损害比较大,且手术风险高。但是,目前还没有针对脑动静脉畸形的有效的药物,因此,亟需一种能够治疗脑动静脉畸形的药物来替代手术治疗。
技术实现要素:
4.为了解决上述技术问题,本发明提供了一种mir-3131抑制剂在制备药物中的应用,能够有效治疗脑动静脉畸形。
5.本发明实施例提供一种mir-3131抑制剂在制备药物中的应用,所述应用包括:所述mir-3131抑制剂在制备治疗脑动静脉畸形的药物中的应用,所述mir-3131抑制剂的基因序列如序列表中seq id no:1所示。
6.具体地,所述药物为抑制kras突变的脑动静脉畸形的药物。
7.具体地,所述药物为抑制kras突变的脑动静脉畸形中内皮间充质转化的药物。
8.具体地,所述药物为抑制kras
g12d
突变的脑动静脉畸形中内皮间充质转化的药物。
9.本发明实施例提供一种mir-3131抑制剂在制备药物中的应用,mir-3131抑制剂可用于制备治疗kras
g12d
突变的bavm内皮细胞endmt的药物,具体地,mir-3131抑制剂可用于制备抑制kras突变的bavm内皮细胞endmt的药物,进一步地,mir-3131抑制剂可用于制备治疗kras突变的bavm的药物,更进一步地,mir-3131抑制剂可用于制备治疗bavm的药物。
10.本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。本发明的目的和其他优点可通过在说明书、权利要求书以及附图中所特别指出的结构来实现和获得。
附图说明
11.附图用来提供对本发明技术方案的进一步理解,并且构成说明书的一部分,与本技术的实施例一起用于解释本发明的技术方案,并不构成对本发明技术方案的限制。
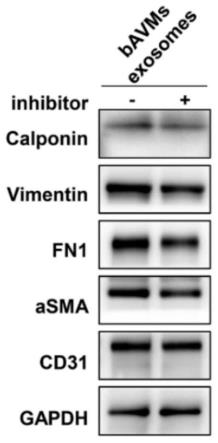
12.图1是本发明实施例提供的mir-3131抑制剂对经bavm外泌体处理的huvec的蛋白质印迹分析结果图,图中,gapdh为参照。
13.图2是本发明实施例提供的mir-3131抑制剂分别对经转染上清液处理的huvec和
转染上清液的蛋白质印迹分析对比图,图中,gapdh为参照。
14.图3是本发明实施例提供的mir-3131抑制剂对患者2的bavm内皮细胞的蛋白质印迹分析结果图,图中,gapdh为参照。
15.图4是本发明实施例提供的mir-3131抑制剂分对用kras
g12d
和kras
nc
转染的huvec衍生的外泌体处理的huvec的对比图,图中,gapdh为参照。
16.图5为mir-3131抑制剂分别对用kras
g12d
和kras
nc
转染的huvec衍生的转染上清液处理的huvec的影响对比图,图中,gapdh为参照。
具体实施方式
17.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例的附图,对本发明实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
18.实施例
19.本发明实施例提供一种mir-3131抑制剂在制备药物中的应用,应用包括:mir-3131抑制剂在制备治疗脑动静脉畸形的药物中的应用,mir-3131抑制剂的基因序列如序列表中seq id no:1所示,具体为:5
’‑
aaggcccuuccaccaguccucga-3’。
20.具体地,药物为抑制kras突变的脑动静脉畸形的药物。
21.具体地,药物为抑制kras突变的脑动静脉畸形中内皮间充质转化(endothelial-to-mesenchymal transition,endmt)的药物。
22.具体地,该药物为抑制kras
g12d
突变的脑动静脉畸形中endmt的药物。
23.获得原代bavm(brain arteriovenous malformation,脑动静脉畸形)内皮细胞的具体步骤如下:
24.1、获得bavm组织:本实施例采用的20例bavm组织的标本分别来自首都医科大学(中国北京)北京天坛医院神经外科的20例bavm患者(编号为患者1~患者20)。出于研究目的,获得了将bavm组织存入银行的知情同意。用于研究目的的bavm组织的收集经北京天坛医院伦理委员会批准。bavm组织被密封在装满盐水的无菌玻璃瓶中,并转移到实验室进行分离和培养。
25.2、bavm组织的分离和培养:将bavm组织用杜氏磷酸缓冲盐溶液(dpbs,#d8537,sigma,usa)洗涤,将洗涤后的bavm组织切成小方块,并与浓度为0.1%的胶原酶i(#c2674,sigma,usa)混合后在37℃下孵育15分钟,进行预消化。将预消化的bavm组织通过100μm的细胞过滤器(#352360,bd biosciences,usa)进行过滤。将通过细胞过滤器的细胞悬液以300
×
g离心3分钟,得到沉淀,然后将沉淀重悬于内皮培养基(ecm,#1001,sciencell,usa)中。使用抗cd31磁珠(#130-091-935,miltenyibiotec,germany)分离bavms内皮。在t75烧瓶(#3290,corning,usa)中用ecm重新悬浮bavms内皮细胞,得到原代bavm内皮细胞,即原代bavm ecs。
26.全外显子和ddpcr验证kras
g12d
突变
27.原代bavm内皮细胞的dna提取和全外显子组测序均使用市售试剂盒(gentrapuregene,qiagen,德国)从bavm内皮细胞中分离基因组dna。使用两种方法检查dna
的质量。1、在浓度为1%的琼脂糖凝胶上监测dna的降解和污染,并使用qubit 2.0荧光计(invitrogen,美国)测量基因组dna浓度。每个样本总共使用0.6μg基因组dna进行文库的制备。使用agilent sureselect human all exon v6试剂盒(agilent technologies,usa)生成测序文库并添加索引代码。使用hiseq pe cluster kit(illumina,usa)在cbot cluster generation system上对索引编码的样本进行聚类。聚类后簇生成,并在illumina hiseq平台上对dna文库进行测序,并生成150bp双末端读数。使用ddpcr验证了kras
g12d
内皮细胞突变。最终,20名bavm患者中有6名被发现在bavm内皮细胞中具有kras
g12d
突变,这6名患者为患者1、患者2、患者3、患者4、患者10和患者18。
28.kras突变不仅可以导致bavm内皮细胞中广泛发生endmt,广泛发生的endmt还是由kras突变内皮细胞对非突变内皮细胞的影响引起的。endmt是成熟的内皮细胞获得间充质细胞特征的过程,表现为内皮细胞的增殖与侵袭、内皮细胞连接紊乱和形成梭形状。在endmt的过程中,以出现间质标志物的升高为主(如calponin、vimentin、fn1和α-sma),可伴或不伴内皮标记物(如cd31)的下降。由于endmt会导致多种疾病,包括bavm,因此调节endmt是治疗bavm的有效方法。
29.通过细胞间接触或旁分泌效应进行的细胞间通讯被认为是血管重塑的关键过程,外泌体天然纳米载体和细胞间信使,在调节细胞间通讯方面发挥着关键作用,是血管疾病发病机制中的重要介质。在本实施例中,具有kras
g12d
突变的bavms内皮细胞分泌的外泌体能够促进huvec(人脐静脉内皮细胞,human umbilical vein endothelial cells)中的endmt。
30.获得kras
g12d
突变的bavm内皮细胞(患者2)的外泌体的具体方法如下:
31.将kras
g12d
突变的bavm内皮细胞在外泌体耗尽的内皮培养基(endothelial cell medium,ecm)中分别培养48小时后进行传代。在37℃,5%co2的恒温孵育箱中培养至少7天,得到培养上清液。提取培养上清液中的外泌体,提取外泌体的方法包括:将培养上清液在4℃下,以3000
×
g离心15分钟,然后以10000
×
g离心30分钟以去除细胞和碎片,得到上清液。用0.22-μm过滤器(millipore)进一步过滤该上清液。将过滤后的上清液在4℃下,以110000
×
g离心90分钟以沉淀外泌体,弃掉上清液,得到沉淀。将沉淀悬浮在磷酸盐缓冲液(phosphate buffered solution,pbs)中,得到kras
g12d
突变的bavm内皮细胞的外泌体。
32.获得kras
g12d
突变的bavm内皮细胞(患者2)的上清液,具体方法如下:在kras
g12d
突变的bavm内皮细胞长满后,继续在37℃,5%co2恒温培养箱中培养48小时,得到kras
g12d
突变的bavm内皮细胞上清液。
33.将一份huvec用获得的外泌体共培养得到第一样本,将另一份huvec用获得的上清液进行共培养得到第二样本。共培养条件均为:在潮湿的气氛中培养和维持,于37℃和浓度为5%的co2气氛下转染24小时。本实施例所用huvec为市售huvec(#8000,sciencell,美国)。
34.向第一样本和第二样本中分别加入mir-3131抑制剂(使用lipo 3000试剂盒标准流程,mir-3131抑制剂以100mm浓度配以5ul的lipo 3000,4小时后换液,继续培养48小时)。通过蛋白质印迹分别检测外泌体和转染上清液转染的huvec的间质标志物calponin、vimentin、fn1和α-sma的变化,用于反映endmt的情况。具体地,蛋白质印迹的方法包括:用放射免疫沉淀测定裂解缓冲液(sigma,美国)提取蛋白质,并用二辛可宁酸蛋白质测定试剂
盒(keygen,中国)进行定量。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离等量的细胞裂解物,并转移到聚偏二氟乙烯转移膜(millipore,美国)上。将聚偏二氟乙烯转移膜在室温下封闭1小时,在4℃下用抗体进行免疫印迹过夜,然后与二抗孵育。使用pierce电化学发光蛋白质印迹底物(thermo fisher scientific,美国)使条带可视化。检测结果如图1至图3所示。结合图1至图3可知,mir-3131抑制剂逆转了用kras
g12d
转染的huvec的外泌体和上清液转染的间充质标志物水平的增加,即mir-3131抑制剂可用于制备治疗kras
g12d
突变的bavm内皮细胞endmt的药物,具体地,mir-3131抑制剂可用于制备抑制kras突变的bavm内皮细胞endmt的药物,进一步地,mir-3131抑制剂可用于制备治疗kras突变的bavm的药物,更进一步地,mir-3131抑制剂可用于制备治疗bavm的药物。
35.将huvec分别采用市售的kras
g12d
慢病毒和市售的对照慢病毒(合生基因,中国)进行转染,得到第三样本和第四样本,转染条件均为:在潮湿的气氛中培养和维持,于37℃和浓度为5%的co2气氛下,按照moi=20转染24小时后,使用ecm完全培养基(#1001,sciencell,china)换液。换液24小时候,使用含有2个单位嘌呤霉素的ecm完全培养基进行筛选(慢病毒带嘌呤霉素抗性基因,成功转染的细胞因表达该基因因而生长不受影响,未成功转染的细胞死亡)2天后,将成功转染的细胞扩增并进行后续实验。
36.向第三样本和第四样本中分别加入mir-3131抑制剂(使用lipo 3000试剂盒标准流程,mir-3131抑制剂以100mm浓度配以5ul的lipo 3000,4小时后换液,继续培养48小时),并通过蛋白质印迹和免疫荧光染色鉴定mir-3131抑制剂对huvec的影响,结果如图4和图5所示。由图4可知,与阴性对照相比,mir-3131抑制剂逆转了用kras
g12d
转染的huvec的外泌体的细胞中间充质标志物水平。由图5可知,与阴性对照相比,mir-3131抑制剂逆转了用kras
g12d
转染的huvec的转染上清液转染的细胞中间充质标志物水平。可见,mir-3131抑制剂对kras突变内皮和正常内皮之间通讯的影响,即对endmt有影响,从而进一步证明,mir-3131抑制剂可用于制备治疗kras
g12d
突变的bavm内皮细胞endmt的药物,具体地,mir-3131抑制剂可用于制备抑制kras突变的endmt的药物。
37.虽然本发明所揭露的实施方式如上,但所述的内容仅为便于理解本发明而采用的实施方式,并非用以限定本发明。任何本发明所属领域内的技术人员,在不脱离本发明所揭露的精神和范围的前提下,可以在实施的形式及细节上进行任何的修改与变化,但本发明的专利保护范围,仍须以所附的权利要求书所界定的范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1