一种环糊精结构和灰黄霉素的复合物和制备方法及其应用
1.本发明属于药物制备领域,具体涉及一种环糊精结构和灰黄霉素的复合物和制备方法及其应用。
背景技术:
2.灰黄霉素作为一种非多烯类抗真菌抗生素,可强烈抑制真菌细胞有丝分裂并干扰真菌dna合成,与微管蛋白结合以防止真菌细胞分裂,自1958年以来已广泛用于治疗皮肤和角质层的真菌感染。灰黄霉素的低水溶性和高渗透性使其在生物药剂学分类系统中属于ii类,其在胃肠道中的低溶出率降低了其生物利用度和临床疗效。因此,如何提高灰黄霉素的溶解度和溶出度成为临床实践的重点。
3.灰黄霉素通过共沉淀、冷冻干燥或固体分散等方法加工成3~5μm的颗粒,水溶性有所提高,当其粒径减小时,溶解度会增加。因此,人们开发了许多方法来转移灰黄霉素粉末到10-1000nm范围内的纳米晶体。通过研磨得到粒径为145nm的灰黄霉素纳米颗粒只需2min,即可获得并显示97%的药物释放。通过高压均质和喷雾干燥,粒径为60nm的灰黄霉素纳米颗粒在糖和存在稳定剂的情况下,由其丙酮和水溶液制成的尺寸为16nm的灰黄霉素纳米颗粒将水溶性提高了近24倍,并在60min内实现了几乎100%的药物释放。
4.通过超临界流体技术,灰黄霉素获得了200-500nm的纳米颗粒,并在90min内显示出80%的药物释放。通过冷冻干燥过程,获得了磷脂灰黄霉素纳米颗粒,并在5h内药物释放曲线提高了7倍;来自乳液溶剂的85nm灰黄霉素纳米颗粒扩散法显示水溶性增加了6倍,并在1min内实现了85%的药物释放。
5.然而,即使在制备灰黄霉素纳米颗粒方面付出了很大的努力,灰黄霉素的水溶性仍然没有显著提高。
6.自1988年以来,环糊精被用于与灰黄霉素形成复合物以增加灰黄霉素的水溶性。当α-环糊精、β-环糊精、二甲基-β-环糊精和γ-环糊精与灰黄霉素通过捏合、喷雾、物理混合或沉淀等方法形成复合物时,发现γ-环糊精对提高水溶性的效果最好;灰黄霉素在复合物中的溶解度、溶出速率和生物利用度受温度、表面活性剂以及环糊精与药物的比例的影响。在络合物的形成过程中,hp-β-环糊精能有效抑制颗粒生长并稳定悬浮液,72%的灰黄霉素形成沉淀,其余的灰黄霉素形成包合物。当灰黄霉素溶液在用β-环糊精处理丙酮和乙醇的混合物中,获得了600-900nm的灰黄霉素纳米颗粒,溶解速度显著提高。尽管如此,这些结果显然还未达到最优状态。
7.β-环糊精接枝聚合物泊洛沙姆-羟乙基纤维素-α-环糊精凝胶、聚乙烯醇-苯乙烯基吡啶鎓/β-环糊精纳米纤维和β-环糊精基纳米海绵与灰黄霉素复合,提高了其溶出度和口服生物利用度。灰黄霉素被磷脂双层包裹,与单独使用灰黄霉素悬浮液相比,在大鼠中的生物利用度提高了两倍,然而使用聚合物会导致放大和质量控制问题,将限制它们的应用。
8.负载在二氧化硅颗粒上的灰黄霉素或氧化的介孔硅纳米颗粒显示出药物释放的改善,但二氧化硅纳米颗粒在器官中的积累也是个不可忽视的问题。
9.基于此,需要一种技术方案,来解决上述技术问题。
技术实现要素:
10.本发明的一个目的在于公开了一种环糊精结构的和灰黄霉素的复合物,其部分地、全部地包合所述灰黄霉素,或与所述灰黄霉素进行络合。
11.上述环糊精结构的和灰黄霉素的相互作用方式,可以任选其一,或者共存。
12.具体地,本发明所公开的环糊精结构和灰黄霉素的复合物的分子结构示意图,如图1所示。
13.进一步地,所述环糊精结构选自2-羟丙基-β-环糊精、γ-环糊精或hp-γ-环糊精的一种或多种。
14.进一步地,所述环糊精结构为2-1000个环糊精分子和/或环糊精复合物组成的结构。
15.本发明的另一个目的在于公开上述环糊精和灰黄霉素的复合物的制备方法,其特征在于,所述环糊精和灰黄霉素的复合物的制备方法包括如下步骤:
16.s1、将所述灰黄霉素配成溶液1,加入含有所述环糊精结构的溶液2,以及乙腈,加热搅拌;
17.s2、然后在二氧化碳的压力氛围下,加热搅拌,然后释放压力,除去溶剂,过滤并冻干得到所述环糊精结构和灰黄霉素的复合物。
18.灰黄霉素与环糊精包合物的制备方法很多,如喷雾干燥法、研磨法、超声波法、微波反应法、高压釜反应器法、水溶液法等。而通过上述超临界二氧化碳辅助的方法比其他方法更有效。
19.本发明的发明人设计如下正交试验:在灰黄霉素与hp-γ-环糊精的摩尔比分别为1:1、1:2或1:3的包合条件下;分别在40℃、50℃或60℃下,分别搅拌10h、15h或20h,转速分别为800r/min、1000r/min,或1200r/min。然后过滤、冻干后得到各条件的包合物进行hplc分析。
20.其中灰黄霉素与hp-γ-环糊精在1:1摩尔比在50℃、1200r/min、20h得到最佳包合。固体搅拌速度为81%,包合率为2%。灰黄霉素在复合物中的水溶性为2.95mg/ml,是灰黄霉素(0.0086mg/ml)的343倍。
21.进一步地,所述环糊精结构和灰黄霉素的复合物的制备方法还包括如下步骤:
22.s0、在所述溶液1或所述溶液2中,加入水溶性物质。
23.进一步地,s1步骤或s2步骤中,所述加热的温度独立地为70-90℃。
24.进一步地,所述水溶性物质选自甲基纤维素、羧甲基纤维素钠、聚乙烯吡咯烷酮、聚乙二醇、十二烷基硫酸钠、溴化己二甲胺、三(羟甲基)氨基甲烷、乙酸钠和苯扎氯铵的一种或多种。
25.环糊精相互之间通过自缔合作用,形成由两到数百个环糊精分子和/或环糊精复合物组成的聚集体或胶束状结构,并且环糊精聚集体可以通过非包合络合来增溶亲脂性水不溶性药物。然而,较大的环糊精聚集体会限制其水溶性,水溶性物质(主要为高分子表面活性剂、阴离子物质或者阳离子物质)可以稳定各种聚集体和胶束状结构以及药物/环糊精复合物。
26.进一步地,s2步骤中,所述二氧化碳的压力为8-10mpa。
27.本发明的另一个目的在于公开上述环糊精结构和灰黄霉素的复合物在药物中的应用。
28.本发明具有以下有益效果:
29.本发明技术手段,通过设计灰黄霉素与环糊精形成包合物,来提高灰黄霉素的水溶性,其公开了环糊精结构和灰黄霉素的复合物结构,在超临界二氧化碳的氛围下,制备而成的产品,其水溶性比原药提高477倍,10min内释放90%的灰黄霉素,体内药代动力学研究的auc提高178%,是迄今为止灰黄霉素水溶性研究中最好的结果。
附图说明
30.图1示出了环糊精结构和灰黄霉素的复合物的分子结构示意图。
31.图2示出了hp-γ-cd、γ-cd、hp-β-cd对灰黄霉素的相溶解度曲线图。
32.图3(a)示出了灰黄霉素的傅里叶变换红外光谱;
33.图3(b)示出了hp-γ-环糊精的傅里叶变换红外光谱;
34.图3(c)示出了实施例1-1的傅里叶变换红外光谱;
35.图3(d)示出了hp-γ-环糊精与灰黄霉素的物理混合物的傅里叶变换红外光谱。
36.图4(a)示出了γ-环糊精的d2o的核磁氢谱图;
37.图4(b)示出了实施例1-1的d2o的核磁氢谱图;
38.图4(c)示出了灰黄霉素的dmsod6的核磁氢谱图;
39.图4(d)示出了实施例1-1的dmsod6的核磁氢谱图。
40.图5示出了hp-γ-环糊精、灰黄霉素,及实施例1-1的hp-γ-环糊精的灰黄霉素的复合物的x射线衍射图。
41.图6(a)示出了hp-γ-环糊精样品的扫描电镜图;
42.图6(b)示出了灰黄霉素样品的扫描电镜图;
43.图6(c)示出了hp-γ-环糊精和灰黄霉素进行物理混合后的样品的扫描电镜图;
44.图6(d)示出了hp-γ-环糊精和灰黄霉素的复合物的样品的扫描电镜图。
45.图7示出了灰黄霉素、hp-γ-环糊精和灰黄霉素的物理混合物、hp-γ-环糊精和灰黄霉素的复合物的溶出度曲线图。
46.图8示出了犬空白血浆灰黄霉素标准曲线图。
47.图9(a)示出了灰黄霉素的hplc图;
48.图9(b)示出了空白狗血浆的hplc图;
49.图9(c)示出了给予灰黄霉素的狗血浆的hplc图;
50.图9(d)示出了给予灰黄霉素的狗血浆的hplc图。
51.图10示出了给予灰黄霉素或其包合物的狗血浆中灰黄霉素的浓度图。
具体实施方式
52.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。
53.所用材料和测试仪器:
54.纯度98%的灰黄霉素购自北京索博科技有限公司;
55.2-羟丙基-β-环糊精、γ-环糊精或hp-γ-环糊精购自上海亿恩化工科技有限公司;
56.分析纯乙醇购自广东省化学试剂工程技术研发中心;
57.无水乙酸钠购自西龙科技有限公司;
58.羟丙基甲基纤维素、苯扎氯铵、羟甲基纤维素钠、溴化己二胺购自上海麦克莱恩生化科技有限公司;
59.烷基(12碳)硫酸钠购自天津贝斯特化工有限公司;
60.聚乙烯吡咯烷酮购自天津天新精细化工开发中心;
61.聚乙二醇4000购自天津永达化学试剂有限公司;
62.水杨酸钠购自上海凌丰化学试剂有限公司;
63.超临界二氧化碳反应器bz-100ml/s0-l购自上海贝加尔湖智能科技有限公司。
[0064]1h nmr谱以d2o和dmsod6为溶剂,在bruker光谱仪(400mhz)上记录;
[0065]
紫外光谱用上海晶华科技仪器有限公司的紫外可见分光光度计仪器j51903001记录;
[0066]
hplc分析采用岛津企业管理(中国)有限公司的lc-15c高效液相色谱仪,使用inertsil ods-3c18(250mm
×
4.6mm)柱进行;
[0067]
溶出度测试在天津新天光分析仪器科技有限公司的rc-3型溶出仪上进行;
[0068]
稳定性测试在上海亿恒科技有限公司的lhh-sg稳定性试验箱上进行;
[0069]
x射线分析在d8 advance(bruker公司)的x射线多晶衍射仪上进行;
[0070]
ftir光谱记录在vertex 70(bruker公司)的傅里叶变换红外光谱仪上进行;
[0071]
扫描电子显微图像在merlin(蔡司公司)的高分辨率场发射扫描电子显微镜上进行;
[0072]
实验用小狗购自广东省医学实验动物中心,空白犬血浆购自广州瑞特有限公司;
[0073]
一次性采血针、5ml抗凝管购自深圳市康之健医疗器械生物科技有限公司;
[0074]
2ml离心管取自biofil clean离心管;
[0075]
0.22μm有机微孔过滤器购自天津金腾实验设备有限公司;
[0076]
氮气鼓风机购自杭州妙欧仪器有限公司;
[0077]
低脂狗粮购自上海吉百创实业有限公司。
[0078]
实施例1-1
[0079]
一种hp-γ-环糊精和灰黄霉素的复合物,hp-γ-环糊精全部地包合灰黄霉素。
[0080]
上述hp-γ-环糊精和灰黄霉素的复合物的制备方法为如下步骤:
[0081]
s1、密闭体系下,将所述灰黄霉素(105mg)溶于乙腈(2ml),配成溶液1(浓度为10wt%),加入含有所述hp-γ-环糊精(1060mg,0.6mmol)的纯水(8ml)溶液2,以及乙腈(8ml),将混合物加热到75℃搅拌2h;
[0082]
s2、然后将液态二氧化碳泵送至上述密闭体系下,保持其内部压力为8mpa,加热到75℃搅拌12h,然后缓慢释放压力,减压蒸馏除去溶剂,过滤并冻干得到所述hp-γ-环糊精和灰黄霉素的复合物,并保存在氮气氛围下的冰箱中。
[0083]
实施例1-2
[0084]
该实施例中的所用原料、原料用量和操作手段同实施例1-1,仅将hp-γ-环糊精等物质的量的替换为γ-环糊精。
[0085]
实施例1-3
[0086]
该实施例中的所用原料、原料用量和操作手段同实施例1-1,仅将hp-γ-环糊精等物质的量的替换为2-羟丙基-β-环糊精。
[0087]
实施例2
[0088]
一种hp-γ-环糊精和灰黄霉素的复合物,hp-γ-环糊精全部地包合灰黄霉素。
[0089]
上述hp-γ-环糊精和灰黄霉素的复合物的制备方法为如下步骤:
[0090]
s0、复配好水溶性物质的组合物,其具体成分为甲基纤维素、羧甲基纤维素钠和聚乙二醇的混合物,三者的重量比为1:1:1。
[0091]
s1、密闭体系下,将所述灰黄霉素(105mg)溶于乙腈(2ml),配成溶液1(浓度为10wt%),加入含有所述hp-γ-环糊精(1060mg,0.6mmol)的纯水(8ml)溶液2,以及乙腈(8ml),并加入上述水溶性物质的组合物,将混合物加热到75℃搅拌2h;
[0092]
s2、然后将液态二氧化碳泵送至上述密闭体系下,保持其内部压力为8mpa,加热到75℃搅拌12h,然后缓慢释放压力,减压蒸馏除去溶剂,过滤并冻干得到所述hp-γ-环糊精和灰黄霉素的复合物,并保存在氮气氛围下的冰箱中。
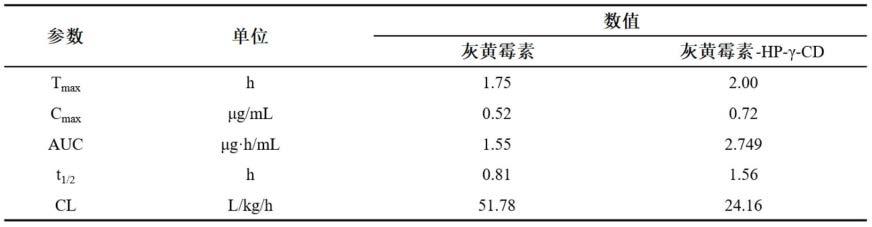
[0093]
对比例1
[0094]
对比例1中,hp-γ-环糊精和灰黄霉素以物质的量为(1:10)进行物理共混,得到物理共混物。
[0095]
测试例
[0096]
对上述实施例1-1~1-3环糊精结构和灰黄霉素的复合物,以及上述对比例的一种或多种,进行一系列表征测试。其中:
[0097]
傅里叶变换红外光谱研究:用傅里叶变换红外光谱分析了灰黄霉素、hp-γ-环糊精的物理混合物以及包合物的kbr丸状物的ftir光谱,并获得了必要的数据。所得数据在400-3800cm-1
之间收集。
[0098]
质子核磁共振研究:所得hp-γ-环糊精和灰黄霉素包合物在d2o中的溶液,灰黄霉素及其包合物在dmso-d6中的溶液,分别在室温下进行1d nmr研究,频率为400mhz。
[0099]
x射线衍射分析:使用cu-kα发射,lynxeye阵列检测器,在电压为40kv,电流为40ma的管子下,通过x射线衍射分析灰黄霉素、hp-γ-环糊精及其包合物(扫描角度范围3-60
°
,扫描速度0.01/s)。
[0100]
采用扫描电镜在高真空下加速电压5kv,研究灰黄霉素、hp-γ-环糊精、灰黄霉素与对比例1,以及实施例1-1的表面形貌。将每个固体样品放置在磁块上,经过喷金处理后,将样品装载到样品棒上进行扫描。图像放大500倍,图像类型为二次电子图像。
[0101]
灰黄霉素含量的测定:将包合物(100mg)溶于去离子水(1ml)中,溶液稀释至8-500μg/ml范围内,根据对其进行hplc分析,通过回归方程得到配合物中灰黄霉素的含量。
[0102]
灰黄霉素在络合物中水溶性的测定:将包合络合物加入水(1ml)中,得到其饱和水溶液,过滤后,用hplc分析溶液,得到灰黄霉素在络合物中的水溶性结果。
[0103]
包合率和包合收率的测定:hp-γ-环糊精和灰黄霉素的复合物的包合率和收率可根据下式计算:
[0104]
收率(%)=[hp-γ-环糊精和灰黄霉素的复合物(mg)/(灰黄霉素(mg)+hp-γ-环糊精(mg))]
×
100%。
[0105]
包合率(%)=[hp-γ-环糊精和灰黄霉素的复合物中的灰黄霉素(mg)/灰黄霉素(mg)]
×
100%。
[0106]
溶出度测定:采用纸浆法测定灰黄霉素在配合物中的溶出度。分别用灰黄霉素(100mg)和hp-γ-环糊精和灰黄霉素的复合物(含100mg灰黄霉素)进行试验。以脱气的超纯水(900ml)为介质,实验条件为37℃,100r/min。分别在2、5、10、15、20、30、45和60min时收集样品(每个3ml)。每次采集后分别加入3ml超纯水。
[0107]
体内药代动力学研究:12只体重为5kg左右的健康狗随机分为灰黄霉素组,和实施例1-1两组,每组包含三只雄性和三只雌性狗。禁食12h后,给药前1h禁水。在10ml水中以15mg/kg的剂量向每只狗施用单次口服剂量的灰黄霉素或实施例1-1。给药后,狗禁食4h,且禁水1h,然后分别在0、0.25、0.5、0.75、1、2、3、4、8、12、24、36、48和72h,用一次性edta抗凝注射器采集血样(2ml)。血浆样品以4000r/min离心10min后,在-80℃冰箱中保存。
[0108]
将溶于1ml乙腈的血浆样品(0.5ml)在2ml离心管中涡旋3min,以13000r/min离心10min,并将上清液收集在玻璃管中。沉淀用0.5ml乙腈萃取2次,将合并的上清液离心并在37℃氮气下干燥,加入0.5ml流动相,涡旋混合4min;并通过0.22μm微孔有机过滤器过滤用于hplc分析(流动相:60:40的乙腈/水和0.1%乙酸;流速:1.0ml/min.;色谱柱:inertsil ods-3c18,250mm
×
4.6mm;检测器:uv at 290nm;温度:30℃)。测得血浆中灰黄霉素的回收率为92.32
±
0.43%~108.75
±
6.12%;批内变异系数为1.11~3.73%;批间变异系数为0.07~5.63%。
[0109]
统计分析:graphpad prism 5.0软件(graphpad software,usa)用于进行统计分析,包括数据处理和图形表示。在每种情况下,使用双尾t检验来评估服用纯灰黄霉素的狗和服用包合物的狗之间pk参数值差异的显著性。ap值为0.05被认为是显著的统计分析。
[0110]
测试结果:
[0111]
实施例1-1、实施例1-2和实施例1-3的环糊精原料(图2中分别显示为hp-γ-cd、γ-cd、hp-β-cd),分别通过相溶解法研究了灰黄霉素在室温下的溶解度。我们发现随着环糊精衍生物浓度的增加,实施例1-1的hp-γ-环糊精对灰黄霉素溶解度的影响最大,并被选择与灰黄霉素形成包合物。相溶解度曲线如图2的相溶解度的曲线所示,分类为a
l
,根据higuchi描述键入。
[0112]
经过后处理和高效液相色谱分析,发现羟丙基甲基纤维素通过与hp-γ-环糊精的络合使灰黄霉素的水溶性最大提高至4.105mg/ml,比灰黄霉素的水溶性高477倍。从水溶性的角度来看,这个结果是迄今为止最好的。该样品用于其结构确认和体外和体内pk研究。
[0113]
傅里叶变换红外光谱用于确认灰黄霉素包合物的形成。如图3(a)所示,灰黄霉素的ftir光谱在1444.02cm-1
处出现cn拉伸的显著峰,c=o振动在1682.16cm-1
处出现显著峰,coc拉伸在1085.35cm-1
处出现显著峰,nh伸缩在3301.77cm-1
处出现峰值,c=c基团振动在1630.68cm-1
处出现峰值,oh在2799.45cm-1
处出现峰值。在包合物中,灰黄霉素与hp-γ-环糊精之间的疏水相互作用、范德华相互作用、氢键等非共价相互作用导致灰黄霉素被包合部分的能量较低,降低了灰黄霉素的峰强度。对应的频率。相应地,如果灰黄霉素的红外吸收峰强度降低、偏移或消失,则证明灰黄霉素和hp-γ-环糊精具有包合作用。
[0114]
hp-γ-环糊精的峰形与实施例1-1相比没有变化,证明hp-γ-环糊精在包合物中的结构基本没有出现变化(图3b和3c)。但与单独的灰黄霉素相比,实施例1-1中灰黄霉素对应的峰形、峰位和峰强度发生了明显变化,表明灰黄霉素与hp-γ-环糊精形成了复合物。而物理混合物(对比例1)的红外光谱看起来就像灰黄霉素和hp-γ-环糊精光谱的叠加(3d)。
[0115]
dmsod6中灰黄霉素的质子核磁共振谱图,hp-γ-环糊精d2o中,d2o和dmsod6中的包合物记录如图4(a)-(d)所示。d2o中包合物的质子核磁共振谱显示灰黄霉素的信号在6.50(1h,s),5.73(1h,s),2.90-2.78(m,2h),2.63(1h,dd),1.25(如图(a)-(d)中所示,och3),三个och3的信号与来自hp-γ-环糊精的信号在4.00-3.50ppm的范围内重叠。而灰黄霉素的质子核磁共振谱在dmsod6中显示的信号为6.51(1h,s),5.61(1h,s),4.05(3h,s,och3),4.03(3h,s,och3),3.63(3h,s,och3),2.86(1h,m),2.79(1h,dd,j1=12.0hz,j2=16.0hz),2.36(1h,dd,j1=4.0hz,j2=16.0hz),0.81(3h,d,j=8.0赫兹,och3);dmsod6络合物中灰黄霉素的质子nmr数据显示在6.45(1h,s),4.02(3h,s,och3),3.92(3h,s,och3),2.76(1h,m)处的信号,2.65(1h,dd),2.33(1h,dd),0.785(3h,d),芳环上两个甲氧基的化学位移由4.05ppm和4.03ppm变为4.02ppm和3.92ppm,化学芳香族质子的位移从6.51ppm变为6.45ppm,表明灰黄霉素的芳香族部分与hp-γ-环糊精有相互作用,灰黄霉素环己酮部分的甲基、ch和ch2基团的化学位移从0.81ppm、2.36ppm、2.79ppm和2.86ppm,变为0.785ppm、2.33ppm、2.65ppm和2.76ppm,这表明灰黄霉素的环己酮部分与hp-γ-环糊精有相互作用,基于这些,我们假设在复合物中,两个hp-γ-环糊精分子与一个灰黄霉素分子复合,如附图中的图1所示。
[0116]
hp-γ-环糊精、灰黄霉素,及实施例1-1的hp-γ-环糊精的灰黄霉素的复合物的x射线衍射图见图5。从图中可见,灰黄霉素是结晶化合物,有尖锐的峰,hp-γ-环糊精是结晶化合物,有特定的多个尖锐的结晶峰,但是,在实施例1-1的产物的x射线衍射图中,hp-γ-环糊精的特征峰和灰黄霉素完全消失,说明该产品不含纯灰黄霉素和纯hp-γ-环糊精。
[0117]
采用扫描电镜研究hp-γ-环糊精、灰黄霉素、对比例1-1的hp-γ-环糊精和灰黄霉素的物理混合物,及实施例1-1的hp-γ-环糊精的灰黄霉素的复合物的表面形貌变化,其显微照片见图6(a)-(d)。从图中可见,当样品放大到20μm时,hp-γ-环糊精样品呈不均匀块状(如图6(a)所示),灰黄霉素样品呈无定形(如图6(b)所示),在对比例1中,灰黄霉素分布hp-γ-环糊精周围(如图6(c)所示),而实施例1-1则呈现不规则的碎片形状(如图6(d)所示)。四张显微照片之间的差异直接证实了hp-γ-环糊精的灰黄霉素的复合物的形成。
[0118]
对灰黄霉素、对比例1,以及实施例1-1的hp-γ-环糊精和灰黄霉素的复合物的溶出速率进行了测试,如图7所示。10min后,灰黄霉素在水中的累积溶出度仅接近2%,灰黄霉素与hp-γ-环糊精的物理混合物的累积溶出度约为18%,而实施例1中的hp-γ-环糊精和灰黄霉素的复合物的累积溶出度-γ-环糊精90%以上,远优于单独使用灰黄霉素,同时避免了hp-γ-环糊精和灰黄霉素的复合物中灰黄霉素的突释。
[0119]
在hp-γ-环糊精和灰黄霉素的复合物中,灰黄霉素被包裹在hp-γ-环糊精圆柱体中,抑制了灰黄霉素与味觉传感器之间的直接接触,从而消除了灰黄霉素令人不快的味道。
[0120]
灰黄霉素与hp-γ-环糊精复合后,其药代动力学性质会发生变化。为了了解灰黄霉素与hp-γ-环糊精络合的影响,进行了该络合物在狗体内的药代动力学研究。因此,将灰黄霉素,及hp-γ-环糊精和灰黄霉素的复合物以15mg/kg的单剂量口服给药于两组(每组6只)的狗,分别在给药后的0、0.25、0.5、0.75、1、2、3、4、6、8、12、24、36、48和72h,收集其血液
样本。
[0121]
将灰黄霉素的乙腈溶液(0.1mg/ml)加入空白狗血浆配制成一系列溶液,经hplc分析得到如图8所示的标准工作曲线。当血浆中灰黄霉素浓度在0.05-20μg/ml范围内时,hplc峰面积与溶液中灰黄霉素浓度呈线性关系,标准工作曲线方程为:y=38.716x+0.961(r2=0.9994,y:峰面积,x:浓度)。s/n≥3:llod为0.05μg/ml,s/n≥10,lloq为0.01μg/ml。
[0122]
灰黄霉素、空白狗血浆、给予灰黄霉素的狗血浆和给予灰黄霉素的狗血浆的hplc分析如图9(a)-(d)所示。hplc结果表明,空白狗血浆对灰黄霉素的检测没有干扰,可以通过hplc测定狗血浆中的灰黄霉素。
[0123]
测试0.1μg/ml、1μg/ml和10μg/ml的空白血浆中灰黄霉素标准溶液的回收率、批内变异系数和批间变异系数,回收率血浆灰黄霉素含量在92.32
±
0.43%~108.75
±
6.12%范围内,批内变异系数在0.07%~5.63%范围内,批间变异系数在1.11%~3.73%。
[0124]
采集的血浆样品用hplc分析,结果如图10所示。采用das 2.0药代动力学软件分析了给予灰黄霉素或其包合物的狗血浆的实验数据。犬血浆中灰黄霉素浓度与时间的关系符合一级吸收二室模型,药代动力学参数(平均值
±
标准差)总结于表1。
[0125]
表1灰黄霉素及其包合物的药动学参数
[0126][0127]
经口给药后,狗血浆中灰黄霉素的cmax和tmax在1.75h时灰黄霉素组为0.52μg/ml,灰黄霉素包合物组在2.0h时为0.72μg/ml,auc 0-120灰黄霉素组为1.55μg
·
h/ml,hp-γ-环糊精和灰黄霉素的复合物组为2.749μg
·
h/ml。通过络合,灰黄霉素的暴露水平提高了177%,灰黄霉素的清除率由51.78变为24.16,半衰期由0.81h变为1.56h,表明需要的药物更少使用灰黄霉素复合物具有相同的治疗效果。
[0128]
实施例1-1的hp-γ-环糊精和灰黄霉素的复合物可以增加的水溶性(477倍),这是迄今为止灰黄霉素水溶性研究中最理想的结果。这也是10min内90%的药物得以释放的原因,并且177%auc
0-12
增加,具有更短的清除率和更长的半衰期。
[0129]
综上所述,通过超临界二氧化碳辅助络合,加入大量水溶性聚合物,制备了hp-γ-环糊精和灰黄霉素的复合物,并通过ftir、nmr、x-ray和esm证实了药物与药物的配比。基于核磁共振数据确定复合物中的环糊精为1:2。通过与hp-γ-环糊精的络合,灰黄霉素的水溶性比单独使用灰黄霉素提高了477倍,是迄今为止灰黄霉素水溶性研究的最佳结果。该复合物显示超过90%的灰黄霉素在20min内被体外释放。其体内pk研究显示药代动力学特性有显着改善,与灰黄霉素相比,c
max
从0.52增加到0.72,auc
0-12
从1.55增加到2.749,清除率从51.78增加到24.16,半衰期从0.81增加到1.56,表明灰黄霉素复合物比单独使用灰黄霉素更有效。
[0130]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论
从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
[0131]
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1