一种基于钌配合物的无载体多功能纳米颗粒的制备及其抗肿瘤应用
1.本发明涉及一种基于钌配合物的无载体多功能纳米颗粒的制备及其抗肿瘤应用,属于医药技术领域。
背景技术:
2.由于钌配合物的低毒性和广谱抗癌活性可以在一定程度上克服铂类化疗药物的缺点,基于钌配合物的金属抗肿瘤药物的研发受到了越来越广泛的关注。其中,含有多吡啶配体的钌配合物往往具有良好的和易于调节的光物理和光化学性质,在光活化抗肿瘤中具有潜在的应用前景。基于金属配合物的光活化药物的抗肿瘤作用机制主要有两种:一是通过激发光照射后,产生活性氧自由基(ros),如单重态氧(
102
),氧化断裂dna;二是通过发生光致配体解离生成水解产物,从而与dna碱基或其他生物活性分子发生配位反应,进而杀死肿瘤细胞。尽管具有潜在的抗癌活性,但大多数已报道的钌配合物在生理条件下稳定性较差、血液循环半衰期短、缺乏肿瘤特异性,这是钌基抗癌试剂进一步临床开发的主要障碍。为了解决这些问题,将钌配合物封装在纳米系统中,以提高药物生物相容性和肿瘤靶向性的策略越来越受到研究者们的青睐。
3.肿瘤细胞会通过激活自身的修复机制,对受损的dna进行修复,以维持癌细胞的基因组稳定性和存活。肿瘤细胞中存在的固有dna损伤修复机制将极大地降低氧化疗法在肿瘤治疗中的疗效。
4.已报道的大部分纳米载药系统仍然由传统合成载体材料组成,存在载药率低和潜在副作用等问题。本发明涉及的无载体多功能纳米颗粒是一种纯药物体系,由具有光疗活性的钌配合物和dna修复抑制剂th287组成,钌配合物光照下产生1o2氧化断裂dna并发生配体解离,th287抑制dna损伤修复,通过小粒径粒子的epr效应及光疗-化疗联合疗法的协同作用,可以实现较好的抗肿瘤作用,具有重要的意义。
技术实现要素:
5.本发明的主要目的是提供一种基于钌配合物的无载体多功能纳米颗粒的制备方法及应用,通过光疗-化疗的协同作用提高其抗肿瘤效果。
6.为实现本发明目的所采用的技术方案是:
7.本发明提供了一种基于钌配合物的无载体多功能纳米颗粒的制备及其抗肿瘤应用,其特征在于:所述多功能纳米颗粒是在无载体条件下,钌配合物与mth1抑制剂通过分子间相互作用力自组装而成,其制备方法包括以下步骤:
8.(1)分别用适量有机溶剂溶解钌配合物和mth1抑制剂,取一定量钌配合物溶液和mth1抑制剂溶液混合。
9.(2)将步骤(1)的混合液在搅拌条件下逐滴分散到一定量的水中,超声,在黑暗条件下搅拌过夜。
10.(3)将步骤(2)的混合液透析,离心,取上清液即得。
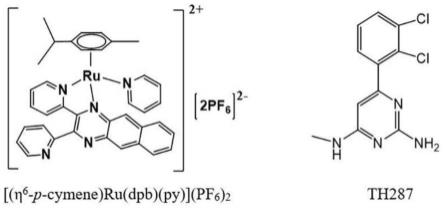
11.本发明技术方案的进一步改进在于:所述钌配合物为钌芳烃配合物[(η
6-p-cymene)ru(dpb)(py)](pf6)2(dpb=2,3-bis(2-pyridyl)benzoquinoxaline,py=pyridine),作为光敏性药物,光照下产生1o2并发生配体解离,所述mth1抑制剂为th287,抑制dna的自我修复。
[0012]
本发明技术方案的进一步改进在于:所述步骤(1)中适量的有机溶剂为二甲亚砜,钌配合物和th287的分子摩尔比为1:1~1:3,所述两种药物混合的时间为4h。
[0013]
所述步骤(2)中的水为超纯水,体积为2ml,超声时间为20min。
[0014]
所述步骤(3)中透析时间为2h,所用透析袋的截留分子量为1000,离心转速为3000rpm,离心时间为10min。
[0015]
采用了上述技术方案,本发明取得的技术进步是:
[0016]
本发明开发了一种基于钌配合物的无载体多功能纳米颗粒的制备方法,该制备方法通过自组装技术实现,可以避免载体潜在的毒性,提高两种疏水性药物的生物利用度,实现了光疗-化疗协同抗肿瘤效果,具有潜在的临床应用价值。
附图说明
[0017]
图1是本发明实施例中所述钌配合物[(η
6-p-cymene)ru(dpb)(py)](pf6)2和th287的结构式
[0018]
图2是本发明实施例1获得的钌配合物多功能纳米药物的tem图(a)和sem图(b)
[0019]
图3是本发明实施例1获得的钌配合物多功能纳米药物的粒径分布图(a)和zeta电位图(b)
[0020]
图4(a)是本发明实施例4获得的钌配合物多功能纳米药物及参比药物在光照条件下细胞存活率对比图;图4(b)是钌配合物多功能纳米药物光照和黑暗条件下细胞存活率对比图
[0021]
图5是本发明实施例5获得的钌配合物多功能纳米药物在细胞内生成ros情况图
具体实施方式
[0022]
下面将结合具体实施例及附图对本发明的技术方案进行详细描述,以便于本领域技术人员理解,但不以任何方式限制本发明。
[0023]
实施例1
[0024]
将钌配合物和th287分别用dmso溶解,配成浓度为10mg/ml和10mg/ml的两种溶液,然后取钌配合物溶液0.1ml、th287溶液0.0286ml(分子摩尔比为1:1)混合在一起,再缓慢滴入正在搅拌的2ml超纯水中并搅拌10min,超声20min,黑暗条件下搅拌过夜,将混合液转移到截留分子量为1000的透析袋中,在超纯水中透析2h,收集透析袋内液体并离心10min,取上清液即得。
[0025]
实施例2
[0026]
将钌配合物和th287分别用dmso溶解,配成浓度为10mg/ml和10mg/ml的两种溶液,然后取钌配合物溶液0.1ml、th287溶液0.0573ml(分子摩尔比为1:2)混合在一起,再缓慢滴入正在搅拌的2ml超纯水中并搅拌10min,超声20min,黑暗条件下搅拌过夜,将混合液转移
到截留分子量为1000的透析袋中,在超纯水中透析2h,收集透析袋内液体并离心10min,取上清液即得。
[0027]
实施例3
[0028]
将钌配合物和th287分别用dmso溶解,配成浓度为10mg/ml和10mg/ml的两种溶液,然后取钌配合物溶液0.1ml、th287溶液0.0859ml(分子摩尔比为1:3)混合在一起,再缓慢滴入正在搅拌的2ml超纯水中并搅拌10min,超声20min,黑暗条件下搅拌过夜,将混合液转移到截留分子量为1000的透析袋中,在超纯水中透析2h,收集透析袋内液体并离心10min,取上清液即得。
[0029]
应用透射电子显微镜(tem)和扫描电子显微镜(sem)对实施例1、2和3钌配合物多功能纳米颗粒进行形貌表征,由于肿瘤的特殊生理结构特征(血管、渗漏等),粒径小于200nm的纳米颗粒基于增强的通透性和保留(epr)效应有利于在肿瘤部位积累。图2(a)为所得实施例1的tem图,图2(b)为所得实施例1的sem图。由图中可见,所得分子摩尔比为1:1(r-t)的自组装纳米药物粒径大约为100nm,呈均匀的圆形,适合在肿瘤部位积累。应用马尔文粒度仪对其水合粒径及电位进行表征,如图3(a)所示,纳米复合物的水合粒径为232.43nm,分散性较好,如图3(b)所示纳米复合物的zeta电位为16.1mv。
[0030]
实施例4
[0031]
cck8法评估纳米药物对体外肿瘤细胞的杀伤效果,步骤为下:
[0032]
将a549细胞以5000~10000/孔的密度接种于96孔板,于恒温培养箱(37℃,5%co2)中孵育24h,弃去旧培养液,加入含有不同浓度纳米复合物(r-t)、单体[(η
6-p-cymene)ru(dpb)(py)](pf6)2(ru@)、单体th287(th287@)以及两个单体药物简单混合(ru+th287)的dmem溶液,继续培养4h,光照组用led双通道控制器(λ=427nm)光照15min,光照之后继续培养20h,黑暗组除不光照外其余条件与光照组均一致,加入cck8试剂1.5h后,通过酶标仪检测450nm处的od值,计算细胞存活率。
[0033]
从图4(a)可以看出r-t、ru@、th287@及ru+th287对a549细胞的抑制作用均呈浓度依赖性,且与其他药物相比,r-t对细胞的杀伤作用显著提高。可能是r-t提高了两个疏水药物的水溶性,增加了向肿瘤细胞的传递和积累。并且与黑暗条件相比,r-t在光照条件下的细胞杀伤效果明显提高,如图4(b)所示,因为光照条件下钌配合物可以产生1o2氧化dna并发生配体解离,生成水解产物,从而与dna碱基或其他生物活性分子发生配位反应,进而双重杀死肿瘤细胞。
[0034]
实施例5
[0035]
dcfh-ha作为荧光探针检测纳米复合物在细胞内ros的产生,步骤如下:
[0036]
将a549细胞接种在15mm共聚焦皿中,于恒温培养箱(37℃,5%co2)中培养24h,加相当于钌配合物10μm、th2871μm的纳米复合物和同等浓度钌配合物或th287的dmem溶液,孵育4h,pbs洗涤2次,加入10μm dcfh-da探针,恒温箱培养30min,光照组用led双通道控制器(λ=427nm)光照25min,pbs洗涤3次,于激光共聚焦显微镜下观察ros的产生情况。
[0037]
纳米复合物在细胞内生成ros的结果如图5所示。从图5中可以看出,纳米复合物的光照处理组的荧光强于其他组,表明细胞内ros的生成量比其他处理组高,在光照下增加了细胞内ros的含量,可能因为细胞对纳米复合物的摄取量更多,从而可以放大对肿瘤细胞的氧化损伤,增强疗效。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1