一种兽药组合物及其汤剂与制备方法和应用
1.本发明涉及兽药领域,尤其涉及一种兽药组合物及其制备方法和应用。
背景技术:
2.珍珠菜为报春花科珍珠菜属植物虎尾珍珠菜的根或全草,其性味苦、辛,性平,归经入肝、脾经。具有清热利湿,活血散瘀,解毒消痈之功效,主治水肿,热淋,黄疸,痢疾,风湿热痹,带下,经闭,跌打,骨折,外伤出血,乳痈,疔疮,蛇咬伤。
3.杭菊为宿根性草本植物,据医学分析,杭菊含有菊城、瞟吟、氨基酸以及微量维生素等成分,其性微寒,味甘苦。有散风清热、清肝明目和解毒消炎作用,能治高血压、偏头痛、急性结膜炎等症。
4.偏翅唐松草为毛茛科唐松草属植物偏翅唐松草的根及根茎,常作为一种藏药,归经入胃、大肠、肝经,具有清热燥湿,泻火解毒之功效,主治湿热泻痢,黄疸,白带,风火牙痛,目赤肿痛,疮疡肿毒。
5.以上三种药物形成的组合物及其治疗效果在现有技术中未公开。
技术实现要素:
6.本发明目的是提供一种兽药组合物及其制备方法和应用。
7.本发明提供了如下的技术方案:
8.一种兽药组合物,其包括以下质量份的组分:珍珠菜20~40份、杭菊15~20 份和偏翅唐松草25~35份。
9.还提供了所述兽药组合物的汤剂。
10.进一步,所述兽药组合物的汤剂含有以下活性成分:芦丁、木犀草苷、异绿原酸a和盐酸小檗碱。
11.本发明还提供了所述兽药组合物的汤剂的制备方法,包括:
12.s1:向所述组分中加入灭菌去离子水进行浸泡,其后进行一次或多次煎煮,得到煎煮液;
13.s2:将所述煎煮液浓缩至固形物的浓度为1~5g/ml,得到所述汤剂。
14.进一步,所述组分与所述灭菌去离子水的固液比1:10~1:20。
15.进一步,所述煎煮的温度为55~75℃,每次煎煮的时间为30~50min;
16.本发明还提供了所述兽药组合物或其汤剂在制备兽用的防治急性肝损伤的药物上的应用。
17.本发明还提供了所述兽药组合物或其汤剂在制备兽用的防治由四氯化碳引起的化学性急性肝损伤的药物上的应用。
18.本发明还提供了所述兽药组合物或其汤剂在制备兽用的防治由对乙酰氨基酚引起的药物性急性肝损伤的药物上的应用。
19.本发明还提供了所述兽药组合物或其汤剂在制备兽用的防治由酒精引起的酒精
性急性肝损伤的药物上的应用。
20.本发明具备以下有益效果:
21.本发明的组合物形成的汤剂针对的靶器官为肝脏,其对多种形式的急性肝损伤具有修复和治疗效果,在具体的临床试验中,该组合物的汤剂对犊牦牛吡喹酮过量使用造成的肝损伤具有较好的保护作用,能够有效地降低谷丙转氨酶和谷草转氨酶的血清水平,能够进一步用作防治畜禽养殖业中药物过量使用引起的肝损伤疾病的药物。
22.本发明的组合物具有良好的抗氧化性、抑菌和抗炎性,对畜禽及环境无毒无害。
附图说明
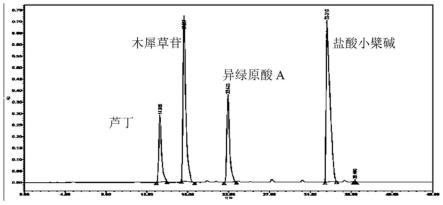
23.图1为实施例1中提供的混合标准品的hplc图。
24.图2为实施例1中提供的组合物汤剂的hplc图。
25.图3为实施例1中提供的毒性试验脏器切片(he染色,
×
400)。
26.图4为实施例1中提供的ccl4所致急性肝损伤外观变化图。
27.图5为实施例1中提供的ccl4所致急性肝损伤肝脏病理组织学变化(he染色,
×
400)。
28.图6为实施例1中提供的ccl4所致急性肝损伤小鼠血清生化指标检测结果。
29.图7为实施例1中提供的ccl4所致急性肝损伤小鼠肝脏抗氧化能力。
30.图8为实施例1中提供的ccl4所致急性肝损伤小鼠肝脏炎性因子检测结果。
31.图9为实施例1中提供的ccl4所致急性肝损伤模型组小鼠肝脏mir-122表达检测结果。
32.图10为实施例1中提供的apap所致急性肝损伤肝脏眼观变化。
33.图11为实施例1中提供的apap导致急性肝损伤肝脏病理组织学变化(he染色,
×
400)。
34.图12为实施例1中提供的apap所致急性肝损伤小鼠血清生化指标检测。
35.图13为实施例1中提供的apap所致急性肝损伤小鼠肝脏抗氧化能力指标检测结果。
36.图14为实施例1中提供的apap所致急性肝损伤小鼠肝脏炎性因子检测结果。
37.图15为实施例1中提供的apap所致急性肝损伤小鼠肝脏mir-122表达水平。
38.图16为实施例1中提供的alcohol所致急性肝损伤肝脏剖检变化。
39.图17为实施例1中提供的alcohol所致急性肝损伤肝脏病理组织学变化(he染色,
×
400)。
40.图18为实施例1中提供的alcohol所致急性肝损伤小鼠血清生化指标检测结果。
41.图19为实施例1中提供的alcohol所致急性肝损伤的肝脏抗氧化能力。
42.图20为实施例1中提供的alcohol所致急性肝损伤小鼠肝脏炎性因子检测结果。
43.图21为实施例1中提供的alcohol所致急性肝损伤小鼠肝脏mir-122表达检测结果。
44.图22为实施例2中本发明提供的组合物汤剂对吡喹酮肝损伤幼龄牦牛谷丙转氨酶和谷草转氨酶的影响。
具体实施方式
45.以下结合实施例和附图对本发明进行详细描述,但需要理解的是,所述实施例和附图仅用于对本发明进行示例性的描述,而并不能对本发明的保护范围构成任何限制。所有包含在本发明的发明宗旨范围内的合理的变换和组合均落入本发明的保护范围。
46.以下实施例所用的测试方法包括:
47.一、对体外抗氧化作用进行评价的方法:
48.(1)fe总抗氧化力
49.取1g/ml组合物汤剂10μl,加ph6.6的磷酸盐缓冲液20μl和1%铁氰化钾溶液20μl,混合后在50℃放置20min,加入10%三氯乙酸溶液250μl混合,取混合液25μl,加入25μl蒸馏水和0.1%氯化铁溶液25μl,混匀,静置10min后,在700nm处测定光密度od,以溶剂代替组合物汤剂作为空白对照。
50.fe总抗氧化能力用δod来表示,δod=od样品-od空白。
51.(2)羟基自由基清除率
52.在试管中依次加入2mmol/l硫酸亚铁溶液0.5ml,6mmol/l过氧化氢0.5ml摇匀后,再加入6mmol/l水杨酸1.5ml,于37℃水浴中15min取出,测其光密度od,空白组加入组合物汤剂0.1ml摇匀,水浴继续加热15min取出200μl测其光密度od样品,以如下的计算式获得羟基自由基清除率:
53.清除率(%)=(od空白-od样品)/od空白
×
100%
54.(3)dpph清除率
55.将dpph配制为0.5mg/ml的溶液,4℃避光保存,3.5h内结束试验。
56.1g/ml组合物汤剂以100μl/孔加入酶标板的微孔中,再向其中加入100μldpph溶液,设置3个重复孔。空白对照组和本底组分别以100μl纯水、无水乙醇替代dpph溶液,同样设置3个重复孔。37℃避光条件下静置30min,酶标仪517nm处测定od值。
57.以如下计算式获得dpph清除率:
58.dpph清除率(%)=[od空白-(od样品-od本底)]/od空白
×
100%
[0059]
二、抗炎性测试方法:
[0060]
采用分光光度法测定对5-脂肪氧化酶活性的抑制率来表征组合物汤剂的体外抗炎活性,其中:
[0061]
底物的制备:将吐温-20分散于0.02mol/l、ph9.0的硼酸盐缓冲液中,摇匀过程中加入适量亚油酸,然后滴加lmol/l的氢氧化钠溶液使其变得澄清透亮且ph保持在9.0。
[0062]
取1μl浓度为1g/ml的组合物汤剂加入已含20μl脂肪氧化酶溶液的1.5mlep管中,30℃水浴加热30min后加入150ml底物再次放入30℃水浴锅中反应3min,加入500μl无水乙醇终止反应后加入500μl蒸馏水混匀待测,记为od1;阳性对照组以1μl蒸馏水替代组合物汤剂,记为od2;阴性对照组以20μl蒸馏水替代脂肪氧化酶,记为od3;空白对照组以1蒸馏水替代组合物汤剂,加底物之前先加入500μl无水乙醇终止反应,记为od4;重复试验3次,各取200μl组合物汤剂在234nm处检测各反应液的吸光度od值,
[0063]
以如下计算式获得抗炎率:
[0064]
抗炎率(%)=[1-(od1-od3)/(od2-od4)]
×
100%
[0065]
三、抑菌性测试方法:
[0066]
采用牛津杯抑菌方法进行:将大肠埃希氏菌atcc25922、金黄色葡萄球菌 atcc43300菌液按一定比例稀释后,涂布器均匀涂布于mh琼脂培养基后将牛津杯置于mh琼脂培养基中,取200μl组合物汤剂加入牛津杯中,37℃恒温培养后测量抑菌圈大小。
[0067]
四、组合物汤剂成分分析:
[0068]
以芦丁、木犀草苷、异绿原酸a和盐酸小檗碱为参照成分,建立组合物汤剂基于hplc的主成分及其含量定性和定量分析方法,以分析组合物汤剂药理学作用的物质基础。具体过程包括:
[0069]
准确称取适量芦丁、木犀草苷、异绿原酸a和盐酸小檗碱标准品,分别以色谱级甲醇配制母液备用,使用前稀释至合适浓度经0.22μm微孔滤膜过滤。色谱条件如下:agilent sb-c18色谱柱(4.6mm
×
250mm,1.5μm),流动相a为乙腈, b为0.2%磷酸水溶液,梯度洗脱:0~11min,a相16%~18%;11-25min,a相 18%~25%,25~30min;a相25%~30%;30~40min,a相30%~35%;40~50min, a相35%~40%;50~55min,a相40%-16%;流速1ml/min,检测波长348nm,进样量10μl,柱温为30℃。
[0070]
五、急性毒性和蓄积毒性测试:
[0071]
将42只18-22g雌性balb/c小鼠随机分为7组,分别为空白对照组(control)、 a、b、c、d、e、f组,空白对照组灌胃生理盐水,a、b、c、d、e、f组分别按生药浓度30g/kg
·
bw、20g/kg
·
bw、13.3g/kg
·
bw、8.9g/kg
·
bw、5.9g/kg
·
bw、3.9g/kg ·
bw剂量灌胃,观察24h。若无死亡及其他异常现象继续进行为期21天的蓄积毒性试验,于第22天进行解剖,观察心、肝、脾、肺、肾等实质器官的一般状态、脏器指数、脏器病理组织学变化。
[0072]
六、对急性肝损伤保护作用的评价测试:
[0073]
将113只18-22g雄性balb/c小鼠,随机挑选8只作为空白对照组,剩余105只分为ccl4(四氯化碳)组、apap(对乙酰氨基酚)组、alcohol(酒精)组,各组35只,每组内再随机分为5个小组,分别为模型组(model)、水飞蓟宾组 (silybin)、高剂量组(h)、中剂量组(m)、低剂量组(l)。空白对照组连续灌胃生理盐水14天;模型组不进行药物灌胃;水飞蓟宾组按50mg/kg进行灌胃,连续14天;高剂量组、中剂量组、低剂量组分别按照生药浓度10g/kg
·
bw、5g/kg ·
bw、2.5g/kg
·
bw连续灌胃14天。第15天除空白对照组外,其它组分别按照下述模型复制方法进行肝损伤模型复制。
[0074]
化学性急性肝损伤模型复制(四氯化碳,ccl4):10g/kg
·
bw腹腔注射1%四氯化碳溶液,第16天处死所有试验小鼠并进行剖检;
[0075]
药物性急性肝损伤模型复制(对乙酰氨基酚,apap):200mg/kg
·
bw腹腔注射对乙酰氨基酚溶液,第16天处死所有试验小鼠并进行剖检;
[0076]
酒精性急性肝损伤模型复制(酒精,alcohol):10ml/kg
·
d连续灌胃酒精度为53度的白酒5天,第20天处死所有试验小鼠并进行剖检。
[0077]
其中,急性肝损伤评价指标如下
[0078]
(1)脏器指数
[0079]
灭菌生理盐水将小鼠心、肝、脾、肺、肾冲洗干净,滤纸吸干后称重并计算脏器指数:脏器指数=脏器/体重
×
100%
[0080]
(2)肝脏病理组织学观察
[0081]
取肝脏左侧大叶中间部分,在4%多聚甲醛中固定48h,然后进行石蜡包埋、切片、
脱蜡、苏木精-伊红(he)染色,最后在显微镜下观察其病理学形态变化。
[0082]
(3)血清生化指标检测
[0083]
按照商品化血清生化试剂盒说明书测定血清tg、t-cho含量水平。
[0084]
(4)肝脏抗氧化能力评价及相关基因表达水平分析
[0085]
制备肝脏匀浆液后,按照商品化剂盒说明书进行t-aoc、gsh-px、sod、 mda检测。
[0086]
称取肝组织匀浆液50mg,加入trizol裂解液1ml进行rna提取,超微量核酸蛋白测定仪检测rna浓度,梯度pcr仪上将rna逆转录成cdna后采用实时荧光定量pcr法测定炎性因子il-1β、il-6、tnf-α和肝脏微小核糖核酸 mir-122的相对表达量。选用gapdh和u6作为内参基因,引物序列如表1。
[0087]
表1qpcr检测的引物序列
[0088][0089]
七、对吡喹酮引起幼龄牦牛肝损伤的作用测试:
[0090]
选21只健康幼龄牦牛(空白对照组、吡喹酮组和组合物汤剂组)进行组合物汤剂对过量使用吡喹酮引起幼龄牦牛肝损伤的保护作用临床评价。除空白组外,其余14只幼龄牦牛按照50mg/kg
·
bw剂量内服吡喹酮,连续给药14天,组合物汤剂组同时按10g/kg
·
bw剂量灌服。第15天颈静脉采血测定血清中谷丙转氨酶和谷草转氨酶的含量,试验期间密切观察各组幼龄牦牛肌颤等外观表现和生理反应等。
[0091]
试验结果统计与分析如下:
[0092]
利用spss软件进行数据统计处理,试验结果以表示。组间统计分析采用lsd检验,p《0.05为差异有统计学意义,记为*;p《0.01,记为**;p《0.001,记为***。
[0093]
实施例1
[0094]
按以下过程制备多组汤剂:
[0095]
s1:将组合物组分与所述水为灭菌去离子水以固液比1:10混合,浸泡30min,煎煮2
k218.3317.3319.67 k319.331919 r1.6740.67 [0104]
由表4可知,抗炎试验中3种因素的影响由大到小排序为a>b>c,推导出以炎为主导的组合物汤剂组合为a1b1c2,记为zjd1(与以抗氧化为主导对比确认的药物组合相同,均记为zjd1)。
[0105]
表4以抗炎为主导极差分析以及综合评分
[0106][0107][0108]
由表5可知,抑菌试验中3种因素的影响由大到小排序为a>c>b,推导出以抑菌为主导的组合物汤剂组合为a3b3c1,记为zjd2。
[0109]
表5以抑菌效果为主导极差分析以及综合评分
[0110] abc抑菌综合得分1111921226313364212452214623347312583218
93339k121.018.021.0 k214.018.015.0 k322.019.019.0 k17.06.07.0 k24.76.05.0 k37.36.36.3 r2.70.32.0 [0111]
最后,以抗氧化、抗炎、抑菌综合活性为主导,对比出抗氧化、抗炎、抑菌综合活评分最高的组合物汤剂组合,见表6,最终将zjd3确定组合物汤剂最佳组方。
[0112]
表6以抗氧化、抗炎、抑菌综合活性为主导的极差分析及综合评分
[0113][0114][0115]
组合物汤剂组方zjd3(a1b1c3)分别进行三次重复试验,以验证重复性,见表7。
[0116]
表7组合物汤剂体外活性重复性评价试验
[0117]
[0118]
进一步的,基于hplc(高效液相色谱)对组合物汤剂的主成分及其含量进行分析,其中,混合标准品线性回归方程如表8所示,标准品和组合物汤剂液相色谱图分别如图1和图2所示。
[0119]
经线性回归分析可知,每1g组合物汤剂中含有芦丁0.27mg,木犀草苷2.72 mg,异绿原酸a 0.26mg,盐酸小檗碱0.28mg。
[0120]
表8标准曲线
[0121][0122][0123]
进一步的,通过中药药理实验方法对组合物汤剂进行归经分析
[0124]
归经分析结果表明,组合物汤剂入肝经率达100%,说明组合物汤剂对肝脏疾病具有预防和治疗作用,见表9。
[0125]
表9组合物汤剂归经分析
[0126][0127]
进一步的,对组合物汤剂的急性毒性和蓄积毒性进行测试和评价,其中,给药组合物汤剂组小鼠心、肝、脾、肺、肾等脏器指数均与空白对照组无显著差异,所得结果如表10和图3所示,表明组合物汤剂安全无毒。
[0128]
表10毒性试验脏器指数
[0129][0130]
进一步,对组合物汤剂由ccl4所致急性肝损伤的影响,以研究组合物汤剂对急性肝损伤保护作用的初步评价。
[0131]
(1)脏器指数:
[0132]
与空白对照组相比,腹腔注射ccl4进行模型复制后,肝脏指数降低,组合物汤剂治疗后得到改善,水飞蓟宾组肝脏指数与空白对照组接近,与模型组存在显著性差异性(见表11)。
[0133]
表11ccl4所致急性肝损伤小鼠脏器指数
[0134][0135]
表11中可见,a:与空白对照组比较存在显著性差异;b:与模型组比较存在显著性差异。
[0136]
(2)肝脏病理组织学变化
[0137]
ccl4急性肝损伤模型组剖检可见肝脏有红色出血点且颜色较暗;水飞蓟宾组、中剂量组和低剂量组则出现不同程度的白色坏死灶,高剂量组表面光滑无明显的外观变化,见图4。
[0138]
空白对照组肝索结构清晰,肝细胞排列整齐。模型组肝索紊乱,肝窦变窄且周围出现大面积肝纤维化,肝细胞明显变性坏死,间质充血细胞核溶解。与模型组比较,各剂量组肝细胞肿胀变形、坏死明显减轻,见图5。
[0139]
(3)ccl4所致急性肝损伤小鼠血清生化标志物检测结果
[0140]
血清生化指标检测结果显示,组合物汤剂连续灌胃14天后,组合物汤剂高剂量组ast、alt与空白对照组趋于一致。组合物汤剂各剂量组对tg的表达具有不同程度的抑制作用,水飞蓟宾组和组合物汤剂高剂量组对t-cho具有维持作用。
[0141]
(4)抗氧化作用
[0142]
与空白对照组相比,模型组小鼠肝组织sod、gsh-px、t-aoc均显著降低,而mda含量显著性升高。与模型组比较,水飞蓟宾组,组合物汤剂组肝脏组织中 sod、cat、gsh-px和mda均不同程度地改善,见图7。
[0143]
(5)ccl4所致急性肝损伤小鼠肝脏炎性因子检测结果
[0144]
qpcr检测结果显示,与模型组相比,组合物汤剂各剂量组对il-1β、il-6、 tnf-α的表达均有一定的抑制作用,且具有统计学意义,见图8。
[0145]
(6)ccl4所致急性肝损伤小鼠肝脏mir-122检测结果
[0146]
与空白对照组相比,模型组mir-122表达量明显增加,由结果可得出,灌胃组合物汤剂后h、m剂量组对mir-122的异常表达有改善作用,见图9。
[0147]
进一步,对组合物汤剂由apap所致急性肝损伤balb/c小鼠的影响测试:
[0148]
(1)脏器指数
[0149]
与模型组相比,灌胃组合物汤剂后,h、m、l剂量组的肝脏指数均呈现显著差异性,表明组合物汤剂不同剂量组均对apap所致急性肝损伤具有保护的作用 (表12)。
[0150]
表12apap所致急性肝损伤小鼠脏器指数
[0151][0152]
表12中可见,a:与空白对照组比较存在显著性差异;b:与模型组比较存在显著性差异
[0153]
(2)肝脏病理眼观变化
[0154]
水飞蓟宾组小鼠肝脏不同程度淤血,组合物汤剂h、m剂量下小鼠肝脏表面均没有出现明显的病理变化,呈现正常暗红色,质地柔软,见图10。
[0155]
he染色显示,组合物汤剂各剂量组灌胃后肝坏死面积明显减少,肝组织变性坏死减轻,表明组合物汤剂干预后可改善apap所致急性肝损伤,见图11。
[0156]
(3)apap所致急性肝损伤小鼠血清生化标志物检测
[0157]
组合物汤剂各剂量组在不同程度上降低ast、alt、tg、t-cho apap模型复制的影响,基本恢复到空白对照组水平,见图12。
[0158]
(4)apap所致急性肝损伤鼠肝脏抗氧化能力
[0159]
与模型组相比,灌胃组合物汤剂后,不同程度上缓解apap模型复制引起的 mda、sod、gsh-px、t-aoc异常,见图13。
[0160]
(5)apap所致急性肝损伤小鼠肝脏炎性因子检测结测
[0161]
与模型组相比,组合物汤剂不同剂量组均对apap所致急性肝损伤表达il-1β、 il-6、tnf-α的表达有抑制作用且具有统计学意义,见图14。
[0162]
(6)apap所致急性肝损伤小鼠肝脏mir-122表达的影响
[0163]
与空白对照组相比,模型组mir-122表达量明显增加,组合物汤剂h、m剂量组的mir-122的表达趋于空白对照组,见图15。
[0164]
进一步,对组合物汤剂对alcohol所致急性肝损伤balb/c小鼠的影响测试:
[0165]
(1)脏器指数
[0166]
水飞蓟宾组和组合物汤剂h、中剂量组的肝脏指数与模型组表现出显著性差异,见表13。
[0167]
表13alcohol所致急性肝损伤小鼠脏器指数
[0168][0169]
表13中可见,a:与空白对照组比较存在显著性差异;b:与模型组比较存在显著性差异。
[0170]
(2)肝脏病理变化观察
[0171]
与空白对照组相比,组合物汤剂高剂量组肝脏未出现明显的外观变化,中剂量组肝脏出现一些不明显的白色坏死灶,低剂量组肝脏边缘出现淤血现象,见图16。
[0172]
空白对照组肝脏经过he染色后肝细胞状态健康,整体无变性、坏死等病变现象。灌胃组合物汤剂后各剂量组肝细胞损伤程度得到减轻,以h组缓解更为明显,见图17。
[0173]
(3)alcohol所致急性肝损伤小鼠血清生化标志物检测结果
[0174]
与模型组相比,水飞蓟宾组和组合物汤剂高剂量组均对血清指标异常ast、 alt、tg、t-cho有显著的改善作用且具有统计学意义,见图18。
[0175]
(4)alcohol所致急性肝损伤小鼠肝脏抗氧化能力
[0176]
alcohol所致急性肝损伤小鼠与空白对照组均出现了显著的差异性,组合物汤剂各剂量组在不同程度上逆转了mda、sod、gsh-px、t-aoc在apap模型复制后的异常,见图19。
[0177]
(5)alcohol急性肝损伤小鼠肝脏炎性因子检测结果
[0178]
与模型组相比,组合物汤剂不同剂量均对alcohol所致急性肝损伤小鼠的 il-1β、il-6、tnf-α的表达具有一定的抑制作用且具有统计学意义,见图20。
[0179]
(6)alcohol急性肝损伤小鼠肝脏mir-122检测结果
[0180]
与空白对照组相比,模型组mir-122表达量明显增加,灌胃组合物汤剂后高剂量组对mir-122的异常表达均有显著地改善作用,见图21。
[0181]
实施例2
[0182]
对第zjd3(a1b1c3)组合物汤剂对吡喹酮引起幼龄牦牛肝损伤的药效的测试:
[0183]
连续给药实施例1中第zjd3(a1b1c3)组合物汤剂,即本发明提供的组合物汤剂14天后,得到幼龄牦牛血清谷丙转氨酶和谷草转氨酶的含量情况,如附图22 所示(图中*表示与空白对照组比较存在显著性差异;#表示与吡喹酮组比较存在显著性差异),其中图(a)为谷丙转氨酶的含量情况,图(b)为谷草转氨酶的含量情况,可以看出,给药后的幼龄牦牛的血清谷丙转氨酶和谷草转氨酶含量明显低于吡喹酮组。与空白对照组相比,谷丙转氨酶的含量差异不显著。此外,试验期间发现吡喹酮组2头幼龄牦牛出现不同程度的肌颤,而空白组和组合物汤剂组均未出现此现象。上述结果表明,组合物汤剂能够缓解吡喹酮引起的幼龄牦牛血清谷丙转氨酶和谷草转氨酶升高及肌肉震颤等不良反应,对吡喹酮引起幼龄牦牛肝损伤具有保护作用。
[0184]
以上实施例仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例。凡属于本发明思路下的技术方案均属于本发明的保护范围。应该指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下的改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1