微针贴剂及其制备方法与流程
1.本发明涉及医药制剂领域,具体而言,涉及一种微针贴剂及其制备方法。
背景技术:
2.化疗、放疗和手术是肿瘤治疗最常见的手段,但都存在一些共有的副作用。例如化疗药物在破坏肿瘤细胞的同时也会损伤人体正常组织细胞,导致患者恶心呕吐。放疗通常会引起患者的肠胃功能紊乱,同样具有导致患者恶心呕吐的副作用。化疗所致恶心呕吐(chemotherapy-induced nausea and vomiting,cinv)和放疗所致恶心呕吐(radiotherapy-induced nausea and vomiting,rinv)会降低患者对于化疗和放疗的耐受性,产生抵触心理。同样地,术后恶心呕吐(postoperative nausea and vomiting,ponv)是患者手术后比较常见的症状,受手术类型、手术时间、麻醉药物及患者心理等多种因素的影响。
3.cinv产生的主要途径是化疗药刺激嗜铬细胞释放5-羟色胺(5-hydroxytryptamine,5-ht),与5-羟色胺-3(5-ht3)受体结合产生神经冲动,由迷走神经和交感神经传入呕吐中枢导致呕吐。因此目前临床上多使用5-ht3受体拮抗剂治疗cinv,同时5-ht3受体拮抗剂也适用于预防和治疗rinv和ponv。5-ht3受体拮抗剂的临床使用剂型主要为片剂、胶囊剂和注射剂。口服5-ht3受体拮抗剂存在肝脏首过效应,且生物利用度不高。注射剂存在患者顺应性差的问题。同时临床试验还表明,5-ht3受体拮抗剂具有诱发转氨酶升高的副作用。
技术实现要素:
4.本发明一方面在于提供一种微针贴剂,该微针贴剂具备预防和治疗因化疗、放疗和手术引起的恶心呕吐的效果,同时能够抑制转氨酶的升高。
5.本技术的微针贴剂,包括可溶性微针和背衬层,可溶性微针固定连接在背衬层的一侧,可溶性微针包括5-ht3受体拮抗剂包合物、转氨酶抑制剂和可降解聚合物,背衬层包括可降解聚合物。
6.5-ht3受体拮抗剂包合物由5-ht3受体拮抗剂与包合材料制成。
7.5-ht3受体拮抗剂包括格拉司琼、昂丹司琼、托烷司琼、阿扎司琼、雷莫司琼、多拉司琼、阿洛司琼和帕洛诺司琼等。本技术的5-ht3受体拮抗剂选自其中的一种或多种。
8.5-ht3受体拮抗剂包合物的包合材料包括羟丙基-β-环糊精、环糊精衍生物等。本技术的5-ht3受体拮抗剂的包合材料选自其中的一种或多种。
9.转氨酶抑制剂包括联苯双酯、双环醇、五味子醇甲、甘草酸铵、甘草酸二铵、水飞蓟宾、谷胱甘肽和多烯磷脂酰胆碱等。本技术的转氨酶抑制剂选自其中的一种或多种。
10.可降解聚合物包括聚乙烯醇(pva)、聚乙烯吡咯烷酮(pvp)、壳聚糖、羧甲基纤维素(cmc)、葡聚糖、透明质酸(ha)、聚乙二醇(peg)等。本技术的可降解聚合物选自其中的一种或多种。
11.在一些实施方式中,以质量百分比计,可溶性微针包括10~30%的5-ht3受体拮抗剂包合物,5~15%的转氨酶抑制剂。
12.在一些实施方式中,微针贴剂的可溶性微针组成微针阵列。
13.本发明的另一方面还提供了微针贴剂的制备方法:
14.将5-ht3受体拮抗剂包合物和可降解聚合物均匀混合后,加入转氨酶抑制剂,得基质液;
15.将基质液注入微针模具的微孔内,离心,干燥处理,得可溶性微针;
16.将可降解聚合物水溶液注入微针模具中,离心,干燥,脱模得微针贴剂。
17.在一些实施方式中,5-ht3受体拮抗剂包合物的制备包括以下步骤:
18.称取5-ht3受体拮抗剂与包合材料;
19.将5-ht3受体拮抗剂加入乙醇溶解至饱和,包合材料加入乙醇溶解;
20.加热搅拌下,将包合材料乙醇溶液滴加至饱和的5-ht3受体拮抗剂乙醇溶液中,滴加完成后继续加热搅拌一段时间;
21.过滤,干燥,即得5-ht3受体拮抗剂包合物。
具体实施方式
22.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
23.因此,旨在本发明覆盖落入所附权利要求的范围及其等同范围中的此类修改和变化。本发明的其它对象、特征和方面公开于以下详细描述中或从中是显而易见的。本领域普通技术人员应理解本讨论仅是示例性实施方式的描述,而非意在限制本发明更广阔的方面。
24.本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
25.本发明中,涉及到数值区间,如无特别说明,上述数值区间内视为连续,且包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值。进一步地,当范围是指整数时,包括该范围的最小值与最大值之间的每一个整数。此外,当提供多个范围描述特征或特性时,可以合并该范围。换言之,除非另有指明,否则本文中所公开之所有范围应理解为包括其中所归入的任何及所有的子范围。
26.在本文中,涉及数据范围的单位,如果仅在右端点后带有单位,则表示左端点和右端点的单位是相同的。比如,300~450μm表示左端点“300”和右端点“450”的单位都是μm(微米)。
27.本发明涉及一种微针贴剂,包括可溶性微针和背衬层,可溶性微针底部面积大于针尖面积,背衬层贴附于可溶性微针的底部,用于固定可溶性微针,二者紧密相连。可溶性微针包括5-ht3受体拮抗剂包合物、转氨酶抑制剂和可降解聚合物,背衬层包括可降解聚合物。
28.5-羟色胺(5-hydroxytryptamine,5-ht)是一种吲哚乙胺,是人体内重要的神经递
质,可参与痛觉、睡眠、体温和呕吐等生理功能的调节。5-ht3受体是5-ht受体的其中一种亚型,主要分布在感觉、迷走和肠内神经,因此5-ht3受体拮抗剂被广泛应用于控制化疗、放疗和术后引起的恶心呕吐。本技术的5-ht3受体拮抗剂包括格拉司琼、昂丹司琼、托烷司琼、阿扎司琼、雷莫司琼、多拉司琼、阿洛司琼和帕洛诺司琼等。
29.但因为5-ht3受体拮抗剂均具有水溶性差和不稳定的缺点,本技术优选将5-ht3受体拮抗剂与包合材料做成5-ht3受体拮抗剂包合物,以提高其药物水溶性、稳定性和生物利用度。
30.转氨酶是催化氨基酸与酮酸之间氨基转移的一类酶,主要存在于肝细胞中,是反映肝脏功能的一项重要指标。临床试验证明化疗、放疗和手术(尤其是肝胆类手术)会在一定程度上引起转氨酶的升高,5-ht3受体拮抗剂也会诱导转氨酶的非正常升高。转氨酶抑制剂在一定程度上能够抑制转氨酶的升高,具有护肝的功效,转氨酶抑制剂包括联苯双酯、双环醇、五味子醇甲、甘草酸铵、甘草酸二铵、水飞蓟宾、谷胱甘肽和多烯磷脂酰胆碱等,本技术优选五味子醇甲。本发明采用可降解聚合物作为微针的载体介质和背衬层的主要材质,可降解聚合物包括聚乙烯醇、聚乙烯吡咯烷酮、壳聚糖、羧甲基纤维素、葡聚糖、透明质酸、聚乙二醇等。
31.使用时,将微针贴剂针头的一侧贴合皮肤,按压背衬层使得可溶性微针刺入皮肤并尽可能完全没入皮肤。可溶性微针中的5-ht3受体拮抗剂包合物和转氨酶抑制剂开始释放,待药物释放完成后,揭下微针贴剂,丢弃即可。可溶性微针的递送药物的方式将药物直接导向表皮或者真皮上层,无需通过角质屏障而直接参与微循环提高了递送效率。同时剩余的材料均为可降解材料,不会对环境造成污染。在一些实施方式中,以质量百分比计,可溶性微针包括10~30%的5-ht3受体拮抗剂包合物,5~15%的转氨酶抑制剂,55~85%的可降解聚合物。
32.优选的,可溶性微针中5-ht3受体拮抗剂包合物的质量百分比为20~25%,转氨酶抑制剂的质量百分比为8~12%。
33.背衬层是由质量分数为20~40%的可降解聚合物水溶液制备而成。
34.本发明的另一方面还提供了微针贴剂的制备方法,包括以下步骤:
35.(1)制备5-ht3受体拮抗剂包合物:分别称取5-ht3受体拮抗剂与包合材料,使其质量比为1:2~1:4;将5-ht3受体拮抗剂加入乙醇中使其溶解,直至饱和,将包合材料加入乙醇溶解;在水浴加热搅拌条件下,将包合材料乙醇溶液滴加至饱和的5-ht3受体拮抗剂乙醇溶液中,其滴加完成后继续水浴加热搅拌一段时间;放至室温,过滤,真空冷冻干燥,即得5-ht3受体拮抗剂包合物。
36.(2)将步骤(1)中得到的5-ht3受体拮抗剂包合物和可降解聚合物均匀混合,加入转氨酶抑制剂,充分溶解并搅拌均匀,得基质液。
37.(3)将基质液注入微针模具的微孔内,除去针模具表面的基质液,干燥处理。
38.(4)将可降解聚合物水溶液注入微针模具中,干燥,脱模,即得微针贴剂。
39.可选的,步骤(1)中,水浴加热搅拌时温度为40~50℃,搅拌速度为3500~4500rpm。将饱和的含药乙醇溶液滴加至包合材料中,滴加时间为1h,滴加完成后,水浴温度升至60℃,继续在温度为60℃,搅拌速度为3500~4500rpm下水浴加热搅拌4h。制备完成后放至室温,0.45μm微孔滤膜过滤,滤液在-0.1mpa真空下冻干,48h后得到5-ht3受体拮抗剂
包合物。
40.可选的,步骤(1)中,包合材料包括羟丙基-β-环糊精和环糊精衍生物中的一种或多种。本技术优选羟丙基-β-环糊精。
41.可选的,步骤(2)中,按质量百分比计,基质液包括10~30%的5-ht3受体拮抗剂包合物、55~85%的可降解聚合物和5~15%的转氨酶抑制剂。
42.可选的,步骤(3)中,将基质液注入微针模具的微孔内,在3~5℃下,离心10~15min,使得基质液充满模具的微孔,之后除去微针模具表面的基质液后,放入干燥器内干燥1h。
43.可选的,步骤(4)中,将可降解聚合物配置成质量分数为20~40%的可降解聚合物水溶液,将其注入微针模具中,在3~5℃下,离心10~15min,放入干燥器内干燥6h后取出,脱模,即得微针贴剂。
44.在一些实施方式中,背衬层为四边形,例如正方形、长方形、梯形等,具体不做限定。当背衬层为正方形时,大小可以为0.5~3cm
×
0.5~3cm,例如0.5cm
×
0.5cm,1cm
×
1cm,2cm
×
2cm,3cm
×
3cm等,具体不做限定。背衬层连接的可溶解微针组成陈列,以1cm
×
1cm的正方形背衬层为例,可溶性微针可形成20
×
20的阵列。
45.在一些实施方式中,单根可溶性微针为底部面积大于针尖面积的结构,例如棱锥、棱台、圆锥、圆台等,以四棱锥形针型为例,底部宽300~450μm,高度为510~600μm。小面积的微针中包含有效量的药物,对皮肤的刺激小。
46.该微针贴剂药物有效成分包括5-ht3受体拮抗剂和转氨酶抑制剂,能够有效改善患者因化疗、放疗和手术所引起的恶心呕吐症状同时具有保护肝功能从而降低转氨酶的疗效,且制备方法简单易操作,药物稳定性好,递送效率高,经济环保。
47.在一些实施方式中,该微针贴剂还可用于抗抑郁的治疗。有研究表明5-ht3受体拮抗剂可用做抗抑郁药物,而五味子醇甲可以通过抑制抑郁小鼠脑内海马和前额叶皮层中胶质细胞源性神经营养因子、细胞外信号调节激酶1/2、活性氧、和pi3k/akt/nadph氧化酶信号通路来发挥抗抑郁作用。
48.下面将结合实施例对本发明的实施方案进行详细描述。
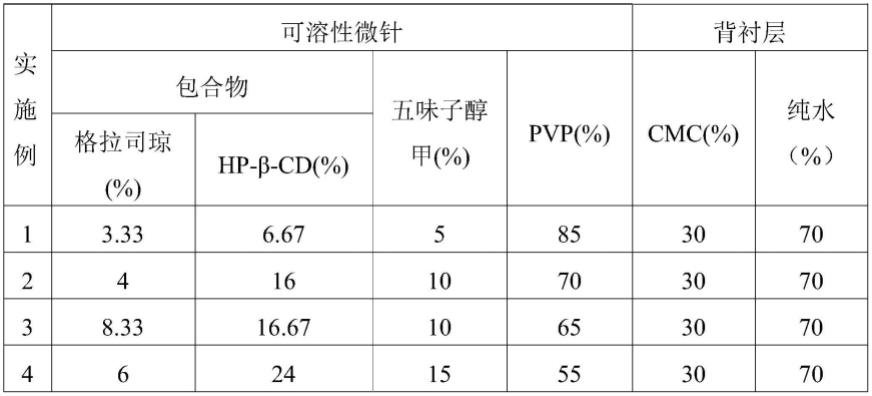
49.在本发明的非限制性实施例中,微针贴剂包含微针和背衬层,微针所含成分包括格拉司琼(羟丙基-β-环糊精,hp-β-cd)包合物、五味子醇甲和聚乙烯吡咯烷酮(pvp)。称取一定量的格拉司琼,羟丙基-β-环糊精,使其质量比为1:2~1:4,制成格拉司琼(hp-β-cd)包合物。以质量百分数计,格拉司琼(hp-β-cd)包合物占比10~30%,五味子醇甲占比5~15%,pvp占比55~85%。背衬层由质量分数为20~40%的羧甲基纤维素(cmc)水溶液制备而成。
50.各组分的具体含量如下表1所示:
51.表1:实施例1~4的组分及含量
[0052][0053]
按照上述表格中的组分分别制备得到微针贴剂,以实施例1为例,首先称取各组分材料,以质量百分数计,格拉司琼在可溶性微针中占比3.33%,hp-β-cd占比6.67%,将纯乙醇加入格拉司琼中使其溶解,直至饱和,共加入了50ml的纯乙醇溶液。在温度为45℃,搅拌速度为4000rpm的条件下水浴加热搅拌,将hp-β-cd乙醇溶液缓慢滴加进饱和的含格拉司琼乙醇溶液中,滴加时间为1h,滴加完成后,继续在温度为60℃,搅拌速度为4000rpm的条件下水浴加热搅拌4h。制备完成后放至室温,0.45μm微孔滤膜过滤,滤液在-0.1mpa真空下冻干,48h后得到格拉司琼(hp-β-cd)包合物。
[0054]
以质量百分数计,将10%的格拉司琼(hp-β-cd)包合物和85%的pvp均匀混合,加入5%的五味子醇甲,在温度为45℃,搅拌速度为4000rpm的条件下水浴加热,使其充分溶解并搅拌均匀,得基质液。
[0055]
将基质液注入微针模具的微孔内,在4℃下离心10min,除去微针模具表面的基质液,放入干燥器内干燥1h。
[0056]
以质量百分数计,取30%cmc和70%的纯水相混合,制成质量分数为30%的cmc水溶液,将其注入微针模具中,在3℃下离心15min,放入干燥器内干燥1h后取出,脱模,即得微针贴剂。
[0057]
以与实施例1相同的制备方法分别制备得到实施例2~4,其中微针贴剂的载药量和参数如下表2所示。
[0058]
表2:实施例1~4制得微针贴剂的载药量和参数
[0059][0060]
由表2可知,实施例1~4的单根微针底部宽300~450μm,微针高度为510~600μm,
符合常见的微针贴剂中微针的大小范围。实施例1~4制得的微针贴剂的质量范围为900~1500mg,该质量范围下的载药量为3~9%,以实施例1为例,该微针贴剂的质量为940mg,载药量为3.1%。与同质量的其他经皮给药方式相比具有更高的载药量。
[0061]
在本发明的另一组非限制性实施方式中,微针贴剂包含可溶性微针和背衬层,可溶性微针包括昂丹司琼(羟丙基-β-环糊精,hp-β-cd)包合物、联苯双酯和pva。称取各组分材料,以质量分数计,昂丹司琼占比2.5%,羟丙基-β-环糊精占比7.5%,联苯双酯占比5%,pva占比85%;背衬层中壳聚糖占比20%,纯水占比80%,采用与实施例1相同的方法进行制备,得到实施例5。测得单根微针参数落在预期范围内,即底部宽300~450μm,微针高度为510~600μm,符合常见的微针贴剂中微针的大小范围。实施例5制得的微针贴剂质量范围为1100~1500mg,该质量范围下的载药量为3~5%,与同质量的其他经皮给药方式相比具有更高的载药量。
[0062]
在本发明的另一组非限制性实施方式中,微针贴剂包含可溶性微针和背衬层,可溶性微针包括托烷司琼(hp-β-cd)包合物、甘草酸铵和羧甲基纤维素(cmc)。称取各组分材料,以质量分数计,托烷司琼占比7.5%,羟丙基-β-环糊精占比22.5%,甘草酸铵占比15%,cmc占比55%;背衬层中葡聚糖占比30%,纯水占比70%。
[0063]
采用与实施例1相同的方法制备得到实施例6。测得单根微针参数同样落在预期范围内,即底部宽300~450μm,微针高度为510~600μm,符合常见的微针贴剂中微针的大小范围。实施例6制得的微针贴剂质量范围为1100~1500mg,该质量范围下的载药量为6~8%,与同质量的其他经皮给药方式相比具有更高的载药量。
[0064]
在本发明的另一组非限制性实施方式中,微针贴剂包含可溶性微针和背衬层,可溶性微针所含成分包括阿扎司琼(hp-β-cd)包合物、谷胱甘肽和葡聚糖。称取各组分材料,以质量分数计,阿扎司琼占比5%,羟丙基-β-环糊精占比10%,谷胱甘肽占比5%,葡聚糖占比80%;背衬层中透明质酸占比40%,纯水占比60%。
[0065]
采用与实施例1相同的方法,制备得到实施例7。测得单根微针参数同样落在预期范围内,即底部宽300~450μm,微针高度为510~600μm,符合常见的微针贴剂中微针的大小范围。实施例7制得的微针贴剂质量范围为1100~1500mg,该质量范围下的载药量为6~8%,与同质量的其他经皮给药方式相比具有更高的载药量。
[0066]
在本发明的另一组非限制性实施方式中,微针贴剂包含可溶性微针和背衬层,微针所含成分包括帕洛诺司琼(hp-β-cd)包合物、多烯磷脂酰胆碱和透明质酸。称取各组分材料,以质量分数计,帕洛诺司琼占比6%,羟丙基-β-环糊精占比24%,多烯磷脂酰胆碱占比10%,透明质酸占比60%;背衬层中pvp占比30%,纯水占比70%。
[0067]
采用与实施例1相同的方法,制备得到实施例8。
[0068]
测得单根微针同样落在预期范围内,即底部宽300~450μm,微针高度为510~600μm,符合常见的微针贴剂中微针的大小范围。实施例8制得的微针贴剂质量范围为1100~1500mg,该质量范围下的载药量为7~9%,与同质量的其他经皮给药方式相比具有更高的载药量。
[0069]
在本发明的另一非限制性实施方式中,微针贴剂包含微针和背衬层,微针所含成分包括格拉司琼(hp-β-cd)包合物和pvp。称取一定量的格拉司琼,羟丙基-β-环糊精,使其质量比为1:3,制成格拉司琼(hp-β-cd)包合物。以质量百分数计,格拉司琼(hp-β-cd)包合
物占比25%,pvp占比75%。背衬层为质量分数为30%的cmc水溶液。
[0070]
采用与实施例1相同的制备方法,制备得到对比例1。对比例1的微针制剂的单根微针底部宽300~450μm,微针高度为510~600μm,符合常见的微针贴剂中微针的大小范围。
[0071]
在本发明的另一非限制性实施方式中,微针贴剂包含微针和背衬层,微针所含成分为质量分数为50%的pvp水溶液。背衬层为质量分数为30%的cmc水溶液。
[0072]
采用与实施例1相同的制备方法,制备得到对比例2。对比例2为空白微针贴剂,单根微针底部宽300~450μm,微针高度为510~600μm,符合常见的微针贴剂中微针的大小范围。
[0073]
按照实施例3的药物组分制备普通贴剂为对比例3,即取格拉司琼,五味子醇甲溶解于乙酸乙酯有机溶剂中,加入丙烯酸酯压敏胶,充分混匀后于20~100℃升温干燥,覆盖背衬层,背衬层选用弹性无纺布。其中以质量分数计,格拉司琼占比10%,五味子醇甲占比5%,丙烯酸酯压敏胶占比85%。
[0074]
实施例5~8与对比例1~2的配方整理如表3所示。
[0075]
表3:实施例5~8与对比例1~2的组分及含量
[0076][0077]
实验例1:微针贴剂的透皮释放能力考察
[0078]
取健康无损伤离体c57鼠皮,去除鼠皮脂肪组织和表面毛发,将实施例1~8、对比例1~2制备得到的微针贴剂和对比例3的贴剂以10n的力按压在鼠皮30s后固定于franz扩
散池装置接收池口(扩散池有效扩散面积1.77cm2,扩散池容积7ml)。鼠皮下表面接触接收液,接收液为0.01mol/l磷酸盐缓冲液(ph=7.2)。接收池中温度设置为(32
±
0.3)℃,始终保持磁力搅拌,转速为100rpm。在实验过程中分别于6h,12h,24h,2d,4d,7d,取样10μl,在每个采样点之后补充等量同温的接收液,以保持整个实验过程中皮肤下表面与接收液接触。取出的样品经0.45μm微孔滤膜过滤后通过高效液相色谱仪测定药物含量,计算药物透皮率。
[0079]
高效液相色谱仪测定条件:
[0080]
色谱柱:ymc-pack ods-a,150
×
4.6mm,5μm);
[0081]
柱温:35℃;
[0082]
流速:1ml/min;
[0083]
进样量:5μl;
[0084]
流动相体积比:15mm kh2po4的水溶液(ph3.0)为a,甲醇为流动相b;a:b=60:40;
[0085]
检测波长:302nm。
[0086]
经计算,分别得到5-ht3受体拮抗剂和转氨酶抑制剂的经皮渗透实验结果,如表4~5所示。
[0087]
表4:5-ht3受体拮抗剂累积释放度(%)
[0088][0089]
表5:转氨酶抑制剂累积释放度(%)
[0090]
[0091][0092]
结果显示,实施例1~8中5-ht3受体拮抗剂的7天累积释药量占总药量之比为85~95%,对比例1中5-ht3受体拮抗剂的7天累积释药量与实施例1~8一致,约为对比例3即普通贴剂的2倍;转氨酶抑制剂的7天累积释药量占总药量之比为85~95%,约为对比例3即普通贴剂的1.5倍。实施例1~8的药物平均渗透速率20~30μg/cm2·
h,约为对比例3即普通贴剂的1~2倍。可见微针贴剂与普通贴剂相比,具有更高的药物负载量和渗透速率。
[0093]
实验例2:微针贴剂对呕吐的影响实验
[0094]
选用c57小鼠适应性喂养两周后,随机分为12组(1组空白组,1组模型组,10组给药组),每组10只,背部脱毛处理。空白组和模型组小鼠分别在脱毛背部使用由对比例2制得的微针贴剂,10组给药组小鼠分别在脱毛背部使用实施例1~8和对比例1、3的微针贴剂。所有小鼠在前7天正常饮食,第8天所有小鼠禁食不禁水24h,第9天对空白组的小鼠尾静脉注射生理盐水0.004ml/g,其余小鼠分别在鼠尾静脉注射顺铂0.004ml/g。记录7天内各组小鼠呕吐的数量及次数,呕吐观察结果如表6所示。
[0095]
表6:小鼠呕吐数量及次数
[0096]
[0097][0098]
表6中小鼠呕吐现象显示,模型组和给药组小鼠的呕吐发生率均高于空白组,说明注射顺铂会引发呕吐;给药组小鼠的呕吐发生率低于模型组,说明5-ht3受体拮抗剂具有抑制呕吐的效果;实施例1、2、5中小鼠的呕吐发生率略高于其他给药组,说明5-ht3受体拮抗剂的含量会影响抑制呕吐的效果;对比例1中小鼠的呕吐发生率与实施例8相近,说明转氨酶抑制剂没有抑制呕吐的效果,且对于5-ht3受体拮抗剂抑制呕吐药效的发挥基本无影响;对比例3中小鼠的呕吐发生率低于模型组,高于相同药物组分的对比例3,说明普通贴剂中5-ht3受体拮抗剂能发挥一定的药效但微针贴剂的抑制呕吐效果优于普通贴剂。
[0099]
实验例3:药物组合预防和治疗顺铂诱导呕吐的实验
[0100]
选用c57小鼠适应性喂养两周后,随机分为12组(1组空白组,1组模型组,10组给药组),每组10只,背部脱毛处理。空白组和模型组小鼠分别在脱毛背部使用由对比例2制得的微针贴剂,10组给药组小鼠分别在脱毛背部使用实施例1~8和对比例1、3的贴剂。所有小鼠在前7天正常饮食,第8天所有小鼠禁食不禁水24h,第9天对空白组的小鼠尾静脉注射生理盐水0.004ml/g,其余小鼠分别在鼠尾静脉注射顺铂0.004ml/g。
[0101]
称取各组小鼠处死时的体重,再取出小鼠肝组织,记录湿重,计算肝脏系数;然后迅速将肝组织置于匀浆器中制成匀浆,将匀浆液反复冻融3次,离心处理,取上清液分装于ep管中,迅速置于-80℃冰箱保存,用于测定谷胱甘肽(gsh)、谷胱甘肽过氧化酶(gsh-px)、丙氨酸转氨酶(alt)活性。gsh和gsh-px采用dtnb比色法进行活性测定,alt采用二硝基苯肼法进行活性测定,均通过试剂盒检测,试剂盒购于南京建成生物工程研究所,严格按照说明书的步骤进行测定。测定结果如表7所示。
[0102]
表7:肝脏系数、gsh、gsh-px、alt水平测定结果
[0103][0104]
表7中检测结果显示,模型组小鼠的肝脏系数、gsh水平和gsh-px水平低于空白组,同时alt水平远高于空白组均说明注射顺铂诱导呕吐会导致肝功能受损;对比例1中小鼠的gsh水平、肝脏系数和gsh-px水平与模型组类似,说明5-ht3受体拮抗剂在发挥抑制呕吐药效的同时会给肝脏带来损伤;除对比例1外,几乎所有给药组小鼠的肝脏系数、gsh水平和gsh-px水平均低于空白组,高于模型组,alt水平高于空白组,低于模型组,说明转氨酶抑制剂能够减轻呕吐和5-ht3受体拮抗剂带来的肝脏损伤;对比例3中小鼠的肝脏系数、gsh水平和gsh-px水平大部分都高于模型组,低于空白组和给药组实施例1~8,alt水平低于模型组,高于空白组和给药组实施例1~8,说明本技术微针贴剂的减轻肝脏受损的效果优于普通贴剂。
[0105]
完成静脉注射顺铂50min后,摘除小鼠眼球取血并高速离心处理,取上清液分装于ep管中,迅速置于-80℃冰箱保存,用于测定超氧化物歧化酶(sod)和脂质过氧化产物(lpo)。sod采用亚硝酸盐比色法进行活力测定,lpo采用硫代巴比妥酸比色法进行活性测定,均通过试剂盒检测,试剂盒购于南京建成生物工程研究所,严格按照说明书的步骤进行测定。测定结果如表8所示。
[0106]
表8:sod和lpo水平测定结果
[0107] sod(nu/mg prot)lpo(nmol/mg prot)空白组165.07
±
14.98131.17
±
5.141模型组99.81
±
4.15764.07
±
6.547实施例1116.71
±
8.10047.10
±
6.110实施例2123.27
±
7.78145.36
±
5.847
实施例3149.52
±
9.58236.13
±
4.357实施例4128.20
±
5.71039.25
±
6.000实施例5119.15
±
8.00247.50
±
3.617实施例6150.12
±
2.21037.11
±
4.560实施例7135.96
±
5.12146.28
±
4.170实施例8130.10
±
5.40036.40
±
2.897对比例198.17
±
7.25777.15
±
5.007对比例3118.17
±
7.25755.74
±
3.177
[0108]
表8中检测结果显示,模型组的sod水平远低于空白组,lpo水平远高于空白组,说明注射顺铂诱导呕吐会导致肝功能受损;除对比例1以外的给药组的sod水平明显低于空白组,高于模型组,lpo水平明显高于空白组,低于模型组,说明转氨酶抑制剂能够减轻肝脏损伤,对比例3中小鼠的sod水平高于模型组,低于空白组和大部分给药组,lpo水平低于模型组,高于空白组和给药组实施例1~8,说明本技术的微针贴剂的减轻肝脏受损的效果优于普通贴剂。
[0109]
完成小鼠眼球取血后取小鼠脑组织,迅速将其置于匀浆器中制成匀浆,将匀浆液反复冻融3次,离心处理,取上清液分装于ep管中,迅速置于-80℃冰箱保存备用。采用酶联免疫吸附实验法(elisa)测定小鼠5-羟色胺(5-ht)和多巴胺(da)水平,均通过试剂盒检测,试剂盒购于南京建成生物工程研究所,严格按照说明书的步骤进行测定。测试结果如表9所示。
[0110]
表9:5-ht和da水平测定结果
[0111] 5-ht(ng/mg)da(pg/mg)空白组0.8835
±
0.020.1898
±
0.034模型组1.1574
±
0.0180.4075
±
0.047实施例11.000
±
0.0200.2614
±
0.009实施例20.9160
±
0.0170.2475
±
0.035实施例30.9054
±
0.0210.2005
±
0.030实施例40.8991
±
0.0280.2500
±
0.050实施例50.9541
±
0.0330.2610
±
0.014实施例60.9710
±
0.0410.2816
±
0.024实施例70.9290
±
0.0310.3001
±
0.040实施例80.9610
±
0.0200.2941
±
0.023对比例11.009
±
0.0160.3000
±
0.028对比例31.098
±
0.0120.3570
±
0.041
[0112]
表9中检测结果显示,模型组小鼠的5-ht和da水平高于空白组,这是注射顺铂诱导呕吐所引起的,与呕吐最相关的神经递质及其受体包括5-ht和da;给药组小鼠的5-ht和da水平高于空白组,低于模型组,说明5-ht3抑制剂能够缓解呕吐症状;对比例3中小鼠的5-ht和da水平低于模型组,高于空白组和给药组实施例1~8,说明本技术的微针贴剂抑制呕吐的效果优于普通贴剂。实验例3:药物组合关于抗抑郁疗效的小鼠实验
[0113]
选用c57小鼠适应性喂养一周后,随机分为12组,包括1组空白组,1组模型组和10
组给药组,每组10只,背部脱毛处理。除空白组外,所有小鼠均采用cums法构建抑郁症模型,应激方式包括:禁食(24h)、禁水(24h)、束缚(3h)、倾笼45
°
(24h)、湿笼(8h)、闪光(12h)、潮湿垫料(24h)、空瓶(3h)、电击(6次/天),1周9种刺激方法随机安排,但同一应激方式不连续应用。造模2周后,给药组在背部脱毛区域分别贴上实施例1~8和对比例1、3的贴剂,空白组和模型组在背部脱毛区域贴上对比例2的微针贴剂;造模给药共计4周。
[0114]
结束后摘除眼球取血,高速离心处理,取上清液分装于ep管中,迅速置于-80℃冰箱保存备用。取出小鼠肝组织,记录湿重,迅速将其置于匀浆器中制成匀浆,将匀浆液反复冻融3次,离心处理,取上清液分装于ep管中,迅速置于-80℃冰箱保存备用。小鼠处死后迅速在冰上断颈剥离出双侧海马组织,液氮急冻保存备用。采用酶联免疫吸附实验法(elisa)测定肿瘤坏死因子-α(tnf-α)、白介素-1β(1l-1β)和脑源神经营养因子(bdnf)水平,均通过试剂盒检测,试剂盒购于南京建成生物工程研究所,严格按照说明书的步骤进行测定。测试结果如表10所示。
[0115]
表10:tnf-α,1l-1β,bdnf和alt水平测定结果
[0116][0117][0118]
表10中检测结果显示,模型组小鼠的tnf-α和1l-1β水平高于空白组,bdnf水平低于空白组,是抑郁造模引起的;给药组小鼠的tnf-α和1l-1β水平低于模型组,bdnf水平高于模型组,说明5-ht3受体拮抗剂具有抗抑郁疗效,对比例1中小鼠的alt水平高于其他给药实施例,说明5-ht3受体拮抗剂在一定程度上具有损害肝功能的弊端,而转氨酶抑制剂能够帮助改善肝功能受损症状;对比例3中小鼠的tnf-α和1l-1β水平低于模型组,高于空白组和给药组实施例1~8,bdnf水平高于模型组,低于空白组和给药组实施例1~8,说明本技术的微
针贴剂的抗抑郁效果优于普通贴剂。
[0119]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0120]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1