一种抑制乳腺癌发生发展的组合物及其应用的制作方法
1.本发明涉及生物医药领域,具体涉及一种抑制乳腺癌发生发展的组合物及其应用。
背景技术:
2.乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤。早期常表现为乳房肿块、乳头溢液、腋窝淋巴结肿大等症状,晚期可因癌细胞发生远处转移,出现多器官病变,直接威胁患者的生命,常被称为“粉红杀手”。全球乳腺癌发病率自20世纪70年代末开始一直呈上升趋势。根据国家癌症中心和卫生部疾病预防控制局2012年公布的乳腺癌发病数据显示:全国肿瘤登记地区乳腺癌发病率位居女性恶性肿瘤的第1位。
3.尽管目前一些治疗手段可以帮助大多数肿瘤患者缓解痛苦,但乳腺癌仍极大威胁着女性生命安全,导致生活质量下降。因此,对乳腺癌发生发展进行研究并研制出有效的治疗药变得更加迫切。
4.现有文献(“c5ar deficiency attenuates the breast cancer development via the p38/p21 axis”,chen et al.,《aging-us》(aging),2020年第12卷第14期)公开了补体c5a/c5ar通路参与了乳腺癌的发病机制,抑制c5a/c5ar通路有望有助于乳腺癌患者的治疗,但目前未有有关基于补体c5a的治疗乳腺癌的更有效的药物组合的相关报道。
技术实现要素:
5.为了克服现有技术中的缺陷,本发明提供了一种抑制乳腺癌发生发展的组合物及其应用。
6.为实现上述目的,本发明采用如下技术方案:
7.本发明的第一方面是提供一种抑制乳腺癌发生发展的组合物,其包括抑制c5a,以及pd-1和/或opn表达的试剂。
8.进一步地,上述组合物包括c5a抗体,以及pd-l1抗体和/或opn抗体。
9.进一步地,上述组合物包括c5a抗体和pd-l1抗体。
10.本发明的第二方面是提供上述组合物在制备治疗乳腺癌药物中的应用。
11.进一步地,上述药物的有效活性成分为c5a抗体,以及pd-l1抗体和/或opn抗体。
12.进一步地,上述药物的有效活性成分为c5a抗体和pd-l1抗体。
13.进一步地,上述药物还包括药物上可接受的载体或者赋形剂。
14.进一步地,上述药物的给药形式为口服、静脉注射或肌肉注射。
15.本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
16.本发明验证了pd-l1抗体和/或opn抗体联合c5a抗体可以显著抑制乳腺癌的发生发展,为制备治疗乳腺癌的药物提供了新的思路,利于提高患者的生活质量。
附图说明
17.图1显示了本发明一实施例中蛋白芯片检测的结果;其中,图a和b分别显示了c5a诱导乳腺癌细胞后,部分蛋白的表达差异;
18.图2显示了本发明一实施例中不同抗体或者抗体组合对条件培养基招募mdscs作用的影响;其中,图a为倒置显微镜的拍照结果,图b显示了迁移细胞的数量的统计结果;
19.图3显示了本发明一实施例中加入opn中和抗体后抑制了c5a调控的条件培养基促进成骨细胞分化的功能;其中,图a-c分别显示了空白组、加入c5a诱导后的乳腺癌细胞的条件培养基组以及加入c5a诱导后的乳腺癌细胞的条件培养基和opn中和抗体的组别中成骨细胞的分化功能;
20.图4显示了本发明一实施例中流式细胞术分析t淋巴细胞分型的结果;其中,图a为流式细胞实验的结果,图b为根据图a统计cd4
+
t细胞数量的结果;
21.图5为本发明一实施例中通过荧光成像技术显示了各抗体或其组合对乳腺癌细胞的骨转移的抑制作用;
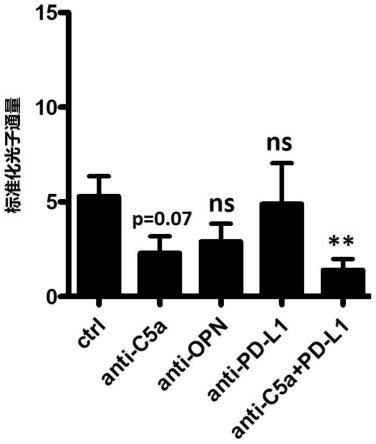
22.图6显示了本发明一实施例中小鼠活动成像荧光强度总量定量分析的结果;**p《0.01。
具体实施方式
23.本发明提供了一种抑制乳腺癌发生发展的组合物及其应用。下面通过具体实施例和附图对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。
24.实施例中方法如无特殊说明的采用常规方法,使用的试剂如无特殊说明的使用常规市售试剂或按常规方法配制的试剂。
25.实施例1
26.本实施例采用蛋白芯片检测的方法筛选出与骨微环境以及免疫微环境变化相关的蛋白,具体的实验步骤和结果如下:
27.1、样品的制备:将mcf-7细胞进行常规培养,并传代至10cm细胞培养皿,待培养皿中的细胞密度达90%时,进行细胞计数,分别取3
×
106细胞铺至2个10cm的细胞培养皿中。
28.2、12小时后待细胞生长稳定,将细胞用pbs溶液洗涤3次后,更换为无酚红,并且不含胎牛血清的dmem培养基,在实验组按浓度为20ng/ml加入人源性c5a,继续培养12小时。
29.3、细胞培养结束后,收集细胞上清液至15ml离心管中,随后使用0.4μm的滤器,对收集的条件培养基进行过滤,处理完毕的样品保存于-80℃冰箱中待测。
30.4、蛋白质芯片检测由瑞博奥(广州)生物有限公司进行,检测的程序如下:对收集的蛋白样品进行浓缩处理后,将样品滴加在包被有抗体的载玻片上,通常反应时间为2小时,随后滴加生物素化的第二抗体,作用2小时后,加入链霉亲和素(cy3)继续反应1小时,即可采用激光扫描获得所结合蛋白相关数据,并进一步采用相应软件进行差异蛋白的分析,结果如图1所示。
31.由图1可知,与对照组相比变化最为显著的是骨桥蛋白(opn)和程序性死亡配体1(pd-l1),它们的表达差异尤为显著。
32.实施例2
33.本实施例探究不同试剂对mdscs细胞的招募作用的影响,具体的实验步骤和实验结果如下:
34.1、取一个24孔细胞培养板,在空白对照组(ctrl)中加入600μl完全培养基;在实验组中在孔中加入600μl培养基(其中含有6μl条件培养基),并根据不同的实验组别加入相应试剂(c5a-cm组中不额外加试剂,c5a-cm-opn ab组中加入opn抗体并使其终浓度为2μg/ml,c5a-cm-pd-l1 ab组中加入pd-l1抗体并使其终浓度为1μg/ml,c5a-cm-pd-l1 ab&-opn ab组中加入pd-l1抗体(终浓度为1μg/ml)和opn抗体(终浓度为2μg/ml)。
35.2、用镊子夹取迁移小室放入孔中,并在小室四个卡角处进行标记,以区分不同实验组。
36.3、将计划进行迁移实验的细胞,常规进行消化、离心处理后,细胞计数,并根据细胞大小不同,取不同数量的细胞铺至迁移小室的上室中,加入液体量为100μl,mdscs铺4
×
105个细胞。
37.4、根据预实验确定好的细胞迁移时间,进行细胞迁移培养,mdscs迁移4小时。
38.5、迁移结束后,将细胞使用4%多聚甲醛固定10分钟后,使用pbs溶液进行洗涤,随后使用0.1%的结晶紫进行染色,通常染色3分钟,染色结束后,使用镊子夹住小室,放入盛有自来水的水槽中洗涤,至洗涤液清亮。
39.6、洗涤结束后,利用棉棒将小室上层的细胞擦除,擦除时需注意将小室上层周边细胞尽量擦除干净,以避免假阳性细胞,自然晾干后使用倒置显微镜进行拍照、统计,结果如图2所示。
40.由图2可知,联用opn以及pd-l1的中和抗体可以发挥协同作用,进一步降低条件培养基对于mdscs的招募作用。
41.实施例3
42.本实施例探究opn中和抗体对c5a调控的条件培养基促进成骨细胞分化的功能的影响,具体的实验步骤和结果如下:
43.1、取8周龄c57bl/6雄性小鼠下肢长骨,并分别保留股骨头以及膝关节、踝关节,将所取组织浸入75%乙醇中,随后转移至生物安全柜进行分离细胞操作。
44.2、至生物安全柜中,更换75%乙醇浸泡5秒,随后浸入pbs溶液中,使用灭菌后的眼科剪剪断肌腱,随后使用纱布将股骨及胫骨表面肌肉去除。将股骨及胫骨分别浸入75%乙醇中5秒,随后浸入pbs溶液中。
45.3、使用20ml注射器吸取10ml完全α-mem改良培养基,并配装1ml注射器针后,使用眼科剪剪除骨髓腔两端骨组织,将注射针插入骨髓腔中,将骨髓冲至15ml离心管中,按上述方法逐一冲洗股骨和胫骨的骨髓腔。
46.4、将冲洗至15ml离心管中的骨髓混合液离心,离心条件为800rpm,5min,随后使用1ml完全α-mem改良培养基重悬细胞。
47.5、将重悬的细胞使用100μm筛网进行过滤,将滤液加入到6cm细胞培养皿中,随后补加3ml完全α-mem改良培养基,继续培养72小时。
48.6、培养72小时后,弃去细胞上清,将细胞进行消化、离心,随后进行细胞计数后,取5
×
104/孔的细胞数量,铺至24孔细胞培养板中,继续培养24小时。
49.7、配制成骨细胞分化培养基,所用试剂包括维生素c(1000
×
),地塞米松(104×
)
和β-甘油磷酸(100
×
),根据不同分组,在成骨细胞分化培养基1ml中加入相应试剂,在条件培养基组加入c5a诱导乳腺癌细胞后的条件培养基10μl,在中和抗体组加入c5a诱导乳腺癌细胞后的条件培养基10μl以及opn的中和抗体并使其终浓度为2μg/ml,继续培养48小时后,再次更换分化培养基。若需进行矿化染色,则需将细胞培养14天。
50.8、将培养分化完成的成骨细胞,使用4%多聚甲醛进行固定后,按照alp染色试剂盒配制染液,室温下染色15分钟后,更换为pbs溶液。在拍照时需注意的是,为避免出现液体反光的现象,将培养板中的pbs溶液去除。染色结果如图3所示。
51.由图3可知,加入c5a诱导并收集的条件培养的促进成骨细胞分化的功能被opn中和抗体所抑制。
52.实施例4
53.本实施例探究pd-l1中和抗体对c5a诱导产生的条件培养基对于cd4
+
t淋巴细胞抑制功能的影响,具体的实验步骤和结果如下:
54.1、完整取出小鼠下肢骨骼,上端保留股骨头,下端保留踝关节,以确保骨髓腔的完整性。
55.2、通过离断膝关节周围韧带后,分离股骨与胫骨,去除表面肌肉后,分别将股骨与胫骨的骨髓腔两端剪下,并用含有1%胎牛血清的pbs溶液冲洗骨髓腔,收集冲洗液并离心(800rpm,5min)。
56.3、离心结束后,使用含有1%胎牛血清的pbs溶液重悬细胞,并予以细胞计数,按106/100μl移至ep管中备用。
57.4、分离培养小鼠骨髓细胞,并加入c5a诱导乳腺癌细胞的条件培养基,作用48小时后,在中和抗体组再加入pd-l1的中和抗体并使其终浓度为1μg/ml,通过流式细胞抗体对于t淋巴细胞的不同亚群进行孵育,利用流式细胞术进行分析。
58.5、按照空白对照、抗体单独染色以及抗体复合染色进行标记ep管,随后按0.5μl/100μl加入流式细胞抗体孵育,为避免加入微量抗体所导致的操作误差,此时可配制抗体稀释液,具体方法为计算所需抗体量后,用pbs溶液稀释10倍后,再按5μl/100μl的方法,加入配制好的抗体稀释液,并注意加入抗体后,需在4℃并且避光的环境中进行孵育,孵育时间为30min。
59.6、孵育结束后,使用含有1%胎牛血清的pbs溶液洗涤3遍,期间离心条件为1000rpm,5min。
60.7、洗涤完毕后,使用600μl含有1%胎牛血清的pbs溶液重悬细胞,并用100μm的筛网进行细胞过滤,处理完毕后进行流式细胞检测。
61.8、若需分次检测,可使用2%多聚甲醛溶液固定15min后,再使用含有1%胎牛血清的pbs溶液洗涤,细胞样品可保存24小时,检测前仍需过滤细胞。
62.由图4可知,加入pd-l1中和抗体后,乳腺癌细胞的条件培养基对于cd4
+
t细胞的抑制功能减弱。
63.实施例5
64.本实施例探究c5a抗体、pd-l1抗体、opn抗体及其组合对癌细胞转移的抑制作用,具体的实验步骤和结果如下:
65.1、选取6至8周龄雌性balb/c小鼠作为实验对象,共7组28只,每组4只,选取表达荧
光素酶的乳腺癌肿瘤细胞4t1,心脏注射细胞数量为1
×
105个/只,采用100μl pbs溶液重悬细胞,并使用100μm筛网进行过滤后备用,由于注射过程中的损耗,细胞准备量通常为计划数量的3倍。
66.2、采用阿弗丁腹腔注射,将balb/c小鼠逐只进行麻醉,并且注意麻醉的程度,切忌麻醉过深,将麻醉满意的小鼠固定于操作台上,使用酒精棉球消毒注射部位后,选取左侧第2/3肋间隙进行穿刺,出现类动脉搏动性回血时,缓慢注射肿瘤细胞悬液,通常约分为5次注射完毕,将注射完毕的小鼠放置于40℃温台上至苏醒。
67.3、心脏注射荧光素酶2天后开始隔天按分组进行药物注射:第一组为空白组,即不进行药物注射;第二组:c5a抗体0.1ml/只;第三组:opn抗体0.1ml/只;第四组:pd-l1抗体0.1ml/只;第五组:c5a抗体+pd-l1抗体,各0.1ml/只。
68.4、待左心室注射完成后2周,进行小鼠活体成像检测,具体操作过程如下:首先,通过腹腔注射的方法,按100μl/只进行荧光素酶底物(luciferin)的注射,注射5分钟后,利用异氟烷气体麻醉系统,将小鼠进行麻醉,麻醉满意后,放置于检测台上进行成像观察,由于细胞转移能力存在差异,通常设定梯度曝光时间1分钟、3分钟、5分钟。
69.由图5和图6可知,c5a抗体对乳腺癌细胞的骨转移具有抑制作用,c5a与pd-l1抗体联用可显著增强抑制作用;opn抗体单独使用对乳腺癌细胞的转移也具有一定抑制作用。
70.以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1