抗人VEGF抗体与化药联用在制备治疗卵巢癌的药物中的应用的制作方法
抗人vegf抗体与化药联用在制备治疗卵巢癌的药物中的应用
技术领域
1.本发明涉及医药领域,具体而言,涉及抗人vegf抗体与化药联用在制备治疗卵巢癌的药物中的应用。
背景技术:
2.卵巢癌是一种起源于上皮的恶性肿瘤,包括上皮卵巢癌,输卵管癌和原发性腹膜癌,是第二位最为常见的和死亡率最高的妇科恶性肿瘤。卵巢癌无特异性肿瘤标志物,很难早期诊断,通常诊断时已为较晚阶段。因此,卵巢癌的预后很差,在欧洲5年生存率仅为37.6%(luigi rossi et al.,oncotarget,2016.8:p.12389-12405)。卵巢癌在中国年新发病例大概在52100人左右,且新发病例每年大概以2%左右的速度递增。年死亡病例大概在22500人左右(chen w.et al.,cancer statistics in china,2015.ca cancer j clin,2016.66(2):p.115-32)。
3.卵巢癌公认的标准治疗是细胞减灭手术和术后进行以铂类和紫杉醇为基础的化疗。尽管一线化疗应答率很高,但高达70-75%的患者仍然会发生复发(luigi rossi et al.,oncotarget,2016.8:p.12389-12405)。卵巢癌患者在含铂类药物治疗后6个月内复发即被定义为铂类耐药。首次复发后,大约25%的患者会发展为铂类抵抗,且最终几乎所有的复发患者均会发展为铂类抵抗。在此情况下,有效治疗的选择非常少,预后也较差。因此需要新的治疗策略来改善其临床预后(pujade-lauraine,e.,et al.,j clin oncol,2014.32(13):p.1302)。
4.血管内皮生长因子(vascular endothelial growth factor,vegf)是一种多功能的细胞因子,是目前已知的作用最强、特异性最高的促血管生成因子,它通过促进肿瘤血管生成、增加血管通透性和下调宿主抗肿瘤免疫应答等机制,参与实体肿瘤的发生发展。有研究显示抗人vegf抗体具有抑制实体瘤生长的作用。
5.bd0801抗体为经过人源化的兔抗人vegf单克隆抗体,研究和探讨bd0801抗体治疗卵巢癌的方案,有利于增加患者的选择,提高卵巢癌的治疗效果,使更多卵巢癌患者受益。
6.有鉴于此,特提出本发明。
技术实现要素:
7.本发明提供抗人vegf抗体与化疗药物的组合、及其治疗卵巢癌的方法或在制备治疗卵巢癌的药物中的应用。
8.在第一方面,本发明提供抗人vegf抗体与化疗药物的组合在制备治疗卵巢癌的药物中的应用,所述化疗药物选自紫杉烷类化合物或喜树碱类化合物,所述抗体包括重链可变区和轻链可变区,所述重链可变区包含hcdr1、hcdr2和hcdr3,所述轻链可变区包含lcdr1、lcdr2和lcdr3,其中,
9.所述hcdr1的序列如seq id no:5所示;
10.所述hcdr2的序列如seq id no:8所示;
11.所述hcdr3的序列如seq id no:11所示;
12.所述lcdr1的序列如seq id no:13所示;
13.所述lcdr2的序列如seq id no:15所示;和,
14.所述lcdr3的序列如seq id no:17所示。
15.在一些具体实施方式中,所述重链可变区的序列如seq id no:1所示,所述轻链可变区的序列如seq id no:3所示。
16.在一些具体实施方式中,所述抗体还包括重链恒定区,所述重链恒定区的序列如seq id no:2所示,所述抗体还包括轻链恒定区,所述轻链恒定区的序列如seq id no:4所示。
17.在一些具体实施方式中,所述卵巢癌为上皮卵巢癌、输卵管癌或原发性腹膜癌。
18.在一些具体实施方式中,所述卵巢癌为铂耐药的复发性卵巢癌。
19.在一些具体实施方式中,所述卵巢癌的病理类型为浆液性腺癌、透明细胞腺癌或混合上皮癌。
20.在一些具体实施方式中,所述紫杉烷类化合物为紫杉醇,所述喜树碱类化合物为盐酸拓扑替康。
21.在一些具体实施方式中,所述抗人vegf抗体的有效施用量为0.5~2mg/kg。
22.在一些具体实施方式中,所述抗人vegf抗体的有效施用量为0.5mg/kg、1mg/kg、1.5mg/kg或2mg/kg。
23.在一些具体实施方式中,所述抗人vegf抗体的剂型为单剂量剂型,每剂含有能够给予患者有效施用量的抗体量。
24.在一些具体实施方式中,所述单剂量剂型含有25~150mg所述抗人vegf抗体。
25.在一些具体实施方式中,所述单剂量剂型含有25mg、50mg、80mg、100mg或150mg所述抗人vegf抗体。
26.在一些具体实施方式中,所述紫杉醇的有效施用量为80mg/m2;所述盐酸拓扑替康的有效施用量为4mg/m2。
27.在第二方面,本发明提供抗人vegf抗体与化疗药物的组合在制备用于治疗卵巢癌的药物中的应用,所述化疗药物选自紫杉烷类化合物或喜树碱类化合物,所述抗体包括重链可变区和轻链可变区,所述重链可变区包含hcdr1、hcdr2和hcdr3,所述轻链可变区包含lcdr1、lcdr2和lcdr3,其中:
28.所述hcdr1选自seq id no:5-7任一项所示序列;
29.所述hcdr2选自seq id no:8-10任一项所示序列;
30.所述hcdr3选自seq id no:11-12任一项所示序列;
31.所述lcdr1选自seq id no:13-14任一项所示序列;
32.所述lcdr2选自seq id no:15-16任一项所示序列;和,
33.所述lcdr3选自seq id no:17所示序列。
34.在一些具体实施方式中,所述重链可变区具有如seq id no:1所示序列,或与seq id no:1相比具有至少95%、96%、97%、98%或99%同一性的序列;所述轻链可变区具有如seq id no:3所示的序列,或与seq id no:3相比具有至少95%、96%、97%、98%或99%同一性的序列。
35.在一些具体实施方式中,所述抗体还包括重链恒定区,所述重链恒定区具有如seq id no:2所示序列,或与seq id no:2相比具有至少95%、96%、97%、98%或99%同一性的序列;所述抗体还包括轻链恒定区,所述轻链恒定区具有如seq id no:4所示的序列,或与seq id no:4相比具有至少95%、96%、97%、98%或99%同一性的序列。
36.在一些具体实施方式中,所述卵巢癌为上皮卵巢癌、输卵管癌或原发性腹膜癌。
37.在一些具体实施方式中,所述卵巢癌为铂耐药的复发性卵巢癌。
38.在一些具体实施方式中,所述卵巢癌的病理类型为浆液性腺癌、透明细胞腺癌或混合上皮癌。
39.在一些具体实施方式中,所述紫杉烷类化合物为紫杉醇,所述喜树碱类化合物为盐酸拓扑替康。
40.在一些具体实施方式中,所述抗人vegf抗体的有效施用量为0.5~2mg/kg,优选为0.5mg/kg、1mg/kg、1.5mg/kg或2mg/kg。
41.在一些具体实施方式中,所述抗人vegf抗体的剂型为单剂量剂型,每剂含有能够给予患者有效施用量的抗体量,优选地,所述单剂量剂型含有25~150mg所述抗vegf抗体,更优选为25mg、50mg、80mg、100mg或150mg。
42.在一些具体实施方式中,所述紫杉醇的有效施用量为80mg/m2。
43.在一些具体实施方式中,所述盐酸拓扑替康的有效施用量为4mg/m2。
44.在第三方方面,本发明还提供一种治疗卵巢癌的方法,所述方法包括向卵巢癌患者施用有效量的抗人vegf抗体与化疗药物的组合,所述化疗药物选自紫杉烷类化合物或喜树碱类化合物,所述抗体包括重链可变区和轻链可变区,所述重链可变区包含hcdr1、hcdr2和hcdr3,所述轻链可变区包含lcdr1、lcdr2和lcdr3,其中:
45.所述hcdr1选自seq id no:5-7任一项所示序列;
46.所述hcdr2选自seq id no:8-10任一项所示序列;
47.所述hcdr3选自seq id no:11-12任一项所示序列;
48.所述lcdr1选自seq id no:13-14任一项所示序列;
49.所述lcdr2选自seq id no:15-16任一项所示序列;和,
50.所述lcdr3选自seq id no:17所示序列。
51.在一些具体实施方式中,所述重链可变区具有如seq id no:1所示序列,或与seq id no:1相比具有至少95%、96%、97%、98%或99%同一性的序列;所述轻链可变区具有如seq id no:3所示的序列,或与seq id no:3相比具有至少95%、96%、97%、98%或99%同一性的序列。
52.在一些具体实施方式中,所述抗体还包括重链恒定区,所述重链恒定区具有如seq id no:2所示序列,或与seq id no:2相比具有至少95%、96%、97%、98%或99%同一性的序列;所述抗体还包括轻链恒定区,所述轻链恒定区具有如seq id no:4所示的序列,或与seq id no:4相比具有至少95%、96%、97%、98%或99%同一性的序列。
53.在一些具体实施方式中,所述卵巢癌为上皮卵巢癌、输卵管癌或原发性腹膜癌。
54.在一些具体实施方式中,所述卵巢癌为铂耐药的复发性卵巢癌。
55.在一些具体实施方式中,所述卵巢癌的病理类型为浆液性腺癌、透明细胞腺癌或混合上皮癌。
56.在一些具体实施方式中,所述紫杉烷化合物为紫杉醇,所述喜树碱类化合物为盐酸拓扑替康。
57.在一些具体实施方式中,所述抗人vegf抗体的有效施用量为0.5~2mg/kg,优选为0.5mg/kg、1mg/kg、1.5mg/kg或2mg/kg。
58.在一些具体实施方式中,所述紫杉醇的有效施用量为80mg/m2。
59.在一些具体实施方式中,所述盐酸拓扑替康的有效施用量为4mg/m2。
60.在一些具体实施方式中,所述抗人vegf抗体的给药频次为每2周给药1次。
61.在一些具体实施方式中,所述紫杉醇的给药频次为每周给药1次。
62.在一些具体实施方式中,所述盐酸拓扑替康的给药频次为每4周给药3次,优选为前3周每周给药1次。
63.在一些具体实施方式中,所述组合的给药周期为28天,所述抗人vegf抗体在第1天和第15天各给药1次,所述紫杉醇在第1天、第8天、第15天和第22天各给药1次,所述盐酸拓扑替康在第1天、第8天和第15天各给药1次。
64.在第四方面,本发明还提供抗人vegf抗体与化疗药物的组合,用于治疗卵巢癌,所述化疗药物选自紫杉烷类化合物或喜树碱类化合物,所述抗体包括重链可变区和轻链可变区,所述重链可变区包含hcdr1、hcdr2和hcdr3,所述轻链可变区包含lcdr1、lcdr2和lcdr3,其中:
65.所述hcdr1选自seq id no:5-7任一项所示序列;
66.所述hcdr2选自seq id no:8-10任一项所示序列;
67.所述hcdr3选自seq id no:11-12任一项所示序列;
68.所述lcdr1选自seq id no:13-14任一项所示序列;
69.所述lcdr2选自seq id no:15-16任一项所示序列;和,
70.所述lcdr3选自seq id no:17所示序列。
71.在一些具体的实施方式中,所述重链可变区具有如seq id no:1所示序列,或与seq id no:1相比具有至少95%、96%、97%、98%或99%同一性的序列;所述轻链可变区具有如seq id no:3所示的序列,或与seq id no:3相比具有至少95%、96%、97%、98%或99%同一性的序列。
72.在一些具体的实施方式中,所述抗体还包括重链恒定区,所述重链恒定区具有如seq id no:2所示序列,或与seq id no:2相比具有至少95%、96%、97%、98%或99%同一性的序列;所述抗体还包括轻链恒定区,所述轻链恒定区具有如seq id no:4所示的序列,或与seq id no:4相比具有至少95%、96%、97%、98%或99%同一性的序列。
73.在一些具体实施方式中,所述卵巢癌为上皮卵巢癌、输卵管癌或原发性腹膜癌。
74.在一些具体实施方式中,所述卵巢癌为铂耐药的复发性卵巢癌。
75.在一些具体实施方式中,所述卵巢癌的病理类型为浆液性腺癌、透明细胞腺癌或混合上皮癌。
76.在一些具体实施方式中,所述紫杉烷类化合物为紫杉醇,所述喜树碱类化合物为盐酸拓扑替康。
77.在一些具体的实施方式中,所述抗人vegf抗体的有效施用量为0.5~2mg/kg,优先为0.5mg/kg、1mg/kg、1.5mg/kg或2mg/kg。
78.在一些具体的实施方式中,所述抗人vegf抗体的剂型为单剂量剂型,每剂含有能够给予患者有效施用量的抗体量,优选地,所述单剂量剂型含有25~150mg所述抗vegf抗体,更优选为25mg、50mg、80mg、100mg或150mg。
79.在一些具体的实施方式中,所述紫杉醇的有效施用量为80mg/m2。
80.在一些具体的实施方式中,所述盐酸拓扑替康的有效施用量为4mg/m2。
81.术语定义和说明
82.除非本发明另外定义,与本发明相关的科学和技术术语应具有本领域普通技术人员所理解的含义。
83.此外,除非本文另有说明,本文单数形式的术语应包括复数形式,复数形式的术语应包括单数形式。更具体地,如在本说明书和所附权利要求中所使用的,除非另外明确指出,否则单数形式“一种”和“这种”包括复数指示物。
84.本文术语“包括”、“包含”和“具有”之间可互换使用,旨在表示方案的包含性,意味着所述方案可存在除所列出的元素之外的其他元素。同时应当理解,在本文中使用“包括”、“包含”和“具有”描述,也提供“由
……
组成”方案。
85.术语“和/或”在本文使用时,包括“和”、“或”和“由所属术语链接的要素的全部或任何其他组合”的含义。
86.本文术语“抗体”按最广义使用,是指包含来自免疫球蛋白重链可变区的足够序列和/或来自免疫球蛋白轻链可变区的足够序列,从而能够特异性结合至抗原的多肽或多肽组合。本文“抗体”涵盖各种形式和各种结构,只要它们展现出期待的抗原结合活性,示例性地,包括完整抗体以及具有结合抗原结合活性的抗体片段。本文所指“期待的抗原结合活性”是指例如抗体通常以高亲和力特异性结合抗原和实质上相同的抗原,但不以高亲和力结合不相关抗原。亲和力通常以平衡解离常数(equilibrium dissociation constant,kd)来反映,其中较低kd表示较高亲和力。示例性地,高亲和力通常指具有约10-7
m或更低、约10-8
m或更低、约1
×
10-9
m或更低、约1
×
10-10
m或更低、1
×
10-11
m或更低或1
×
10-12
m或更低的kd。kd计算方式如下:kd=kd/ka,其中kd表示解离速率,ka表示结合速率。可采用本领域周知的方法测量平衡解离常数kd,如表面等离子共振(例如biacore)或平衡透析法测定。
87.本文“抗体”包括一种典型的“四链抗体”,其属于由两条重链(hc)和两条轻链(lc)组成的免疫球蛋白;重链是指这样的多肽链,其在n端到c端的方向上由重链可变区(vh)、重链恒定区ch1结构域、铰链区(hr)、重链恒定区ch2结构域、重链恒定区ch3结构域组成;并且,当所述全长抗体为ige同种型时,任选地还包括重链恒定区ch4结构域;轻链是在n端到c端方向上由轻链可变区(vl)和轻链恒定区(cl)组成的多肽链;重链与重链之间、重链与轻链之间通过二硫键连接,形成“y”字型结构。由于免疫球蛋白重链恒定区的氨基酸组成和排列顺序不同,故其抗原性也不同。据此,可将本文“免疫球蛋白”分为五类,或称为免疫球蛋白的同种型,即igm、igd、igg、iga和ige,其相应的重链分别为μ链、δ链、γ链、α链和ε链。同一类ig根据其铰链区氨基酸组成和重链二硫键的数目和位置的差别,又可分为不同的亚类,如igg可分为igg1、igg2、igg3、igg4,iga可分为iga1和iga2。轻链通过恒定区的不同分为κ链或λ链。五类ig中每类ig都可以有κ链或λ链。
88.本文“抗体”可以来源于任何动物,包括但不限于人和非人动物,所述非人动物可选自灵长类动物、哺乳动物、啮齿动物和脊椎动物,例如骆驼科动物、大羊驼、原鸵、羊驼、
羊、兔、小鼠、大鼠或软骨鱼纲(例如鲨)。
89.本文术语“人源化抗体”是指,经基因工程改造的非人源抗体,其氨基酸序列经修饰以提高与人源抗体的序列的同源性。通常而言,人源化抗体的全部或部分cdr区来自于非人源抗体(供体抗体),全部或部分的非cdr区(例如,可变区fr和/或恒定区)来自于人源免疫球蛋白(受体抗体)。人源化抗体通常保留或部分保留了供体抗体的预期性质,包括但不限于,抗原特异性、亲和性、反应性、提高免疫细胞活性的能力、增强免疫应答的能力等。
90.本文术语“可变区”是指抗体重链或轻链中牵涉使抗体结合抗原的区域,“重链可变区”与“vh”、“hcvr”可互换使用,“轻链可变区”与“vl”、“lcvr”可互换使用。天然抗体的重链和轻链的可变域(分别是vh和vl)一般具有相似的结构,每个域包含四个保守的框架区(fr)和三个高变区(hvr)。参见例如kindt et al.,kuby immunology,6th ed.,w.h.freeman and co.,p.91(2007)。单个vh或vl域可足以赋予抗原结合特异性。
91.本文术语“互补决定区”与“cdr”可互换使用,通常指重链可变区(vh)或轻链可变区(vl)的高变区(hvr),该部位因在空间结构上可与抗原表位形成精密的互补,故又称为互补决定区,其中,重链可变区cdr可缩写为hcdr,轻链可变区cdr可缩写为lcdr。本文术语“构架区”或“fr区”可互换,是指抗体重链可变区或轻链可变区中除cdr以外的那些氨基酸残基。通常典型的抗体可变区由4个fr区和3个cdr区按以下顺序组成:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。
92.对于cdr的进一步描述,参考kabat等人,j.biol.chem.,252:6609-6616(1977);kabat等人,美国卫生与公共服务部,“sequences of proteins of immunological interest”(1991);chothia等人,j.mol.biol.196:901-917(1987);al-lazikani b.等人,j.mol.biol.,273:927-948(1997);maccallum等人,j.mol.biol.262:732-745(1996);abhinandan和martin,mol.immunol.,45:3832-3839(2008);lefranc m.p.等人,dev.comp.immunol.,27:55-77(2003);以及honegger和pl
ü
ckthun,j.mol.biol.,309:657-670(2001)。本文“cdr”可由本领域公知的方式加以标注和定义,包括但不限于kabat编号系统、chothia编号系统或imgt编号系统,使用的工具网站包括但不限于abrsa网站(http://cao.labshare.cn/abrsa/cdrs.php)、abysis网站(www.abysis.org/abysis/sequence_input/key_annotation/key_annotation.cgi)和imgt网站(http://www.imgt.org/3dstructure-db/cgi/domaingapalign.cgi#results)。
93.示例性地,seq id no:1或3所示vh或vl序列的cdr如下表所示:其中kabat和chothia使用abysis网站,imgt使用imgt网站。
94.表1抗人vegf抗体重链及轻链cdr区氨基酸序列表
[0095][0096]
本文术语“重链恒定区”是指抗体重链的羧基端部分,其不直接参与抗体与抗原的结合,但是表现出效应子功能,诸如与fc受体的相互作用,其相对于抗体的可变结构域具有更保守的氨基酸序列。“重链恒定区”至少包含:ch1结构域,铰链区,ch2结构域,ch3结构域,或其变体或片段。“重链恒定区”包括“全长重链恒定区”和“重链恒定区片段”,前者具有基本上与天然抗体恒定区基本相似的结构,而后者仅包括“全长重链恒定区的一部分”。示例性地,典型的“全长抗体重链恒定区”由ch1结构域-铰链区-ch2结构域-ch3结构域组成;当抗体为ige时,其还包括ch4结构域;当抗体为重链抗体时,则其不包括ch1结构域。示例性地,典型的“重链恒定区片段”可选自ch1、fc或ch3结构域。
[0097]
本文术语“轻链恒定区”是指抗体轻链的羧基端部分,其不直接参与抗体与抗原的结合,所述轻链恒定区可选自恒定κ结构域或恒定λ结构域。
[0098]
本文术语“fc”是指完整抗体经木瓜蛋白酶水解而成的抗体羧基端部分,典型地,其包含抗体的ch3和ch2结构域。fc区包括例如天然序列fc区、重组fc区和变体fc区。尽管免疫球蛋白重链的fc区的边界可以略微变化,但是人igg重链的fc区通常被定义为从cys226位置的氨基酸残基或从pro230延伸至其羧基末端。fc区的c末端赖氨酸(根据kabat编号系统的残基447)可以例如在抗体的产生或纯化过程中,或通过对编码抗体重链的核酸重组工程化而除去,因此,fc区可包括或不包括lys447。
[0099]
本文术语“同一性”可通过以下方式计算获得:为确定两个氨基酸序列或两个核酸序列的“同一性”百分数,将所述序列出于最佳比较目的比对(例如,可以为最佳比对而在第一和第二氨基酸序列或核酸序列之一或二者中引入空位或可以为比较目的而抛弃非同源序列)。随后比较在对应氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸。当第一序列中的位置由第二序列中对应位置处的相同氨基酸残基或核苷酸占据时,则所述分子在这个位置处是相同的。
[0100]
考虑到为最佳比对这两个序列而需要引入的空位的数目和每个空位的长度,两个序列之间的同一性百分数随所述序列共有的相同位置变化而变化。
[0101]
本文术语“药物”是指用以预防、治疗及诊断疾病的物质,包括“药物组合物”或“药物组合”,示例性地,所述药物还包括细胞治疗剂,例如治疗用car-t细胞或car-nk细胞。“药物组合物”是指这样的制剂,其以允许包含在其中的活性成分的生物学活性有效的形式存
在,并且不含有对施用所述药物组合物的受试者具有不可接受的毒性的另外的成分。本文所用的术语“组合”或“药物组合”是指非固定组合,其中活性剂和至少一种另外的活性剂可以同时或在时间间隔内单独施用,特别是在这些时间间隔允许组合配偶体显示合作(例如,协同)效应的情况下。术语“非固定组合”意指活性成分(例如,一种活性剂和至少一种另外的活性剂)均作为分开的实体同时或在没有特定时间限制的情况下顺序地施用于患者,其中这种施用提供了患者体内两种化合物的治疗有效水平。
[0102]
本文术语“治疗”是指外科手术或药物处理(surgical or therapeutic treatment),其目的是预防、减缓(减少)治疗对象中不希望的生理变化或病变,如癌症或肿瘤的进展。有益的或所希望的临床结果包括但不限于症状的减轻、疾病程度减弱、疾病状态稳定(即,未恶化)、疾病进展的延迟或减慢、疾病状态的改善或缓和、以及缓解(无论是部分缓解或完全缓解),无论是可检测的或不可检测的。需要治疗的对象包括已患有病症或疾病的对象以及易于患上病症或疾病的对象或打算预防病症或疾病的对象。当提到减缓、减轻、减弱、缓和、缓解等术语时,其含义也包括消除、消失、不发生等情况。
[0103]
本文术语“患者”或者“受试者”是指接受对如本发明所述的特定疾病或病症的治疗的生物体。“患者”或者“受试者”的实例包括接受疾病或病症治疗的哺乳动物,如人、灵长类动物(例如,猴)或非灵长类哺乳动物。
[0104]
本文术语“有效量”指单独给予或与另一治疗剂组合给予细胞、组织或对象时能有效防止或缓解疾病病症或该疾病进展的治疗剂用量。“有效量”还指足以缓解症状,例如治疗、治愈、防止或缓解相关医学病症,或治疗、治愈、防止或缓解这些病症的速度增加的化合物或具有治疗作用的细胞(例如car-t细胞,car-nk细胞)的用量。当将活性成分单独给予个体时,治疗有效剂量单指该成分。
[0105]
本文术语“癌症”指向或描述哺乳动物中典型地以不受调节的细胞生长为特征的生理状况。此定义中包括良性和恶性癌症。本文术语“肿瘤”或“瘤”是指所有赘生性(neoplastic)细胞生长和增殖,无论是恶性的还是良性的,及所有癌前(pre-cancerous)和癌性细胞和组织。术语“癌症”和“肿瘤”在本文中提到时并不互相排斥。
[0106]
本文术语“患者”或者“受试者”是指接受对如本发明所述的特定疾病或病症的治疗的生物体。“患者”或者“受试者”的实例包括接受疾病或病症治疗的哺乳动物,如人、灵长类动物(例如,猴)或非灵长类哺乳动物。
附图说明
[0107]
图1.bd0801、avastin和paclitaxel在人卵巢癌ovcar-8裸鼠移植瘤模型中抗肿瘤效果。
[0108]
图2.bd0801、avastin和paclitaxel单药及联用在人卵巢癌ovcar-8裸鼠移植瘤模型中抗肿瘤效果。
[0109]
图3.bd0801、avastin和paclitaxel单药及联用在人卵巢癌sk-ov-3裸鼠移植瘤模型中的抗肿瘤效果。
[0110]
图4.bd0801联用ptx组受试者客观缓解率(orr)。
[0111]
图5.bd0801联用ptx组/topo组卵巢癌患者客观缓解率(orr)与bd0801 auc的分层分析图。
[0112]
图6.受试者总体中位无进展生存期(pfs)图。
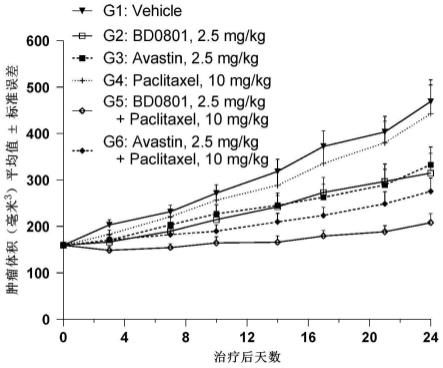
[0113]
图7.bd0801联合ptx暴露量与肿瘤最长直径之和(sld)缩小百分比的关系。
具体实施方式
[0114]
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0115]
本发明实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
[0116]
下述实施例使用的bd0801抗体由山东先声生物制药有限公司生产和提供,于2-8℃保存。bd0801抗体的序列信息如下所示。
[0117]
重链可变区(seq id no:1):
[0118]
evqlvesggglvkpggslrlscaasgfsfsnndvmcwvrqapgkglewigcimttdvvteyanwaksrftvsrdsaknsvylqmnslraedtavyfcardsvgsplmsfdlwgpgtlvtvss;
[0119]
重链恒定区(seq id no:2):
[0120]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk;
[0121]
轻链可变区(seq id no:3):
[0122]
diqmtqspsslsasvgdrvtincqasqsiynnnelswyqqkpgkppklliyrastlasgvpsrfsgsgsgtdftltisslqpedvatyycggyksysndgngfgggtkveik;
[0123]
轻链恒定区(seq id no:4):
[0124]
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec。
[0125]
实施例1 bd0801对人卵巢癌裸鼠移植瘤模型的疗效评价
[0126]
1.1实验材料和肿瘤评估方法(如无特别说明,本实施例使用1.1所述实验材料和肿瘤评估方法)
[0127]
受试药物:
[0128]
bd0801由山东先声生物制药有限公司生产和提供;
[0129]
贝伐珠单抗(avastin)购自罗氏(roche);
[0130]
紫杉醇(paclitaxel)购自北京协和。
[0131]
药物配制方法:药物皆用无菌生理盐水(购自江苏淮安双鹤药业有限责任公司)进行配制和稀释。
[0132]
ovcar-8细胞:美国国立卫生研究院(nih)。
[0133]
sk-ov-3细胞:中国科学院上海生命科学研究院(sibs)。
[0134]
试剂:rpmi1640:gibco,货号:c22400500bt;
[0135]
胎牛血清:gibco,货号:10099-141c;
[0136]
pbs:hyclone,货号:sh30256.01;
[0137]
基质胶:corning,货号:354234。
[0138]
肿瘤评估方法:
[0139]
肿瘤体积v=0.5
×a×
b2,其中a为肿瘤的长径,b为肿瘤的短径;
[0140]
相对肿瘤体积rtv=v
t
/v0,其中v0为分组时该动物的肿瘤体积;v
t
为治疗后该动物肿瘤体积。
[0141]
相对肿瘤增殖率t/c(%)=t
rtv
/c
rtv
×
100%,其中t
rtv
为治疗组平均rtv;c
rtv
为阴性对照组平均rtv。
[0142]
肿瘤生长抑制率tgi(%)=(1-t/c)
×
100%。
[0143]
1.2 bd0801对人卵巢癌ovcar-8裸鼠移植瘤模型的疗效评价-单药
[0144]
实验动物:balb/c nude小鼠,雌性,6-8周,体重18.5-25.5g,购自江苏集萃药康生物科技有限公司,生产许可证编号:scxk(苏)2018-0008,动物合格证编号:201911201。饲养环境:spf级。
[0145]
ovcar-8细胞培养在含10%胎牛血清的rpmi1640培养液中。收集指数生长期的细胞,1
×
107ovcar-8细胞重悬在1:1的pbs与基质胶中(0.1ml/只)于实验小鼠的皮下接种细胞。待肿瘤生长至平均体积158.62mm3分组给药,分组给药当天定义为第0天(d0),将小鼠随机分为8组(n=8),每组小鼠分别经尾静脉给予生理盐水(vehicle),0.8mg/kg,2.5mg/kg或7.5mg/kg测试药bd0801,0.8mg/kg,2.5mg/kg或7.5mg/kg对照药avastin,或15mg/kg阳性对照药paclitaxel。bd0801和avastin,每周给药2次,共给药约6周,paclitaxel,每四天给药1次,共给药4次。每周测2次瘤体积,称鼠重,记录数据,统计约6周内的肿瘤大小变化和小鼠体重变化。由此可见,在人卵巢癌ovcar-8裸鼠移植瘤模型中,bd0801在2.5mg/kg和7.5mg/kg可以显著抑制肿瘤生长,且抑瘤作用优于avastin。
[0146]
给药后第38天,0.8mg/kg bd0801组的肿瘤体积与vehicle对照组相比无统计学差异,2.5mg/kg和7.5mg/kg bd0801组的肿瘤体积与对照组相比,都显示了显著的抑瘤作用。0.8mg/kg,2.5mg/kg和7.5mg/kg avastin组的肿瘤体积与vehicle对照组相比没有统计学差异。在同一个剂量下,bd0801的抑瘤作用都优于avastin,且在0.8mg/kg和2.5mg/kg两个剂量下有统计学差异。不同剂量的bd0801和avastin均未看到动物体重减轻或其他明显毒性反应。15mg/kg paclitaxel也产生了显著的抑瘤作用,但药物有明显的毒性反应,8只小鼠中有2只小鼠死亡。详见表2和图1。结果表明,在人卵巢癌ovcar-8裸鼠移植瘤模型中,bd0801在2.5mg/kg和7.5mg/kg可以显著抑制肿瘤生长,且抑瘤作用优于avastin。
[0147]
表2受试物对ovcar-8异种移植瘤模型的抑瘤效果
[0148]
[0149]
注:a.显示数据为平均值
±
标准差(sd)。
[0150]
b.p值运用two-way anova进行分析相对肿瘤体积所得,所显示的p值皆为各组与溶媒对照组进行比较的数值。
[0151]
c.paclitaxel 15mg/kg组的2只荷瘤鼠分别在第5,12天发现死亡,第38天肿瘤体积及相应计算中无这两只小鼠。
[0152]
1.3 bd0801对人卵巢癌ovcar-8裸鼠移植瘤的疗效评价-联合化疗
[0153]
实验动物:balb/c nude小鼠,雌性,6-8周,体重16.2-21.5g,购自江苏集萃药康生物科技有限公司,生产许可证编号:scxk(苏)2018-0008,动物合格证编号:202002168。饲养环境:spf级。
[0154]
ovcar-8细胞培养在含10%胎牛血清的rpmi1640培养液中。收集指数生长期的细胞,1
×
107ovcar-8细胞重悬在1:1的pbs与基质胶中(0.1ml/只)于实验小鼠的皮下接种细胞。待肿瘤生长至平均体积159.42mm3分组给药,分组给药当天定义为第0天(d0),将小鼠随机分为6组(n=8),每组小鼠分别经尾静脉给予生理盐水(vehicle),2.5mg/kg测试药bd0801,2.5mg/kg对照药avastin,10mg/kg阳性对照药paclitaxel,2.5mg/kg bd0801联合10mg/kg paclitaxel,或2.5mg/kg avastin联合10mg/kg paclitaxel。bd0801和avastin,每周给药2次,共给药4周,paclitaxel,每四天给药1次,共给药4次。每周测2次瘤体积,称鼠重,记录数据,统计约4周内的肿瘤大小变化和小鼠体重变化。
[0155]
给药后第24天,2.5mg/kg bd0801或2.5mg/kg avastin都可以显著抑制肿瘤的生长,且抑瘤效果相当。2.5mg/kg avastin和10mg/kg paclitaxel联用组相对于avastin单药组未显示显著增强的抑瘤效果;而2.5mg/kg bd0801和10mg/kg paclitaxel联用相对于两个单药组都显示了显著增强的抑瘤效果,且联用组的抑瘤效果有优于avastin和paclitaxel联用组的趋势。荷瘤小鼠对bd0801在2.5mg/kg,avastin在2.5mg/kg,paclitaxel 10mg/kg剂量下单独给药,以及bd0801 2.5mg/kg联合paclitaxel 10mg/kg给药,avastin 2.5mg/kg联合paclitaxel 10mg/kg给药,治疗可以耐受。详见表3和图2。结果表明,在人卵巢癌ovcar-8裸鼠移植瘤模型中,2.5mg/kg bd0801单药治疗有显著的抑瘤作用,在和10mg/kg paclitaxel联用时相对于两个单药组都显示了显著增强的抑瘤效果,且有明显地优于同剂量avastin和paclitaxel联用组抗肿瘤药效的趋势。
[0156]
表3受试物对ovcar-8异种移植瘤模型的抑瘤效果
[0157][0158]
注:a.显示数据为平均值
±
sd。
[0159]
b.p值运用two-way anova进行分析相对肿瘤体积所得,所显示的p值皆为各组与溶媒对照组进行比较的数值。
[0160]
1.4 bd0801对人卵巢癌sk-ov-3裸鼠移植瘤的疗效评价-联合化疗
[0161]
实验动物:balb/c nude小鼠,雌性,6-8周,体重18.0-23.5g,购自江苏集萃药康生物科技有限公司,生产许可证编号:scxk(苏)2018-0008,动物合格证编号:202002168。饲养环境:spf级。
[0162]
sk-ov-3细胞培养在含10%胎牛血清(依科赛,货号:fnd500)的mccoy's 5a培养液(mccoy's 5a:gibco,货号:12330-031)中。收集指数生长期的细胞,1
×
107sk-ov-3细胞重悬在1:1的pbs与基质胶中(0.1ml/只)于实验小鼠的皮下接种细胞。待肿瘤生长至平均体积135.48mm3分组给药,分组给药当天定义为第0天(d0),将小鼠随机分为8组(n=8),每组小鼠分别经尾静脉给予生理盐水(vehicle),2.5mg/kg或7.5mg/kg测试药bd0801,2.5mg/kg或7.5mg/kg对照药avastin,10mg/kg阳性对照药paclitaxel,10mg/kg paclitaxel联合2.5mg/kg bd0801,或10mg/kg paclitaxel联合2.5mg/kg avastin。bd0801和avastin,每周给药2次,共给药4周,paclitaxel,每四天给药1次,共给药4次。每周测2次瘤体积,称鼠重,记录数据,统计约4周内的肿瘤大小变化和小鼠体重变化。
[0163]
给药后第24天,和对照组相比,所有给药组都显示了显著的抑制肿瘤生长的活性。测试药bd0801显示了非常好的剂量依赖性,而对照药avastin的剂量依赖性稍弱。bd0801的抑瘤作用在2.5mg/kg剂量下与avastin相当,而在7.5mg/kg剂量下,bd0801的抑瘤作用显著优于同剂量的avastin。2.5mg/kg avastin和10mg/kg paclitaxel联用组相对于avastin单药组未显示显著增强的抑瘤效果;而2.5mg/kg bd0801和10mg/kg paclitaxel联用相对于两个单药组都显示了显著增强的抑瘤效果。荷瘤小鼠对bd0801分别在2.5mg/kg和7.5mg/kg,avastin分别在2.5mg/kg和7.5mg/kg,paclitaxel 10mg/kg剂量下单独给药,以及bd0801 2.5mg/kg联合paclitaxel 10mg/kg给药,avastin 2.5mg/kg联合paclitaxel 10mg/kg给药,治疗可以耐受。详见表4和图3。结果表明,在人卵巢癌sk-ov-3裸鼠移植瘤模型中,bd0801和avastin治疗对sk-ov-3小鼠卵巢癌模型都有显著的抑瘤作用,bd0801显示了非常好的剂量反应关系,avastin的剂量反应关系稍弱。bd0801在高剂量7.5mg/kg时抑瘤作用显著优于同剂量的avastin,并且在2.5mg/kg和paclitaxel联用时相对于两个单药组都显著增强了抑瘤效果。
[0164]
表4受试物对sk-ov-3异种移植瘤模型的抑瘤效果
[0165][0166]
注:a.显示数据为平均值
±
sd。
[0167]
b.p值运用two-way anova进行分析相对肿瘤体积所得,所显示的p值皆为各组与溶媒对照组进行比较的数值。
[0168]
实施例2 bd0801联合化疗在卵巢癌患者中的临床试验
[0169]
研究目的
[0170]
评价bd0801单抗联合化疗治疗铂类耐药复发性上皮卵巢癌、输卵管癌和原发性腹膜癌患者的安全性及耐受性、药代动力学特征和抗肿瘤效果。
[0171]
研究设计
[0172]
采取多中心、开放、bd0801单抗剂量递增设计,联合化疗治疗铂类耐药复发性上皮卵巢癌、输卵管癌和原发性腹膜癌患者。
[0173]
试验分两部分:第一阶段为剂量递增阶段,bd0801单抗剂量递增设计为0.5mg/kg、1mg/kg、1.5mg/kg、2mg/kg,每2周给药一次,剂量递增以完成2次给药周期(两次bd0801单抗联合化疗,一般为28天,最长不超过56天)内发生的剂量限制性毒性(dlts)作为依据,期间采集血样标本用于药物浓度的测定。选择联用的化疗药物为紫杉醇(每周给药一次)或盐酸拓扑替康(每4周给药3次)。治疗结束后评价疗效,临床获益的受试者可以按原给药剂量和频率继续用药,直至疾病进展或出现不能耐受的不良反应或撤回知情同意/失访或开始新的抗肿瘤治疗。
[0174]
第二阶段为扩展入组阶段,以进一步考察本品的安全性和有效性。如果每个剂量组的前3例受试者在前2个治疗周期(第4周)结束时均未观察到dlt或前6例受试者在前2个治疗周期(第4周)结束时仅1例受试者观察到dlt,则允许继续入组至8-12例。另外,经研究者和申办方共同讨论可以选择一个特定剂量组扩展最多至40例受试者。用药方法及采血方法与该剂量组已入组受试者相同。
[0175]
剂量递增及终止标准:
[0176]
受试者个体内不进行剂量递增。组间剂量递增将以完成2个给药周期(bd0801单抗给药两次,一般为28天,最长不超过56天)剂量限制性毒性(dlt)的发生情况作为指导。采用传统“3+3”方式进行剂量递增,每个剂量组先入组1例受试者,完成1次bd0801单抗给药(d14)后,若未发生dlt,再入组2例受试者。每个剂量组至少有3例受试者完成第1和第2个周期的治疗和评估且可用于dlt评价,在无dlt发生时方可递增至下一剂量;如前3例有1例患者出现dlt,另纳入3例患者到该剂量组,如有≥2/6受试者出现dlt,剂量递增停止;如前3例有2例患者出现dlt,剂量递增停止。
[0177]
mtd(最大耐受剂量)定义为少于三分之一受试者在规定时间内发生dlt的最高剂量。mtd的判定以完成2个给药周期(bd0801单抗给药两次,一般为28天,最长不超过56天)内dlt的发生情况作为依据。
[0178]
受试者人群
[0179]
铂类耐药复发性上皮卵巢癌、输卵管癌和原发性腹膜癌患者。
[0180]
入选标准:
[0181]
1.年龄:≥18岁;
[0182]
2.组织学或细胞学证实为铂类耐药上皮卵巢癌、输卵管癌或原发性腹膜癌,类型为:非特异性腺癌(nos),透明细胞腺癌,子宫内膜腺癌,恶性布伦纳氏瘤,混合上皮癌,粘液腺癌,浆液性腺癌,移行细胞癌和未分化癌;
[0183]
3.至少有一个可测量的肿瘤病灶(根据recist 1.1);
[0184]
4.ecog ps评分0-1;
[0185]
5.受试者必须有适当的器官功能,入组前符合下列所有实验室检查结果:
[0186]
a)骨髓储备基本正常(筛选前14天内未输血及血制品,未使用g-csf及其他造血刺
激因子纠正):anc≥1.5
×
109/l,hb≥90g/l,plt≥100
×
109/l;
[0187]
b)肝功能基本正常:tbil≤1.5
×
uln,ast≤2.5
×
uln,碱性磷酸酶≤2.5
×
uln;
[0188]
c)肾功能基本正常:血肌酐≤uln或者gfr(肾小球清除率)≥60ml/min,根据cockroft-gault公式计算:男gfr=(140-age)*bw/(scr*72),女gfr=男*0.85;
[0189]
d)凝血功能基本正常:inr≤1.5(若患者接受稳定剂量的华法林以管理静脉血栓,则inr范围应在2-3之间),aptt≤1.2
×
uln;
[0190]
6.完成至少4周期含铂治疗后6个月内发生疾病进展;
[0191]
7.预计生存时间≥12周;
[0192]
8.距最近一次化疗时间至少4周,如果接受过抗肿瘤生物制品,则至少需经过4个半衰期的洗脱期;
[0193]
9.以往治疗引起的毒副反应,则需要恢复至≤1级(nci ctc4.03);
[0194]
10.受试者须在试验前对本研究知情同意,并自愿签署书面的知情同意书;
[0195]
11.受试者能够与研究者进行良好的沟通并能够依照研究规定完成研究。
[0196]
排除标准:
[0197]
1.既往接受过》2种抗肿瘤治疗方案;
[0198]
2.患者为铂类难治性疾病,难治性疾病定义为患者在既往含铂治疗期间疾病进展;
[0199]
3.恶性潜力较低的卵巢肿瘤,如交界性肿瘤;
[0200]
4.患者患有侵袭性恶性肿瘤(非黑色素皮肤癌除外)或既往恶性肿瘤治疗为当前治疗方案所禁忌;
[0201]
5.患者接受过任何盆腔或腹部放疗;
[0202]
6.患者伴有严重的未愈合的伤口、溃疡或骨折;
[0203]
7.有肠梗阻(包括闭塞性疾病)病史患者,有腹腔瘘、胃肠穿孔、腹腔脓肿病史。筛选期盆腔检查直肠乙状结肠受侵,或ct检查发现肠道受侵的患者,或者是有临床症状的肠梗阻;
[0204]
8..严重的感染需要静脉输注抗生素或住院治疗;
[0205]
9.入组前6个月内有血栓栓塞或者出血性疾病史;
[0206]
10.与肿瘤无关的cns疾病,症状性脑转移;
[0207]
11.伴有临床意义的心血管疾病:
[0208]
a)不可控制的高血压(收缩压≥150mmhg和/或舒张压≥90mmhg);
[0209]
b)入组前6个月内有心肌梗死或者不稳定性心绞痛史;
[0210]
c)充血性心力衰竭或,纽约心脏病学会(nyha)ⅱ级心衰;
[0211]
d)严重需要药物治疗的心律失常;不包括可控心率的无症状房颤;
[0212]
12.左室射血分数低于正常值下限;
[0213]
13.既往存在≥ctcae 2级的神经病变(仅限于紫杉醇+bd0801单抗组);
[0214]
14.已知对方案使用的治疗药物或辅料严重过敏;
[0215]
15.妊娠期或哺乳期女性;
[0216]
16.有蛋白尿的患者(筛选期检查中发现尿蛋白》1+,或蛋白尿为1+,24小时内复测未恢复正常);
[0217]
17.既往接受过贝伐珠单抗、bd0801单抗等抗vegf蛋白类药物治疗者;
[0218]
18.患者进行重大的手术或预计进行手术治疗:
[0219]
a)入组前28天内接受过大型外科手术或有明显的外伤;
[0220]
b)在研究过程中预计要进行大型外科手术,包括但不限于疾病进展前的腹部手术(开腹或腹腔镜手术);
[0221]
c)入组前7天内进行过开放性活检;
[0222]
19.当前或者入组前30天内接受其他研究药物的治疗。
[0223]
受试药物
[0224]
bd0801抗体由山东先声生物制药有限公司生产和提供,2-8℃保存。
[0225]
紫杉醇注射液:生产厂家:北京协和药厂。
[0226]
注射用盐酸拓扑替康:生产厂家:江苏奥赛康药业股份有限公司。
[0227]
给药方式
[0228]
bd0801单抗给药方案:特定剂量(0.5mg/kg、1mg/kg、1.5mg/kg、2mg/kg)每2周(14天)给药一次。
[0229]
紫杉醇:80mg/m2,28天给药周期中第1、8、15、22天各给药一次。按照说明书应用。
[0230]
盐酸拓扑替康:4mg/m2静脉输注,28天给药周期中第1、8、15天各给药1次。按照说明书应用。
[0231]
给药顺序:按照各自的给药周期进行给药。如果bd0801单抗与化疗药在同一天给药,先输注bd0801单抗。
[0232]
试验分组
[0233]
bd0801单抗+紫杉醇组:bd0801单抗每2周(14天)为一个给药周期,紫杉醇28天给药周期中第1、8、15、22天各给药一次,如两者同一天给药,先输注bd0801单抗。
[0234]
bd0801单抗+盐酸拓扑替康组:bd0801单抗每2周(14天)为一个给药周期,盐酸拓扑替康28天给药周期中第1、8、15天各给药1次,如两者同一天给药,先输注bd0801单抗。
[0235]
治疗持续至疾病进展或出现不能耐受的不良反应或满足其他结束治疗标准。
[0236]
研究指标及其评价标准
[0237]
安全性指标:dlt、不良事件、临床安全性实验室检查、心电图、重要体征、超声心动图等。
[0238]
疗效终点:客观缓解率(orr)、疾病控制率(dcr)、无进展生存期(pfs)及总生存期(os)。
[0239]
药代动力学指标:cmax、tmax、auc
(tau)
、accumulation ratio(ar)、c
trough
。
[0240]
统计与分析
[0241]
分析数据集:
[0242]
全分析集(fas):所有入组,且接受了研究药物,且在基线期后至少进行过一次肿瘤评估的受试者。
[0243]
安全性数据集(ss):所有入组,且接受了研究药物的受试者。dlt评估分析集:dlt评估集包括剂量递增阶段完成至少一次bd0801单抗治疗,并且完成dlt评估观察期(如自第一次用药28天)或者观察期内因dlt退出的受试者。
[0244]
pk浓度集(pkcs):所有入组,且接受了研究药物,试验期间至少有1个有效血药浓
度数据的受试者。
[0245]
pk参数分析集(pkps):所有入组,且接受了研究药物,试验期间至少有1个有效pk参数的受试者。不纳入pkps者还包括:a)因严重违背方案入选者,影响pk参数结果,或无法估测参数者;b)试验过程中出现合并用药,且对pk参数有影响者。
[0246]
安全性分析:
[0247]
根据ss/dlt评估分析集分析。确定dlt和mtd。采用描述性统计对不良事件,实验室检查指标,生命体征,心电图等进行分析。根据剂量组汇总不良事件,不良反应,重要不良事件,严重不良事件,导致停药的不良事件等的发生率。
[0248]
药代动力学分析:
[0249]
对bd0801单抗血药浓度根据剂量水平和计划时间进行描述性统计总结;而对pk参数则根据剂量水平做描述性统计分析。将对试验中测得的各受试者的血药浓度-时间数据绘制各受试者的药-时曲线及平均药-时曲线。
[0250]
免疫原性分析:
[0251]
汇总免疫原性阳性反应的频次及比率,按受试者和研究日期列表给出相应滴度值。并探讨免疫原性可能对bd0801单抗药动学和安全性的影响。
[0252]
疗效分析:
[0253]
根据全分析集(fas)计算客观缓解率(orr),疾病控制率(dcr)及其95%置信区间。对无进展生存期(pfs)和总生存期(os),采用kaplan-meier法估计生存曲线,并绘制生存曲线图。对肿瘤大小变化进行描述性统计。
[0254]
客观缓解率(orr):计算orr及其95%置信区间(clopper-pearson精确法)。
[0255]
orr=(cr+pr)/(cr+pr+sd+pd+ne)
×
100%
[0256]
同时分析确认(confirmed)和未确认(unconfirmed)的cr和pr结果。
[0257]
疾病控制率(dcr):计算dcr及其95%置信区间(clopper-pearson精确法)。
[0258]
dcr=(cr+pr+sd)/(cr+pr+sd+pd+ne)
×
100%
[0259]
同时分析确认(confirmed)和未确认(unconfirmed)结果。
[0260]
无进展生存期(pfs):自开始研究药物治疗至首次记录pd或死亡日期之间的时间,取决于哪一个首先发生;如果未观察到疾病进展,截尾日期应为接受新的抗肿瘤药物之前末次肿瘤测量的日期。采用kaplan-meier检验绘图总结pfs,分别列出删失率、四分位数及其95%ci(brookmeyer-crowley法),并估算不同时间无进展生存率其95%ci(loglog转换)。
[0261]
pfs(月)=(首次疾病进展or死亡日期or末次肿瘤测量日期
–
首次给药日期+1)/30.4375
[0262]
总生存期(os):自开始研究药物治疗至死亡日期的时间(任何原因);若未观察到死亡发生,已知最后存活日期作为截尾日期。采用kaplan-meier检验绘图总结os,分别列出删失率、四分位数及其95%ci(brookmeyer-crowley法),并估算不同时间生存率及其95%ci(loglog转换)。
[0263]
os(月)=(死亡日期or末次随访日期
–
首次给药日期+1)/30.4375
[0264]
肿瘤大小变化:对可测量肿瘤最长径总和(sld)较基线变化进行描述性统计。并将每例患者sld较筛选期减少的最大百分比做瀑布图。另外,还将列出每例患者用药后每次肿
瘤评估时sld较基线的变化。
[0265]
结果
[0266]
1.受试者人群
[0267]
共29例受试者参与本试验,并接受了至少1次研究药物的治疗。29例受试者中,平均病程约为28.19个月,大部分为上皮性卵巢癌(25例,86.2%),原发性腹膜癌和输卵管癌各2例(6.9%),病理诊断以浆液性腺癌为主(25例,86.2%),透明细胞腺癌2例(6.9%),混合上皮癌1例(3.4%),其他1例(3.4%)。详见表5。
[0268]
表5肿瘤病史
[0269][0270]
29例受试者均有靶病灶,靶病灶之和最大值为195.54mm,最小值为12mm,平均值为71.342mm。
[0271]
入组受试者既往均接受过化疗,均未接受过放疗,有1例受试者(3.4%)接受过parp抑制剂治疗,8例受试者(27.6%)接受过其他治疗。
[0272]
29例受试者中大多数(26例,89.7%)入组时ecog评分为0分,有3例受试者(10.3%)评分为1分。
[0273]
29例受试者既往均有重大手术史。
[0274]
最常见的伴随疾病为高血压(5例,17.2%)和糖尿病(5例,17.2%),最常见的伴随用药为系统用抗菌药(2例,6.9%)。
[0275]
29例受试者中共22例(75.9%)在研究治疗结束后进行了后续化疗药物抗肿瘤治疗,其中0.5mg/kg剂量组有2例,1mg/kg剂量组11例,1.5mg/kg剂量组9例。
[0276]
2.安全性
[0277]
本研究无dlt事件,mtd未达到,推荐剂量为1.5mg/kg q2w。
[0278]
截止研究结束,共29例受试者(100%)发生不良事件,各个剂量组及不同化疗方案
组间不良事件的发生频率无差异,以血液学毒性较为常见。发生率>5%的3级及以上不良事件有中性粒细胞计数降低(51.72%)、白细胞计数降低(41.38%)、血小板计数降低(17.24%)、贫血(17.24%)、γ-谷氨酰转移酶升高(10.34%)、呕吐(10.34%)、高血压(10.34%)、高甘油三酯血症(6.90%)。
[0279]
共27例受试者(93.10%)发生与bd0801单抗相关的不良事件,三个剂量组药物相关不良事件发生率相似,按照pt分类,发生率最高的药物相关不良反应为白细胞计数降低(24.14%)。
[0280]
共发生1例次导致死亡的sae,为1.5mg/kg剂量组(联合盐酸拓扑替康)发生的颅内出血,研究者认为此sae与试验药物可能无关,与联用化疗药物可能无关。共有11例受试者发生15例次治疗后sae,按照pt分类,发生率最高的sae为中性粒细胞计数降低(6.9%)。
[0281]
共26例受试者(89.66%)发生导致bd0801单抗减量或暂停的不良事件,发生率最高的为中性粒细胞计数降低(44.83%);共3例受试者(10.34%)出现用药后导致bd0801单抗永久停药的不良事件,1.5mg/kg剂量组2例,分别为血小板计数降低、蛋白尿,1.0mg/kg剂量组1例,为腹痛。
[0282]
本研究的特别关注不良事件包括:胃肠穿孔或瘘管、高血压、蛋白尿、栓塞和血栓事件、各类出血等,发生情况详见表6。按照soc分类,发生率最高的aesi为肾脏及泌尿系统疾病(11例/37.93%),其次为各类检查(9例/31.03%)、血管与淋巴管疾病(7例/24.14%)以及呼吸系统、胸及纵隔疾病(3例/10.34%)。按照pt分类,发生率最高的aesi为蛋白尿(11例/37.93%),其次为尿蛋白检出(7例/24.14%)、高血压(6例/20.69%)。
[0283]
表6用药后特别关注的不良事件分系统分析(ss)
[0284]
[0285][0286]
3级及以上不良事件分析
[0287]
共25例受试者(86.21%)发生用药后严重程度≥3级不良事件,0.5mg/kg组、1.0mg/kg组和1.5mg/kg组比例分别为100%、91.67%和78.57%。发生率≥5%的3级及以上不良事件包括中性粒细胞计数降低(51.72%)、白细胞计数降低(41.38%)、血小板计数降低(17.24%)、贫血(17.24%)、γ-谷氨酰转移酶升高(10.34%)、高血压(10.34%)、中性粒细胞百分比降低(6.90%)、呕吐(10.34%)、高甘油三酯血症(6.90%)。详见表7。
[0288]
表7用药后≥3级的不良事件分系统分析(ss)
[0289]
[0290][0291]
与bd0801单抗相关的≥3级的不良事件发生率为37.93%,其中1.5mg/kg组发生率为57.14%,稍高于1.0mg/kg组(25.0%),紫杉醇亚组稍高于盐酸拓扑替康亚组(45.45%vs33.33%)。发生率≥5%的与bd0801单抗相关的≥3级的不良事件包括白细胞计数降低(10.34%)、中性粒细胞计数降低(10.34%)、高血压(10.34%)、γ-谷氨酰转移酶升高(6.90%)、血小板计数降低(6.90%)。详见表8。无用药后≥3级的与bd0801单抗相关且与化疗不相关的不良事件。
[0292]
表8用药后≥3级的与bd0801单抗相关的不良事件分系统分析(ss)
[0293][0294]
3.药代动力学/药效学
[0295]
不同剂量bd0801单抗给药后药代动力学参数详见表9-1,表9-2和表9-3。其中,单次给药后,0.5-1.5mg/kg剂量范围内t
1/2
为56.41~93.4h,cl为0.35~0.38ml/h/kg,v为28.52~48.63ml/kg;主要暴露量参数(c
max
、auc
0-t
、auc
0-inf
)随剂量增加而增加,且呈现较好的线性关系。多次给药后,0.5-1.5mg/kg剂量范围内t
1/2
为63.5~101.97h,cl为0.35~0.49ml/h/kg,v为32.27~61.84ml/kg;主要暴露量参数(c
max
、auc
0-t
、auc
0-inf
)随剂量增加而增加,且呈现较好的线性关系。稳态下auc与首次给药auc值近似,显示多次给药后bd0801单抗无明显蓄积。
[0296][0297]
备注:*t
max
采用median(range)描述;ar,蓄积系数,ar=auc
0-t
(稳态)/auc
0-t
(首次)。
[0298]
表9-2 bd0801单抗给药后药代动力学参数(mean
±
sd)
[0299][0300]
备注:*t
max
采用median(range)描述;ar,蓄积系数,ar=auc
0-t
(稳态)/auc
0-t
(首次)。
[0301]
表9-3 bd0801单抗给药后药代动力学参数(mean
±
sd)
[0302][0303]
备注:*t
max
采用median(range)描述;ar,蓄积系数,ar=auc
0-t
(稳态)/auc
0-t
(首次)。
[0304]
免疫原性
[0305]
bd0801单抗在铂类耐药复发性上皮卵巢癌、输卵管癌和原发性腹膜癌患者研究中共有29例受试者纳入免疫原性分析。同基线水平相比,bd0801单抗给药后共有9例患者血清检测出ada(抗药抗体)阳性,ada个体阳性检出率为31.0%(9/29)。
[0306]
4.有效性
[0307]
(1)肿瘤病灶总体最佳疗效分析(确认)
[0308]
总体客观缓解率(orr)为31%,共20例受试者临床获益,临床获益率(dcr)为69.0%,共1例(3.4%)受试者总体最佳疗效为cr,为1.0mg/kg剂量组紫杉醇亚组。最佳疗效为pr的受试者共有8例(27.6%),其中0.5mg/kg剂量组1例(33.3%),1mg/kg剂量组3例(25.0%),1.5mg/kg剂量组4例(28.6%)。共11例受试者(37.9%)最佳疗效为sd,1mg/kg剂量组6例(50.0%),1.5mg/kg剂量组5例(35.7%)。各个剂量组详细的总体最佳疗效分析见表10。
[0309]
bd0801单抗联合紫杉醇亚组11例受试者中7例出现缓解,总体客观缓解率为63.6%,8例临床获益,dcr为72.7%。0.5mg/kg剂量组、1.0mg/kg剂量组、1.5mg/kg剂量组的orr分别为50.0%、66.7%、66.7%。
[0310]
bd0801单抗联合盐酸拓扑替康组18例受试者中2例出现缓解,总体客观缓解率为11.1%,12例受试者临床获益,dcr为66.7%
[0311]
。0.5mg/kg剂量组、1.0mg/kg剂量组、1.5mg/kg剂量组的orr分别为0、22.2%、0。
[0312]
表10肿瘤病灶总体最佳疗效(确认)综合分析(fas)
[0313][0314][0315]
注:最佳疗效指从治疗开始到疾病进展/复发之前所记录的最好的疗效。
[0316]
客观缓解率(orr)=n1/n,n1=cr+pr;
[0317]
临床获益率(dcr)=n2/n,n2=cr+pr+sd;
[0318]
将不能够划分为cr、pr、sd和pd的病情划分为ne(不可评估)。
[0319]
确认的:cr或pr患者必须在初次评价为cr或pr后4周重复检查以确认疗效。
[0320]
(2)肿瘤病灶总体最佳疗效综合分析(未确认)
[0321]
未确认的总体客观缓解率为37.9%,临床获益率为69.0%,共1例(3.4%)受试者总体最佳疗效为cr,为1.0mg/kg剂量组。总体最佳疗效为pr的受试者共10例(34.5%),其中0.5mg/kg剂量组1例(33.3%),1.0mg/kg剂量组3例(25.0%),1.5mg/kg剂量组6例(42.9%)。各个剂量组详细的总体最佳疗效分析见表11。
[0322]
bd0801单抗联合紫杉醇治疗亚组11例受试者中共8例出现客观缓解,orr为72.7%,其中0.5mg/kg剂量组、1.0mg/kg剂量组、1.5mg/kg剂量组orr分别为50.0%、66.7%、83.3%。共8例受试者临床获益,dcr为72.7%,0.5mg/k剂量组、1.0mg/kg剂量组、1.5mg/kg剂量组dcr分别为50.0%、66.7%、83.3%。
[0323]
bd0801单抗联合盐酸拓扑替康治疗亚组18例受试者中共3例出现客观缓解,orr为
16.7%,其中0.5mg/kg剂量组、1.0mg/kg剂量组和1.5mg/kg剂量组orr分别为0、22.2%和12.5%。共12例受试者临床获益,dcr为66.7%,0.5mg/kg剂量组、1.0mg/kg剂量组和1.5mg/kg剂量组dcr分别为0、88.9%、50.0%。
[0324]
表11肿瘤病灶总体最佳疗效(未确认)综合分析(fas)
[0325][0326][0327]
注:最佳疗效指从治疗开始到疾病进展/复发之前所记录的最好的疗效。
[0328]
客观缓解率(orr)=n1/n,n1=cr+pr;
[0329]
临床获益率(dcr)=n2/n,n2=cr+pr+sd;
[0330]
将不能够划分为cr、pr、sd和pd的病情划分为ne(不可评估)。
[0331]
未确认:未确认的cr或pr(计算时无需考虑下一次肿瘤评估确认)。
[0332]
(3)疾病无进展生存期(月)分析
[0333]
29例受试者中共27(93.1%)例受试者发生pfs事件,2例1.5mg/kg剂量组的受试者删失,均为紫杉醇亚组。中位pfs为5.4个月,0.5mg/kg组、1.0mg/kg组和1.5mg/kg组中位pfs分别为1.9个月、5.9个月和4.6个月。3个月无进展生存率为65.5%,6个月无进展生存率为40.3%,1年无进展生存率为4.0%。详细的无进展生存期分析见表12-13。
[0334]
bd0801单抗联合紫杉醇亚组11例受试者中9例(81.8%)出现pfs事件,中位pfs为
5.3个月,0.5mg/kg组、1.0mg/kg组和1.5mg/kg组中位pfs分别为5.2个月、5.3个月和5.7个月。3个月无进展生存率为72.7%,6个月无进展生存率为43.6%,1年无进展生存率为14.5%。
[0335]
bd0801单抗联合盐酸拓扑替康亚组18例受试者(100%)均发生pfs事件,中位pfs为5.5个月,0.5mg/kg组、1.0mg/kg组和1.5mg/kg组中位pfs分别为1.0个月、6.1个月和4.0个月。3个月无进展生存率为61.1%,6个月无进展生存率为38.9%,1年无进展生存率为0。
[0336]
表12疾病无进展生存期(月)分析(fas)
[0337][0338][0339]
注:95% ci采用brookmeyer-crowley法计算。
[0340]
表13不同时间(月)无进展生存率(%)(fas)
[0341]
[0342]
注:95% ci采用loglog转换计算。
[0343]
(4)总生存期(月)分析
[0344]
截止到2020年10月20日,中位随访时间为12.8个月,共随访到15例(51.7%)os事件,14例删失(存活10例,失访4例),中位os为14.9个月,0.5mg/kg剂量组mos未达到,1.0mg/kg剂量组、1.5mg/kg剂量组中位os分别为13.5个月、18.9个月。6个月总生存率为86.2%,1年总生存率为71.0%,2年总生存率为31.2%。详细的总生存期及生存率分析见表14-15。
[0345]
bd0801单抗联合紫杉醇治疗亚组11例受试者中共随访到4例(36.4%)os事件,0.5mg/kg剂量组2例受试者均未达到os,1.0mg/kg剂量组和1.5mg/kg剂量组中位os分别为14.2个月和18.9个月。0.5mg/kg剂量组、1.0mg/kg剂量组和1.5mg/kg剂量组6个月生存率分别为100%、100%和83.3%,1年总生存率分别为100%、66.7%和83.3%。
[0346]
bd0801单抗联合盐酸拓扑替康治疗组18例受试者中共11例(61.1%)发生os事件,中位os为12.8个月。0.5mg/kg剂量组、1.0mg/kg剂量组和1.5mg/kg剂量组中位os分别为3.5个月、12.8个月和15.1个月。6个月总生存率为83.3%,1年总生存率为65.7%,2年总生存率为24.6%。
[0347]
表14总生存期(月)分析(fas)
[0348][0349]
表15不同时间(月)总生存率(%)(fas)
[0350][0351][0352]
(4)暴露量与疗效关系分析
[0353]
11例患采用bd0801单抗者联用紫杉醇(ptx)化疗方案,orr为7/11(63.6%),进一步分析将11例ptx组受试者按剂量分组,对受试者最佳总体疗效的客观缓解率(orr)与给药剂量之间进行量效关系分析如图4。
[0354]
在bd0801单抗联用紫杉醇(ptx)或盐酸拓扑替康化疗方案中,将受试者的auc从低到高排序,共分3层。对受试者最佳总体疗效的orr与药物暴露量(auc)之间进行量效关系分层分析,orr与bd0801单抗暴露量呈一定的正相关性,相比之下,bd0801单抗联用盐酸拓扑替康(topo)的orr与暴露量之间无明显相关性,如图5。
[0355]
在总体人群中不同剂量下的无进展生存期(pfs)与剂量间无明显相关性,详见图6。
[0356]
bd0801单抗联合紫杉醇(ptx)暴露量与肿瘤最长直径之和(sld)缩小百分比的关系,详见图7,可见bd0801单抗的暴露量与肿瘤缩小呈正相关。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1