眼用混悬液及其制备方法与流程
1.本发明涉及眼科药物技术领域,具体而言,涉及一种眼用混悬液及其制备方法。
背景技术:
2.眼用制剂系指直接用于眼部疾病的无菌制剂。对于眼部疾病而言,局部用药可大幅度降低药物的全身吸收,减少药物的不良反应,且在眼部治疗区域达到较高浓度,从而产生更好的治疗效果,提高用药安全性。
3.眼用制剂中最常见的类型为溶液型的滴眼液。但是部分药物由于溶解性问题无法制备成溶液型,只能考虑以混悬剂、乳剂或其他类型给药。常规混悬剂药物微粒一般在0.5μm~10μm之间,对于眼用制剂而言,药物粒径太大存在用药舒适性和刺激性问题。眼用乳剂为了保持产品无菌,需采用湿热灭菌或除菌过滤等工艺进行灭菌,而这均可能导致乳滴破裂合并。
4.纳米混悬液系采用少量表面活性剂或其它载体等稳定纯药物粒子所形成的一种亚微米胶体分散体系。纳米混悬液相对于其它纳米载药系统,不仅适用于水不溶而脂溶性强的化合物,而且也适用于水油都不溶的化合物。
5.申请日为2021年11月19日的中国发明申请cn113855630a公开了一种混悬注射剂,采用先将药液高剪切搅拌再高压均质的制备方法,均质压力为5.0mpa~7.0mpa,时间为5~20分钟。该产品不进行终端灭菌,物料需进行除菌过滤并使用无菌原料药,高压均质需在无菌条件下进行,制得产品中醋酸倍他米松粒径≤20μm。大粒径的混悬液刺激性大,不适合用作眼用制剂。
6.申请日为2021年06月17日的中国发明申请cn113350280a公开了一种难溶性药物的纳米混悬液及其制备方法,将难溶性药物加至含羟丙基甲基纤维素衍生物助悬剂的水溶液中进行高压均质,均质压力为 800bar~1200bar,循环10~20圈。制得纳米混悬液中药物的浓度为 165mg/ml~185mg/ml。该专利使用特制羟丙基甲基纤维素衍生物作为助悬剂,制得混悬液浓度高,不适用于用量小、活性成分浓度低的眼用纳米晶混悬剂。
技术实现要素:
7.本发明的第一目的在于提供一种眼用混悬液,其包含i)活性成份颗粒,所述活性成份颗粒以治疗有效量存在且粒径≤1.5μm,ii)0.1w/w%~1.0w/w%助悬剂,和iii)所述活性成份颗粒难溶的水性溶剂。
8.本发明的第二目的在于提供一种如上所述的眼用混悬液的制备方法,包括:
9.a)将活性成份均匀地分散于含助悬剂的浓配液中,使得所述活性成份的浓度为0.1w/w%~5w/w%,采用微射流超高压均质工艺将浓配液中的活性成份的粒径降低至≤1.5μm;
10.b)与不含活性成份的水性载体混合。
11.此外,作为优选方案,还包括c)湿热灭菌。
12.眼用混悬液为了保持产品无菌,采用湿热灭菌是灭菌效果较好的工艺选择,然而这可能导致乳滴破裂合并。本发明所制备得到的眼用混悬液采用湿热灭菌工艺进行灭菌不影响药物粒径。
13.本发明的第三目的在于提供试剂盒,其包含容器和适于将该组合物施予至患者的眼部的分配装置;所述容器包含如上所述的眼用混悬液。
14.本发明所提供的眼用混悬液,将难溶性原料药分散于含特定的助悬剂中制备得到,其粒径≤1.5μm,对眼部刺激性小,极大改善了眼用混悬剂用药舒适性问题,且粒度均匀,重悬效果好。
具体实施方式
15.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
16.除非另有说明,用于披露本发明的所有术语(包括技术和科学术语)的意义与本发明所属领域普通技术人员所通常理解的相同。通过进一步的指导,随后的定义用于更好地理解本发明的教导。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
17.本文所使用的术语“和/或”、“或/和”、“及/或”的选择范围包括两个或两个以上相关所列项目中任一个项目,也包括相关所列项目的任意的和所有的组合,所述任意的和所有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。需要说明的是,当用至少两个选自“和/或”、“或/和”、“及/或”的连词组合连接至少三个项目时,应当理解,在本技术中,该技术方案毫无疑问地包括均用“逻辑与”连接的技术方案,还毫无疑问地包括均用“逻辑或”连接的技术方案。比如,“a及/ 或b”包括a、b和a+b三种并列方案。又比如,“a,及/或,b,及/或,c,及/或,d”的技术方案,包括a、b、c、d中任一项(也即均用“逻辑或”连接的技术方案),也包括a、b、c、d的任意的和所有的组合,也即包括a、 b、c、d中任两项或任三项的组合,还包括a、b、c、d的四项组合(也即均用“逻辑与”连接的技术方案)。
18.本发明中所使用的术语“含有”、“包含”和“包括”是同义词,其是包容性或开放式的,不排除额外的、未被引述的成员、元素或方法步骤。
19.本发明中用端点表示的数值范围包括该范围内所包含的所有数值及分数,以及所引述的端点。
20.本发明中涉及浓度数值,其含义包括在一定范围内的波动。比如,可以在相应的精度范围内波动。比如2%,可以允许
±
0.1%范围内波动。对于数值较大或无需过于精细控制的数值,还允许其含义包括更大波动。比如 100mm,可以允许
±
1%、
±
2%、
±
5%等范围内的波动。涉及分子量,允许其含义包括
±
10%的波动。
21.本发明中,涉及“多个”、“多种”等描述,如无特别限定,指在数量上指大于等于2。
22.本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
23.本发明中,“优选”、“更好”、“更佳”、“为宜”仅为描述效果更好的实施方式或实施例,应当理解,并不构成对本发明保护范围的限制。
24.如本文所采用的,“难溶”是表明所指物质在水性分散剂中是难溶的,特别优选的是“极微溶的”或“几乎不溶的”活性成分。在另一实施方式中,优选所述活性成分在室温(15℃~25℃)和近中性ph(ph6.0到ph8.0)下测定的水中溶解度小于约0.01g/100ml。
25.本发明的第一方面涉及一种眼用混悬液,其包含i)活性成份颗粒,所述活性成份颗粒以治疗有效量存在且粒径≤1.5μm,ii)0.1w/w%~1.0w/w%助悬剂,和iii)所述活性成份颗粒难溶的水性溶剂。
26.如果原料药难溶于水或者其它生物相容性溶剂体系,或者如果它是对水解不稳定的,则简单的溶液可能不适合或者不代表最佳的选择。在此情况下,药物混悬液可以通过缓慢溶解和吸收活性成分来获得延长的药理作用。本发明所提供的眼用混悬液,体系稳定性更好,且更小的粒径刺激性更小。混悬液可被定义为一种分散类型,即具有至少一种连续的(或连贯的) 相和至少一种不连续的(或内部的)分散在所述连续相内的相的体系。在混悬液中,被分散相为固态。用于实施本发明的所述混悬液是液态,至少在生理学温度是液态,这意味着所述连续相是液态。所述混悬液通常在室温也是液态。
27.被分散活性成份颗粒的粒度在1.5μm以下,这意味着大部分颗粒,例如至少约90%的颗粒具有在该范围内的尺寸。何种颗粒直径被认为是粒度将取决于粒度分布采用的方法,其进而被选择以适用于这种类型固体材料和近似粒度范围。例如,激光衍射或动态光散射法(也称为光子相关光谱法或准弹性光散射法)适用于测定在胶体中低微米范围的粒度。
28.水性溶剂即整体表现是水性(而非油性)的溶剂。其中水的含量可以为至少70w/w%,例如75w/w%、80w/w%、85w/w%、90w/w%、95w/w%、 96w/w%、97w/w%、98w/w%、99w/w%、100w/w%。水性溶剂还可以还有一些有机溶剂,可能有用的有机溶剂实例包括甘油、丙二醇、聚乙二醇、叔丁醇、乙二醇和乙醇。有机溶剂可用作增溶剂使用。水可以为注射用水。
29.治疗有效量是指用于产生所需药理作用的剂量、浓度或强度。
30.助悬剂又可称为稳定剂,适用于本发明的助悬剂优选是非离子型的,其在混悬液中的粘度范围例如1000cp~10000cp,如2000cp、3000cp、4000cp、 5000cp、6000cp、7000cp、8000cp、9000cp。较为优选的包括甲基纤维素、羟丙甲基纤维素和卡波姆中的一种或多种。
31.在一些实施方式中,眼用混悬液还包含渗透压调节剂和表面活性剂,以及任选的ph缓冲剂、螯合剂、抑菌剂中的一种或多种。
32.容易理解,本发明所提供的眼用混悬液中的各成分均是眼科上可接受的成分,优选为在水性溶剂中基本稳定的成分,优选为非离子型成分。除上述成分外,还可以根据需要包含酸、碱、抗氧化剂、稳定剂、增效剂、着色剂和(如果在特定情况中需要的,除抑菌剂之外的)防腐剂。
33.在一些实施方式中,眼用混悬液还包含0.5w/w%~2.0w/w%的渗透压调节剂和0.1w/w%~0.5w/w%表面活性剂。
34.在一些实施方式中,所述渗透压调节剂包括甘油、氯化钠和氯化钾中的一种或多种。
35.渗透压调节剂的含量可以为0.5w/w%~2.0w/w%,例如1w/w%,1.5 w/w%。
36.在一些实施方式中,所述表面活性剂为非离子型表面活性剂。
37.在一些实施方式中,所述表面活性剂包括聚山梨酯(如聚山梨酯20、聚山梨酯40、聚山梨酯60、聚山梨酯80)、泊洛沙姆、聚乙二醇-15-羟基硬脂酸酯、聚氧乙烯氢化蓖麻油(如聚氧乙烯氢化蓖麻油60、聚氧乙烯氢化蓖麻油40、聚氧乙烯蓖麻油35)和聚乙二醇-硬脂酸酯中的一种或其组合。
38.表面活性剂的含量可以为0.1w/w%~0.5w/w%,例如0.2w/w%、0.3 w/w%、0.4w/w%。
39.如本文使用的术语“ph缓冲剂”指水溶液或组合物,当酸或碱加入该溶液或组合物中时,所述水溶液或组合物抵抗ph中的变化。这种对ph变化的抗性是由于此类溶液的缓冲性质。因此,显示出缓冲活性的溶液或组合物被称为缓冲液或缓冲溶液。缓冲液一般不具有无限的维持溶液或组合物的ph的能力。相反,它们一般能够维持在特定范围内的ph,例如ph 7
–ꢀ
ph 9。一般地,缓冲液能够维持在其pka上和下一个对数内的ph(参见例如,mohan,buffers,a guide for the preparation and use of buffers in biologicalsystems,calbiochem,1999)。缓冲液和缓冲溶液一般由缓冲盐或优选非离子缓冲液组分如tris和hepes制备。可以在本发明的方法中使用的缓冲液优选选自磷酸盐缓冲液、磷酸盐缓冲盐水缓冲液(pbs)、2-氨基-2 羟甲基-1,3-丙二醇(tris)缓冲液、tris缓冲盐水溶液(tbs)和tris/edta (te),在一些优选的实施方式中,所述ph缓冲剂包括硼酸、磷酸氢二钠和磷酸二氢钠中的一种或多种。
40.ph缓冲剂的含量可以为0.1w/w%~2w/w%,例如0.2w/w%、0.3 w/w%、0.4w/w%、0.5w/w%、1w/w%、1.5w/w%。
41.螯合剂能进一步增强药物的稳定性,其可以与金属离子形成稳定的水溶性螯合物,能够防止自身的氧化,有利于提高药物在制备、存储和临床配制过程中的稳定性。在一些实施方式中,所述螯合剂包括依地酸二钠。
42.螯合剂的含量可以为0.01w/w%~0.2w/w%,例如0.05w/w%、0.1 w/w%、0.15w/w%。
43.抑菌剂可以是季铵盐类、酯类、有机汞类等,例如苯扎氯铵、苯扎溴铵、羟苯酯类等,在一些具体的实施方式中,所述抑菌剂包括苯扎氯铵。
44.抑菌剂的含量可以为0.005w/w%~0.02w/w%,例如0.01w/w%、0.015 w/w%。
45.在一些实施方式中,所述活性成份颗粒的平均粒径为100nm~1000nm,例如200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm,优选为200nm~800nm。
46.活性成份的实例包括只提及的一些潜在的候选药物:水难溶性抗细菌药物,例如氧氟沙星、环丙沙星、左氟沙星、红霉素、夫西地酸;水难溶性抗真菌药物,例如两性霉素b;水难溶性类皮质激素类,例如氟氢缩松、泼尼松龙或地塞米松;水难溶性非甾体类抗炎药物,例如布洛芬、吲哚美辛或氟比洛芬;或水难溶性抗病毒药物,例如更昔洛韦。在一些优选的实施方式中,所述活性成份颗粒是热稳定的。在具体的实施方式中,所述活性成份颗粒包括丙酸氟替卡松、曲安奈德、曲安西龙、醋酸可的松、氯替泼诺、地塞米松、环孢素、阿昔洛韦、更昔洛韦、他克莫司、氧氟沙星、环丙沙星、左氟沙星、红霉素、夫西地酸、两性霉素b、氟氢缩松、泼尼松龙、布洛芬、吲哚美辛或氟比洛芬中的一种或多种。
47.在一些实施方式中,所述活性成份颗粒的含量为0.01w/w%~1w/w%,例如0.02%w/w、0.03%w/w、0.04%w/w、0.05%w/w、0.06%w/w、0.07%w/w、 0.08%w/w、0.09%w/w、
0.1%w/w、0.2%w/w、0.3%w/w、0.4%w/w、0.5%w/w、 0.6%w/w、0.7%w/w、0.8%w/w、0.9%w/w。
48.根据本发明的再一方面,还涉及如上所述的眼用混悬液的制备方法,包括:
49.a)将活性成份均匀地分散于含助悬剂的浓配液中,使得所述活性成份的浓度为0.1w/w%~5w/w%,采用微射流超高压均质工艺将浓配液中的活性成份的粒径降低至≤1.5μm;
50.b)与不含活性成份的水性载体混合。
51.由于眼用制剂活性成分浓度低,因而本领域技术人员通常并不会想到采用微射流超高压均质工艺,其均质效果较差。本发明意外的发现,高浓度的难溶性活性成分通过微射流超高压均质后再稀释,一方面可以降低均质药液量,大大降低均质时间;另一方面高浓度均质可以增强均质过程中的有效剪切碰撞,增强均质效果。从而达到了更加的均质效果。
52.本发明提供的工艺为微射流超高压均质工艺,在增压机构的作用下,高压溶液快速的通过均质腔,物料会同时受到高速剪切,高速撞击,空穴现象以及对流撞击等机械力作用,最终达到良好的均质效果。与高压均质工艺相比,制备的药物粒径更小,更容易达到目标粒径要求,粒度也更均一。
53.含助悬剂的浓配液可使得活性成份浓度为0.1%w/w~5%w/w,因而采用微射流超高压均质工艺时具有更加的控制粒径的效果。在浓配液中,活性成份的浓度还可以为0.5%w/w、1%w/w、2%w/w、3%w/w、4%w/w。
54.在一些实施方式中,所述浓配液与所述水性载体的体积比为1:(1~50),例如1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:12、1:13、1:14、 1:15、1:20、1:25、1:30、1:40。
55.在一些实施方式中,除活性成份外,所述浓配液与所述水性载体含有相同的成分种类。
56.在一些实施方式中,除活性成份外,每种成分在所述浓配液与所述水性载体中的浓度比独立地选自1:(0.8~1.2),例如1:0.9,1:1,1:1.1。浓配液和水性载体中相应的各成分浓度相近,有助于保持制备过程中溶液体系的稳定。
57.在一些实施方式中,所述微射流超高压均质压力为1000bar~1500bar,例如1100bar、1200bar、1300bar、1400bar。
58.在一些实施方式中,所述微射流超高压均质的循环次数为20~200次,例如30、40、50、60、70、80、90、100、130、150、170。
59.在一些实施方式中,所述的眼用混悬液的制备方法还包括c)灭菌。
60.灭菌可以在高压高温下进行,例如在约0.1mpa的压力和约121℃的温度下进行。灭菌的时间可以为约15min~约45min。
61.在一些实施方式中,所述活性成份为热稳定的活性成分,所述灭菌为湿热灭菌。热稳定是指至少在湿热灭菌的温度下是稳定的,即在此温度下不发生活性的明显减少。
62.该制备方法制备的制剂可以采用湿热灭菌工艺进行灭菌不影响药物粒径,适用于热稳定性好的难溶性药物,整体工艺步骤更简化,操作更简便。
63.此外,本发明提供试剂盒,其包含容器和适于将该组合物施予至患者的眼部的分配装置;所述容器包含如上所述的眼用混悬液。
64.本发明所提供的眼用混悬液为局部给药的液体组合物,给药部位优选为a)结膜、眼睑和眼睛前部的其它结构;b)角膜;c)前室和后室及它们的相关结构;以及d)玻璃体腔。
65.在一优选实施方式中,所述分配装置适于以小于约30μl/滴的体积逐滴分配所述组合物。在进一步的实施方式中,所述分配装置适于分配分别具有小于约20μl、15μl、10μl或5μl的体积的液滴。在一些实施方式中,所述容器和所述分配装置是连接一体的。
66.下面将结合实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,优先参考本发明中给出的指引,还可以按照本领域的实验手册或常规条件,还可以参考本领域已知的其它实验方法,或者按照制造厂商所建议的条件。
67.下述的具体实施例中,涉及原料组分的量度参数,如无特别说明,可能存在称量精度范围内的细微偏差。涉及温度和时间参数,允许仪器测试精度或操作精度导致的可接受的偏差。
68.实施例1
69.1)浓配液配制
70.取250ml容器,加入适量纯化水,依次加入0.5g甲基纤维素、0.9g甘油、0.055g氯化钠、1g硼酸、0.1g依地酸二钠、0.2g聚山梨酯80和0.01g 苯扎氯铵,完全溶解后加入1g丙酸氟替卡松,搅拌润湿分散。采用匀浆机以转速11000rpm匀浆混合30min,超声脱气20min。调节溶液ph至7.0
±
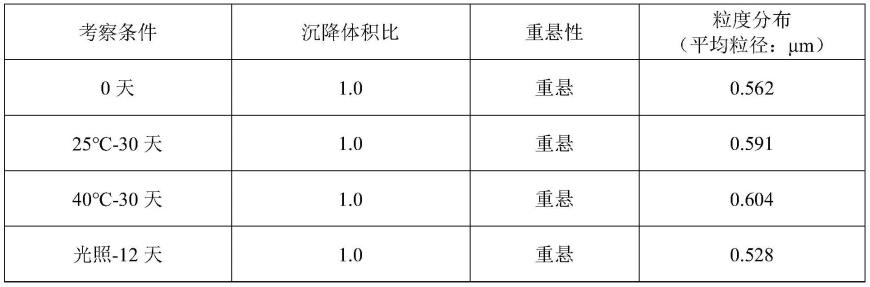
0.5,加纯化水定量至100g。
71.2)微射流超高压均质
72.采用ats ah-1500型设备进行微射流超高压均质。取适量浓配液进行微射流超高压均质处理,均质压力设定1250bar,均质70个循环。
73.3)水性载体配制
74.取一个2l容器,加入适量纯化水,依次加入5g甲基纤维素、9g甘油、 0.55g氯化钠、10g硼酸、1g依地酸二钠、2g聚山梨酯80和0.1g苯扎氯铵,完全溶解后调节溶液ph至7.0
±
0.5,加纯化水定量至1000g。
75.4)稀释灭菌
76.将微射流超高压均质后药液加入水性载体,以体积比1:9混合,搅拌均匀,121℃高压灭菌30min,冷却至室温,搅拌混合15min。
77.对微射流超高压均质后的药液和最终药液进行粒度分布检测,结果如下:
78.粒度分布微射流超高压均质后的药液最终药液d10(μm)0.3640.392d50(μm)0.6880.708d90(μm)1.0231.048平均粒径(μm)0.6990.720
79.实施例2
80.1)浓配液配制
81.取250ml容器,加入适量纯化水,依次加入0.5g羟丙甲纤维素、1g甘油、0.7g磷酸氢二钠、0.1g依地酸二钠、0.2g聚山梨酯80和0.01g苯扎氯铵,完全溶解后加入0.5g曲安奈德,搅拌润湿分散。采用匀浆机以转速10000rpm匀浆混合20min,超声脱气15min。调节溶液ph至
7.0
±
0.5,加纯化水定量至100g。
82.2)微射流超高压均质
83.采用ats ah-1500型设备进行微射流超高压均质。取适量浓配液进行微射流超高压均质处理,均质压力设定1100bar,均质80个循环。
84.3)水性载体配制
85.取一个2l容器,加入适量纯化水,依次加入5g羟丙甲纤维素、10g 甘油、7g磷酸氢二钠、1g依地酸二钠、2g聚山梨酯80和0.1g苯扎氯铵,完全溶解后调节溶液ph至7.0
±
0.5,加纯化水定量至1000g。
86.4)稀释灭菌
87.将微射流超高压均质后药液加入水性载体,以体积比1:9混合,搅拌均匀,121℃高压灭菌30min,冷却至室温,搅拌混合15min。
88.以制得的样品进行影响因素试验,考察沉降体积比、重悬性和粒度分布等检测项目的变化。试验结果显示,25℃和40℃放置30天,光照12天,沉降体积比、重悬性和粒度分布均无明显变化。
[0089][0090]
实施例3
[0091]
1)浓配液配制
[0092]
取250ml容器,加入适量纯化水,依次加入0.5g卡波姆、0.5g甘油、 0.1g氯化钾、1.2g硼酸、0.1g依地酸二钠、0.3g聚山梨酯80和0.01g苯扎氯铵,完全溶解后加入1g环孢素,搅拌润湿分散。采用匀浆机以转速 11000rpm匀浆混合30min,超声脱气15min。调节溶液ph至7.0
±
0.5,加纯化水定量至100g。
[0093]
2)微射流超高压均质
[0094]
采用ats ah-1500型设备进行微射流高压均质。取适量浓配液进行微射流超高压均质处理,均质压力设定1400bar,均质60个循环。
[0095]
3)水性载体配制
[0096]
取一个2l容器,加入适量纯化水,依次加入5g卡波姆、5g甘油、1g 氯化钾、12g硼酸、1g依地酸二钠、3g聚山梨酯80和0.1g苯扎氯铵,完全溶解后调节溶液ph至7.0
±
0.5,加纯化水定量至1000g。
[0097]
4)稀释灭菌
[0098]
将微射流超高压均质后药液加入水性载体,以体积比1:4混合,搅拌均匀,121℃高压灭菌30min,冷却至室温,搅拌混合15min。
[0099]
本实施例所制备的药液平均粒径为0.54nm。25℃和40℃放置30天,光照12天,沉降
体积比、重悬性和粒度分布均无明显变化。
[0100]
实施例4
[0101]
1)浓配液配制
[0102]
取250ml容器,加入适量纯化水,依次加入0.7g甲基纤维素、1g甘油、 0.8g磷酸二氢钠、0.1g依地酸二钠、0.2g泊洛沙姆和0.01g苯扎氯铵,完全溶解后加入2g更昔洛韦,搅拌润湿分散。采用匀浆机以转速10000rpm匀浆混合15min,超声脱气10min。调节溶液ph至7.0
±
1.0,加纯化水定量至 100g。
[0103]
2)微射流超高压均质
[0104]
采用ats ah-1500型设备进行微射流高压均质。取适量浓配液进行微射流超高压均质处理,均质压力设定1300bar,均质100个循环。
[0105]
3)水性载体配制
[0106]
取一个2l容器,加入适量纯化水,依次加入7g甲基纤维素、10g甘油、 8g磷酸二氢钠、1g依地酸二钠、2g泊洛沙姆和0.1g苯扎氯铵,完全溶解后调节溶液ph至7.0
±
0.5,加纯化水定量至1000g。
[0107]
4)稀释灭菌
[0108]
将微射流超高压均质后药液加入水性载体,以体积比1:3混合,搅拌均匀,121℃高压灭菌30min,冷却至室温,搅拌混合15min。
[0109]
本实施例所制备的药液平均粒径为0.68nm。25℃和40℃放置30天,光照12天,沉降体积比、重悬性和粒度分布均无明显变化。
[0110]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1