一种地佐辛缓释微球及其制备方法
1.本发明属于药物制剂技术领域,尤其涉及一种地佐辛缓释微球及其制备方法。
背景技术:
2.随着临床人文的不断进步,疼痛逐渐受到重视,被列为第五大生命体征。尤其是术后慢性疼痛性疾病及癌症患者,术后疼痛会延迟患者的术后康复,降低患者生活质量,有效的围手术期疼痛管理有助于加速患者康复,降低医疗成本,提高患者生活质量。目前,术后镇痛仍以纯阿片类镇痛药为主,而呼吸抑制、恶心、呕吐、过度镇静、皮肤瘙痒和尿潴留等副作用伴随而来且发生率较高,给术后镇痛患者增添了新的烦恼。
3.地佐辛(dezocine,dez)是在我国上市不久的混合型阿片类受体激动拮抗剂,是κ受体激动剂,可产生镇痛和轻度镇静作用;也是μ受体部分拮抗剂,不产生典型的μ受体依赖,故特点是成瘾性小,镇痛效果好。于2009年在中国上市以来,广泛用于全麻诱导、术后镇痛和超前镇痛,并用于治疗内脏疼痛和癌症疼痛。其2015年销售额超过30亿人民币,约为中国单品种药物销售前第5位,占据中国阿片类镇痛药物44%市场(2016年),而吗啡仅占2%。其结构式如下:
[0004][0005]
地佐辛目前主要以注射剂应用于临床,但肌肉注射给药存在许多缺点,如给药频率高以及因首过效应导致的生物利用度低等。而微球是通过将药物溶解或分散在聚合物材料中而形成的骨架型的实体,其粒径范围在1-250μm之间。一般制备成混悬剂供注射或口服用。药物微球化后具有以下特点:掩盖药物不良气味,提高药物的稳定性,减少对胃的刺激或减少药物在胃内的失活,使液态药物固态化便于贮存或再制成其他剂型,控制药物释放速率等。而且,目前市场还没出现关于地佐辛的微球制剂。
[0006]
采用现有的技术来制备地佐辛缓释微球发现:(1)在前期实施过程中,地佐辛微球在制备过程中的去除有机溶剂步骤时,极易出现“流沙”现象,表观为极细小的微粒悬浮在溶液体系中,不易沉降。(2)继续收集后发现微球包封率极低,扫描电镜结果显示微球成形性差,且药物大部分以微粒形式存在,未与聚合物形成微球。“流沙”现象产生的原因系微球制备过程中挥发去除有机溶剂时,药物随有机溶剂的扩散,一并扩散至水相中并结晶析出。现有的文献和专利表明,控制有机溶剂的挥发程度可显著提高微球的包封率结果,但在实际实施过程中,药物与药物之间存在性质差异,其他药物微球的挥发数据参考意义较小。且有机溶剂的挥发程度受到仪器、湿度、温度等多种因素的共同影响,无法加以准确控制。另外,从微观角度,利用搅拌条件制备的o/w型乳液,其乳滴的粒径分布较大,各乳滴所需的最
适挥发程度不同,即使处于相同的挥发程度下,小粒径乳滴中的药物更易扩散至水相,导致“流沙”现象形成。因此,地佐辛微球剂型的开发存在诸多困难。
技术实现要素:
[0007]
为解决上述技术问题,本发明提供了一种地佐辛缓释微球及其制备方法。
[0008]
本发明的第一个目的是提供一种地佐辛缓释微球的制备方法,包括以下步骤,
[0009]
(1)将地佐辛、含疏水链段的可降解聚合物和增溶剂溶于有机溶剂中,得到含药聚合物溶液;
[0010]
(2)通过微流控技术,将步骤(1)所述的含药聚合物溶液和稳定剂溶液混合,得到水包油型乳液;
[0011]
(3)在搅拌条件下,对步骤(2)所述的水包油型乳液进行固化,得到所述地佐辛缓释微球。
[0012]
在本发明的一个实施例中,在步骤(1)中,所述含疏水链段的可降解聚合物为聚乳酸-羟基乙酸共聚物(plga)、聚乳酸(pla)、聚乳酸-聚乙二醇(pla-peg)和聚己内酯(pcl)中的一种或多种;
[0013]
进一步地,所述plga是由丙交脂与乙交酯按照摩尔比17:3-10:10制备得到。
[0014]
进一步地,所述plga是由丙交脂与乙交酯按照摩尔比15:5-10:10制备得到。
[0015]
在本发明的一个实施例中,在步骤(1)中,所述含疏水链段的可降解聚合物的相对分子质量为5000-150000da。
[0016]
在本发明的一个实施例中,在步骤(1)中,所述有机溶剂为甲醇、二氯甲烷、乙酸乙酯、二甲基亚砜、丙酮、甲基乙基酮和四氢呋喃中的一种或多种。
[0017]
进一步地,所述有机溶剂为甲醇、二氯甲烷、乙酸乙酯、二甲基亚砜和丙酮中的一种或多种。
[0018]
在本发明的一个实施例中,在步骤(1)中,所述增溶剂为聚乙二醇15羟基硬脂酸酯、维生素e聚乙二醇琥珀酸酯、大豆磷脂、聚乙二醇400的一种或多种。
[0019]
进一步地,所述增溶剂为聚乙二醇400。
[0020]
在本发明的一个实施例中,在步骤(1)中,所述地佐辛、含疏水链段的可降解聚合物和增溶剂重量比为1:1-100:0.1-5。
[0021]
在本发明的一个实施例中,在步骤(1)中,所述含疏水链段的可降解聚合物占含药聚合物溶液总重的0.5%-20%。
[0022]
进一步地,所述含疏水链段的可降解聚合物占含药聚合物溶液总重的1%-15%。
[0023]
在本发明的一个实施例中,在步骤(2)中,所述稳定剂为聚乙烯醇(pva)、聚山梨酯20、聚山梨酯80、聚乙二醇和十二烷基硫酸钠的一种或多种;所述稳定剂和稳定剂溶液的比例为0.5%-5%(w/v)。
[0024]
进一步地,所述稳定剂为聚乙烯醇(pva);所述稳定剂溶液中稳定剂的占比为0.5%-5%(w/v)。
[0025]
在本发明的一个实施例中,在步骤(2)中,所述水包油型乳液是由平流泵将含药聚合物溶液和稳定剂溶液输送至微流控装置,经混合得到;所述平流泵的流速为2-30ml/min。
[0026]
在本发明的一个实施例中,在步骤(2)中,所述含药聚合物溶液和稳定剂溶液的体
积比为1:2-50。
[0027]
在本发明的一个实施例中,在步骤(2)中,还包括去除水包油型乳液中有机溶剂的步骤,去除有机溶剂减重占乳液总重的5-25%。
[0028]
进一步地,去除有机溶剂减重占乳液总重的10-20%。
[0029]
在本发明的一个实施例中,在步骤(3)中,所述搅拌的速率为50-1000rpm。
[0030]
在本发明的一个实施例中,在步骤(3)中,所述固化的温度为4-10℃。固化使微球更加坚硬,避免微球的收集过程中发生变形,微球形态良好。
[0031]
在本发明的一个实施例中,首先,地佐辛为疏水性药物,与含疏水链段的可降解聚合物和增溶剂共溶于有机溶剂中,可以降低药物损失,提高载药量与包封率;其次,采用微流控装置混合含药聚合物溶液和稳定剂溶液,并通过控制溶液的加入速率,控制微球的粒径;接着,通过控制水包油型乳液中有机溶剂的挥发程度,使药物稳定存在于微球内部,避免了“流沙”现象的产生,进一步提高了微球包封率。
[0032]
本发明的第二个目的是提供一种所述的方法所制备的地佐辛缓释微球,所述地佐辛缓释微球的平均粒径为30μm-90μm,载药量为20%-30%,包封率为65%-99%。
[0033]
本发明的技术方案相比现有技术具有以下优点:
[0034]
(1)本发明所述的制备方法通过控制溶液注入微流控装置的速度,从而形成粒径均一的o/w型液滴,从而显著降低乳滴之间的粒径差异;控制有机溶剂的挥发程度,能够极大地减少“流沙”现象的产生,有效提高微球的载药量及包封率。
[0035]
(2)本发明所述的制备方法在制备含药聚合物溶液过程中添加一定量的增溶剂,有两个作用:一方面,作为增溶剂,能够提高药物在有机溶剂中的溶解度;另一方面,增溶剂也可作为增稠剂,显著提高整个含药聚合物溶液的黏度,最终使制备得到的o/w乳液更加稳定,使药物存在于微球内部,而非随有机溶剂扩散至水相析出,从而减少“流沙”现象的产生,有效提高微球的载药量及包封率。
[0036]
(3)本发明所述的制备方法简单快速,制备的地佐辛缓释微球微球尺度均一、分散性好、形态圆整,可缓慢释放一周,能提供长效镇痛作用,有效提高患者顺应性。
附图说明
[0037]
为了使本发明的内容更容易被清楚地理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中:
[0038]
图1为本发明实施例2的地佐辛缓释微球的扫描电镜图。
[0039]
图2为本发明实施例6的地佐辛缓释微球的扫描电镜图。
[0040]
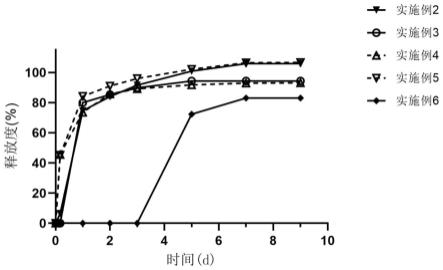
图3为本发明实施例2-6的地佐辛缓释微球的体外释放曲线图。
具体实施方式
[0041]
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
[0042]
实施例1
[0043]
一种地佐辛缓释微球及其制备方法,具体包括以下步骤:
[0044]
(1)称取plga 200mg(丙交脂与乙交酯的摩尔比=3:1,mw=90kda),溶于9ml的二
氯甲烷中。称取地佐辛100mg和聚乙二醇400 50mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中,形成油相。
[0045]
(2)将50ml的1%(w/v)的pva溶液作为水相。
[0046]
(3)将水油两相置于容器中,通过平流泵均使其按5ml/min的流速送至微流控装置中,混合形成o/w初乳。在室温下继续搅拌以挥发二氯甲烷,其中,搅拌速率为400rpm,挥发量为9.5g。
[0047]
(4)随后将上述体系加入到250ml的水中固化30min。之后收集微球,用纯化水冲洗微球,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末
[0048]
实施例2
[0049]
一种地佐辛缓释微球及其制备方法,具体包括以下步骤:
[0050]
(1)称取plga 150mg(丙交脂与乙交酯的摩尔比=3:1,mw=90kda)和plga 50mg(丙交脂与乙交酯的摩尔比=3:1,mw=28kda),溶于9ml的二氯甲烷中。称取地佐辛100mg和聚乙二醇400 50mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中,形成油相。
[0051]
(2)将50ml的1%(w/v)的pva溶液作为水相。
[0052]
(3)将水油两相置于容器中,通过平流泵均使其按5ml/min的流速送至微流控装置中,混合形成o/w初乳。在室温下继续搅拌以挥发二氯甲烷,其中,搅拌速率为400rpm,挥发量为9g。
[0053]
(4)随后将上述体系加入到250ml的水中固化30min,固化过程采用冰水浴,温度为7℃。之后收集微球,用纯化水冲洗微球,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0054]
实施例3
[0055]
一种地佐辛缓释微球及其制备方法,具体包括以下步骤:
[0056]
(1)称取plga 150mg(丙交脂与乙交酯的摩尔比=3:1,mw=90kda)和plga 50mg(丙交脂与乙交酯的摩尔比=3:1,mw=150kda),溶于9ml的二氯甲烷中。称取地佐辛100mg和聚乙二醇400 50mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中,形成油相。
[0057]
(2)将50ml的1%(w/v)的pva溶液作为水相。
[0058]
(3)将水油两相置于容器中,通过平流泵均使其按5ml/min的流速送至微流控装置中,混合形成o/w初乳。在室温下继续搅拌以挥发二氯甲烷,其中,搅拌速率为400rpm,挥发量为8g。
[0059]
(4)随后将上述体系加入到250ml的水中固化30min,固化过程采用冰水浴,温度为7℃。之后收集微球,用纯化水冲洗微球,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0060]
实施例4
[0061]
一种地佐辛缓释微球及其制备方法,具体包括以下步骤:
[0062]
(1)称取plga 200mg(丙交脂与乙交酯的摩尔比=3:1,mw=12kda,coor端),溶于4ml的二氯甲烷中。称取地佐辛100mg和聚乙二醇400 50mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中,形成油相。
[0063]
(2)将50ml的1%(w/v)的pva溶液作为水相。
[0064]
(3)将水油两相置于容器中,通过平流泵均使其按5ml/min的流速送至微流控装置中,混合形成o/w初乳。在室温下继续搅拌以挥发二氯甲烷,其中,搅拌速率为400rpm,挥发量为2g。
[0065]
(4)随后将上述体系加入到250ml的水中固化30min,固化过程采用冰水浴,温度为7℃。之后收集微球,用纯化水冲洗微球,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0066]
实施例5
[0067]
一种地佐辛缓释微球及其制备方法,具体包括以下步骤:
[0068]
(1)称取plga 200mg(丙交脂与乙交酯的摩尔比=3:1,mw=90kda,coor端),溶于4ml的二氯甲烷中。称取地佐辛100mg和聚乙二醇400 50mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中,形成油相。
[0069]
(2)将50ml的1%(w/v)的pva溶液作为水相。
[0070]
(3)将水油两相置于容器中,通过平流泵均使其按5ml/min的流速送至微流控装置中,混合形成o/w初乳。在室温下继续搅拌以挥发二氯甲烷,其中,搅拌速率为400rpm,挥发量为2g。
[0071]
(4)随后将上述体系加入到250ml的水中固化30min,固化过程采用冰水浴,温度为7℃。之后收集微球,用纯化水冲洗微球,采用布氏漏斗抽滤干燥1h,得到微球粉末。
[0072]
实施例6
[0073]
一种地佐辛缓释微球及其制备方法,具体包括以下步骤:
[0074]
(1)称取pla 200mg(mw=90kda,coor端),溶于9ml的二氯甲烷中。称取地佐辛100mg和聚乙二醇400 50mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中,形成油相。
[0075]
(2)将50ml的1%(w/v)的pva溶液作为水相。
[0076]
(3)将水油两相置于容器中,通过平流泵均使其按5ml/min的流速送至微流控装置中,混合形成o/w初乳。在室温下继续搅拌以挥发二氯甲烷,其中,搅拌速率为400rpm,挥发量为9.5g。
[0077]
(4)随后将上述体系加入到250ml的水中固化30min,固化过程采用冰水浴,温度为7℃。之后收集微球,用纯化水冲洗微球,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0078]
对比例1
[0079]
(1)称取plga 200mg(丙交脂与乙交酯的摩尔比=3:1,mw=90kda),溶于9ml的二氯甲烷中。称取地佐辛100mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中。
[0080]
(2)在搅拌状态下逐滴滴入至50ml的1%(w/v)的pva溶液中,形成o/w乳剂。在室温下继续搅拌以挥发二氯甲烷,其中,搅拌速率为400rpm,挥发量为乳剂质量的5%。
[0081]
(3)随后将上述体系加入到250ml的水中固化2h后,收集微球并用水洗涤4次,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0082]
对比例2
[0083]
(1)称取plga 200mg(丙交脂与乙交酯的摩尔比=3:1,mw=90kda),溶于9ml的二氯甲烷中。称取地佐辛100mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中。
[0084]
(2)在搅拌状态下逐滴滴入至50ml的1%(w/v)的pva溶液中,形成o/w乳剂。在室温下继续搅拌以挥发二氯甲烷,其中,搅拌速率为400rpm,挥发量为乳剂质量的10%。
[0085]
(3)随后将上述体系加入到250ml的水中固化2h后,收集微球并用水洗涤4次,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0086]
对比例3
[0087]
(1)称取plga 200mg(丙交脂与乙交酯的摩尔比=3:1,mw=90kda),溶于9ml的二氯甲烷中。称取地佐辛100mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中。
[0088]
(2)在搅拌状态下逐滴滴入至50ml的1%(w/v)的pva溶液中,形成o/w乳剂。在室温下继续搅拌以挥发二氯甲烷,其中,搅拌速率为400rpm,挥发量为乳剂质量的15%。
[0089]
(3)随后将上述体系加入到250ml的水中固化2h后,收集微球并用水洗涤4次,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0090]
对比例4
[0091]
(1)称取plga 100mg(丙交脂与乙交酯的摩尔比=3:1,mw=90kda),溶于4.5ml的二氯甲烷中。称取地佐辛50mg和聚乙二醇15羟基硬脂酸酯25mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中。
[0092]
(2)在搅拌状态下逐滴滴入至50ml的1%(w/v)的pva溶液中,形成o/w乳剂。在室温下继续搅拌以挥发二氯甲烷1h,其中,搅拌速率为400rpm。
[0093]
(3)随后将上述体系加入到125ml的水中固化30min。之后收集微球,用纯化水冲洗微球,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0094]
对比例5
[0095]
(1)称取plga 100mg(丙交脂与乙交酯的摩尔比=3:1,mw=90kda),溶于4.5ml的二氯甲烷中。称取地佐辛50mg和维生素e聚乙二醇琥珀酸酯25mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中。
[0096]
(2)在搅拌状态下逐滴滴入至50ml的1%(w/v)的pva溶液中,形成o/w乳剂。在室温下继续搅拌以挥发二氯甲烷1h,其中,搅拌速率为400rpm。
[0097]
(3)随后将上述体系加入到125ml的水中固化30min。之后收集微球,用纯化水冲洗微球,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0098]
对比例6
[0099]
(1)称取plga 100mg(丙交脂与乙交酯的摩尔比=3:1,mw=90kda),溶于4.5ml的二氯甲烷中。称取地佐辛50mg和聚乙二醇40025mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中。
[0100]
(2)在搅拌状态下逐滴滴入至50ml的1%(w/v)的pva溶液中,形成o/w乳剂。在室温下继续搅拌以挥发二氯甲烷1h,其中,搅拌速率为400rpm。
[0101]
(3)随后将上述体系加入到125ml的水中固化30min。之后收集微球,用纯化水冲洗微球,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0102]
对比例7
[0103]
(1)称取plga 150mg(丙交脂与乙交酯的摩尔比=3:1,mw=90kda)和plga 50mg(丙交脂与乙交酯的摩尔比=3:1,mw=28kda),溶于9ml的二氯甲烷中。称取地佐辛100mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中,形成油相。
[0104]
(2)将50ml的1%(w/v)的pva溶液作为水相。
[0105]
将水油两相置于容器中,通过平流泵均使其按5ml/min的流速送至微流控装置中,混合形成o/w初乳。在室温下继续搅拌以挥发二氯甲烷,其中,搅拌速率为400rpm,挥发量为9g。
[0106]
(3)随后将上述体系加入到250ml的水中固化30min,固化过程采用冰水浴,温度为7℃。之后收集微球,用纯化水冲洗微球,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0107]
对比例8
[0108]
(1)称取pla 200mg(mw=90kda,coor端),溶于9ml的二氯甲烷中。称取地佐辛100mg,溶于1ml甲醇中。将含有药物的甲醇溶液加入到plga的二氯甲烷溶液中,形成油相
[0109]
(2)将50ml的1%(w/v)的pva溶液作为水相。
[0110]
(3)将水油两相置于容器中,通过平流泵均使其按5ml/min的流速送至微流控装置中,混合形成o/w初乳。在室温下继续搅拌以挥发二氯甲烷,其中,搅拌速率为400rpm,挥发量为9.5g。
[0111]
(4)随后将上述体系加入到250ml的水中固化30min,固化过程采用冰水浴,温度为7℃。之后收集微球,用纯化水冲洗微球,混悬放入-80℃冰箱预冻8h后,冷冻干燥48h,得到微球粉末。
[0112]
测试例1微球粒径
[0113]
取实施例1-6、对比例1-8制备的微球适量,分成三份,各用适量0.1%的吐温80水溶液混悬,用激光粒度分布仪测定微球粒径,结果如表1所示。
[0114]
表1不同实施例和对比例的微球粒径
[0115]
[0116][0117]
从表1可以看出,所得的实施例1-6微球粒径(特指中位径)范围在50-80μm之间,适合注射使用。未采用微流控技术实施的对比例1-6粒径相对更大,且均一度较差,而采用微流控技术实施的对比例7-8则与实施例呈现出相似的粒径分布,表明微球制备过程中,利用平流泵将水油两相送入至微流控装置后充分混合,制备o/w乳液,能够显著降低乳滴之间的粒径差异,从而得到粒径均一的微球产品。
[0118]
测试例2微球形态
[0119]
取实施例2、6制备的微球适量,用扫描电镜测定微球形态,结果见图1-2。由图1-2可以看出,地佐辛缓释微球粒度较为均一,微球圆整,形态良好,制备的地佐辛缓释微球存在明显的蜂窝状结构。
[0120]
测试例3微球载药量与包封率
[0121]
分别称取实施例1-6、对比例1-8制备的地佐辛缓释微球20mg,加入1ml dmso,涡旋溶解,加入4ml 0.1mol/l盐酸提取药物,离心(10000rpm,10min),将上清液转移至50ml容量瓶中,重复三次后定容,摇匀,取液,hplc分析,可求得总药物量。另称取实施例1-19制备的地佐辛缓释微球20mg,加入4ml 0.0025mol/l的庚烷磺酸钠溶液,涡旋仪震荡;离心机离心,12000rpm,10min,取净上清液,进行hplc分析,即可得游离药物量,从而换算出微球包载药物量,进一步换算为微球的载药量与包封率。结果如表2所示。载药量与包封率的计算公式如下:
[0122]
[0123][0124]
表2不同实施例和对比例的载药量与包封率
[0125]
试样载药量(%)包封率(%)实施例121.6468.24实施例220.9574.22实施例320.7271.15实施例425.0683.98实施例520.0369.53实施例626.2089.87对比例14.2011.43对比例24.5413.41对比例37.7222.31对比例48.1826.36对比例58.6329.01对比例616.2948.67对比例714.4140.02对比例816.9348.90
[0126]
实施例1-6的结果显示,采用微流控装置制备初乳相较于传统搅拌的方法,制备得到的微球粒径更均一,且处方中加入了增溶剂聚乙二醇400,制备过程均未产生“流沙”现象,包封率均有明显的提升,其中,实施例的包封率最高能达到89.87%。表明通过在油相中添加聚乙二醇400、微流控技术,能够显著改善地佐辛微球制备过程中的“流沙”现象,显著提高微球包封率。
[0127]
对比例1-3的结果显示,采用传统方法,且处方中未加入聚乙二醇400的处方,仅通过控制有机溶剂的挥发程度较难有效提高微球的包封率。在制备过程中,有机溶剂的挥发程度往往受到仪器、湿度、温度等多种因素的共同影响,无法加以准确控制。另外,从微观角度,利用搅拌条件制备的o/w型乳液,其乳滴的粒径分布较大,各乳滴所需的最适挥发程度不同,即使处于相同的挥发程度下,小粒径乳滴中的药物更易扩散至水相,导致“流沙”现象形成,导致微球的包封率结果较差。
[0128]
对比例4-6的结果显示,在处方中加入不同种类的增溶剂能够提高微球的包封率。特别是对比例6中聚乙二醇400的引入,其作为增溶剂和增稠剂,有效改善了药物在有机溶剂中的溶解度和油相黏度,显著抑制了药物随有机溶剂扩散至水相的行为,减小了“流沙”现象的产生,包封率能改善到48%。但由于未采用微流控技术制备,制备过程中各对比例仍出现不同程度的“流沙”现象,导致微球包封率仍小于50%,表明微流控技术对微球的均一化控制能显著提高微球包封率。
[0129]
对比例7与实施例2对比,对比例8与实施例6对比,在处方中未添加聚乙二醇400,包封率结果小于50%,表明聚乙二醇400改善微球包封率的重要性。但对比例7-8由于采用了微流控技术制备,相较于对比例1-3,包封率还是有明显改善。
[0130]
综上,通过在油相中添加聚乙二醇400、微流控技术,能够显著改善地佐辛微球制备过程中的“流沙”现象,显著提高微球包封率。
[0131]
测试例4微球的体外释放曲线
[0132]
将6.8g磷酸氢二钾和0.79g氢氧化钠溶解于1000ml水中,加入0.2%(w/v)吐温80,得到释放介质pbs-吐温80溶液。
[0133]
称取实施例2-6制备的地佐辛缓释微球约20mg,置于50ml锥形瓶中,加入50ml的0.2%吐温80的pbs溶液(ph7.4),置于水浴恒温振荡箱中。在37℃的条件下,以100rpm的速率振荡,分别于4h、1、2、3、5、7、9天取出样品1ml离心(8000rpm,10min),取上清液进样分析。计算累积释放百分率,绘制累积释放百分率-时间的释放曲线图,剩下微球用新鲜介质重新混悬继续放样,结果如图3所示。从图3可以看出,地佐辛缓慢从微球中释放出来,释放曲线平缓,可持续释放一周。其中,实施例6采用疏水性更大的pla制备微球,导致药物释放更加缓慢。
[0134]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1