一种基于性别的肺腺癌免疫预后模型的构建方法
本发明属于生物医药领域,涉及一种基于性别的肺腺癌免疫分型方法和免疫预后模型构建方法。
背景技术:
1、肺癌是世界上最常见的恶性肿瘤,其在男性和女性中的发病率和死亡率逐年上升,给患者和社会造成了严重的负担。肺癌的发病率和死亡率最高的地区分布在北美、欧洲和东亚。根据癌细胞类型,肺癌分为小细胞肺癌(15%)和非小细胞肺癌(nsclc,75%)。nsclc的三种主要亚型是肺腺癌(luad,40%)、肺鳞状细胞癌(lusc,30%)和大细胞癌(15%)。
2、在多种癌症类型中,已经报道了癌症起始、进展、治疗反应和预后结果的性别差异。癌症的发生、发展和对治疗的反应受到癌症患者性别的影响。免疫治疗反应在很大程度上取决于肿瘤微环境(tumor micro-environment,tme),但性别如何影响某些tme特征仍不清楚。当前很多研究仅建立了某种癌症患者的预后模型,而极少有研究会基于性别建立预后模型为不同性别的病人提供有效的预后风险评估,促进不同性别的个体化治疗。
技术实现思路
1、同一物种之间,因为性别而带来的差别,被叫做性别二态性,而对于人类而言,这种区别也体现在免疫反应上。对此,本发明提供了一种基于性别的肺腺癌免疫预后模型的构建方法,以便针对不同性别的肺腺癌患者提供更有针对性的治疗方案。
2、为解决上述技术问题,本发明采用的技术方案为:
3、一种基于性别的肺腺癌免疫预后模型的构建方法,包括以下步骤:
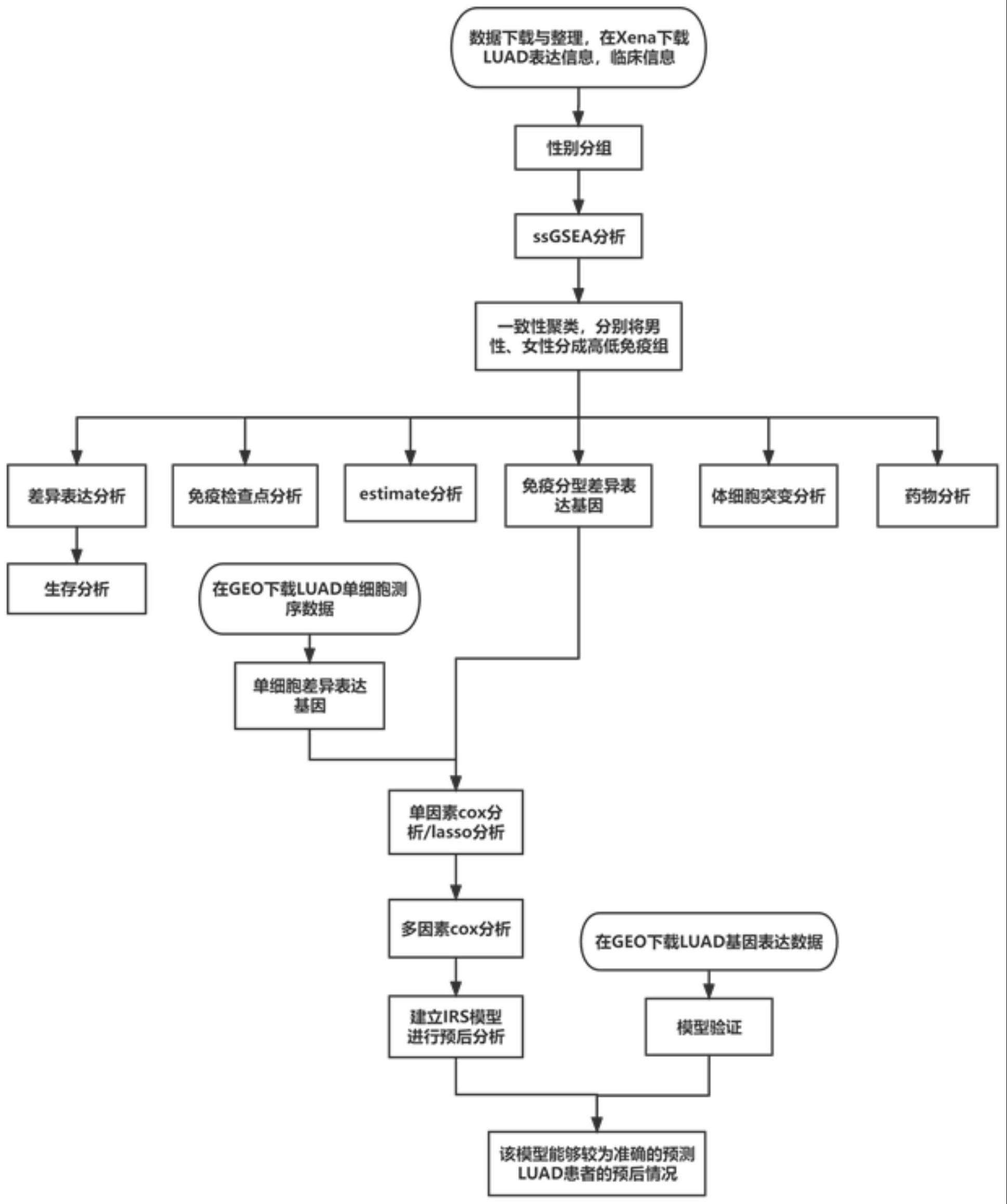
4、将肺腺癌的基因表达数据和临床数据根据性别分成男性组和女性组,分别进行单样本基因集富集分析;对得到的单样本基因集富集分析结果进行一致性聚类,将男性组和女性组分别分成高、低免疫组;将男性高、低免疫组和女性高、低免疫组分别进行差异表达分析;将得到的差异表达免疫相关基因进行生存分析,分别得到男性组和女性组与生存显著相关的基因,取交集得到既与男性又与女性生存显著相关的基因,取差集得到只与男性或者只与女性生存显著相关的基因;将男性高、低免疫组和女性高、低免疫组分别进行estimate分析、免疫检查点分析、突变分析、药物分析,并进行免疫相关预后模型构建;将差异表达免疫相关基因和单细胞测序数据分析得到的差异表达免疫相关基因取交集得到共同差异表达的免疫相关基因,对这些基因进行单因素cox回归分析,最后用逐步多因素cox回归分析建立女性免疫相关预后模型并验证;对这些基因进行最小绝对收缩算法回归分析,最后用逐步多因素cox回归分析建立男性免疫相关预后模型并验证。
5、进一步的,单样本基因集富集分析结果表示给定数据集内每个样本中基因集的绝对富集程度,用consensusclusterplus包对单样本基因集富集分析结果进行一致性聚类,重复50次,每次使用80%的样本。
6、进一步的,用r软件limma包进行差异表达分析,所述差异表达分析的阈值条件均设置为:fdr<0.05,且|log2fc|>1;fdr伪发现率,fc为差异倍数;满足阈值条件的基因为差异表达基因。
7、进一步的,所述生存分析包括:利用r软件中survival和survminer包,使用kaplan-meier法,对差异表达免疫相关基因,以logrank p<0.05作为筛选标准,得到与生存显著相关的差异表达免疫相关基因。
8、进一步的,所述estimate分析包括:使用r语言的“estimate”包推断肿瘤细胞组成和浸润,并识别与基质细胞和免疫细胞浸润相关的特异性特征。
9、进一步的,所述突变分析包括:免疫亚型突变频率排前20的基因瀑布图,免疫亚型突变频率排前20的基因相关性分析,免疫亚型的肿瘤突变负荷分析。
10、进一步的,用prrophetic包进行药物预测,分析了常见治疗肺癌的药物在男性组和女性组中的差异;所述常见治疗肺癌的药物包括vinorelbine、etoposide、gemcitabine、docetaxel、vinblastine、mitomycin c、erlotinib、gefitinib、trametinib、cisplatin和paclitaxel。
11、进一步的,对单细胞测序数据用seurat包进行差异表达分析,差异表达分析的阈值条件设置为:p_val_adj<0.05,且|avg_log2fc|>1;p_val_adj伪发现率,fc为差异倍数,满足阈值条件的基因为差异表达基因;单因素cox回归分析,以p<0.05作为筛选标准,得到与生存显著相关的关键基因;多因素cox回归分析中,计算筛选的关键基因的预后风险评分公式为:
12、
13、n表示预后关键基因的数量,expi表示该基因的表达水平,ci表示基因的估计回归系数。
14、一种用于男性肺腺癌预后评估的基因组合,包括用于检测与男性生存显著相关的基因表达水平的试剂,所述基因包括:dusp2、nkg7、rac2、lcp1、gmfg、coro1a、il7r、evi2a、aif1、hla-dpb1和il32。
15、一种用于女性肺腺癌预后评估的基因组合,包括用于检测与女性生存显著相关的基因表达水平的试剂,所述基因包括:birc3和ptprc。
16、一种基于性别的肺腺癌免疫预后模型的构建方法,包括:
17、步骤1)从ucsc xena数据库下载tcga(the cancer genome atlas)中肺腺癌的基因表达数据和临床数据。
18、步骤2)将下载的数据根据性别分成男性组和女性组,分别进行28种免疫细胞数据集的单样本基因集富集分析(single sample gene set enrichment analysis,ssgsea)。
19、步骤3)对步骤2)得到的ssgsea结果进行一致性聚类,将男性组和女性组分别分成高、低免疫组。
20、步骤4)对步骤3)得到的男性高、低免疫组和女性高、低免疫组分别进行差异表达分析。
21、步骤5)根据步骤4)得到的差异表达免疫相关基因进行生存分析,分别得到男性组和女性组与生存显著相关的基因,取交集得到既与男性又与女性生存显著相关的基因,取差集得到只与男性或者只与女性生存显著相关的基因。
22、步骤6)对步骤3)得到的男性高、低免疫组和女性高、低免疫组分别进行estimate分析。
23、步骤7)对步骤3)得到的男性高、低免疫组和女性高、低免疫组分别进行免疫检查点分析。
24、步骤8)对步骤3)得到的男性高、低免疫组和女性高、低免疫组分别进行突变分析。
25、步骤9)对步骤3)得到的男性高、低免疫组和女性高、低免疫组分别进行药物分析。
26、步骤10)对步骤3)得到的女性高、低免疫组进行免疫相关预后模型构建。将tcga数据分析得到的差异表达免疫相关基因和单细胞测序数据分析得到的差异表达免疫相关基因取交集得到共同差异表达的免疫相关基因,再对这些基因进行单因素cox回归分析,最后用逐步多因素cox回归分析建立女性免疫相关预后模型。
27、步骤11)对步骤10)得到的女性免疫相关预后模型进行验证。
28、步骤12)对步骤3)得到的男性高、低免疫组进行免疫相关预后模型构建。将tcga数据分析得到的差异表达免疫相关基因和单细胞测序数据分析得到的差异表达免疫相关基因取交集得到共同差异表达的免疫相关基因,再对这些基因进行最小绝对收缩算法(lasso)回归分析,最后用逐步多因素cox回归分析建立男性免疫相关预后模型。
29、步骤13)对步骤12)得到的男性免疫相关预后模型进行验证。
30、进一步的,步骤1)中,所述的肺腺癌基因表达数据集,是从ucsc xena数据库下载的tcga-luad的fpkm数据,每个数据集为一个数据矩阵,行名为基因名称,列名为样本名称。
31、进一步的,步骤2)中,ssgsea分数表示给定数据集内每个样本中基因集的绝对富集程度。
32、进一步的,步骤3)中,用consensusclusterplus包对ssgsea结果进行一致性聚类,重复50次,每次使用80%的样本。
33、进一步的,步骤4)中,用r软件limma包进行差异表达分析,上述差异表达分析的阈值条件均设置为:fdr<0.05,且|log2fc|>1;fdr(false discovery rate)伪发现率,fc为(fold change)差异倍数;满足阈值条件的基因为差异表达基因。
34、进一步的,步骤5)中,利用r软件中survival和survminer包,使用kaplan-meier法,对步骤4)中的得到的差异表达免疫相关基因,以logrank p<0.05作为筛选标准,得到与生存显著相关的差异表达免疫相关基因。
35、进一步的,步骤6)中,使用r语言的“estimate”包推断肿瘤细胞组成和浸润,并识别与基质细胞和免疫细胞浸润相关的特异性特征。
36、进一步的,步骤7)中,分析了8个免疫检查点基因包括:cd274(pd-l1)、ctla4、havcr2、lag3、pdcd1(pd-1)、pdcd1lg2(pd-l2)、tigit、siglec15。
37、进一步的,步骤8)中,使用tcgabiolinks包下载tcga-luad的突变数据,使用maftools包进行可视化。突变分析包括:免疫亚型突变频率排前20的基因瀑布图,免疫亚型突变频率排前20的基因相关性分析,免疫亚型的肿瘤突变负荷分析。
38、进一步的,步骤9)中,用prrophetic包进行药物预测,分析了11种常见的治疗肺癌的药物在男性组和女性组中的差异。
39、进一步的,步骤10)中,对tcga基因表达量数据用r软件limma包进行差异表达分析,差异表达分析的阈值条件设置为:fdr<0.05,且|log2fc|>1;fdr(false discoveryrate)伪发现率,fc为(fold change)差异倍数,满足阈值条件的基因为差异表达基因。对单细胞测序数据用seurat包进行差异表达分析,差异表达分析的阈值条件设置为:p_val_adj<0.05,且|avg_log2fc|>1;p_val_adj伪发现率,fc为(fold change)差异倍数,满足阈值条件的基因为差异表达基因。单因素cox回归分析,以p<0.05作为筛选标准,得到与生存显著相关的关键基因。多因素cox回归分析中,计算筛选的关键基因的预后风险评分公式为:
40、
41、n表示预后关键基因的数量,expi表示该基因的表达水平,ci表示基因的估计回归系数。
42、进一步的,步骤11)中,从ncbi geo数据库中下载gse31210数据集作为验证集去验证,步骤10)建立的女性免疫相关预后模型。
43、进一步的,步骤12)中,对tcga基因表达量数据用r软件limma包进行差异表达分析,差异表达分析的阈值条件设置为:fdr<0.05,且|log2fc|>1;fdr(false discoveryrate)伪发现率,fc为(fold change)差异倍数,满足阈值条件的基因为差异表达基因。对单细胞测序数据用seurat包进行差异表达分析,差异表达分析的阈值条件设置为:p_val_adj<0.05,且|avg_log2fc|>1;p_val_adj伪发现率,fc为(fold change)差异倍数,满足阈值条件的基因为差异表达基因。lasso回归分析,得到与生存显著相关的关键基因。多因素cox回归分析中,计算筛选的关键基因的预后风险评分公式为:
44、
45、n表示预后关键基因的数量,expi表示该基因的表达水平,ci表示基因的估计回归系数。
46、进一步的,步骤13)中,从ncbi geo数据库中下载gse50081数据集作为验证集去验证,步骤12)建立的男性免疫相关预后模型。
47、有益效果
48、肿瘤免疫治疗作为一线治疗方案之一,生物标志物的选择显得尤为重要,免疫相关基因对肺腺癌的发生和发展起了至关重要的作用。本发明将tcga-luad数据进行ssgsea分析,再进行一致性聚类分成高免疫组和低免疫组,通过高、低免疫组之间的差异表达分析得到差异表达免疫相关基因。将luad单细胞测序数据进行整理、降维聚类、注释得到免疫细胞组和非免疫细胞组,通过组间的差异表达分析得到差异表达免疫相关基因。最后将tcga-luad数据和luad单细胞测序数据得到的差异表达免疫相关基因取交集作为筛选出来的基因。
49、本发明引入了单细胞测序数据,通过免疫组间的差异表达分析来筛选基因,基于性别分别建立了男性和女性的肺腺癌免疫相关预后模型,可以促进个体化治疗,为不同性别的肺腺癌患者进行免疫治疗分别提供潜在的新靶点。
- 还没有人留言评论。精彩留言会获得点赞!