一种高精度组织内光敏剂浓度测量装置及其使用方法
1.本发明涉及一种高精度组织内光敏剂浓度测量装置及其使用方法,属于光电测量技术领域。
背景技术:
2.光动力疗法(pdt)是一种基于光化学方法,联合利用光敏剂、激发光和氧分子,通过光动力反应选择性治疗肿瘤的技术手段。光动力治疗前,光敏剂通常通过静脉或局部给药,然后使用特定波长的光对治疗部位进行照射,组织内的光敏剂受到激发,而激发态的光敏剂将能量传递给周围的氧,生成具有强氧化性的单线态氧,单线态氧和相邻的生物大分子发生氧化反应,对细胞产生一定的毒性作用,从而导致细胞受损或死亡。由光动力治疗过程可知,组织内的光敏剂浓度是决定光动力疗法治疗效果的重要因素之一。
3.目前,人们通过开发多功能纳米诊疗药物,将光敏剂的荧光检测技术与影像学方法如磁共振成像技术(mri)、正电子发射计算机断层显像技术(pet-ct)结合,来实现光敏剂在体空间分辨测量。
4.但是现有基于荧光强度法的光敏剂浓度测量存在以下问题,首先,探测器获取的荧光信号不仅来自于光敏剂,还来自组织中蛋白、脂肪等产生的自体荧光,自体荧光与光敏剂荧光光谱重叠导致无法直接利用荧光确定光敏剂浓度;其次,荧光信号强度也受几何因素的影响,比如,相对于组织表面激发和检测的距离、角度等;临床上仍然没有可用于组织中光敏剂浓度精确检测的技术和仪器,因此组织内的光敏剂高精度测量仍有较大困难。而光敏剂的精准测量可以为个性化和计量化pdt提供关键技术支持,鉴于此,本发明提出了一种双激发激光调制方法,对组织内光敏剂进行精准测量。
技术实现要素:
5.本发明为了解决现有组织内自体荧光干扰、探测和接收条件不一致导致的低浓度光敏剂精确测量难度较大的问题,提供一种高精度组织内光敏剂浓度测量装置及其使用方法。
6.本发明的技术方案:
7.本发明的目的之一是提供一种高精度组织内光敏剂浓度测量装置,该装置包括:光学探测结构和信号采集处理结构,信号采集处理结构用于采集和分析光学探测结构探测和传输的光信号。
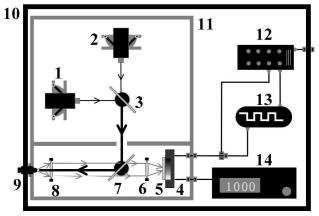
8.进一步限定,光学探测结构包括处于暗箱11中的第一激光器1、第二激光器2、第一二向色镜3、光电倍增管4、第一凸透镜6、第二二向色镜7、第二凸透镜8和光纤耦合器9,以及位于暗箱外侧与光纤耦合器9连接的光纤探头;暗箱内,光纤耦合器9、第二凸透镜8、第二二向色镜7、第一凸透镜6和光电倍增管4依次处于同一直线a上,且第二二向色镜7与光纤耦合器9出射的光束斜切;第二激光器2、第一二向色镜3与第二二向色镜7依次处于同一直线b上,直线b与直线a垂直,且第一二向色镜3与第二激光器2发出的光束斜切;第一激光器1与
第一二向色镜3处于同一直线c上,直线c与直线b垂直,且第一二向色镜3与第一激光器1发出的光束也斜切。
9.进一步限定,光纤探头为针形光纤。
10.进一步限定,使用具有孔洞的挡板将第一激光器1、第二激光器2和第一二向色镜3,与光电倍增管4、第一凸透镜6、第二二向色镜7、第二凸透镜8和光纤耦合器9分隔开。
11.进一步限定,第一激光器1和第二激光器2均安装在六维转动底座上,通过调整使第一激光器1和第二激光器2发射的光束呈90
°
夹角并照射在第一二向色镜3的同一位置。
12.进一步限定,第一激光器1为405nm激光器。
13.进一步限定,第二激光器2为450nm激光器。
14.进一步限定,第一二向色镜3和第二二向色镜7均安装在四维转动支架上,且第一二向色镜3和第二二向色镜7均为500nm长波通滤光片。
15.进一步限定,光电倍增管4前贴有630nm的带通滤光片5。
16.进一步限定,第一凸透镜6和第二凸透镜8之间距离为200mm。
17.进一步限定,信号采集处理结构包括数采卡12、锁相放大器13和高压源14,高压源14与光电倍增管4连接,光电倍增管4将光信号转化为电信号输送至锁相放大器13和数采卡12中,利用工控机对电信号进行处理,计算得到光敏剂浓度。
18.本发明的目的之二是提供一种上述高精度组织内光敏剂浓度测量装置的使用方法,该方法包括以下步骤:
19.s1,在注入光敏剂前将光纤探头插入待测组织内并固定;
20.s2,打开第一激光器1和第二激光器2,调节第二激光器2的驱动电流,使当前信号幅值为0;
21.s3,注入光敏剂得到周期性信号,信号分别进入数据采集卡12和锁相放大器13,锁相放大器13鉴别出该信号的幅值为幅值i,并对该信号求取平均值a,由公式(1)计算光学参量op;
[0022][0023]
s4,光学参量op经多次平均处理后代入公式(2)求得光敏剂浓度c;
[0024]
c=(op-b)/a (2)
[0025]
s5,更换光纤探头插入待测组织内的部位,需重复步骤1~4,获得待测组织内不同部位的光敏剂浓度。
[0026]
本发明与现有技术相比具有以下有益效果:
[0027]
(1)本发明通过对组织荧光强度的测量消除自体荧光对光敏剂荧光的干扰,并将同波长的组织荧光作为参考信号以消除探测和激发条件变化造成的测量误差。由于组织荧光最大激发波长位于450nm附近,而光敏剂在此波长范围存在极弱的吸收,因此本发明采用双波长激发形式,利用以405nm激光激发出较强的光敏剂荧光和组织自体荧光,以450nm激光仅会激发出较强的组织荧光的特点,在交替激发过程中,可用450nm激光激发出的组织荧光消除405nm激光激发出的组织荧光,并以光敏剂荧光强度和组织荧光强度的比为最终参量,建立该参量和光敏剂浓度的关系,实现激发和探测条件发生改变时,组织荧光和光敏剂荧光同步变化的目的,因而具有抗干扰能力。有效解决了现有单激发方式获得的信号是组
织荧光和光敏剂荧光的总和,无法通过荧光强度得到精确的光敏剂浓度值,并且使用光纤光谱仪探测荧光,弱激发下其荧光信号信噪差,因而不具备高精度测量能力的问题。
[0028]
(2)本发明提出的检测方法能够避免因探测和激发条件的变化引起的测量误差,且由于采集到的信号为周期性信号,能够利用锁相放大器进行微弱信号处理,从而提高测量精度,采集到的信号为周期性信号,能够利用锁相放大器进行微弱信号处理,从而提高测量精度,适用于多种光敏剂浓度检测。
附图说明
[0029]
图1为本发明提供的光敏剂浓度测量装置原理图;
[0030]
图2为本发明提供的光敏剂浓度测量装置示意图;
[0031]
图3为实施例1获得的信号曲线图;
[0032]
图4为实施例1获得的定标曲线图;
[0033]
图5为实施例1的测量不确定度;
[0034]
图6为实施例1中小鼠肿瘤区域光敏剂积累过程和浓度分布图;
[0035]
图中1-第一激光器,2-第二激光器,3-第一二向色镜,4-光电倍增管,5-630nm的带通滤光片,6-第一凸透镜,7-第二二向色镜,8-第二凸透镜,9-光纤耦合器,10-外壳,11-暗箱,12-数采卡,13-锁相放大器,14-高压源。
具体实施方式
[0036]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
[0037]
下述实施例中所使用的实验方法如无特殊说明均为常规方法。所用材料、试剂、方法和仪器,未经特殊说明,均为本领域常规材料、试剂、方法和仪器,本领域技术人员均可通过商业渠道获得。
[0038]
实施例1:
[0039]
本实施例提供的光敏剂浓度测量装置,如图1和图2所示,由用于探测和传输光信号的光学模块、用于信号采集和分析的电学模块组成,其中光学模块为光学探测结构,电学模块为信号采集处理结构,信号采集处理结构用于采集和分析光学探测结构探测和传输的光信号,光学探测结构和信号采集处理结构均置于外壳10内。
[0040]
其中,光学探测结构包括处于暗箱11中的第一激光器1、第二激光器2、第一二向色镜3、光电倍增管4、第一凸透镜6、第二二向色镜7、第二凸透镜8和光纤耦合器9,以及位于暗箱外侧与光纤耦合器9连接的光纤探头;暗箱内,光纤耦合器9、第二凸透镜8、第二二向色镜7、第一凸透镜6和光电倍增管4依次处于同一直线a上,且第二二向色镜7与光纤耦合器9出射的光束斜切;第二激光器2、第一二向色镜3与第二二向色镜7依次处于同一直线b上,直线b与直线a垂直,且第一二向色镜3与第二激光器2发出的光束斜切;第一激光器1与第一二向色镜3处于同一直线c上,直线c与直线b垂直,且第一二向色镜3与第一激光器1发出的光束也斜切,且第一激光器1为405nm激光器,第二激光器2为450nm激光器。如此设置,光学探测结构包含两个激光器,第一激光器1为405nm激光器,第二激光器2为450nm激光器,利用第一
激光器1激发出较强的光敏剂荧光和组织自体荧光,第二激光器2仅会激发出较强的组织荧光的原理,两者交替激光过程中。利用第一激光器1激发出的组织荧光消除第一激光器1激发出的组织荧光,并将同波长的组织荧光作为参考信号以消除探测和激发条件变化造成的测量误差。且光学探测结构处于独立的避光暗箱11中以避免外界光干扰。
[0041]
使用具有孔洞的挡板将第一激光器1、第二激光器2和第一二向色镜3,与光电倍增管4、第一凸透镜6、第二二向色镜7、第二凸透镜8和光纤耦合器9分隔开。第一激光器1和第二激光器2均安装在六维转动底座上,通过调整使第一激光器1和第二激光器2发射的光束呈90
°
夹角并照射在第一二向色镜3的同一位置。第一二向色镜3和第二二向色镜7均安装在四维转动支架上,且第一二向色镜3和第二二向色镜7均为500nm长波通滤光片。如此设置,激发部分和探测部分被挡光板隔离,第一二向色镜3和第二二向色镜7装在四维转动支架上便于调节光束的方向,通过调整第一激光器1和第二激光器2的角度,使两者发射的光束呈90
°
夹角并照射在第一二向色镜3的同一位置,经过第一二向色镜3耦合后的光束穿过挡光板的孔洞照射在第二二向色镜7上,光束反射并耦合进光纤耦合器9中,光纤探头探测到的荧光经耦合器后为发散光,再经第二凸透镜8准直为平行光,该平行光为长波长光束可直接穿过第二二向色镜7,进而被第一凸透镜6汇聚到光电倍增管4中,光电倍增管4前贴有630nm的带通滤光片5以阻止杂散光的进入,继而实现在光纤探头插入组织中,在传输激发光的同时收集产生的荧光,荧光最终被探测器接收,最终转化为电信号。
[0042]
信号采集处理结构包括数采卡12、锁相放大器13和高压源14,高压源14与光电倍增管4连接,光电倍增管4将光信号转化为电信号输送至锁相放大器13和数采卡12中,利用工控机对电信号进行处理,计算得到光敏剂浓度。如此设置,高压源14为光电倍增管4供电,将将光信号转化为电信号,电信号被输送至锁相放大器13和数据采集卡12,最终利用工控机对该信号进行处理,计算得到光敏剂浓度。并且两个激光器交替工作产生的周期性信号可以同时进入锁相放大器13和数据采集卡12,且锁相放大器13可对该信号的幅度进行鉴别,幅度信息同样被数据采集卡收集,此外采用直流模组为第一激光器1、第二激光器2、锁相放大器13和工控机供电,测量结果和数据处理算法均由工控机内的软件进行处理和显示。
[0043]
本实施例采用上述装置测量光敏剂浓度的方法如下:
[0044]
步骤1,利用专用夹具加持针形光纤,光纤一端插入待测组织中;
[0045]
步骤2,打开两个激光器,调节第二激光器2的驱动电流,使当前信号幅值为0,信号如图3中(a)所示,此时信号近似为直流信号;
[0046]
步骤3,向待测组织中注入光敏剂得到周期性信号,如图3中(b)所示。
[0047]
信号分别进入数据采集卡12和锁相放大器13,锁相放大器13鉴别出该信号的幅值为幅值i,并对该信号求取平均值a,由公式(1)计算光学参量op;
[0048][0049]
步骤4,光学参量op经多次平均处理后代入公式(2)求得光敏剂浓度c;
[0050]
c=(op-b)/a (2)
[0051]
步骤5,更换测量部位以及针形光纤插入深度后,需重复步骤1~4,获得待测组织内不同部位的光敏剂浓度。
[0052]
实施例2:
[0053]
利用实施例1所述的量装置和测量方法对模拟组织液中的光敏剂浓度进行测量,具体操作如下:
[0054]
步骤1,利用专用夹具加持针形光纤,光纤一端插入使用3ml比色皿承装模拟组织液中;
[0055]
步骤2,打开两个激光器,调节第二激光器2的驱动电流,使当前信号幅值为0;
[0056]
步骤3,向模拟组织液中注入光敏剂,具体的将7组不同浓度的光敏剂原卟啉
ⅸ
(ppix)加入比色皿,测试不同光敏剂浓度下的光学参量op。
[0057]
光学参量op和ppix浓度的关系曲线如图4所示,两者呈现出线性关系;且在连续测量中计算浓度值的波动,测量结果的相对测量误差如图5所示,由测量结果的标准差确定使用本发明提出的测量装置和测量方法达到的检出限是0.5ng/ml,相比于现有方法检出限100ng/ml有大幅度的降低。
[0058]
实施例3:
[0059]
利用实施例1所述的量装置和测量方法对小鼠体内肿瘤区域的hmme浓度进行测量,具体操作如下:
[0060]
小鼠首先进行皮下肿瘤生长,肿瘤生长尺寸达到10mm后进行实验。通过腹腔注射向小鼠体内注入ppix,分别测量了小鼠肿瘤内ppix的积累过程和肿瘤内不同位置的测量ppix浓度。其结果如图6所示。由图6可知,本技术提供的光敏剂浓度测量装置以及测量方法可以实现生物组织内任意位置光敏剂浓度的空间分辨测量,为医务人员提供精确光敏剂浓度值。
[0061]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1