一种化疗诱导的肿瘤蛋白抗原纳米疫苗的制备方法及其应用
1.本发明涉及纳米疫苗领域,具体涉及一种化疗诱导的肿瘤蛋白抗原纳米疫苗的制备方法及其在抗肿瘤免疫治疗中的应用。
背景技术:
2.癌症是严重威胁人类生命健康的公共卫生问题之一。世界卫生组织国际癌症研究机构最新统计数据表明,2020年全球新发癌症病例达1929万例,死亡病例996万例。2018年诺贝尔生理学或医学奖授予了肿瘤免疫治疗,此后antipd-1广泛应用到临床中并在一些肿瘤患者(如黑色素瘤患者)中表现出很好的治疗效果。然而,antipd-1的突出缺点是响应率低,只在少部分肿瘤患者中发挥较好的治疗效果。因此临床上出现了很多化疗、放疗、靶向治疗等手段与免疫治疗结合的组合治疗方案,希望达到协同治疗的效果。
3.在众多临床试验中,化疗和免疫治疗的组合治疗方案是最多的,化疗和免疫治疗的组合方案显示出极大的肿瘤治疗潜力。但是,在很多临床试验中,我们发现化疗与免疫治疗并不总是产生积极的协同作用。例如,一项发表在《自然-医学》的研究表明,多柔比星与antipd-1的联合使用,可以提高antipd-1单药的响应率,而环磷酰胺和antipd-1的联合使用的治疗效果则是相反。针对这一问题,需要从化疗的作用机制出发。化疗对免疫治疗的影响可分为两部分。第一部分是化疗对肿瘤细胞的直接作用。化疗药物直接杀死肿瘤细胞,释放肿瘤相关抗原taa和肿瘤新生抗原tsa。这些抗原是被认为是外来物质,可以诱导机理产生抗肿瘤免疫应答。这是化疗诱导的肿瘤抗原性增强的体现。同时,化疗药物诱导肿瘤细胞产生免疫应激,释放大量的损伤相关分子模式damps,这些damps可作为危险信号,激活和活化dc细胞,从而达到免疫响应增强的效果。这是化疗诱导的肿瘤抗原性的增加;第二部分是化疗表现为无差别的细胞毒性,这点是无法控制的。化疗药物可以杀死免疫抑制细胞如bmdc,treg,这些细胞对免疫系统的抗肿瘤免疫应答是有利的。但是,化疗药物也可以杀死发挥免疫应答的t细胞,dc细胞,这会使得肿瘤抗原引起的机体免疫应答大打折扣。因此,无差别的细胞毒性可能是化疗联合免疫治疗在某些临床试验中不总是发挥协同治疗效果的原因。
技术实现要素:
4.基于上述现有技术所存在的问题,本发明提供了一种化疗诱导的肿瘤蛋白抗原纳米疫苗的制备方法及其在抗肿瘤免疫治疗中的应用,致力于解决化疗和免疫治疗联合使用不能发挥协同治疗效果的问题。本发明疫苗制剂不含任何载体,是全细胞生物制剂,安全性和生物相容性更好,有利于临床转化和实现个性化治疗。
5.本发明化疗诱导的肿瘤蛋白抗原纳米疫苗的制备方法,是以化疗处理的受损肿瘤细胞、死亡肿瘤细胞以及细胞培养上清液为肿瘤抗原来源,在有机溶剂作用下,将肿瘤抗原中的有效蛋白成分(damps、taa、tsa等)制备成粒径均一的纳米疫苗。
6.所述化疗药物包括但不限于奥沙利铂、顺铂、卡铂、紫杉醇、阿霉素、环磷酰胺、洛
铂、奈达铂、依托泊苷、伊立替康、吡柔比星、尼莫司汀、卡莫司汀、洛莫司汀、异环磷酰胺、卡培他滨、甘磷酰芥、去氧氟鸟苷、多西氟鸟啶、5-氟尿嘧啶、巯嘌呤、硫鸟嘌呤、氟鸟苷、替加氟、吉西他滨、卡莫氟、羟基脲、甲氨蝶呤、优福定、安西他滨、放线菌素d、柔红霉素、表柔比星、丝裂霉素、培洛霉素、平阳霉素、吡柔比星、三尖杉酯碱、羟基喜树碱、长春瑞宾、泰索帝、拓扑替康、长春新碱、长春地辛、长春酰胺、长春碱、依托泊苷、榄香烯、阿他美坦、阿那曲唑、氨鲁米特、福美坦、甲他孕酮、他莫昔芬、抑乳癌、门冬酰胺酶、达卡巴嗪、乐沙定、可铂奥沙、米托蒽醌、丙卡巴肼、阿糖胞苷、硫鸟喋吟、多西他赛中的一种或多种的组合。
7.所述有机溶剂包括但不限于乙腈、乙醇、丙酮、环己烷、乙醛、乙酰胺、苯乙酮、丙烯醛、丙烯酸、丙烯腈、3-氯丙烯、苯胺、三氯甲苯、苄基氯、双氯甲醚、三溴甲烷、二硫化碳、四氯化碳、苯、二甲苯、甲苯、三氯乙烯、三氯甲烷、氯苯、2-氯-1,3-丁二烯、异丙基苯、硫酸二甲酯、环氧氯丙烷、丙烯酸乙酯、乙苯、1,2-二溴乙烷、乙二醇、正己烷、异佛尔酮、甲醇、二氯甲烷、硝基苯、邻二甲苯、四氯乙烯、乙醚、乙酸乙酯、乙酰乙酸乙酯、甲酸、异丁醛、甲酸甲酯、正丁醇中的一种或多种的组合。
8.本发明中的肿瘤细胞系包括但不限于鼠源或人源的细胞系ct26、4t1、llc、b16f10、mc38、att-20、b16、bend.3、beta-tc-6、c127、c6、fo、el4、9l/lacz、hepa 1-6、mltc-1、neuro-2a、l1210、okt 11、p19、p388d1、p3x63ag8、p3x63ag8.653、p815、rg2、rag、rh-35、rm-1、rpmi 1846、mltc-1、s-180、shz-88、sp2/0、sp2/0-ag14、umr-106、y1、y3-ag 1.2.3、35.1、yac-1、9l/lacz、a-375、a-673、a172、bt-549、daoy、daudi、ht-1080、huh-6、imr-32、jeko-1、mda-mb-435s、mg-63、mm.1r、mm.1s、nci-h2452[h2452]、rd、rt4、saos-2、sh-sy5y、hela、a549、sk-n-sh、sw 1353、u-118mg、u-87mg、u-937、u251、weri-rb-1、5637、769-p、786-o[786-0]、8305c、a-431、a-427、achn、aspc-1、b-cpap、c-33a、ca ski、caco-2、calu-1、calu-3、calu-6、cal-62、cfpac-1、chago-k-1、colo 205、colo 320dm、cw-2、dld-1、dms 114、du 145、es-2、fadu、gbc-sd、hcc1937、hec-1-a、hct-15、hec-1-a、hep 3b2.1-7、ht-29、hgc-27、hs 578t、huh-7、j82、jeg-3、kyse-150、li-7、lncap clone fgc、lovo、ls 174t、mcf7、mda-mb-231、me-180、miapaca-2、ms751、nccit、nih:ovcar-3、panc-1、pc-3、pc-9、siha、siha、rko、shp-77、sk-br-3、t-47d、sw-13、sw1116、sw620、t-47d、t24、t84、tccsup、te-1、tt、um-uc-3、vcap或zr-75-1。
[0009]
本发明中的肿瘤包括但不限于结直肠癌、肺癌、乳腺癌、恶性黑色素瘤、脑瘤、脑胶质瘤、头颈部肿瘤、甲状腺癌、喉癌、口腔癌乳腺癌、宫颈癌、卵巢癌、子宫内膜癌、外阴癌、食道癌、贲门癌、胃癌、肝癌、大肠癌、直肠癌、肝管癌、鳞状细胞癌、基底细胞癌、腺癌、乳头状癌、移行上皮癌、纤维肉瘤、恶性纤维组织细胞瘤、脂肪肉瘤、平滑肌肉瘤、横纹肌肉瘤、血管肉瘤、骨肉瘤、软骨肉瘤、恶性淋巴瘤、白血病、绒毛膜上皮癌、恶性葡萄胎、精原细胞瘤、生殖细胞肿瘤、眼内黑色素瘤、睪丸癌、肾癌、皮肤癌、恶性畸胎瘤、恶性间皮瘤、视网膜母细胞瘤、非霍奇金淋巴瘤、胰脏癌、阴茎癌、垂体瘤、非小细胞性肺癌、转移癌、即多发性内分泌腺瘤、成神经细胞瘤、胰腺神经内分泌肿瘤、怀孕与乳腺癌、原发性腹膜癌、卡波西肉瘤、小肠肿瘤、鼻咽癌、尿道癌等。
[0010]
本发明化疗诱导的肿瘤蛋白抗原纳米疫苗的制备方法,包括如下步骤:
[0011]
s1:将肿瘤细胞与浓度为1-300μm的化疗药物共培养1-4天(肿瘤细胞按60-200万个细胞每毫升的浓度分瓶培养),分别收集受损肿瘤细胞和细胞培养液(通过200-20000rpm
离心5-60分钟,分离受损细胞、死细胞和细胞培养上清液)。
[0012]
s2:受损肿瘤细胞和死亡肿瘤细胞经过2-10次液氮和37℃水浴冻融,通过200-20000rpm离心5-60min收集细胞裂解液并与步骤1获得的细胞培养液合并。
[0013]
s3:使用截留分子量为1-100kda的超滤杯浓缩s2合并后的混合液,无内毒素的去离子水清洗,使用bradford蛋白检测试剂盒定量,获得浓度为0.1-10mg/ml的蛋白溶液。
[0014]
s4:将有机溶剂以0.1-9ml/min的速度滴加到浓度为0.1-10mg/ml的蛋白溶液中,有机溶剂与蛋白溶液的体积比为1-20:1。
[0015]
s5:搅拌,待有机溶剂挥发后,使用截留分子量为1-100kda的超滤管超滤纳米疫苗,清洗。
[0016]
本发明化疗诱导的肿瘤蛋白抗原纳米疫苗为裸抗原簇状纳米球,其电镜照片如图2中a图所示。
[0017]
本发明化疗诱导的肿瘤蛋白抗原纳米疫苗的应用,是在肿瘤治疗的过程中作为治疗性纳米疫苗药物制剂使用。
[0018]
本发明化疗诱导的肿瘤蛋白抗原纳米疫苗的应用,是在化疗联合免疫治疗的过程中作为治疗性纳米疫苗药物制剂和免疫治疗联合使用,发挥协同治疗效果。
[0019]
本发明的有益效果体现在:
[0020]
本发明中的化疗诱导的肿瘤蛋白抗原纳米疫苗具有抗原性和佐剂性更强的蛋白组分,利用自身尺寸优势引流到淋巴结中,实现肿瘤抗原的有效递送。dc细胞熟化后,将肿瘤抗原呈递给t细胞,随后诱发机体产生抗肿瘤免疫应答。同时,给予免疫检查点抑制剂用于解救肿瘤抑制微环境中的细胞毒性t淋巴细胞。通过纳米疫苗和免疫治疗联合使用,提高免疫治疗的响应率。该纳米疫苗制备成本低,有利于临床转化和实现个性化治疗。
附图说明
[0021]
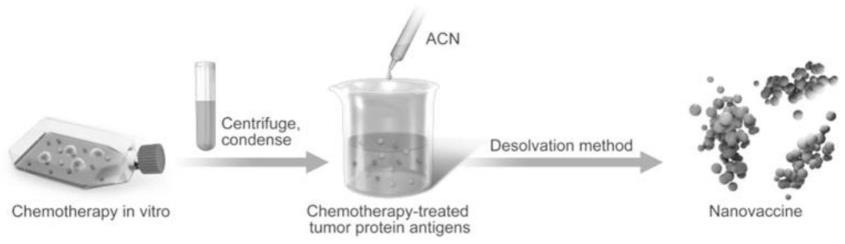
图1是实施例2化疗诱导的肿瘤蛋白抗原纳米疫苗制备的示意图。
[0022]
图2是实施例3纳米疫苗的透射电镜图(图2a)以及流体力学直径(图2b)。
[0023]
图3是实施例4顺铂和奥沙利铂处理ct26结直肠癌细胞制备的纳米疫苗的蛋白种类分析(图3a,c)和dmpas分析(图3b)。
[0024]
图4是实施例5结直肠癌模型中纳米疫苗与免疫检查点抑制剂联用的给药方案(图4a)、肿瘤生长曲线(图4b,c)以及小鼠生存曲线(图4d)。
[0025]
图5是实施例6纳米疫苗的淋巴结引流(图5a,b)、dc细胞捕获(图5c)以及诱导的dc细胞熟化(图5d)。
[0026]
图6是实施例7纳米疫苗体外再刺激脾脏细胞实验方案(图6a),流式细胞仪和elispot检测干扰素γ(图6b-e)。
[0027]
图7是实施例8纳米疫苗诱导的肿瘤t细胞浸润,流式细胞仪检测(图7a-d)和免疫组化(图7e)。
具体实施方式
[0028]
为了更好的展示本发明的优点和创新性,接下来将结合附图和具体实施例对本发明进行说明。
[0029]
本发明化疗诱导的肿瘤蛋白抗原纳米疫苗的制备方法,是以化疗药物诱导产生的肿瘤蛋白抗原,在有机溶剂作用下,自组装形成化疗诱导的肿瘤蛋白抗原纳米疫苗。
[0030]
所述化疗药物包括但不限于奥沙利铂、顺铂、卡铂、紫杉醇、阿霉素、环磷酰胺、洛铂、奈达铂、依托泊苷、伊立替康、吡柔比星、尼莫司汀、卡莫司汀、洛莫司汀、异环磷酰胺、卡培他滨、甘磷酰芥、去氧氟鸟苷、多西氟鸟啶、5-氟尿嘧啶、巯嘌呤、硫鸟嘌呤、氟鸟苷、替加氟、吉西他滨、卡莫氟、羟基脲、甲氨蝶呤、优福定、安西他滨、放线菌素d、柔红霉素、表柔比星、丝裂霉素、培洛霉素、平阳霉素、吡柔比星、三尖杉酯碱、羟基喜树碱、长春瑞宾、泰索帝、拓扑替康、长春新碱、长春地辛、长春酰胺、长春碱、依托泊苷、榄香烯、阿他美坦、阿那曲唑、氨鲁米特、福美坦、甲他孕酮、他莫昔芬、抑乳癌、门冬酰胺酶、达卡巴嗪、乐沙定、可铂奥沙、米托蒽醌、丙卡巴肼、阿糖胞苷、硫鸟喋吟、多西他赛中的一种或多种的组合。
[0031]
所述有机溶剂包括但不限于乙腈、乙醇、丙酮、环己烷、乙醛、乙酰胺、苯乙酮、丙烯醛、丙烯酸、丙烯腈、3-氯丙烯、苯胺、三氯甲苯、苄基氯、双氯甲醚、三溴甲烷、二硫化碳、四氯化碳、苯、二甲苯、甲苯、三氯乙烯、三氯甲烷、氯苯、2-氯-1,3-丁二烯、异丙基苯、硫酸二甲酯、环氧氯丙烷、丙烯酸乙酯、乙苯、1,2-二溴乙烷、乙二醇、正己烷、异佛尔酮、甲醇、二氯甲烷、硝基苯、邻二甲苯、四氯乙烯、乙醚、乙酸乙酯、乙酰乙酸乙酯、甲酸、异丁醛、甲酸甲酯、正丁醇中的一种或多种的组合。
[0032]
本发明中的肿瘤细胞系包括但不限于鼠源或人源的细胞系ct26、4t1、llc、b16f10、mc38、att-20、b16、bend.3、beta-tc-6、c127、c6、fo、el4、9l/lacz、hepa 1-6、mltc-1、neuro-2a、l1210、okt 11、p19、p388d1、p3x63ag8、p3x63ag8.653、p815、rg2、rag、rh-35、rm-1、rpmi 1846、mltc-1、s-180、shz-88、sp2/0、sp2/0-ag14、umr-106、y1、y3-ag 1.2.3、35.1、yac-1、9l/lacz、a-375、a-673、a172、bt-549、daoy、daudi、ht-1080、huh-6、imr-32、jeko-1、mda-mb-435s、mg-63、mm.1r、mm.1s、nci-h2452[h2452]、rd、rt4、saos-2、sh-sy5y、hela、a549、sk-n-sh、sw 1353、u-118mg、u-87mg、u-937、u251、weri-rb-1、5637、769-p、786-o[786-0]、8305c、a-431、a-427、achn、aspc-1、b-cpap、c-33a、ca ski、caco-2、calu-1、calu-3、calu-6、cal-62、cfpac-1、chago-k-1、colo 205、colo 320dm、cw-2、dld-1、dms 114、du 145、es-2、fadu、gbc-sd、hcc1937、hec-1-a、hct-15、hec-1-a、hep 3b2.1-7、ht-29、hgc-27、hs 578t、huh-7、j82、jeg-3、kyse-150、li-7、lncap clone fgc、lovo、ls 174t、mcf7、mda-mb-231、me-180、miapaca-2、ms751、nccit、nih:ovcar-3、panc-1、pc-3、pc-9、siha、siha、rko、shp-77、sk-br-3、t-47d、sw-13、sw1116、sw620、t-47d、t24、t84、tccsup、te-1、tt、um-uc-3、vcap或zr-75-1。
[0033]
本发明中的肿瘤包括但不限于结直肠癌,肺癌、乳腺癌、恶性黑色素瘤、脑瘤、脑胶质瘤、头颈部肿瘤、甲状腺癌、喉癌、口腔癌乳腺癌、宫颈癌、卵巢癌、子宫内膜癌、外阴癌、食道癌、贲门癌、胃癌、肝癌、大肠癌、直肠癌、肝管癌、鳞状细胞癌、基底细胞癌、腺癌、乳头状癌、移行上皮癌、纤维肉瘤、恶性纤维组织细胞瘤、脂肪肉瘤、平滑肌肉瘤、横纹肌肉瘤、血管肉瘤、骨肉瘤、软骨肉瘤、恶性淋巴瘤、白血病、绒毛膜上皮癌、恶性葡萄胎、精原细胞瘤、生殖细胞肿瘤、眼内黑色素瘤、睪丸癌、肾癌、皮肤癌、恶性畸胎瘤、恶性间皮瘤、视网膜母细胞瘤、非霍奇金淋巴瘤、胰脏癌、阴茎癌、垂体瘤、非小细胞性肺癌、转移癌、即多发性内分泌腺瘤、成神经细胞瘤、胰腺神经内分泌肿瘤、怀孕与乳腺癌、原发性腹膜癌、卡波西肉瘤、小肠肿瘤、鼻咽癌、尿道癌等。
[0034]
本发明化疗诱导的肿瘤蛋白抗原纳米疫苗的制备方法,该包括以下步骤:
[0035]
s1:肿瘤细胞按60-200万个细胞每毫升的浓度分瓶培养,将肿瘤细胞与浓度为1-300μm的化疗药物共培养1-4天。收集化疗处理的受损肿瘤细胞、死亡肿瘤细胞以及细胞培养上清液。通过200-20000rpm离心5-60分钟,分离受损细胞、死细胞和细胞培养上清液。
[0036]
s2:受损肿瘤细胞和死亡肿瘤细胞经过2-10次液氮和37℃水浴冻融,通过200-20000rpm离心5-60min收集细胞裂解液并与步骤1获得的细胞培养液合并。
[0037]
s3:使用截留分子量为1-100kda的超滤杯浓缩细胞裂解液,无内毒素的去离子水清洗。蛋白溶液定量使用bradford蛋白检测试剂盒。
[0038]
s4:有机溶剂与蛋白溶液的体积比为1-20:1,将乙腈以1-9ml/min的速度滴加到浓度为1-10mg/ml的蛋白溶液中。
[0039]
s5:搅拌,待有机溶剂挥发后,使用截留分子量为1-100kda的超滤管超滤纳米疫苗,清洗。
[0040]
本发明中的化疗诱导的肿瘤蛋白抗原纳米疫苗利用自身尺寸优势可被引流到淋巴结中,实现肿瘤抗原的有效递送。dc细胞熟化后,将肿瘤抗原呈递给t细胞,随后诱发机体产生抗肿瘤免疫应答。同时,给予免疫检查点抑制剂用于解救肿瘤抑制微环境中的细胞毒性t淋巴细胞。通过纳米疫苗和免疫治疗联合使用,提高免疫治疗的响应率。
[0041]
下面通过具体实施方式对本发明做进一步说明。本实施例提供了一类化疗诱导的肿瘤蛋白抗原纳米疫苗的制备方法仅供示范之用。实施例中使用的试剂均为市售产品,购自sigma、山东铂源药业有限公司等。
[0042]
实施例1:化疗诱导的肿瘤蛋白抗原的提取、纯化和定量
[0043]
收集与浓度为1-300μm的奥沙利铂或1-20μm的顺铂共培养的ct26结直肠癌受损细胞、死亡细胞以及细胞培养上清液。化疗处理的受损细胞和死亡细胞经过2-10次液氮和37℃水浴冻融,通过200-20000rpm离心5-60min,收集细胞裂解液并与细胞培养上清液合并。使用截留分子量为1-100kda的超滤杯浓缩,无内毒素的去离子水清洗。使用bradford蛋白检测试剂盒进行蛋白定量。
[0044]
实施例2:化疗诱导的肿瘤蛋白抗原纳米疫苗的制备
[0045]
乙腈和蛋白溶液的体积比为1-20:1,将乙腈以1-9ml/min的速度滴加到浓度为1-10mg/ml的蛋白溶液中。搅拌,待有机溶剂挥发后,使用截留分子量为1-100kda的超滤管超滤纳米疫苗(图1),无内毒素的去离子水清洗。
[0046]
实施例3:纳米疫苗的表征
[0047]
将纳米疫苗分散在去离子水中,乙酸铀负染后拍摄透射电镜(图2a)。纳米疫苗用粒度仪测量电位和流体力学直径(图2b)。
[0048]
实施例4:顺铂和奥沙利铂处理ct26结直肠癌细胞制备的纳米疫苗的蛋白组学分析
[0049]
收集蛋白质并进行质谱分析,包括还原、烷基化和胰蛋白酶消化。为了鉴定新抗原,构建了包括突变位点上下游1-50个位点的突变氨基酸序列库,只有检测到的覆盖突变位点的序列才被鉴定为新抗原(图3a、b、c)。相比于化疗诱导的dna损伤肿瘤细胞,我们的蛋白疫苗对中和表位的免疫反应更加集中,能引起更加强烈的免疫应答。这种免疫优势称为免疫显性。我们化疗诱导的肿瘤抗原蛋白纳米疫苗富集了肿瘤细胞中的肿瘤特异性抗原
tsa、肿瘤相关抗原taa和损伤相关分子模式dmps并通过蛋白组学得到验证。
[0050]
实施例5:ct26结直肠癌模型中奥沙利铂2022/11/15或顺铂处理的肿瘤细胞制备成的纳米疫苗联合免疫治疗的药效试验
[0051]
在balb/c小鼠皮下植入ct26结直肠癌细胞,在植瘤后的第5天、第8天、第11天注射肿瘤纳米疫苗和免疫检查点阻断剂antipd-1。其中纳米疫苗剂量为0.7mg/只,antipd-1为100μg/只,共给药三个疗程(图4a)。观察和记录小鼠体重和肿瘤体积,当肿瘤体积达到3000mm3时,处死小鼠。治疗效果主要通过肿瘤体积和小鼠生存曲线体现(图4b、c、d)。
[0052]
实验结果表明:采用本发明提供的方法制备的化疗诱导的肿瘤蛋白抗原纳米疫苗与antipd-1联用,与单独的antipd-1治疗相比,化疗诱导的肿瘤抗原纳米疫苗可以提高antipd-1治疗效果,也显著延长小鼠的生存时间。
[0053]
实施例6:纳米疫苗在淋巴结的引流以及dc细胞的捕获和熟化
[0054]
使用近红外荧光染料cy5.5-nhs与bsa,以1:10-200的投料比,反应10小时用于制备cy5.5标记的bsa。将pbs、cy5.5标记的bsa和bsa-nps皮下注射到balb/c小鼠左侧。给药后1小时和16小时,取小鼠左侧腹股沟淋巴结分别用ivis成像并对荧光强度定量(图5a、b)。淋巴结研磨后裂红,使用活死和抗小鼠cd11c,cd80和cd86流式荧光抗体染色用于流式分析dc细胞对纳米疫苗的捕获和dc细胞熟化情况(图5c、d)。
[0055]
实验结果表明:采用本发明提供的方法制备的化疗诱导的肿瘤蛋白抗原纳米疫苗能有效递送到淋巴结的dc细胞并促进更多的dc细胞熟化。
[0056]
实施例7:纳米疫苗对小鼠脾脏细胞分泌的干扰素γ的检测
[0057]
最后一次接种后一周,从balb/c小鼠中分离脾脏以获得单细胞悬液。脾细胞以每孔105个细胞的密度接种在elispot专用96孔板,并与10-100μg非化疗诱导的肿瘤蛋白抗原或化疗诱导的肿瘤蛋白抗原共孵育。5-24小时后,按照ifn-γelispot的说明书加入生物素化检测抗体、酶试剂和aec底物试剂,在elispot仪器上读板(图6a、b、c)。
[0058]
最后一次接种后一周,从balb/c小鼠中分离脾脏以获得单细胞悬液。将脾细胞接种在12孔板中,每孔106个细胞,然后添加10-100μg非化疗诱导的肿瘤蛋白抗原或化疗诱导的肿瘤蛋白抗原共孵育24-72小时。脾细胞使用抗小鼠cd3、cd4和cd8流式抗体在4℃下进行5-30分钟的染色。最后,将细胞固定、渗透并用抗小鼠ifn-γ抗体染色。流式细胞仪检测ifnγ
+
cd8
+
t细胞和ifn-γ
+
cd4
+
t细胞的相对丰度(图6a、d、e)。
[0059]
实验结果表明:采用本发明提供的方法制备的化疗诱导的肿瘤蛋白抗原纳米疫苗在体外诱导小鼠脾脏细胞分泌更多干扰素γ,激活更多分泌干扰素γ的cd8
+
t细胞和cd4
+
t细胞。
[0060]
实施例8:流式细胞仪分析小鼠肿瘤部位t淋巴细胞的浸润
[0061]
在最后一次给药后的一周,收集所有小鼠的肿瘤进行流式分析。将小鼠肿瘤研磨成单细胞悬液并裂红,肿瘤细胞用活死染料在4℃下染色5-30分钟,随后使用抗小鼠cd16/cd32,cd45,cd3,cd4,cd8和foxp3抗体进行5-30分钟胞内外抗体染色用于流式分析(图7a、b、c、d)。
[0062]
最后一次接种疫苗一周后,从所有治疗组的小鼠身上获取肿瘤组织。肿瘤组织用4%多聚甲醛固定12-48小时,然后包埋在石蜡中脱水。接下来,将肿瘤制成4μm切片,并用抗cd3、cd4和cd8抗体染色。使用tissuefaxs plus拍摄(图7e)。
[0063]
实验结果表明:本发明中制备的化疗诱导的肿瘤蛋白抗原纳米疫苗可显著提高肿瘤部位细胞毒性t淋巴细胞的浸润。
[0064]
实施例9:提取人原代肿瘤细胞制备肿瘤蛋白纳米疫苗
[0065]
取人体肿瘤组织,将其剪碎至约1mm3的组织块,将碎组织块在培养皿中用hanks液洗2-3次。加入0.25%的胰蛋白酶,摇匀后放4℃过夜。次日再用hanks液洗涤,弃去上清,重复洗2-3次。加入少量含血清的培养基吹打分散,细胞计数,按60-200万个细胞每毫升的浓度分瓶培养。
[0066]
收集与浓度为1-300μm的奥沙利铂或1-20μm的顺铂共培养的受损原代细胞、死亡原代细胞以及细胞上清液。肿瘤细胞经过2-10次液氮和37℃水浴冻融以及200-20000rpm离心5-60分钟后与细胞培养液上清合并。使用截留分子量为1-100kda的超滤杯浓缩,清洗。取乙腈和蛋白溶液的体积比为1-20:1,将乙腈以1-9ml/min的速度滴加到浓度为1-10mg/ml的蛋白溶液中。搅拌,待有机溶剂挥发后,使用截留分子量为1-100kda的超滤管超滤纳米疫苗,清洗。最终得到人原代肿瘤细胞制备的肿瘤蛋白纳米疫苗。
[0067]
实施例10:提取未接受过化疗的病人原代肿瘤细胞制备肿瘤蛋白纳米疫苗
[0068]
从未接受过化疗治疗的结直肠癌病人中肿瘤组织,将其剪碎至约1mm3的组织块,将碎组织块在培养皿中用hanks液洗2-3次。加入0.25%的胰蛋白酶,摇匀后放4℃过夜。次日再用hanks液洗涤,弃去上清,重复洗2-3次。加入少量含血清的培养基吹打分散,细胞计数,按60-200万个细胞每毫升的浓度分瓶培养。
[0069]
收集未化疗病人的原代细胞、死亡原代细胞以及细胞上清液。肿瘤细胞经过2-10次液氮和37℃水浴冻融以及200-20000rpm离心5-60分钟后与细胞培养液上清合并。使用截留分子量为1-100kda的超滤杯浓缩,清洗。取乙腈和蛋白溶液的体积比为1-20:1,将乙腈以1-9ml/min的速度滴加到浓度为1-10mg/ml的蛋白溶液中。搅拌,待有机溶剂挥发后,使用截留分子量为1-100kda的超滤管超滤纳米疫苗,清洗。最终得到未化疗病人原代肿瘤细胞制备的肿瘤蛋白纳米疫苗。
[0070]
实施例11:提取未接受过化疗的病人原代肿瘤细胞进行药物处理并制备肿瘤蛋白纳米疫苗
[0071]
从未接受过化疗治疗的结直肠癌病人中肿瘤组织,将其剪碎至约1mm3的组织块,将碎组织块在培养皿中用hanks液洗2-3次。加入0.25%的胰蛋白酶,摇匀后放4℃过夜。次日再用hanks液洗涤,弃去上清,重复洗2-3次。加入少量含血清的培养基吹打分散,细胞计数,按60-200万个细胞每毫升的浓度分瓶培养。
[0072]
加入浓度为1-300μm的奥沙利铂或1-20μm的顺铂与来自未化疗病人的原代细胞共培养1-4天。收集未化疗病人的受损原代细胞、死亡原代细胞以及细胞上清液。肿瘤细胞经过2-10次液氮和37℃水浴冻融以及200-20000rpm离心5-60分钟后与细胞培养液上清合并。使用截留分子量为1-100kda的超滤杯浓缩,清洗。取乙腈和蛋白溶液的体积比为1-20:1,将乙腈以1-9ml/min的速度滴加到浓度为1-10mg/ml的蛋白溶液中。搅拌,待有机溶剂挥发后,使用截留分子量为1-100kda的超滤管超滤纳米疫苗,清洗。最终得到未化疗病人原代肿瘤细胞体外药物培养的肿瘤蛋白纳米疫苗。
[0073]
实施例12:提取接受过化疗的病人原代肿瘤细胞制备肿瘤蛋白纳米疫苗
[0074]
从接受过奥沙利铂或顺铂治疗的结直肠癌病人中肿瘤组织,将其剪碎至约1mm3的
组织块,将碎组织块在培养皿中用hanks液洗2-3次。加入0.25%的胰蛋白酶,摇匀后放4℃过夜。次日再用hanks液洗涤,弃去上清,重复洗2-3次。加入少量含血清的培养基吹打分散,细胞计数,按60-200万个细胞每毫升的浓度分瓶培养。
[0075]
收集化疗病人的原代细胞、死亡原代细胞以及细胞上清液。肿瘤细胞经过2-10次液氮和37℃水浴冻融以及200-20000rpm离心5-60分钟后与细胞培养液上清合并。使用截留分子量为1-100kda的超滤杯浓缩,清洗。取乙腈和蛋白溶液的体积比为1-20:1,将乙腈以1-9ml/min的速度滴加到浓度为1-10mg/ml的蛋白溶液中。搅拌,待有机溶剂挥发后,使用截留分子量为1-100kda的超滤管超滤纳米疫苗,清洗。最终得到化疗病人原代肿瘤细胞制备的肿瘤蛋白纳米疫苗。
[0076]
实施例13:提取接受过化疗的病人原代肿瘤细胞体外药物培养并制备肿瘤蛋白纳米疫苗
[0077]
从接受过奥沙利铂或顺铂治疗的结直肠癌病人中肿瘤组织,将其剪碎至约1mm3的组织块,将碎组织块在培养皿中用hanks液洗2-3次。加入0.25%的胰蛋白酶,摇匀后放4℃过夜。次日再用hanks液洗涤,弃去上清,重复洗2-3次。加入少量含血清的培养基吹打分散,细胞计数,按60-200万个细胞每毫升的浓度分瓶培养。
[0078]
收集与浓度为1-300μm的奥沙利铂或1-20μm的顺铂共培养1-4天的来自化疗病人的受损原代细胞、死亡原代细胞以及细胞上清液。肿瘤细胞经过2-10次液氮和37℃水浴冻融以及200-20000rpm离心5-60分钟后与细胞培养液上清合并。使用截留分子量为1-100kda的超滤杯浓缩,清洗。取乙腈和蛋白溶液的体积比为1-20:1,将乙腈以1-9ml/min的速度滴加到浓度为1-10mg/ml的蛋白溶液中。搅拌,待有机溶剂挥发后,使用截留分子量为1-100kda的超滤管超滤纳米疫苗,清洗。最终得到化疗病人原代肿瘤细胞体外药物培养的肿瘤蛋白纳米疫苗。
[0079]
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本公开的具体实施例而已,并不用于限制本公开,凡在本公开的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本公开的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1