用于内耳感觉毛细胞再生/替换的联合疗法的制作方法
用于内耳感觉毛细胞再生/替换的联合疗法
1.本技术为2019年01月24日进入中国国家阶段、申请号201780048020.8、申请日为2017年06月02日、发明名称为“用于内耳感觉毛细胞再生/替换的联合疗法”的发明专利申请的分案申请。
2.相关申请的交叉引用本技术根据35u.s.c.119(e)要求2016年06月03日提交的美国序列号62/345,740的优先权,其整体内容通过引用并入本文。
背景技术:
3.耳聋和平衡功能障碍是常见的人类残疾。在大多数情况下,这些残疾是由(1)耳蜗中的柯蒂氏器(organ of corti,oc)、(2)嵴中的前庭上皮或(3)前庭器官的球囊或椭圆囊中的感觉毛细胞的丧失造成的。目前,没有fda批准的治疗可以通过恢复这些组织中的感觉毛细胞来治愈这些疾病。
4.目前解决该问题的方法涉及前庭康复以适应前庭器官的损伤。康复是耗时的,并且不能恢复失去的功能。对于感音神经性耳聋,可以使用助听器或人工耳蜗进行康复治疗。但是,这些装置昂贵,产生低于正常的声音质量并且仅部分恢复功能,并且就耳蜗植入而言可能需要大手术。
5.治疗听力障碍的另一种方法是施用肽或其他小分子。由于必须达到相对较高的耳蜗浓度(微或毫摩尔),因此使用这些药剂通常会限制治疗效果。此外,由于血流中的血液迷路屏障和蛋白质清除、以及潜在的抗原性,蛋白质或肽抑制剂难以全身递送以治疗耳朵。在将足够浓度的肽和蛋白质直接递送到耳蜗方面也存在困难,尤其是由于分子的大小而使用局部递送。
6.这些传统方法的一种潜在替代方案是使用靶向基因疗法来诱导内耳毛细胞再生和替换。例如,通过使用病毒载体来将atohl基因引入内耳感觉上皮细胞,已经在啮齿动物中实现了毛细胞再生或替换。但是,这种方法具有病毒载体治疗中固有的风险,包括感染的诱导、炎症性免疫应答、基因突变、瘤形成的发展和其他风险。kiplp27rna的沉默已显示诱导毛细胞再生,但是以异位的方式而不恢复功能。视网膜母细胞瘤基因的调节也可以产生额外的毛细胞,但是在操纵癌基因或致癌基因方面可能存在固有的危险。因此,针对内耳毛细胞的再生或替换的当前基因疗法未能鉴定安全有效的分子靶标和递送方法。
7.一种潜在的基因治疗方法是通过使用短干扰rna(sirna)。一旦引入细胞中,sirna分子就会与靶基因表达的信使rna(mrna)上的互补序列复合。该sirna/mrna复合物的形成通过称为rna干扰(rnai)的天然细胞内过程而导致mrna的降解。rnai是一种用于鉴定在特定细胞过程中基因的功能以及用于鉴定疾病模型中的潜在治疗靶标的成熟工具。尽管rnai传统上已用于细胞培养和体外应用,但现在正在探索利用该过程的基于基因治疗的疗法。
8.如上所述,在内耳毛细胞的再生方面,已经探索了几种基因靶标,但没有取得很大的成功。基本的螺旋-环-螺旋(bhlh)基因hes1和hes5已鉴定为在耳朵的耳蜗和前庭结构中的感觉毛细胞发育中起作用。此外,用于防止毛细胞缺失的潜在基因靶标是丝裂原活化蛋
白激酶1(mapkl),其在细胞程序性死亡或凋亡中起作用。
9.糖原合成酶激酶3(gsk-3)是一种丝氨酸/苏氨酸蛋白激酶,其介导磷酸分子添加到丝氨酸和苏氨酸氨基酸残基上。它是多种不同途径中超过40种不同蛋白质的激酶,并且涉及多种疾病。因此,已在动物模型中测试了gsk-3抑制剂(gsk3i)的安全性和有效性;但是,gsk-3的抑制可能在各种信号级联中发挥的作用仍不清楚。
技术实现要素:
10.本公开涉及用于利用降低内耳组织中基因的表达的组合物或药剂和第二药剂来再生和/或恢复毛细胞的组合物和方法。
11.在一些实施方案中,所述基因是hes1、hes5或mapk1。
12.在一些实施方案中,降低内耳组织中基因的表达的组合物或药剂可包括sirna分子。在一些实施方案中,降低内耳组织中基因的表达的组合物或药剂可包括调节所述基因的通路的抑制剂,例如notch信号通路抑制剂,例如γ分泌酶抑制剂(由于例如hes1的转录由notch信号介导)。
13.在一些实施方案中,所述第二药剂是引发(priming)组合物。在一些实施方案中,所述引发组合物表现出一种或多种功能,所述功能选自稳定β连环蛋白、增加内耳中多能细胞的数量、增加内耳中预先存在的多能细胞的可塑性、或信令(signaling)内耳的细胞中的分化。在一些实施方案中,该第二药剂是gsk-3抑制剂。在进一步的实施方案中,所述gsk-3抑制剂是chir99021、6-溴靛玉红-3
’‑
肟(6-bromoindirubin-3’oxime,bio)或tideglusib(tide)中的任何一种或多种。
14.在一些实施方案中,所述降低内耳组织中基因的表达的组合物可包括纳米颗粒,该纳米颗粒包含降低内耳组织中基因的表达的药剂。
15.在一些实施方案中,所述纳米颗粒包封降低内耳组织中基因的表达的药剂。
16.在一些实施方案中,所述纳米颗粒包含可生物降解的聚合物。在进一步的实施方案中,所述可生物降解的聚合物是聚乳酸-羟基乙酸共聚物(plga)或聚乙二醇化的plga(peg-plga)。
17.在一些实施方案中,所述纳米颗粒是磁响应的或包括磁响应颗粒。在一些实施方案中,所述磁响应颗粒是超顺磁性氧化铁(spion)。
18.在一些实施方案中,所述第二药剂可被包含在与降低内耳组织中基因的表达的药剂相同或不同的纳米颗粒中。
19.本公开的方面涉及以足以治疗听力损失和/或恢复和/或再生毛细胞的治疗有效量来施用降低内耳组织中基因的表达的组合物或药剂和第二药剂的方法。在一些实施方案中,施用步骤同时进行。在替代的实施方案中,施用步骤按顺序进行。在进一步的实施方案中,在施用降低内耳组织中基因的表达的组合物或药剂之前或之后施用所述第二药剂。
附图说明
20.图1是内耳的标记图。
21.图2描绘了来自实验中鼠柯蒂氏器(0c)的中回(middle turn)的代表性图像,该实验用于证明载有hes1 sirna的plga纳米颗粒(np)处理在耳毒性损伤后使毛细胞再生。将新
生(p3)鼠0c暴露于4-羟基-2-壬烯醛(4-hne,450μm)耳毒素中24小时,然后不处理或用非靶向乱序rna np(scrnanp)或载有hes1 sirna的np(hes1 sirnanp)处理,7天后,将组织固定并用荧光团缀合的鬼笔环肽(phalloidin)标记。在来自未处理的培养物的oc中观察到三排外毛细胞(ohc)和一排内毛细胞(ihc)(左上图),在4-hne处理(右上图)和4-hne加scrnanp处理的oc(左下图)中观察到一排ihc和少量分散的ohc(开放箭头)。在用hes1 sirnanp(800μg/ml)处理的oc中观察到额外的ohc(箭头,右下图)和ihc(箭头头,右下图)。
22.图3显示了响应于hes1 sirna np处理,在暴露于4-hne耳毒素的新生鼠oc中恢复的hc数量中观察到的剂量依赖性效应。用高剂量的np(>400μg/ml)处理也导致基底中ohc数量的显著增加。与未处理的培养物相比,***和*分别表示与仅暴露于4-hne的组相比p<0.001和0.05。###、##和#分别表示p<0.001、0.01和0.05。括号内的数字表示其中计算hc的oc的数量。
23.图4描绘了来自以下实验中oc的中回的代表性图像。将新生(p3)鼠oc暴露于耳毒性氨基糖苷类(新霉素(neo,0.75mm))中24小时,然后不处理或用逐步增加剂量的载有hes1sirna的np进行处理。7天后,将组织固定并用myo7a抗体(绿色,上图)和荧光团缀合的鬼笔环肽(下图)进行标记。在来自未处理的培养物的oc中观察到三排ohc和一排ihc(左上图)。在未处理的、neo暴露的oc(neo单独)中观察到少量分散的ohc(开放箭头)。在用逐步增加剂量的包封有sihes1的plga np处理的oc中观察到hc数量的剂量依赖性增加。所示np的剂量当量对应于溶液中的总sirna浓度,并分别代表145、230和385μg/ml包封有sihes1的plga np。
24.图5表明,在暴露于耳毒性氨基糖苷类(新霉素(neo))并随后用逐步增加剂量的hes1 sirna np处理的新生鼠0c中恢复的hc(myo7a阳性细胞)的数量中也观察到剂量依赖性效应。在oc的中顶回(mid-apical turn)、中回和中底回(mid-basal turn)进行hc计数。所示的剂量当量代表溶液中的总sirna浓度,并对应于78、145、230和385μg/ml的plga np。观察到hc数量显著增加。***表示与未处理的培养物相比p<0.001。###和##分别表示与暴露于单独的neo的组相比p<0.001和0.01。
25.图6描绘了在测试频率为2、4、8和16khz的假处理或治疗性sihes1np处理的耳朵的活豚鼠的噪声损伤的耳蜗中听觉脑干反应(abr)阈值恢复(损伤后)的时间过程。声创伤由以4khz为中心的130db spl的声过曝诱导2小时。通过使用微型渗透泵(七天后通过手术切除)单侧输注直接进入耳蜗的基底(耳蜗造口术),使用载有假非靶向乱序rna(scrna)的np(800μg/ml)或治疗性sihes1np(800μg/ml)进行延迟(损伤后72h)治疗干预。然后在损伤后两周、四周、八周和十周对来自两个实验组的动物进行abr测量。与假处理的对照相比,在该实验的时间过程中,暴露于噪音的动物中的sihes1 np处理的耳朵表现出更大程度的渐进性听觉功能恢复(即在测试的频率范围内降低的abr阈值)。
26.图7描绘了图6中描绘的abr阈值恢复的简化时间过程,证明在暴露于急性声创伤的活豚鼠中使用sihes1 np的延迟(损伤后72h)治疗干预后实现的听力恢复水平比使用非靶向scrna np的更高。
27.图8显示与在测试频率为2、4、8和16khz的声过曝后一天相比,在治疗后10周,在手术注入的耳朵内使用scrna np或sihes1np的延迟(损伤后72小时)治疗干预后活豚鼠aat后的abr阈值恢复的差异。在aat后观察到的阈值恢复的sihes1 np治疗特异性改善预计具有
临床意义。
28.图9描绘了从经处理的耳朵的耳蜗的底回(basal turn)收集的图像,其证明sihes1 np输注导致成熟的染色豚鼠的噪声损伤的耳蜗中的hc数量增加。在假性(scrna)和治疗性(sihes1)处理的耳朵中的myo7a标记和鬼笔环肽标记显示,在scrna np注入的耳朵中ohc的明显丧失和在sihes1 np处理的耳朵中ohc数量的显著恢复。箭头表示在sihes1处理的耳朵中出现带有静纤毛束的额外myo7a阳性ihc(箭头)。
29.图10显示sihes1np处理在破坏性声过曝后在体内恢复hc数量。在伤后数周,对myo7a免疫标记的ihc和ohc的数量进行定量,并绘制为耳蜗毛细胞图(cytocochleogram),描绘ihc和ohc损失百分比作为距离scrna np和sihes1 np处理的耳朵中的0c顶端的距离百分比函数(以千赫兹为单位的频率位置)。数据绘制为平均值
±
sem。每个数据点分析三个耳蜗。在scrna np处理的耳朵中观察到明显的基底至顶端梯度的ohc和ihc损失,其在sihes1 np处理的耳朵(包括沿着oc的基底的高频张力(tonotopic)区域)中的耳蜗螺旋的全长上显著降低。
30.图11描绘了从耳蜗的基底收集的图像,证明sihes1np输注在暴露于杀死毛细胞的巨大破坏性噪声的成熟小鼠体内恢复hc数量。将4周龄的c57bl/6小鼠暴露于116db spl的8-16khz倍频带噪声的声过曝2小时。在声创伤后72小时,使用微型渗透泵将sihes1np(800μg/ml)单侧注入后半规管,持续7天。在噪音损伤后8周,将组织固定并收获hc的myo7a免疫标记。sihes1 np输注导致体内噪声受损的小鼠耳蜗的结构正确位置的hc数量增加。
31.图12是来自外淋巴模拟培养基中的plga纳米颗粒的hes1 sirna的累积释放曲线图。
32.图13描绘了sihes1单独地或与gsk-3抑制剂(bio)的分阶段(s)或同时(一起,t)应用相结合,对在未受损的出生后(p3)柯蒂氏器的器官型培养物中增加内部和外部hc(分别为ihc和ohc)数量的影响。将柯蒂氏器(oc)在培养基中单独培养24小时,然后加入含有单独载体(二甲基亚砜,dmso)或浓度为2或10微摩尔(用于分阶段施用,s)的gsk-3抑制剂(bio)的培养基。再培养72小时后,在存在或不存在20nm sihes1转染复合物(jesi 10mm,polyplus transfection,illkirch,france)的条件下更换培养基并用含有dmso(用于正常对照(nc)、或分阶段(s)的施用实验)或bio以2或10微摩尔(用于同时施用,t)的培养基替换。再过48小时后,用基础培养基替换所有培养基并再培养48小时,然后固定并用抗myo7a免疫标记hc。顺序施用10微摩尔的bio然后用sihes1转染,引起未受损的oc中ihc和ohc数量的最大增加(即产生更多的从头(de novo)毛细胞),在0c的中底回(通常对产后耳蜗中新的hc的产生顽固的区域)中观察到最大的区别。
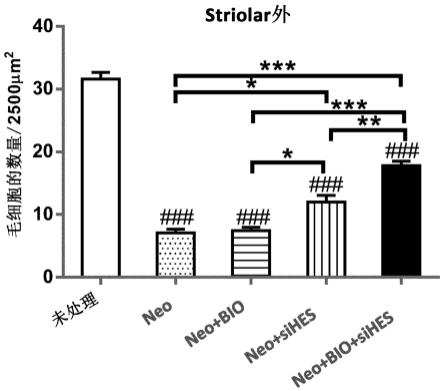
33.图14显示了用bio和sihes1的组合处理的结果,证明了与单独使用单一治疗剂的治疗相比,耳毒素消融的椭圆囊(utricle)的striolar外区域中hc的数量的协同增加。为了评估bio是否可以增强hes1 sirna在毒性损伤后在再生hc中的治疗效力,将新生鼠囊状组织暴露于新霉素(neo),然后不处理或用一种或两种治疗剂处理。在体外总共8天后,将组织固定并用hc标志物myo7a标记。###,相对于未处理的对照,myo7a阳性细胞中p<0.0001差异。*、**和***,分别为p<0.05、0.01和0.001,是相对于治疗组之间myo7a-阳性细胞的数量的显著差异。
34.图15描绘了来自图14的不同实验组的代表性图像。在neo处理后,hc数量大大减少
(小图2)。单独的hes1 sirna处理导致hc数量增加,主要在striolar区内(小图4),而用sihes1和bio的组合处理导致增强的也跨越striolar外区域的再生反应(小图5)。
35.图16表明,与单独的bio或sihesl或用bio加上γ-分泌酶抑制剂(gsi)去羟基ly411575(二苯并氮卓,5μm)的分阶段治疗(其中组合治疗效果主要限于椭圆囊外植体的striolar区)观察到的相比,用bio和sihes1的分阶段治疗导致在neo消融的椭圆囊的striolar外区域中更强的转分化反应。
36.图17描绘了来自图16的不同实验组的代表性图像。在neo处理后,hc数量大大减少(小图2)。单独地,bio、hes1 sirna和gsi单独处理导致在striolar区域内的hc数量增加(小图4和6),而用bio和sihes1的组合处理独特地导致也跨越了striolar外区域的增强的再生反应(小图5)。
37.图18描绘了来自成熟鼠oc的整个耳蜗培养模型的代表性图像,显示了此处在20倍和40倍的放大倍数下显示的不同实验组的中回。使用该整个耳蜗培养模型来研究hc再生,收获成熟的鼠耳蜗(pi 6)并在单独的培养基中培养24小时,在此期间,预先存在的ihc和ohc快速退化并死亡。培养24小时后,将这些培养物用5μm bio处理72小时,然后用sihes1(20nm)转染,并随后在体外培养总共9天,此时将组织固定并用鬼笔环肽(红色)标记或用hc标记物myo7a(绿色)进行标记。在这些条件下,用bio和hes1 sirna的组合处理导致感觉上皮区域内hc数量的显著增加(右图)。
38.图19描绘了血清饥饿的mdck细胞中gsk3i介导的增殖的代表性图像。最初在10%胎牛血清(fbs)的存在下培养细胞,然后转换至无血清培养基中24小时,然后加入0.2%含血清的培养基,其中包括在10mm edu的存在下的指定浓度的gsk3i。将细胞再培养48小时,然后通过在铜催化的环加成(“click”反应,click-it edu,life technologies)中缀合alexafluor488叠氮化物,固定和观察edu阳性细胞核(绿色)。用dapi(蓝色)染色总细胞核。在整个实验的时间过程中,在10%fbs的存在下培养正常对照(nc)或未处理的细胞。gsk3itideglusib在所测试的剂量范围内支持持续的增殖反应,而由其他gsk3i(例如sb-216763)诱导的增殖反应随着剂量的增加而逐渐减弱。
39.图20显示了用于在血清饥饿的(即有丝分裂抑制的)mdck细胞中诱导增殖反应的gsk3抑制剂的比较结果。使用imagej软件(nih)对来自如图13中所述培养的mdck细胞的成像区域的edu阳性细胞核进行定量,并绘制为相对于在每个区域中dapi染色的细胞核总数的edu阳性细胞数的平均百分位数。在该分析中包括每个实验条件的至少四个细胞区域。(*和***,分别为p<0.05和0.001,相对于未处理的、血清饥饿的对照,edu阳性细胞核的统计学显著增加)。在该靶向分析中检测的gsk3i中,在这些血清限制条件下tideglusib支持所测试的gsk3i浓度范围内最强的有丝分裂反应。
40.图21描绘了响应于tideglusib处理,在出生后柯蒂氏器中的有丝分裂活性细胞的edu标记。出生后第3天收获oc并在体外培养24小时,然后在终浓度为0.5或2.0μm的单独载体(dmso)或tideglusib(tide)的存在下加入含有10μm edu的培养基。器官型培养物在这些药剂的存在下连续培养72小时,然后如上所述固定和可视化edu阳性细胞核。显示了来自每个组的oc的中回的图像。括号表示每个图像中的感觉上皮区域。与载体处理的对照相比,tideglusib在所培养的柯蒂氏器的感觉上皮区域中诱导显著更大的有丝分裂反应。
41.图22描绘了从鼠oc的器官型培养物的中顶和中间区域定量的毛细胞(myo7a+细
胞),其在暴露于新霉素(0.7mm)24小时后并且随后在存在或不存在gsk3抑制剂tideglusib(tide)和/或sihesl(20nm)脂质转染复合物(jetsi,polyplus)的情况下恢复。在用tide和sihes1的组合处理的培养物中,在oc的中顶回和中回中观察到更高的hc数量,而tide然后sihes1的分阶段施用引起hc数量的最显著增加。**和***,与单独的neo处理相比,p<0.01和0.001。##,与neo+sihes1处理相比,p<0.01。
42.图23描绘了从鼠oc的器官型培养物的中顶和中间区域定量的毛细胞(myo7a+细胞),其在暴露于新霉素(0.7mm)24小时后并且随后在存在或不存在gsk3抑制剂tideglusib(tide)和/或sihes1(20nm)脂质转染复合物(jetsi,polyplus)的情况下恢复。尽管在新霉素后72小时用sihes1处理的培养物中在0c的中顶回和中回中观察到更高的hc数量,但是tide然后sihes1处理的阶段性组合产生在oc的中间和中顶中hc数量的协同增加。*和***,与单独的neo处理相比,p<0.05和0.001。###,与neo+sihes1处理相比,p<0.01。
43.图24描绘了来自图23中描述的实验的neo-损伤的器官型培养物中来自对照和处理组的0c的中回的myo7a免疫标记。
44.图25描绘了从鼠oc的器官型培养物的中顶、中间和中底区域定量的毛细胞(myo7a+细胞),其在暴露于新霉素(0.7mm)24小时后并且随后在存在或不存在gsk3抑制剂tideglusib(tide)和/或sihes1(20nm)脂质转染复合物(jetsi,polyplus)的情况下恢复。在存在2ng/ml fgf-2作为培养基补充物的情况下,用tide然后用sihes1处理一组neo消融的0c,目的是潜在地增强tideglusib的效果。在用tide和sihes1的分阶段组合处理的培养物中,在oc的中顶回和中回中观察到更高的hc数量,而向生长培养基中添加fgf-2通过oc的中底回(通常是对hc再生更加顽固的区域)增强了效果。*和***,与单独的neo处理相比,为p<0.05和0.001。###,与neo+sihes1处理或处理组之间相比,p<0.01。
45.图26描绘了来自图25中描述的实验的neo损伤的器官型培养物中来自对照和处理组的oc的中回的myo7a免疫标记。
46.图27描绘了使用在哺乳动物hes1转录物中具有保守的靶位点的两种不同的sihes1分子,相对于鼠内耳细胞系(imo-2b1)中模拟处理的对照的hes1击倒效率(knockdown efficiency)的比较剂量曲线分析的逆转录-定量聚合酶链反应(rt-qpcr)结果。使用商业转染剂(rnaimax,thermofisher sci.)将sirna分子转染到imo-2b1的亚汇合孔(sub-confluent well)中。转染后48小时,分离总rna并使用针对hes1和管家基因gapdh的引物进行rt-qpcr分析。通过2
‑△△
ct
方法测定相对hes1水平(参见liyak and schmittgen(2001)methods 25(4):402-408,其通过引用整体并入)。分子#7用于消除hes1转录物水平的表观效力显著大于分子#1的表现效力,因为使用少至2nm sirna(相对于分子#1所需的~20nm)观察到使用分子#7的最佳击倒。
47.图28描绘了在20,000(左图)和40,000(右图)
×
放大倍数下sihesi peg-plga np的代表性扫描电子显微镜(sem)图像。
48.图29描绘了显示在imo-2b1内耳细胞中荧光团-缀合的载有sirna的peg-plga np的剂量依赖性摄取的图。
49.图30描绘了imo-2b1中的双荧光团plga np内化和定位,其用递增剂量(200、400或800μg/ml)的np培养24小时之后,洗涤、固定并进行fam scrna(绿色,左上图)和af555-plga(红色,右上图)的共聚焦显微镜成像。蓝色标记(左下图)表示细胞核的dapi染色。合并图像
(右下图)描绘了来自内化的np的scrna和plga之间的信号(黄色)的重叠。比例尺为10μm并适用于所有图像。
50.图31描绘了来自图30的800μg/ml共焦图像集的放大图。
51.图32描绘了imo-2b1细胞中的双荧光团peg-plga np内化和定位,其用递增剂量(200、400或800μg/ml)的np培养24小时之后,洗涤、固定并进行fam scrna(绿色,左上图)和af555-plga(红色,右上图)的共聚焦显微镜成像。蓝色标记(左下图)表示细胞核的dapi染色。合并图像(右下图)描绘了来自内化的np的scrna和peg-plga之间的信号(黄色)的重叠。比例尺为10μm并适用于所有图像。
52.图33描绘了来自图32的800μg/ml共聚焦图像集的放大图。
53.图34描绘了评估新的载有sihes1的peg-plga np配方的剂量递增对内耳细胞活力的潜在细胞毒性作用的结果。
54.图35描绘了通过新的载有sihes1的peg-plga np配方相对于载有sihes1的plga np的剂量递增而实现的内耳细胞中相对hes1沉默效率的成对比较评估的结果。
55.图36描绘了通过新的载有sihes1的peg-plga np配方相对于平行合成的载有sihes1的plga np的剂量递增而实现的内耳细胞中蛋白质水平的相对hes1沉默效率的比较评估的结果。
56.图37显示了gsk3抑制与sihes1 np协同作用以恢复耳毒素消除的0c中的hc数量。将出生后(p3)鼠(cd1)0c外植体暴露于耳毒性氨基糖苷类(新霉素)24小时,然后单独使用60nm sihes1 np处理;单独使用gsk3抑制剂tideglusib(tide)(2μm)处理;或者将60nm sihes1 np与递增剂量的tideglusib(0.5、2或10μm)组合处理6天,然后固定并针对hc特异性标志物myo7a进行免疫标记。中回作为所示图像中的固定参考。
57.图38显示了tide与sihes1 np协同作用以恢复耳毒素消除的oc中的hc数量。用次优(60nm)剂量的sihes1 np单独或与递增剂量的tide组合处理neo-消融的oc。当tideglusib和低剂量sihes1np处理相结合时,hc定量显示0c的中回和中底回中hc数量的协同增加。sihes1 np的持续释放曲线模拟了两种疗法的分阶段应用。在用tide和sihes1 np共同处理时,在整个oc中观察到毛细胞密度的剂量依赖性增加。*和***,与单独的neo处理相比,p<0.05和0.001。#和###,与neo+sihes1np处理相比,p<0.05和0.001。n=5个oc/条件。
58.图39显示了sihes1纳米颗粒在噪声变聋的豚鼠中恢复听觉功能的一天输注的结果。将豚鼠暴露于震耳欲聋的噪声水平(以4khz为中心的125db spl倍频带噪声)持续3小时。声创伤后72小时,载有假性(即非靶向乱序rna,scrna)或治疗性hes1 sirna(sihes1)的plga np(800μg/ml)通过微型渗透泵以24小时(一天输注)的过程每小时1.0μl的速度输送到耳蜗(耳蜗造口术)。在治疗后三周记录听觉脑干反应(abr)测量值,并且对于每组,在2-16khz的测试频率上绘制平均abr阈值恢复(即与声过曝后一天相比的听力恢复)。虽然破坏性噪声暴露在所有测试频率上引起明显的听力损失(即高abr阈值偏移),但相对于scrna np处理的耳朵,sihes1 np处理的耳朵在整个2-16khz范围内显示出阈值恢复的显著改善(*和***,p<0.05和0.001;每组n=6)。
59.图40显示了与在2、4、8和16khz的测试频率下的声过曝后一天相比,在治疗后9周在体内注射(一天给药)的耳朵中使用scrna np或sihes1np延迟(损伤后72小时)治疗性干
预后的活体豚鼠abr阈值恢复的差异。预测此处观察到的sihes1np处理特异性阈值恢复改善的程度具有临床意义(*p<0.05,**p<0.01)。
60.图41表明sihes1np处理恢复了来自暴露于噪声的成熟染色豚鼠中经处理的耳朵的耳蜗底回中的hc数量。在假性(scrna)和(sihes1)np处理的耳朵中的myo7a-和鬼笔环肽标记显示,在噪音消融的豚鼠耳蜗的中回和底回中,在scrna np注入的耳朵中ohc显著丧失并且在sihes1 np处理的耳朵中ohc数量显著恢复。箭头表示在sihes1 np处理的耳中在ihc区域中独特地观察到的具有静纤毛束的异位myo7a阳性hc(箭头)的出现,与形态上成熟的hc的从头生产一致。
61.详细说明
62.1.定义
63.如本文所使用的,术语“足够的量以”是指能够实现预期效果的量,例如,降低内耳组织中基因的表达。这样的量可以通过本领域已知的基于预期效果的各种测定来确定。
64.如本文所使用的,术语“施用”或“给药”是指将指定的药剂、组合物或力引入指定区域或对象的所有方法。“给药”或“施用”可以在整个治疗过程中连续或间歇地以一个剂量进行。确定最有效的给药方式和剂量的方法是本领域技术人员已知的,并且会随用于治疗的组合物、治疗目的、所治疗的靶细胞和所治疗的对象而变化。单次或多次施用可以在治疗医师选择剂量水平和模式的情况下进行。施用药剂的合适的剂型和方法是本领域已知的。还可以确定给药途径,并且确定最有效的给药途径的方法是本领域技术人员已知的,并且会随用于治疗的组合物、治疗目的、以及所治疗的对象和靶细胞或组织健康状况或疾病阶段而变化。给药途径的非限制性实施例包括口服给药、鼻腔给药、吸入、注射和局部应用。给药可用于工业和治疗应用。
65.如本文所使用的,术语“可生物降解的”在本文中用于描述旨在在使用期间降解的物质,例如聚合物、组合物和配方。可生物降解的物质也可以是“生物相容的”,即对活组织无害的。非限制性示例性可生物降解的物质包括聚乳酸(pla)和聚乳酸-羟基乙酸共聚物(plga),任选地为聚乙二醇化的。
66.如本文所使用的,术语“bio”或“6-溴靛玉红-3
’‑
肟”是指具有下述结构的化合物及其药学上可接受的盐:
[0067][0068]
如本文所使用的,术语“细胞”是指真核细胞。术语“毛细胞”是指感觉上皮细胞,其特征在于具有长纤毛(例如毛细胞静纤毛和/或毛细胞纤毛),其在显微镜下显示为细毛;如本文所使用的,毛细胞(hc)可以通过它们的位置来识别,例如内耳毛细胞(ihc)或外耳毛细胞(ohc)。
[0069]
已知这种毛细胞至少存在于耳朵的耳蜗柯蒂氏器、斑(maculae)和嵴中。
[0070]
如本文所使用的,术语“分化”是指引起细胞发育成成熟/特化细胞类型(例如毛细
胞)的细胞的特定条件,该成熟/特化细胞类型的细胞产生与特定的成熟/特殊细胞类型一致和/或促进/维持特定的成熟/特殊细胞类型的特定基因产物。
[0071]
如本文所使用的,术语“表达”是指多核苷酸转录成mrna的过程和/或转录的mrna随后翻译成肽、多肽或蛋白质的过程。基因的表达水平可以通过测量细胞或组织样品中mrna或蛋白质的量来确定;此外,可以确定多个基因的表达水平以建立特定样品的表达谱。当在表达的上下文中使用时,术语“增加”是指用于增加转录和/或翻译的量的一种或多种动作。同样地,术语“减少”是指用于减少转录和/或翻译的量的一种或多种动作。
[0072]
如本文所使用的,本文使用的术语“基因”意指广泛地包括转录成rna分子的任何核酸序列,无论rna是编码的(例如mrna)或是非编码的(例如ncrna)。
[0073]
如本文所使用的,术语“gsk-3”是指与该名称相关的蛋白质,即丝氨酸/苏氨酸蛋白激酶,其介导磷酸分子添加到丝氨酸和苏氨酸氨基酸残基上。
[0074]
如本文所使用的,术语“hes1”(也称为hes家族bhlh转录因子1、b类基本螺旋-环-螺旋蛋白质39、毛状蛋白质、毛状同源物、bhlhb39、hhl、hry、split多毛增强子1(果蝇)、split多毛增强子1、毛状同源物(果蝇)、hes-1或hl)是指与该名称和/或gcid:gc03p194136、hgnc:5192、entrez gene:3280、ensembl:ensg00000114315、omim:139605、uniprotkb:q14469(每个都通过引用整体并入本文)相关的基因和所得蛋白质产物,以及其在特定物种(包括但不限于人、小鼠、大鼠、豚鼠和南美栗鼠)中的同源物或直系同源物。人hes1的非限制性示例性氨基酸序列在下文提供(seq id no:25):
[0075][0075][0076]
如本文所使用的,术语“hes5”(也称为hes家族bhlh转录因子5、b类碱性螺旋-环-螺旋蛋白质38、split多毛增强子5、bhlhb38、split多毛增强子5(果蝇))是指与该名称和/或gcid:gc01m002528、hgnc:19764、entrez gene:388585、ensembl:ensg00000197921、omfm:607348、uniprotkb:q5ta89(每个都通过引用整体并入本文)相关的基因和所得蛋白质产物,以及特定物种(包括但不限于人、小鼠、大鼠、豚鼠和南美栗鼠)中的同源物或直系同源物。人hes5的非限制性示例性氨基酸序列在下文提供(seq id no:26):
[0077][0077][0078]
如本文所使用的,术语“抑制剂”是指抑制或阻止分子(例如蛋白质、核酸或其他生物分子)参与特定反应的组合物或药剂。例如,gsk-3抑制剂可用于指防止gsk-3参与其一种或多种生物学功能的组合物或药剂。非限制性示例性gsk-3抑制剂包括bio、tide、chiron化合物、氯化锂和sb-216763。
[0079]
如本文所使用的,术语“mapk1”(也称为丝裂原活化蛋白激酶1、细胞外信号调节激酶2、丝裂原活化蛋白激酶2、map激酶同种型p42、map激酶1、map激酶2、ec2.7.11.24、p42-mapk、mapk 2、prkm1、prkm2、erk-2、erk2、ert1、蛋白酪氨酸激酶erk2、ec 2.7.11、p42mapk、p41mapk、mapk 1、mapk2、p40、p38、erk、p41)是指与该名称和/或gcid:gc22m021754、hgnc:
6871、entrez gene:5594、ensembl:ensg00000100030、omim:176948、uniprotkb:p28482(每个都通过引用整体并入本文)相关的基因和蛋白质产物,以及特定物种(包括但不限于人、小鼠、大鼠、豚鼠和南美栗鼠)中的同源物或直系同源物。人mapk1(同种型1)的非限制性示例性氨基酸序列在下文提供(seq id no:27):
[0080]080][0081]
如本文所使用的,术语“磁响应”是指颗粒或药剂响应由称为磁性的物理现象引起的吸引力或排斥力的能力。在一些实施方案中,磁响应允许通过施加磁梯度来控制颗粒或药剂的移动或运输。“磁响应”药剂的非限制性实施例是氧化铁;某些氧化铁颗粒可以是超顺磁性的。这种超顺磁性氧化铁颗粒可以是宏观级、微观级或纳米级的。纳米级超顺磁性氧化铁颗粒用简写spion来表示。
[0082]
如本文所使用的,术语“微球”包括具有尺寸为约1至约1000微米的基本上球形的胶体结构,例如由生物相容性聚合物(例如主题组合物)形成的。通常,“微胶囊”可以与微球区分开,因为微胶囊通常被某种类型的物质覆盖,例如聚合物配方。术语“微粒”是微球和微胶囊、以及可能不容易放入上述两类中的结构,所有这些都具有平均小于约1000微米的尺寸。如果结构的直径小于约1微米,则可以使用相应的本领域公认的术语“纳米球”、“纳米胶囊”和“纳米颗粒”。
[0083]
术语“药学上可接受的载体”(或“药学上可接受的赋形剂”)是指可用于本公开的组合物中的任何稀释剂、赋形剂或载体。药学上可接受的载体包括离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白(例如人血清白蛋白)、缓冲物质(例如磷酸盐)、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的偏甘油酯混合物、水、盐或电解质(例如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁)、聚乙烯吡咯烷酮、纤维素基物质、聚乙二醇、羧甲基纤维素钠、聚丙烯酸酯、蜡、聚乙烯-聚氧丙烯-嵌段聚合物、聚乙二醇、微球、微粒或纳米颗粒(包含例如可生物降解的聚合物,例如聚乳酸-羟基乙酸共聚物)和羊毛脂。合适的药物载体描述于remington’s pharmaceutical sciences,mack publishing company,其是该领域的标准参考文献。它们可以根据预期的给药形式进行选择,即口服片剂、胶囊、酏剂、糖浆等,并且与常规药学实践一致。
[0084]
如本文所使用的,术语“可塑性(plasticity)”是指一种细胞(例如干细胞)具有另一种细胞特征的能力,并且通常用于分化的背景中。术语“多能”是指细胞产生几种不同细胞类型的能力。
[0085]
如本文所使用的,术语“聚合物”是指由重复亚基组成的分子。通常,相对于归类为“小分子化合物”的那些分子,聚合物具有较大分子量的趋势。
[0086]
如本文所使用的,术语“替换”或“再生”是指毛细胞的更新、再生或恢复。术语“保护”意指预防或减轻毛细胞损失。
[0087]
如本文所使用的,诊断或治疗的术语“对象”是细胞或动物,例如哺乳动物或人。受到诊断或治疗的非人类动物是指受到所称的疾病或病症(例如听力损失)的动物或其动物
模型,例如,猿猴、鼠(例如大鼠、小鼠、南美栗鼠)、犬(例如狗)、兔(例如兔子)、牲畜、运动动物和宠物。
[0088]
如本文所使用的,术语“sirna”意指双链rna分子,其干扰特定基因或转录后基因的表达。在一些实施方案中,sirna用于使用rna干扰通路来干扰或抑制基因表达。使用包含一个或多个经修饰的核酸残基(例如,肽核酸(pna)、锁核酸(lna)、解锁核酸(una)或三唑连接的dna)的短发夹rna(shrna)、微小rna(mrna)和/或核酸(例如sirna、shrna或mirna)中的一种或多种可以实现类似的干扰或抑制作用。
[0089]
如本文所使用的,术语“tide”或“tideglusib”是指具有下述结构的化合物及其药学上可接受的盐和衍生物:
[0090][0091]
预期的衍生物的非限制性实施例包括美国2014/005195中公开的那些,其通过引用整体并入本文。这种tide衍生物可以具有与tide相同的功能,但可以进行修饰以改善稳定性、溶解度或药代动力学。本文考虑的衍生物的其他非限制性实施例包括在morales-garcia et al.(2012)acs chem.nuerosci.3:963-917中公开的那些,其通过引用整体并入本文。与tide相关的gsk3抑制剂及其衍生物包括gsk3抑制剂类似物的tdzd家族。
[0092]
如本文所使用的,术语“组织”是指活的或死的生物体的组织或源自或旨在模仿活的或死的生物体的任何组织。
[0093]
如本文所使用的,术语“治疗有效量”是指足以实现所需效果的量。在治疗应用的背景下,有效量将取决于所讨论病症的类型和严重程度以及个体对象的特征,例如一般健康状况、年龄、性别、体重和对药物组合物的耐受性。在免疫原性组合物的背景下,在一些实施方案中,有效量是足以导致分解生物膜的量。在其他实施方案中,免疫原性组合物的有效量是足以导致针对抗原产生抗体的量。在一些实施方案中,有效量是赋予有此需要的对象无源免疫所需的量。关于免疫原性组合物,在一些实施方案中,除了上述因素外,有效量还取决于预期用途、特定抗原化合物的免疫原性程度和对象的免疫系统的健康/反应性。本领域技术人员将能够根据这些和其他因素确定合适的量。在体外应用的情况下,在一些实施方案中,有效量将取决于所讨论的应用的大小和性质。它还取决于体外靶标的性质和敏感性以及使用的方法。本领域技术人员将能够基于这些和其他考虑确定有效量。根据实施方案,有效量可包括组合物的一次或多次给药。
[0094]
如本文所使用的,术语“治疗”包括预防在易患或患有疾病、障碍和/或病症的对象中发生疾病、障碍或病症;抑制疾病、障碍或病症,例如阻碍其进展;并且缓解或逆转疾病、障碍或病症,例如引起疾病、障碍和/或病症的消退。治疗疾病或病症还可以包括改善特定疾病或病症的至少一种症状。术语“听力损失/丧失”是指逮捕声音的能力受损;因此,其治疗意味着上面列出的任何一种对逮捕声音能力的影响。术语“感觉神经性听力损失”是指特定类型的听力损失,其中内耳或从内耳到大脑的神经通路受损。
[0095]
2.执行本发明的模式
[0096]
本公开的方面涉及通过将一种或多种药剂或组合物施用于耳朵的特定组织或区域来治疗听力损失(任选地感觉神经性听力损失)和/或替换、再生或保护毛细胞的方法。
[0097]
可基于本公开的方法治疗的耳朵区域包括但不限于在图1中标记的其外耳区域、中耳区域或内耳区域。
[0098]
组合物
[0099]
本公开的方面涉及降低内耳组织中基因的表达的组合物或药剂和第二药剂。
[0100]
在一些实施方案中,所述降低内耳组织中基因的表达的组合物或药剂是干扰核酸,例如sirna、shrna、mirna、反义寡核苷酸(aso),和/或包含一个或多个经修饰的核酸残基的核酸。在一些实施方案中,干扰核酸被优化(基于序列)或化学修饰以在递送至目标组织之前和/或之后使降解最小化。这些干扰核酸的市售来源包括但不限于thermo-fisher scientific/ambion、origene、qiagen、dharmacon和santa cruz biotechnology。在一些实施方案中,可以进行这样的优化和/或修饰以确保将干扰核酸的足够有效负载递送至目标组织中。其他实施方案包括使用小分子、适体或寡核苷酸,所述小分子、适体或寡核苷酸通过与基因的dna结合来限制表达,例如抗原寡核苷酸,或通过包括但不限于直接结合靶向转录物或基因产物或一种或多种其他蛋白质的使得所述基因的表达降低的机制来施加转录后基因沉默(ptgs);或使用其他减少特定基因表达的小分子诱饵来降低基因的表达。在一些实施方案中,降低内耳组织中基因的表达的组合物或药剂可包括通过其调节基因的通路的抑制剂,例如notch信号通路抑制剂,例如γ分泌酶抑制剂(因为例如hes1的转录是由notch信号介导的)。
[0101]
在一些实施方案中,所述基因是hes1、hes5或mapkl。这些基因的非限制性示例性序列和针对它们的sirna序列提供于例如美国专利号9,101,647中,其通过引用整体并入本文。进一步的非限制性示例性sirna序列在下文提供,如seq id no:1-24(这些序列中的小写字母是任选的;seq id no:1-14,针对hes1;seq id no:15-20,针对hes5;seq id no:21-24,针对mapkl)。可以根据本领域已知的方法,例如,fakhr et al.(2016)cancer gene ther.23(4):73-82,测定另外的序列。
[0102][0103]
*分子1和3具有与小鼠/人转录物中保守靶序列互补的引导序列;
[0104]
分子1的mrna靶序列在小鼠、大鼠、人和豚鼠hes1转录物中是保守的。
[0105]
氨基酸位置对应于部分或完全编入由引导链结合的mrna基因座内的密码子。
[0106][0107]
*分子5和7具有与小鼠/人转录物中保守靶序列互补的引导序列;
[0108]
分子5和7的mrna靶序列在小鼠、大鼠、人和豚鼠hes1转录物中是保守的。
[0109]
氨基酸位置对应于部分或完全编入由引导链结合的mrna基因座内的密码子。
[0110][0111]
氨基酸位置对应于部分或完全编入由引导链结合的mrna基因座内的密码子。
[0112][0113]
*分子11具有与小鼠/人转录物中的保守靶序列互补的引导序列;
[0114]
分子11的mrna靶序列在小鼠、人和豚鼠mapk1转录物中是保守的。
[0115]
氨基酸位置对应于部分或完全编入由引导链结合的mrna基因座内的密码子。
[0116]
在一些实施方案中,所述第二药剂是引发组合物。在一些实施方案中,所述引发组合物表现出一种或多种功能,所述功能选自稳定β连环蛋白、增加内耳中多能细胞的数量、增加内耳中预先存在的多能细胞的可塑性、或信令内耳的细胞中的分化。在一些实施方案中,该第二药剂是gsk-3抑制剂。在进一步的实施方案中,gsk-3抑制剂是6-溴靛玉红-3
’‑
肟(bio)或tideglusib(tide)。在一些实施方案中,第二药剂可包含一种或多种成分,例如但不限于gsk-3抑制剂和/或参与发育信号传导的一种或多种因子(例如碱性成纤维细胞生长因子(fgf2和/或fgf模拟物);该家族的非限制性实施例提供于例如katoh and katoh
(2006)cancer biol.therapy 5(9):1059-1064,其通过引用整体并入本文。
[0117]
配方
[0118]
在一些实施方案中,所述降低内耳组织中基因的表达的组合物可包括含有降低内耳组织中基因的表达的药剂的配方和/或颗粒。
[0119]
此类配方和/或颗粒的非限制性实施例包括纳米颗粒、脂质转染、凝胶或水凝胶(例如kechai et al.(2016)j control release.226:248-57)、纳米乳(例如美国公开号2005/0288292)、微粒(例如uang et al.(2012)electrophoresis.33(21):3173-80)、胶体悬浮液(例如ariana et al.(2016)otolaryngol head neck surg.154(5):917-9)、无菌悬浮液(例如ciprodex at http://www.ciprodex.com/)、溶液(例如parra et al.(2002)antimicrob agents chemother.46(3):859-62.)、气溶胶(例如li et al.(2013)ieee trans.biomed.eng.60(9):2450-2460)、粉末(例如http://fauquierent.blogspot.com/2009/10/treatment-of-chronic-draining-ear.html#ixzz459wcrk or)、滴耳液(例如winterstein et al.(2013)otolaryngol head neck surg.148(2):277-83)、纳米纤维(例如akiyama et al.(2013)int j nanomedicine.8:2629-2640)、或者乳脂(例如乳脂)。上文引用的所有参考文献都通过引用整体并入。
[0120]
在一些实施方案中,配方和/或颗粒特别适用于递送至内耳。例如,凝胶配方,例如热可逆水凝胶(例如pluronic f-127),允许药物保持在中耳中,与圆窗膜接触,使得药物可以扩散或被运输至内耳。胶体悬浮液同样可以特别配制用于直接注入内耳或穿过鼓膜以扩散或通过圆窗膜的其它方式的运输。同样地,可以配制包含多个纳米颗粒的纳米颗粒或配方用于通过例如磁力的受控递送。这种方法可以推广到微粒和/或替代的纳米级结构。
[0121]
在一些实施方案中,所述第二药剂可以被包含在与降低内耳组织中基因的表达的药剂相同或不同的配方和/或颗粒中。在一些实施方案中,所述第二药剂处于相同或不同的配方中和/或以促进其施用于靶组织的时间-相对于降低内耳组织中基因的表达的颗粒药剂同时或相继地。例如,对于同时递送但顺序释放,所述第二药剂可以被包含在与持续释放配方和/或包含降低内耳组织中基因的表达的药剂的颗粒一起施用的溶液中。通过使用单一配方和/或颗粒可以实现类似的效果,所述配方和/或颗粒包含两种配制用于不同药剂的不同释放曲线的药剂。
[0122]
在一些实施方案中,所述纳米颗粒包含或包封降低内耳组织中基因的表达的药剂。在一些实施方案中,所述纳米颗粒包含可生物降解的聚合物。在进一步的实施方案中,所述可生物降解的聚合物是聚乳酸-羟基乙酸共聚物(plga)或聚乙二醇化的plga(peg-plga)。在一些实施方案中,纳米颗粒可包含其他添加剂,包括但不限于聚乙烯醇(pva)或其他已知的纳米颗粒稳定剂。在一些实施方案中,纳米颗粒是磁响应的或包括磁响应颗粒。在一些实施方案中,磁响应颗粒是氧化铁,任选地是超顺磁性氧化铁(spion)。在一些实施方案中,纳米颗粒可进一步被包含在溶液、悬浮液、凝胶或适于其递送的其他配方中。
[0123]
在进一步的实施方案中,相同或不同的纳米颗粒可包含或包封所述第二药剂。上文所述的纳米颗粒可通过油包水乳液或本领域已知的任何其他技术形成。因此,有多种选择可用于产生包含多于一种药剂的纳米颗粒,例如但不限于双核/壳加载(例如e.g.narayan et al.(2014)acta biomaterialia.2112-2124)、共包封(例如song et al.(2008)eur j pharm biopharm.69(2):445-53.)、以及逐层沉积(例如deng et al.(2013)
acs nano.7(11):9571-9584)。上文引用的所有参考文献都通过引用整体并入。
[0124]
可以配制纳米颗粒以促进释放的时间,例如,水溶性差的第二药剂(例如tide)可以被包封在载有亲水剂的纳米颗粒的有机壳中,所述亲水剂降低内耳组织中基因中的表达(例如sihes1)。由于第二药剂更容易接近水,它将首先释放,然后持续释放降低内耳组织中基因的表达的药剂。
[0125]
给药方式
[0126]
上述药剂、组合物、配方和/或颗粒可以同时或相继给药,所述第二药剂在降低内耳组织中基因的表达的药剂之前或之后给药。
[0127]
剂量可以通过本领域已知的方法容易地确定。例如,有效的体外剂量,例如约0.5至10μm的第二种药剂(例如,tide)和降低内耳组织中基因的表达的约20至320nm之间的药剂(例如,sihes1)可按比例放大至适当的体内剂量。降低内耳组织中基因的表达的药剂的非限制性示例性体内剂量为约100至300nm sihes1。在一些实施方案中,合适的体内剂量可以是约5nm至5mm的第二药剂(例如tide)和降低内耳组织中基因的表达的约1nm至5mm之间的药剂(例如sihes1)。预期适当的剂量方案可能需要以适当的间隔对每种药剂施用一次或多次剂量;这些间隔可能因药剂或指示而异。适当的给药间隔可以是约一天、两天、三天、四天、五天、六天、一周、两周、三周、四周、五周、一个月、两个月、三个月或更多。
[0128]
在一些实施方案中,应用和/或给药可以是例如指定的药剂或组合物的直接施用、注射或输注。在一些实施方案中,所述指定的药剂或组合物可以通过圆窗膜(rwm)直接注射或通过穿过rwm放置的临时或永久性套管输注来施用。在一些实施方案中,输注或注射可以通过附接的微量输注泵、透析设备或流体交换系统来辅助。在类似的实施方案中,注射或输注技术也可以应用于卵圆窗和/或卵圆窗韧带或环。所述注射或输注还可以通过耳蜗造口术或其他进入骨迷路(boney labyrinth)(例如半圆形管之一)的开口来完成。或者,可以在迷路上移除皮质骨,并且可以将指定的药剂或组合物施加在去皮的骨上以进行骨内递送。在一些实施方案中,所述组合物或药剂通过静脉内或动脉内给药全身递送。
[0129]
上面列出的给药途径并非详尽无遗。通常,有多种递送到内耳的方式,分为两大类:通过造口术进入内耳(必要时,通过钻、刀或激光打开)以及通过rwm、镫骨足板的韧带或通过耳蜗区域或前庭结构(通常情况下,骨骼区域变薄到一定厚度,以便只留下最薄的骨骼,将中耳空间分开,形成内耳骨内膜和液体)扩散。
[0130]
在一些实施方案中,在使用造口术的情况下,所述造口术通过机器或手工进行。在一些实施方案中,所述造口术穿过镫骨的足板、穿过钻入耳蜗的开口、穿过钻入半规管的开口、穿过前庭导水管、通过耳蜗造口术、通过直接进入rwm。在一些实施方案中,所述造口术用于植入电极的插入;因此,一种或多种所公开的配方和/或颗粒可以与电极表面结合以将一种或多种药剂或组合物洗脱到环境中。在一些实施方案中,经受造口术的一个或多个开口可在约一天至约一周、两周、三周、四周或一个月之间开放,例如,在约1至30天之间开放。在一些实施方案中,所述造口术适合于在开口开放的持续时间内单次注射或连续输注。
[0131]
在一些实施方案中,在采用扩散的情况下,所述药剂、组合物、配方和/或颗粒允许扩散穿过特定的膜结构进入内耳液。非限制性示例性配方包括溶液、凝胶、乳液或悬浮液。例如,凝胶或丸粒可适合于递送上文所述的一种或多种药剂、组合物和/或颗粒。例如,凝胶可以经鼓室地放置在镫骨上方和rwm上方以及在变薄的骨区域上以通过增加用于递送的表
面积来增强递送。同样地,可以将固体或半固体颗粒放置在镫骨足板、rwm或变薄的骨区域上,作为增强药物与所述膜接触并防止药物从中耳空间移除的手段。
[0132]
不受理论束缚,向内耳液输送药物的侵入性较小的扩散方法的挑战之一可能是rwm的小表面积和镫骨足板韧带的甚至更小的表面积。在一些实施方案中,本领域已知为“蓝衬(blue-lining)”的步骤可以解决该问题。通过“蓝衬”,钻出的区域极度变薄并且几乎不覆盖内耳内表面上的骨内膜。这可以大大增加吸收的表面积,并且可以比实际打开进入耳内或其他内耳区域的侵入性小。熟练的耳科医生应该能够安全地执行此步骤。
[0133]
在一些实施方案中,可以通过鼓膜进行单次或多次注射来实现递送。在一些实施方案中,可以通过插入鼓膜中的塑料管进行单次或多次注射来实现递送。在一些实施方案中,可以通过导管连续输注来实现递送,其中其尖端直接放置在将要发生扩散的区域上。
[0134]
试剂盒
[0135]
还要求保护包含进行如本文所述的体外和体内方法所必需的药剂和说明书的试剂盒。因此,本公开提供了用于实施这些方法的试剂盒,其可包括本公开的一种或多种药剂、组合物、配方和/或颗粒以及用于实施本公开的方法的说明书,例如收集组织和/或进行筛选,和/或分析结果,和/或给予有效量的如本文所定义的干扰剂。这些可以单独使用或与其他合适的治疗剂组合使用。
[0136]
适应症
[0137]
在一些实施方案中,本公开的配方、组合物、方法、给药方式和药剂盒可用于治疗一种或多种适应症。本文考虑的非限制性示例性适应症包括感觉神经性听力损失,其导致由大声噪声、声创伤、爆炸冲击波、毒素、病毒或细菌感染、衰老引起的耳蜗感觉毛细胞的损失,还包括涉及感觉毛细胞损失和代谢病症(如糖尿病或甲状腺功能减退症)的遗传性听力损失。进一步的非限制性示例性适应症包括由于毒素、创伤、病毒或细菌感染、衰老、基因诱导的平衡感觉毛细胞损失或代谢病症(例如糖尿病或甲状腺功能减退症)引起的外周前庭器官(嵴或斑)中的感觉毛细胞的损失或损伤而引起的平衡障碍。
3.实施例
[0138]
以下实施例是非限制性的并且说明了可以在实施本公开的各种情况下使用的步骤。另外,下文公开的所有参考文献都通过引用整体并入。
[0139]
实施例1-sihes1纳米颗粒的生成及其评估
[0140]
生成负载的纳米颗粒
[0141]
为此研究制备的载有sirna的plga纳米颗粒通过先前报道(cun et al.(2010)intl.j.pharmaceutics 390:70-75;du et al.(2013)hear.res.304c:91-110)的水包油包水(wl/o/w2)双乳液溶剂蒸发方法来配制。简而言之,将sirna溶解于50μl te缓冲液(10mm tris-hcl和1mm edta的milliq水溶液,ph 7.5)中,并与含有100mg plga的100ml二氯甲烷(dcm)混合,并通过超声处理将混合物乳化成初级wl/o乳液。将4毫升5%(w/v)聚乙烯醇(pva)的milliq水溶液直接倒入初级乳液中,然后通过超声处理进一步乳化30秒
×
3以形成wl/o/w2双乳液。将得到的乳液用50ml 0.3%(w/v)pva的milliq水溶液稀释,并在室温下磁力搅拌2小时以蒸发dcm。通过在4℃下以13,000xg超速离心20分钟来收集plga纳米颗粒,用milliq水洗涤三次,重悬于5ml milliq水中,并冷冻干燥(在-100℃和40mtorr下)。载有
sirna的np的最佳配方由15nmol sirna、100mg plga和5%的pva制成。分别使用动态光散射(zetasizer nano zs,malvern,instruments ltd,worcestershire,uk)、uv-vis分光光度计(nanodrop 2000,thermo scientific,waltham,ma)和扫描电子显微镜(zeiss supra 55,vp,fe-sem,oberkochen,germany)对所得np的颗粒平均直径(pmd)、多分散指数(pdi)、药物包封效率百分比(ee%)和形态进行表征。合成的np通常储存在-80℃直至使用。
[0142]
体外纳米颗粒研究
[0143]
将新生(p3)鼠柯蒂氏器(oc)暴露于耳毒素4-羟基-2-壬烯醛(4-hne,450μm)24小时,然后未经处理或用非靶向乱序rna np(scrnanp)或载有hes1 sirna的plga np(hes1sirnanp)处理,7天后,将组织固定并用荧光团缀合的鬼笔环肽进行标记(图2)。或者,以与上述相同的方式进行实验,使用耳毒性氨基糖苷类新霉素(neo,0.75mm),并且随后进行载有hes1 sirna的plga np的治疗施用,将组织固定,并用针对毛细胞标志物的抗体肌球蛋白vila(myo7a)和荧光团偶联的鬼笔环肽来标记亲和力,以促进沿耳蜗螺旋长度免疫荧光介导的hc的定量(图4)。响应于hes1 sirna np处理,在暴露于耳毒素(4-hne或neo)的新生鼠oc中恢复的hc的数量中观察到剂量依赖性反应(图3和5)。
[0144]
体内纳米颗粒研究
[0145]
将成年染色豚鼠(250g,4周龄)暴露于以4khz为中心的130db spl的声过曝中2小时。在损伤后72小时(即延迟治疗),将载有800μg/ml非靶向乱序rna np或sihes1 np的微型渗透泵通过外科手术植入耳蜗的底回(耳蜗造口术),并在七天内将假性或治疗性处理单侧注入耳蜗,然后通过手术切除泵。在声损伤之前和损伤后24小时、2周、4周、8周和10周进行2、4、8和16khz的听觉脑干反应(abr)测量。在终末10周的abr记录期后,对动物实施安乐死并将耳蜗组织固定、微切割,并用标志物进行免疫标记以用于hc的可视化和定量。来自sihes1np处理的、暴露于噪音的豚鼠的耳蜗相对于来自用非靶向scrna np处理的暴露于噪声的豚鼠的耳蜗显示出内部和外部hc数量的显著恢复(图9-10)。
[0146]
将成熟的c57bl/6小鼠(4周龄)暴露于声过曝(8-16khz倍频带噪声,116db spl)中2小时。损伤后72小时,载有800μg/ml siheslnps的微型渗透泵通过外科手术植入后半规管,并在7天内单侧输注治疗处理,之后通过手术切除泵。处理后8周,对动物实施安乐死并将耳蜗组织固定、微切割,并用抗myo7a免疫标记以用于hc的可视化和定量。来自sihes1np处理的、暴露于噪音的小鼠的耳蜗相对于来自暴露于噪音的对照的耳蜗显示出内部和外部hc数量(在结构上正确的位置)的显著恢复(图11)。
[0147]
体外药物释放研究
[0148]
采用wangemann p,schacht j,dallos p,popper an,fay rr(eds.),thecochlea,sptinger,new york,1996,pp.130-185的透析方法,一式三份地进行来自载有hes1 sirna的plga np的体外药物释放研究。具体地,将1mg含有hes1 sirna或包封的(游离的)hes1 sirna的粉末状plga np悬浮在含有1ml无蛋白质的模拟外淋巴培养基(spm)的内部透析袋中(spectra/por float-a-lyzer g2,mwco 20kda,spectrum laboratories inc.,rancho dominguez,ca)。将含有胶体悬浮液的袋置于3ml的模拟内淋巴培养基(sem)中。将该系统置于37℃的水平水浴(vwr scientific water bath model 1211,sheldon manufactuing inc.,cornelius,or)中。以指定的时间间隔取出三个10μl等分试样的sem,并用30μl新鲜的sem替换以维持沉降条件。在每个时间点间隔(1-10天)计算平均药物释放百分比(%
±
标准
偏差)。
[0149][0150]
来自pgla纳米颗粒的sirna的释放动力学可以使用本领域已知的以下等式确定:零阶:
[0151]qt
=q0+k0t
[0152]
(药物释放速率与其溶解物质的浓度无关。)
[0153]
一阶:
[0154]
log q
t
=log q0+kt/2.303
[0155]
(药物释放速率取决于其浓度)
[0156]
hixson-crowell:
[0157][0158]
(药物通过溶解释放)
[0159]
higuchi:
[0160]qt
=kht
1/2
[0161]
(药物通过扩散释放)
[0162]
korsmeyer-peppas:
[0163]
f=(m
t
/m)=kmtn[0164]
(n=0.50表示菲克(fickian)扩散
[0165]
0.5<n<0.89表示异常扩散或非菲克扩散:扩散和侵蚀控制速率释放的组合。
[0166]
如果n>0.89表示情况2松弛或超高速运输-2:聚合物链的侵蚀。)
[0167][0168]
游离的hes1 sirna的释放曲线与零阶模型(r2=0.97)很好地吻合(图12)。这表明药物释放速率不依赖于外部模拟内淋巴培养基(sem)中可溶性sirna的量。因此,不管模拟外淋巴培养基(spm)中可溶性sirna的浓度如何,游离的hes1 sirna不断地通过半透膜扩散
(释放率百分比为6.6%/天)。hes1 sirna在最早的采样间隔穿过半透膜进入外部sem的显著初始迁移(20%,1天)与自由溶质的被动扩散一致。
[0169]
与游离的hes1 sirna相反,包封在plga np内的hes1 sirna的释放曲线显示出符合一阶(r2=0.97)、hixson-crowell(r2=0.95)和korsmeyer-peppas(r2=0.96,n=0.94)方程式的持续释放曲线(见图)。该扩散模式表明释放主要受hes1 sirna通过np的聚合物壳(plga)的延迟水解降解的溶解控制。此外,hes1 sirna的溶解伴随着plga聚合链的侵蚀。
[0170]
来自np悬浮液1(np1)和np悬浮液2(np2)的sirna的释放曲线的成对比较表明,释放速率随着np中sirna载量的增加而增加(释放率百分比分别为5.9和6.3%/天)。这表明药物释放速率取决于外部sem中可溶性sirna的量。两种np配方的hes1 sirna的低初始突释(-5%,1天)被解释为由于吸附在np表面上的sirna的存在。
[0171]
对于游离的sirna,在该药物释放模型系统中需要4.2天才能释放50%的初始载量。对于npl,需要7.8天才能释放50%的初始载量。对于np2,需要6.2天才能释放50%的初始载量。
[0172]
实施例2-bio和hes1 sirna
[0173]
未受损的pc
[0174]
培养来自鼠耳蜗的器官型培养物,然后在出生后第3天(p3)从cd1小鼠中收获。然后将这些外植体在适当的培养基中培养24小时。在相当于p4(即离体24小时)的情况下,将培养的柯蒂氏器(oc,即耳蜗感觉上皮细胞)浸泡在含有dmso(载体)或gsk3抑制剂6-溴靛玉红-3
’‑
肟(bio)的新鲜培养基中,并相应地将oc培养72小时。在相当于p7(即离体96小时)的情况下,用20nm hes1sirna转染来自两个处理组的培养物子集(jetsi 10mm,polyplus transfection,illkirch,france)24小时。为了检查顺序施用的效果,在没有bio的培养基中转染sihes1。为了检查同时施用的效果,在含有bio的培养基中转染sihes1。在24小时转染培养期后,指定用于检测两种药剂的顺序处理的培养物在不含bio的培养基中培养,而指定同时施用的培养物在bio存在下培养额外的48小时。将所有培养物保持在不含任何一种测试药剂的培养基中最后24小时,之后将组织固定在4%多聚甲醛溶液中并用针对毛细胞标志物的抗体肌球蛋白vila(myo7a)和适当的二级抗体进行免疫标记,用于随后沿着耳蜗螺旋长度的hc的免疫荧光介导定量(图13)。
[0175]
neo损伤的椭圆囊
[0176]
培养来自鼠椭圆囊斑(utricular maculae)的器官型培养物(平衡器官感觉上皮细胞),然后在出生后第3天(p3)从cdl小鼠中收获。然后将这些外植体在适当的培养基中培养二十四小时。在相当于p4(即离体24小时)的情况下,将培养的椭圆囊浸泡在含有耳毒性氨基糖苷类新霉素(neo)的新鲜培养基中24小时以诱导hc损失,然后在p5上施用dmso(载体)或gsk3抑制剂6-溴靛玉红-3
’‑
肟(bio,2.5μm)。相应地培养椭圆囊72小时。在相当于p8(即离体120小时)的情况下,用不含治疗剂的新鲜培养基替换培养物,并用20nm hes1 sirna转染来自两个处理组的培养物的子集(jetsi 10mm,polyplus transfection,illkirch,france)或在存在5μm的notch通路抑制剂ly411575的条件下孵育,并再培养72小时。然后将所有培养物保持在不含任何一种测试药剂的培养基中最后24小时,之后将组织固定在4%多聚甲醛溶液中并用针对毛细胞标志物的抗体肌球蛋白vila(myo7a)和适当的第二抗体进行免疫标记,用于随后沿着耳蜗螺旋长度的hc的免疫荧光介导定量(图14-17)。
tideglusib被包含在培养基中用于培养物的子集。在p11上,所有培养基都被不含任何治疗剂的新鲜培养基替换。在p12上,将组织固定以用于免疫标记。在暴露于耳毒性氨基糖苷类eo后,该治疗范例的比较分析的一个实施例如图22所描绘。在用tide和sihes1组合处理的培养物中,在暴露于耳毒素的oc的中顶回中观察到更多的hc数量,以及tide和sihes1的分阶段组合在这些条件下引起hc数量的最显著增加(图22-24)。图22中数据的hc定量结果显示在下表中。
[0186][0187]
使用上述tide和sihes1的分阶段应用重复该实验,其结果强调了在预先施用tide之后用于恢复hc数量的sihes1功效的以表明药剂之间的协同作用的方式的显著增强(图23-24)。
[0188]
再次重复该实验范例,添加另外的处理组,其中fgf-2任选地在p5、p7和p9以2ng/l被包含在培养基中用于培养物子集。在用tide和sihes1的分阶段组合处理的培养物中,在oc的中顶回和中回中观察到更高的hc数量,同时添加fgf-2(在该浓度下其自身不引起治疗反应)至生长培养基中通过oc的中底回(通常对出生后哺乳动物耳蜗中的hc再生更加顽固的区域)增强tide/sihes1处理的治疗效果(图25-26)。
[0189]
实施例4-进一步的纳米颗粒实验
[0190]
使用载有sihes1的纳米颗粒——持续释放配方——以及各种剂量的tide以及使用包含sihes1和tide的纳米颗粒重复实验2和/或3的子集。
[0191]
在该方案的一些重复中,持续释放的sihes1纳米颗粒和tide的共同施用以设计用于模拟tide和sihes1脂质转染复合物的分阶段施用的方式进行。使用实验2和3中描述的新霉素方案实现模拟,添加tide(在递增剂量在0.5至20μm之间的一些重复中)和同时施用的持续释放的sihes1纳米颗粒。
[0192]
此外,用sihes5和simapk1重复所有上述参考实验。
[0193]
以下是示例性方案。
[0194]
申请人假设,从生物相容性plga np中延迟但持续释放的sihes1将概括当共同施用两种药物时分阶段应用gsk3抑制剂和针对hes1的sirna的治疗属性。为了测试该假设,使用亚最大有效剂量(60nm)的sihes1 np以及递增剂量(0.5、2和10μm)的gsk3i(tideglusib)以具有足够的实验余量,来评估在新霉素(neo)暴露的柯蒂氏器(oc)的器官型培养物中的再生剂量-反应曲线。使用该范例,随后在6天的过程中,单独使用sihes1np或与tideglusib组合地培养neo消融的oc,然后进行固定和免疫组织学分析。
[0195]
如图37和38所示,当oc与递增剂量的tideglusib联合处理时,观察到sihes1 np诱导的毛细胞(hc)再生的清晰的浓度依赖性增强。但是,单独使用tideglusib处理并未引起统计学上显著的再生反应,这表明它可能在此背景下充当引发剂以固有地增强sihes1介导的反应,而不是独立地作用以再生hc。
[0196]
这些处理组中hc数量的定量显示,在oc的中回浓度为10μm以及在oc的底回浓度为2和10μm的临床相关的gsk3抑制剂tideglusib在sihes1 np再生功效中促进了统计学上显著的增加(相对于单独的sihes1 np)。在sihes1 np再生反应始终最高的中顶区域,处理组之间没有统计学上显著的差异。由于缺乏单独由tideglusib诱导的再生反应,由该组合治疗策略诱导的增强的治疗效果可以描述为在hc数量中治疗增加方面是协同的。
[0197]
实施例5-额外的纳米颗粒实验
[0198]
通过如前所述稍加修改的水包油包水(w/o/w)双乳液溶剂蒸发法,制备载有sihes1(分子#1)的聚乳酸-羟基乙酸共聚物(plga)或聚乙二醇-plga纳米颗粒(peg-plga np)。mccall and sirianni(2013)j vis exp.82:51015;doi:10.3791/51015。
[0199]
简而言之,将一定体积的sihes1水溶液(100μl)滴入1,000μl含有100mg plga的plga np或50mg plga和50mg peg-plga的peg-plga np的二氯甲烷(dcm)中(表1)。
[0200]
通过超声处理(10秒,25w)(microson ultrasonic cell disruptor xl misonix inc.,farmingdale,ny)将混合物乳化成初级w1/o乳液。对于plga np,将初级乳液稀释在4ml5%pva水溶液中。将得到的二级乳液稀释在milliq水(millipore co.,billerica,ma)中的50ml 0.3%(w/v)(plga np)或0.125%pva(w/v)(peg-plga np)中并在室温下磁搅拌2小时(ro 10,ika-werke gmbh&co,staufen,germany)以蒸发dcm。通过在10℃下以13,000g超速离心20分钟(tomy mx-201高速冷冻微量离心机)收集peg-plga np,用milliq水洗涤三次以除去过量的溶剂(dcm)和残留的pva,然后在无菌玻璃容器在5ml milliq水中重悬,并在-100℃、40mtorr(virtis benchtop冷冻干燥器,gardiner,ny)下冷冻干燥连续三天。
[0201]
将获得的粉末状np在uv下灭菌20-30分钟并储存在-80℃直至进一步使用。
[0202]
表1.载有sihes1的纳米颗粒的配方参数。
[0203][0204]
载有sihes1的聚乙二醇化plga np(表2)比标准plga配方更小(即降低的颗粒平均直径[pmd])和带有更少的负电荷(即增加的ζ电位[zp])。装载到peg-plga纳米颗粒配方中的sihes1(pmol/mg)的量相对于plga配方随着纳米载体的尺寸减小而成比例地降低。
[0205]
表2.平行合成的载有hes1 sirna的plga和peg-plga np的代表性配方的比较物理化学性质。
[0206][0207]
基于它们的大小和物理化学性质,我们假设载有sirna的peg-plga np很容易被内
耳细胞内吞。为了评估该假设并比较内耳细胞中载有sirna的peg-plga np相对于plga np的摄取,使用与用于合成sihes1 np的相同的合成方法将荧光素(fam)-缀合的非靶向sirna模拟物(乱序rna,scrna)双链体包封在alexfluor 555-缀合的peg-plga和plga np配方中。在合成之前,使用碳二亚胺偶联反应(chan et.al.(2010)methods mol biol.624:163-75)进行alexa fluor 555(af555,mw:1.25kda,thermofisher,rockford,il)与plga(mw:15kda)(polymers material inc.,montreal,canada)的缀合。将等摩尔量的plga和af555混合并在室温下搅拌过夜。通过透析(spectra/por float-a-lyzer g2,mwco 3.5-5kda spectrum laboratories inc.rancho dominguez,ca)对去离子水(direct-q 3uv system,millipore sas,molsheim,france)除去未反应的组分,在室温下放置3小时。将含有plga缀合的af555的纯化悬浮液在纯化水中回收,并在8℃以15,000rpm离心30分钟。
[0208]
合成后,所得的载有fam-scrna的alexafluor555plga或peg-plga np(以下称为双荧光团nps)在尺寸、电荷和残留的pva含量方面具有可比性,如载有sihes1的np,表明它们有能力用作sihes1纳米载体配方的可行替代物(表3)。
[0209]
表3.平行合成的载有双荧光团标记的非靶向sirna的plga和peg-plga np的代表性配方的比较物理化学性质。
[0210][0211]
使用紫外光谱-光谱法(uv-spec)和共聚焦显微镜的组合,在33℃、5%co2下孵育24小时后,在imo-2b1鼠内耳细胞中检查双荧光团plga和peg-plga np的细胞摄取。
[0212]
对于uv-spec,将细胞接种在96孔板中并在完全生长培养基中培养以达到70%汇合。24小时后,将细胞与200、400、800μg/ml在33℃、5%co2下孵育24小时。在用pbs溶液洗涤三步后,用50μl的0.2%台盼蓝淬灭细胞外荧光1-5分钟(gibco,brl,grand island,ny)(hed j.methods for distinguishing ingested from adhering particles.methods enzymol.1986;132:198-204)。使用酶标仪(beckman coulter dtx 880multimode detector,brea,ca)在对于fam scrna为485
±
20nm的发射波长和525
±
25nm的激发波长和对于af555plga为555
±
20nm的发射波长和572
±
25nm的激发波长下测定内化荧光强度。阳性对照(pc)孔,其中在培养基排空之前孵育的np悬浮液的未洗涤荧光,用于建立每个参考标准的100%荧光。未与双荧光团np配方一起孵育的细胞的正常对照(nc)孔用作背景对照。np摄取的酶标仪评估表明,在400和800μg/ml的剂量下,peg-plga np相对于plga np表现出优异的内化(图29,**,p<0.01)。在浓度为200μg/ml时,两种配方之间内化np的总荧光强度相似。
[0213]
在用荧光团标记的np孵育24小时后,imo-2b1固定细胞的共聚焦显微镜证实,两种配方以剂量依赖性方式在细胞内内化(图30)。虽然载有sirna的plga np在imo-2b1细胞内表现出异分散定位模式,但是等效的peg-plga np配方表现出比plga np更一致的核周定位(图30-33)。该观察结果表明,peg-plga np在对于sirna介导的基因沉默是最佳的亚细胞区域中递送的sirna生物分子的更有效递送和积累(chiu et al.(2004)chem.biol.11(8):1165-75)。
[0214]
为了评估载有sihes1的peg-plga np配方的潜在细胞毒性作用,将imo-2b1细胞与
plga或peg-plga配方一起孵育48小时,然后进行3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴化物(mtt)测定以评估细胞活力。mtt测定法是一种通过将黄色四唑鎓染料mtt还原成其不溶性紫色产物甲瓒(formazan)来测量nad(p)h依赖性细胞氧化还原酶活性、从而客观地定量细胞代谢能力的比色法。
[0215]
因此,通过比较测试孔中形成的总甲瓒产物的量与未处理的细胞的对照孔中形成的相应量,可以辨别评估中的药物的相对细胞毒性作用。使用该方法,在暴露48小时后,imo-2b1细胞充分耐受高达800μg/ml(~66nm sirna当量)的剂量递增的载有sihes1的peg-plga np(图34)。在测试的最高浓度下,使用mtt测定法测定np配方与未处理对照(utd)相比,没有观察到统计学上显著的细胞存活率损失。相反,用细胞毒性水平(2%)的非离子型去污剂tritonx-100(tx)处理的孔在该测定中显示出明显的细胞活力损失。
[0216]
为了测试包封在peg-plga np中的sihes1生物分子(分子#1)的相对沉默效率,将剂量递增的载有sirna4的plga和peg-plga np与imo-2b1细胞的亚汇合孔一起培养,使得成对的剂量控制每个孔中的总sirna(28.8、57.6、115.2nm sirna当量)。在np处理开始后72小时,分离总rna并使用针对hes1和管家基因gapdh的引物进行rt-qpcr分析。通过2-δδct
方法测定相对hes1水平。参见livak and schmittgen(2001)methods25(4):402-8.。
[0217]
与其明显增强的摄取效率和功能最佳的核周累积模式一致,载有sihes1(分子#1)的peg-plga np在低剂量当量下比plga np对hes1表达引起更明显的沉默效应(图35,###,p<0.001,相对于由peg-plga np相对于plga np在指定剂量下诱导的沉默程度)。
[0218]
在蛋白质水平对imo-2b1中sihes1kd效率的靶向比较(暴露后96小时),反映了在转录水平hes1的测量获得的结果(暴露后72小时)(图36)。np孵育后,用抗hes1的抗体对细胞提取物进行免疫印迹,并使用nih image j软件通过光密度分析测定免疫印迹中hes1的相对水平。每条道下面的数字表示相对于每个印迹中未处理的(模拟)对照样品在每种提取物中测量的hes1蛋白质的量。在浓度为350μg/ml及以上时,观察到聚乙二醇化的plga np的hes1蛋白质显著降低,而plga np的hes1水平的明显降低首次在600μg/ml及以上观察到。
[0219]
实施例6-给药的持续时间实验
[0220]
在后续实验中通过限制给药至仅一天(24小时),在震耳欲聋后72小时开始,测试sihes1 np的治疗剂量的持续时间。如图39所示,使用该替代给药范例,早在输注后三周,在多个测试频率上观察到显著的、统计学上显著的听力改善。如图40所示,在延长的9周时间内也观察到显著的听力改善,在高频率基底区域中具有最大的逐步改善。这些结果显示,对于恢复噪声变聋的动物的听觉功能,一天的sihes1 np输注似乎与10天输注一样有效。虽然这个结果有点令人惊讶,但它表明,在这种情况下,np介导的sihes1的递送导致sirna有效加载到内源性多蛋白rna诱导的沉默复合物(risc)中,一旦加载,就可以在非分裂细胞中单剂量给药后维持基因沉默数周。参见wei et al.(2011)mol pharmacol.79(6):953.pubmed pmid:21427169;bartlett et al.(2006)nucleic acids res.34(1):322.epub 2006/01/18.pubmed pmid:16410612;pmcid:1331994;bartlett et al.(2007)biotechnol bioeng.97(4):909.pubmed pmid:17154307。
[0221]
用本文所描述的组合疗法重复类似的实验。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1