一种类过氧化氢纳米酶水凝胶及其制备方法与应用
1.本发明属于生物医药材料技术领域,涉及一种类过氧化氢纳米酶水凝胶及其制备方法与应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.据发明人研究了解,糖尿病伤口长期难以愈合由多种因素共同导致,第一,慢性高血糖使伤口局部代谢紊乱,形成慢性炎症的微环境,伤口周围的血管及神经都遭到破坏,在血供缺乏及营养供给不足的情况下伤口难以愈合。第二,持续的开放性创面通常伴随难以控制的细菌感染,尤其是耐药性细菌使伤口感染治疗变得困难,感染伤口未能有效控制将进一步转变为慢性溃疡,面临截肢甚至死亡等不良结局。目前常用的临床治疗方法包括多次清创和伤口脓液引流,但都难以满足促进伤口愈合的同时抵抗细菌感染的治疗要求。
技术实现要素:
4.为了解决现有技术的不足,本发明的目的是提供一种类过氧化氢纳米酶水凝胶及其制备方法与应用,本发明提供的类过氧化氢纳米酶水凝胶集改善缺氧环境、抗菌、抗炎、抗氧化、促进血管再生、促进细胞增殖功能于一体,从而促进糖尿病伤口愈合。
5.为了实现上述目的,本发明的技术方案为:
6.一方面,一种类过氧化氢纳米酶水凝胶,由温敏性水凝胶和类过氧化氢纳米酶组成,所述类过氧化氢纳米酶负载在温敏性水凝胶内,所述类过氧化氢纳米酶由银纳米颗粒表面包覆金属多酚网络结构(mpn)涂层形成,mpn涂层表面连接表面生长因子(egf),所述mpn涂层由三价铁离子与没食子酸(ga)络合形成。
7.另一方面,一种类过氧化氢纳米酶水凝胶的制备方法,将银纳米颗粒溶液加入至含有固体三价铁源的容器中,再加入没食子酸溶液,在溶液扰动的条件下进行反应,使三价铁与ga在银纳米颗粒表面络合形成mpn涂层,获得gap;
8.向gap溶液中加入egf,在1~10℃和搅拌条件下进行反应,使得mpn涂层中的三价铁与egf内部的富含组氨酸和蛋氨酸的结构域结合,获得类过氧化氢纳米酶;
9.将类过氧化氢纳米酶加入至温敏性水凝胶溶液中,混合均匀,即得。
10.第三方面,一种上述类过氧化氢纳米酶水凝胶在制备促进糖尿病伤口愈合的药物中的应用。
11.本发明提供的类过氧化氢纳米酶水凝胶通过ga和铁(fe iii)络合形成一种核壳结构的纳米颗粒ga/fe@ap(gap),进一步通过铁离子直接和egf表面的组氨酸和蛋氨酸通过配位作用连接,最终形成了多功能纳米药物egf+ga/fe@ap(egap)。egap具有较好的抗菌、抗氧化、抗炎、供氧活性及促血管生成的作用。此外,为了实现在伤口局部应用的目的,本发明
使用具有生物相容性好、安全性高、形状自适性功能的温度敏感性水凝胶作为载体,将具有治疗作用的egap包裹其中,形成了原位水凝胶药物治疗体系egap@hg。这种治疗体系为细胞增殖、血管生成、肉芽组织形成和上皮再生提供了舒适的微环境,在体内和体外都显著加速了糖尿病类伤口愈合的愈合。
12.本发明的有益效果为:
13.1.本发明制备的类过氧化氢纳米酶结构稳定,并且egap@hg类过氧化氢纳米酶水凝胶可在糖尿病伤口局部注射治疗。制备的egap类过氧化氢纳米酶颗粒为明显的核壳结构,dls动态光散射(dls)确定egap的平均直径为137.3nm,ζ电位分别为-26.87
±
1.44mv。制备的egap@hg类过氧化氢纳米酶水凝胶在常温下为流体状态,可用注射器在皮肤伤口局部进行注射,注射到皮肤伤口后,可随着温度升高变成凝胶状态,粘附在伤口表面,形成保护性物理屏障和维持湿性愈合环境。
14.2.本发明提供的类过氧化氢纳米酶水凝胶生物相容性好,安全性高。经体外溶血实验、细胞活死染色实验及体内毒性试验,证明具有良好的生物相容性,不会对细胞活力或者小鼠皮肤及体内脏器造成伤害。
15.3.本发明提供的类过氧化氢纳米酶水凝胶利用药物的协同作用提高疗效,创造性的将mpn、ap与egf相结合。mpn一方面发挥类过氧化氢酶效果,将伤口局部的h2o2转化为o2,缓解伤口缺氧环境,同时发挥抗炎、抗氧化作用。而ap释放有效杀灭伤口细菌,egf则促进伤口细胞增殖及血管生成。体内实验可见与对照组或者单因素治疗组(单纯抗菌组或者单纯促愈合组)相比较,egap@hg伤口处再上皮化、胶原蛋白沉积及血管生成效果显著,明显加快糖尿病伤口的愈合速度。
附图说明
16.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
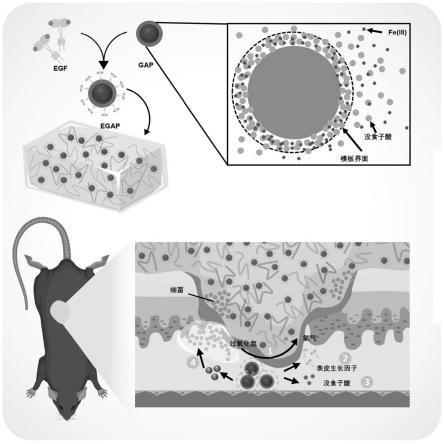
17.图1为本发明实施例制备的egap@hg促进糖尿病伤口愈合的示意图;
18.图2为本发明实施例中gap的连续组装过程(a)以及mpn网络分子结构图(b);
19.图3为本发明实施例中egap的合成及表征图,a为gap组装过程的照片,b为egap的制造的示意图,c为ga、ap、gap和egap的紫外-可见-近红外吸收光谱,d为ap的代表性tem图像,e为egap的代表性tem图像,f为ap、gap和egap的尺寸分布,g为ap、gap和egap的ζ电位,h为egf与gap的结合率,i为egap与过氧化氢共存的不同时间的反应效率;
20.图4为本发明实施例中hg、egap@hg合成模式图及性质表征图,a为hg的制造示意图,b为hg和egap@hg在不同温度(25℃和37℃)下的状态的可视化。在37℃,hg和egap@hg明显处于凝胶状态,而在25℃,它们处于溶胶状态,c为可注射的egap@hg,d为hg和egap@hg的应变实验,e为hg和egap@hg的自愈合性检测,在两个周期内应用1%至100%的交替应变;
21.图5为本发明实施例中egap@hg体外治疗效果,图a和b分别为抑菌圈实验中对金黄色葡萄球菌的抑制区的照片和定量统计,c和d分别为菌落计数实验中金黄色葡萄球菌活力的照片和定量统计,e为用pbs和不同的条件培养基培养24小时后hacat细胞的活力,f和g分别为与egap@hg培养0小时、12小时、18小时、24小时和36小时后,hacat细胞迁移区域的定量分析和形态学;
22.图6为本发明实施例中egap@hg的生物相容性、体外毒性、体内毒性的实验结果图,a和b分别为与triton x-100、pbs、hg、gap溶液、egap溶液、gap@hg提取物或egap@hg提取物孵育1小时后的照片和溶血率,c为hacat细胞与不同条件培养基培养24小时后的活/死检测的共聚焦显微镜图像,d为体内毒性实验中伤口的代表图像;
23.图7为本发明实施例中egap@hg对糖尿病伤口愈合的实验结果图,a为糖尿病诱导和随后的感染性伤口诱导和愈合的实验设计示意图,b为创伤后和治疗后第3、5、7和10天的伤口代表图像,c为不同组别在第3天至第10天的伤口面积示意图,d为第3天、第5天、第7天和第10天的残余伤口的量化;
24.图8为本发明实施例中egap@hg促进糖尿病伤口愈合的组织学评估结果图,a为第10天不同组别伤口组织切片的h&e染色代表图像,b为第10天不同组别伤口组织切片的masson三色染色代表图像,c为第10天不同组伤口组织切片的cd31免疫组化图像。
具体实施方式
25.应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
26.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
27.鉴于现有药物难以促进糖尿病伤口愈合,本发明提出了一种类过氧化氢纳米酶水凝胶及其制备方法与应用。
28.本发明的一种典型实施方式,提供了一种类过氧化氢纳米酶水凝胶,由温敏性水凝胶和类过氧化氢纳米酶组成,所述类过氧化氢纳米酶负载在温敏性水凝胶内,所述类过氧化氢纳米酶由银纳米颗粒表面包覆mpn涂层形成,mpn涂层表面连接egf,所述mpn涂层由三价铁离子与ga络合形成。
29.在一些实施例中,mpn涂层表面通过三价铁与egf内部的富含组氨酸和蛋氨酸的结构域结合与egf连接。
30.在一些实施例中,所述银纳米颗粒为氨基修饰的银纳米颗粒。
31.在一些实施例中,类过氧化氢纳米酶的直径为120~140nm。
32.在一些实施例中,银纳米颗粒的直径为100~120nm。
33.在一些实施例中,所述温敏性水凝胶为泊洛沙姆水凝胶。具体地,所述泊洛沙姆水凝胶为泊洛沙姆407与泊洛沙姆188按照质量比为3.0~4.0:1混合制备获得。
34.本发明的另一种实施方式,提供了一种类过氧化氢纳米酶水凝胶的制备方法,将银纳米颗粒溶液加入至含有固体三价铁源的容器中,再加入没食子酸溶液,在溶液扰动的条件下进行反应,使三价铁与ga在银纳米颗粒表面络合形成mpn涂层,获得gap;
35.向gap溶液中加入egf,在1~10℃和搅拌条件下进行反应,使得mpn涂层中的三价铁与egf内部的富含组氨酸和蛋氨酸的结构域结合,获得类过氧化氢纳米酶;
36.将类过氧化氢纳米酶加入至温敏性水凝胶溶液中,混合均匀,即得。
37.本发明所述的固体三价铁源为不溶于溶剂且含有三价铁的固体物质,例如锈钉等。采用锈钉作为固体三价铁源时,将铁钉依次进行去除油脂和酸洗获得。具体地,去除油脂时,先采用脱脂溶液洗涤,然后采用丙酮将附着在铁钉表面的脱脂溶液洗涤脱除。具体地,采用5~15%的盐酸进行酸洗。
38.在一些实施例中,银纳米颗粒与ga的添加质量比4~6:1。
39.在一些实施例中,溶液扰动的条件的方法为:持续摇动,摇动的频率为30~50rpm。
40.在一些实施例中,在溶液扰动的条件下进行反应的时间为50~70min。
41.在一些实施例中,在溶液扰动的条件下进行反应后,取出固体三价铁源,将溶液离心分离,收集沉淀,采用超纯水对沉淀进行分散,再离心分离,获得gap。gap溶液是将gap分散于超纯水中获得。
42.在一些实施例中,在1~10℃和搅拌条件下进行反应中,搅拌的数量为550~650rpm。
43.在一些实施例中,egf与ga的加入质量比为1:550~650。
44.在一些实施例中,在1~10℃和搅拌条件下进行反应的时间为50~70min。
45.在一些实施例中,温敏性水凝胶的制备方法为:将泊洛沙姆407与泊洛沙姆188按照质量比为2.0~4.0:1(优选为2.0~3.0:1)加入至1~10℃的水中混合均匀获得。
46.本发明的第三种实施方式,提供了一种上述类过氧化氢纳米酶水凝胶在制备促进糖尿病伤口愈合的药物中的应用。
47.所述药物为外用制剂,例如膏剂、擦剂、贴剂等。
48.为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
49.实施例
50.egap类过氧化氢纳米酶颗粒的制备:
51.固态源性的铁钉(3~4cm左右长)先用脱脂溶液洗涤脱去表面的油脂,然后用milli-q水彻底清洗脱脂的铁钉,并晾干,然后在丙酮中浸泡10分钟用milli-q水清洗后晾干。接着,将铁钉放入含有50ml 10%盐酸的烧杯中。24小时后,将生锈的钉子从烧杯中取出清洗后,风干以备后续使用。在含有锈钉的15ml离心管中加入3ml浓度为10mg/ml的氨基修饰的ap(市售获得),之后再加入2mg/ml的ga溶液3ml(调节ph~5),在形成gap的过程中离心管保持持续摇动,频率为40rpm。1小时后将铁钉取出,收集溶液并在10000g离心5分钟,收集沉淀,并重新悬浮于1ml的milli-q水中,6000g离心5分钟,重复3次。将10μg的egf加入到1ml的gap溶液中,并在4℃、600rpm下混合1小时,10000g离心5分钟,收集沉淀。然后得到的gap用1
×
pbs洗涤四次,最后重新悬浮在1mlpbs溶液中。
52.egap@hg类过氧化氢纳米酶水凝胶的制备:
53.称取一定量的无菌泊洛沙姆407(pol-407,平均分子量为12600,peo101-ppo66-peo101)和泊洛沙姆188(pol-188,平均分子量为8400,peo80-ppo27-peo80),将其加入4℃冰水中按照pol-407浓度17.9%(w/w)和pol-188为8%(w/w)即得到水凝胶(hg),充分溶解后放置于4℃冰箱过夜,即得到澄清的溶液。将1mg的egap充分溶解到1ml的hg中得到egap@hg。
54.结果与讨论
55.本实施例的机理如图1所示,将mpn、ap与egf相结合,gap的连续组装过程以及mpn网络分子结构,如图2所示。mpn一方面发挥类过氧化氢酶效果,将伤口局部的h2o2转化为o2,缓解伤口缺氧环境,同时发挥抗炎、抗氧化作用。而ap释放有效杀灭伤口细菌,egf则促进伤口细胞增殖及血管生成。
56.1.egap的制备与表征分析:
57.本实施例采用了氨基修饰的ap作为模板,因为它具有强效和广谱的抗微生物特性。并使用生锈的铁钉作为固体铁源。同时,通过酚离子和铁离子的配位,在ap上形成了金属-酚网络(mpn)膜,形成的mpn膜的厚度随着反应时间的延长而增加,溶液的颜色也逐渐从透明变为蓝紫色。在mpn涂层的形成过程中,不断摇动离心管,通过离心和洗涤得到具有核壳结构的纳米粒子,这些纳米粒子被命名为ga@ap(gap)(图3a)。将得到的gap颗粒重悬,并在重悬液中加入egf,通过将铁(fe iii)与egf内部富含组氨酸和蛋氨酸的结构域结合,最终制备egap纳米颗粒(图3b)。ap的直径约为110纳米,由mpn涂层和egf修饰的egap可以看到明显的核壳结构,外壳直径为20纳米,egap纳米颗粒的直径为130纳米(图3d,3e)。通过动态光散射(dls)测定分子的流体动力学直径,ap、gap和egap的直径分别为110.1、132.0和137.3纳米(图3f)。氨基修饰的ap表现出21.00
±
1.28mv的正表面电位,gap和egap经mpn涂层和egf修饰后的ζ电位分别为-14.80
±
1.06和-26.87
±
1.44mv(图3g)。通过bca方法测量egf与gap的结合率。通过将不同浓度的egf与1毫克/毫升的gap结合,发现结合率随着egf浓度的增加而增加,并在大约1微克/毫升时进入平稳期;因此,选择10微克/毫升egf与gap结合(图3h)。本实施例进一步通过测量过氧化氢转化率来评估egap促进过氧化氢分解的效果,发现加入egap后,过氧化氢转化率随时间推移而逐渐增加(图3i)。
58.2.hg的制备与表征分析:
59.一般来说,作为应用于治疗伤口的医疗敷料,水凝胶需要具有一定的机械性能,以满足伤口愈合的需要。pol-407在25%浓度下的临界水凝胶温度为15℃,而pol-188在25%浓度下的临界温度约为50℃。在水溶液中,peo-ppo-peo共聚物的两亲特性导致大分子自聚成胶束,其内芯由ppo组成,外壳由亲水单元peo组成(图4a)。本实施例通过将pol-188加入到pol-407中,观察到pol-407浓度为17.9%(w/w)、pol-188浓度为8%(w/w)时,得到的水凝胶的临界胶化温度为37℃。在临界胶化温度下,随着pol-408对pol-407的加入,混合物逐渐变成胶状(图4b)。因此,凝胶的流体状态可以在最大程度上适应伤口的不规则性。当接触皮肤的温度上升到37℃时,水凝胶达到了凝胶状态,并粘附在伤口部位。此外,egap@hg样品可以用10ml注射器连续注入培养皿中,形成的"sdu"可以保持凝胶状态,证实了水凝胶的可注射性(图4c)。hg和egap@hg的应变扫描检测显示,在低于100%的应变下,g
′
和g
″
有一个交点,这是表明水凝胶网络崩溃的重要一点(图4d)。在高动态应变(100%)下,g
′
的值下降并低于g
″
的值,显示出凝胶网络的损坏。一旦施加较低的应变(1%),g
′
和g
″
的值几乎可以恢复到它们的原始值。值得注意的是,这种相变甚至在两次交替循环后还能重复发生,证明了hg和egap@hg的自主自我修复能力(图4e)。
60.3.egap@hg的体外抗菌活性:
61.由于高血糖和免疫系统反应差,糖尿病伤口常伴有顽固的细菌感染,最常见的感染细菌是金黄色葡萄球菌。本实施例制备的egap@hg敷料中的抗菌效果主要由ap主导,它诱导局部膜穿孔;因此nps被内化,导致进一步的损害,最终由于其与细胞内蛋白质(尤其是富
含硫磺的蛋白质)和dna的相互作用而导致细菌死亡。egap@hg对革兰氏阳性金黄色葡萄球菌的体外抗菌活性首先用抑制圈(zoi)试验进行了评估。根据图5(a,b)所示的抑制圈试验,egap@hg显示出随着egap浓度的增加,其抗菌活性也在增加。从中可以看出,在低浓度时(《25ug/ml),抑菌圈并不明显,随着egap浓度的增加,抑菌圈的直径也在增加。当egap浓度为25微克/毫升、50微克/毫升、100微克/毫升时,形成的抑制圈的平均直径分别为10.67
±
1.53毫米、17.67
±
2.52毫米和27.67
±
0.58毫米。通过比较不同egap含量的egap@hg,发现其抗菌活性与egap含量呈正相关。因此,可以通过调整egap含量来调整抗菌性能。本实施例随后选择了egap浓度为100μg/ml的水凝胶进行实验。进一步用gap溶液、egap溶液、gap@hg提取物和egap@hg提取物对细菌进行共培养,并通过菌落计数法评估体外抗菌性能,如图5c、5d所示。与pbs阴性对照和纯hg相比,gap溶液、egap溶液、gap@hg提取物和egap@hg提取物都表现出良好的抗菌效果,几乎所有细菌都被杀死。这说明用egf修饰的gap封装在hg中的抗菌活性没有受到影响,可以起到良好的杀菌效果。
62.4.egap@hg对细胞的影响:
63.通过细胞存活率实验测试egap@hg对细胞的影响,如图5e所示。24小时后,在不同条件培养基中培养的hacat细胞的存活率与对照组无明显差异,表明egap@hg系统可以维持细胞生长和增殖。本实施例进一步进行了体外细胞划痕试验,以评估egap@hg对hacat细胞迁移的影响,这在很大程度上决定了伤口愈合的效率。随着划痕两边的细胞逐渐向中心迁移,细胞之间的距离逐渐缩小,egap@hg组的划痕伤口闭合速度比对照组快(图5f,5g)。在12h、18h、24h和36h对两组的划痕伤口面积进行了量化比较,发现egap@hg组的伤口面积在12h时明显小于对照组,分别占初始面积的75.70
±
1.72%和94.67
±
5.26%。此外,随着培养时间的增加,两组的差异更加明显,分别为61.94
±
1.77%、40.73
±
1.79%、25.45
±
2.79%和79.25
±
2.18%、61.58
±
3.44%、51.58
±
3.13%。这一发现表明,egap@hg对hacat细胞的迁移表现出明显的促进作用。总之,本实施例制备的egap@hg载药水凝胶可以明显改善表皮细胞的生长和迁移,从而促进伤口愈合。
64.5.egap@hg的生物相容性及安全性:
65.在伤口敷料的临床应用中,良好的生物相容性和安全性是至关重要的。因此,本实施例通过血液相容性实验、细胞死亡实验和体内毒性实验对egap@hg进行生物相容性和安全性评估。首先,用triton x-100溶液作为阳性对照,处理后的红细胞上清液呈鲜红色,而pbs、hg、gap、egap、gap@hg和egap@hg组的上清液无色透明(图6a)。用酶标仪检测各组上清液在542nm处的吸光度(od),可以看出pbs、hg、gap、egap、gap@hg和egap@hg组的od值远远低于triton x-100处理组,计算出的溶血率小于2%,可以认为是止血材料的安全水平。这些数据反映出,本实施例设计的纳米药物与水凝胶敷料相结合对红细胞的溶血作用可以忽略不计(图6b)。然后通过细胞活/死染色技术进一步探讨了所设计的纳米药物和水凝胶的细胞毒性。用hg-、gap-、egap-、gap@hg-和egap@hg条件下的培养基培养hacat细胞,并在培养24小时后进行细胞死活染色。如图6c所示,hacat细胞在hg-、gap-、egap-、gap@hg-和egap@hg条件下培养24小时后很少死亡(红色荧光),表明本实施例的纳米药物和水凝胶的细胞毒性很低甚至可以忽略不计。本实施例进一步在小鼠身上进行了毒性试验,在小鼠背部皮肤上做了一个直径为6厘米的全皮肤缺损模型(图6d),并隔天应用hg、gap、egap、gap@hg和egap@hg。对照组用pbs处理,在任何一组都没有观察到皮肤损伤。在普通小鼠模型中,与对
照组相比,egap@hg组显示出促进伤口愈合的良好效果。
66.6.egap@hg有效促进糖尿病伤口愈合
67.为了确定egap@hg系统是否能有效地促进糖尿病伤口愈合,本实施例在小鼠体内建立了糖尿病伤口模型,以评估egap@hg系统的体内抗菌和促进愈合的效果。图7a是建立和处理被金黄色葡萄球菌感染的全皮肤伤口模型的示意图。图7b显示了不同组(对照组、hg组、ap组、gap组、ap@hg组、egap组、gap@hg组、egap@hg组)在治疗前3天感染时以及治疗后第3、5、7和10天的伤口和伤口闭合痕迹的代表性照片。从记录的照片可以看出,感染金黄色葡萄球菌后,小鼠的伤口皮肤红肿,局部皮肤温度升高。图7c、d分别为开放性伤口的示意图和开放性伤口的计算结果。从治疗的第3天开始,egap@hg组的伤口愈合率明显快于其他组。在第10天,egap@hg处理的伤口表现出最小的开放性伤口(5.95%),伤口几乎完全愈合,而对照组、hg、ap、gap、ap@hg、egap、gap@hg组的开放性伤口分别为24.17%、18.81%、18.93%、15.83%、13.33%、12.26%、11.90%。这些结果表明,与其他组相比,egap@hg组的伤口愈合效果最好。
68.7.egap@hg促进糖尿病伤口愈合的组织学评估
69.第10天,对小鼠实施安乐死,收集伤口和伤口周围组织,并通过h&e染色和masson染色对伤口组织切片进行一系列组织病理学分析,以评估伤口愈合。再上皮化、胶原蛋白沉积和血管生成是评估皮肤伤口愈合的常用指标。图8a显示的是伤口组织的h&e染色。与其他组相比,egap@hg在第10天显示出最好的伤口修复,再生组织完全连续,伤口处完全上皮化。此外,胶原蛋白是伤口组织的重要修复材料,所以用masson染色法测定其含量以评估治疗效果(图8b)。与所有其他组相比,egap@hg组的蓝色更深,表明胶原蛋白的数量增加。对照组表现出稀疏、无序的低水平胶原蛋白沉积,而egap@hg组的胶原蛋白纤维排列密集有序,形成成熟的胶原蛋白沉积束;因此,这一明显的差异表明,egap@hg可以明显加速胶原蛋白的沉积。实现血管生成也是糖尿病患者伤口有效愈合的主要目标之一,为了进一步证明egap@hg的应用是否导致了血管生成的增强,本实施例调查了伤口再生组织中cd31信号阳性细胞的存在(图8c)。结果发现,与对照组和单因素处理组相比,egap@hg处理的伤口中cd31信号阳性细胞的表达量明显增加,而且新生血管更大、更成熟,血管生成明显增强。总之,与对照组和单因素治疗组相比,egap@hg组组织表现出更完整的上皮化、更多的胶原蛋白沉积、肉芽组织新生和更成熟的血管生成,有效促进了糖尿病小鼠感染伤口愈合。
70.以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1