一种灵芝强效应组分及其制备方法与流程
1.本发明属于医药技术领域,涉及一种灵芝强效应组分及其制备方法。
背景技术:
2.灵芝又称瑞草、仙草,为多孔菌科真菌赤芝ganoderma lucidum或紫芝ganoderma sinense的干燥子实体,为我国传统珍稀名贵药材,在《神农本草经》中归于“上药”。《本草纲目》记载:灵芝性平,味苦,无毒,主胸中结,益心气,补中,增智慧,不忘,久服轻身不老,延年神仙。现代研究进一步证实了灵芝的卓越功效,发现灵芝具有抗肿瘤、免疫调节、降血脂、降血糖、保肝护肝、镇静安神等多种药理作用,临床上可用于冠心病、高血脂症、高血压、糖尿病和肿瘤等疾病的治疗。
3.灵芝活性成分的含量与其临床疗效密切相关,药物分析学研究发现灵芝含有多糖、三萜、甾体、生物碱和微量元素等多种活性成分,其中灵芝三萜类物质被认为是灵芝发挥抗肿瘤作用的重要活性成分。中国专利cn201410476890.3公开了一种高效抗肿瘤灵芝提取物及其制备方法,其特征在于:所述高效抗肿瘤灵芝提取物中的灵芝三萜类物质含量为30%-80%。中国专利cn200910027230.6公开了具有抗肿瘤活性的灵芝子实体提取物及其制备方法,其特征在于:所述具有抗肿瘤活性的灵芝子实体提取物中,三萜类成分的含量为30-70wt%。中国专利cn201410551800.2公开了高抗人源肿瘤细胞活性的灵芝总三萜纯化物及其纯化方法,其特张在于:所述高抗人源肿瘤细胞活性的灵芝总三萜纯化物中,灵芝总三萜含量不低于60%,其中,灵芝酸含量不低于47.6%。其中以上报道有一个共同之处,均以灵芝(总)三萜的抗肿瘤活性反映灵芝或灵芝提取物的抗肿瘤活性。但论文“赤芝抗乳腺癌细胞增殖活性成分及其构效关系研究,广州中医药大学,2017”报道,赤芝不同提取部位的抗肿瘤活性为:灵芝醇富集部位>甾体和脂肪酸富集部位>灵芝酸富集部位>水溶性部位,表明灵芝中还存在多种成分的抗肿瘤作用强于作为灵芝三萜主要成分的灵芝酸,也表明灵芝三萜类物质的抗肿瘤活性并不能全面反映灵芝或灵芝提取物的抗肿瘤活性。现有公开方案均以灵芝总三萜或灵芝酸的含量评价灵芝提取物的活性,但公开文本中报道各类灵芝三萜的活性存在较大差异。
技术实现要素:
4.针对现有技术存在的问题,本发明提供了一种含有灵芝醇、甾体、脂肪酸、灵芝酸、杂萜的灵芝强效应组分,并通过体内外药理实验明确了灵芝强效应组分在抗肿瘤、调节免疫等方面的应用。
5.为实现上述目的,本发明采用的技术方案如下:
6.首先,提供了一种灵芝强效应组分,包括以下成分:灵芝醇、甾体、脂肪酸、灵芝酸、杂萜。
7.优选地,所述灵芝强效应组分按照质量百分份数计,包括以下成分:灵芝醇20-65份,甾体10-35份,脂肪酸8-40份,灵芝酸8-30份,杂萜5-25份。
5h。
25.进一步优选地,步骤(2)中所述料液比为1:10,提取温度为52℃,提取时间为1h。
26.进一步优选地,步骤(2)中将灵芝药材粉碎后还包括过筛步骤。
27.进一步优选地,步骤(4)中所述大孔树脂、水的体积比为1:4-6;所述乙醇洗脱中大孔树脂、乙醇的体积比为1:3-5。
28.进一步优选地,步骤(4)中所述用水洗脱所述水为去离子水。
29.优选地,步骤(5)中将得到的灵芝强效应组分浓缩后还包括干燥步骤。
30.最后,提供了一种所述的灵芝强效应组分或所述的制备方法得到的灵芝强效应组分在制备抗肿瘤、辅助抗肿瘤、调节免疫力产品中的应用。
31.进一步地,所述产品的剂型包括粉剂、颗粒剂、片剂、胶囊剂、口服液、软膏剂、栓剂、气雾剂、注射剂、散剂、丸剂。
32.相比于现有技术,本发明具有以下有益效果:
33.(1)本发明以低共熔溶剂作为提取溶剂,具有成本低、得率高等优点,符合“绿色制造”的要求;
34.(2)本发明中的灵芝强效应组分不仅具有高效的抗肿瘤活性,还有显著的免疫调节活性,并逆转肿瘤细胞的多药耐药性,可从多个途径发挥抗肿瘤作用,且安全性良好,具有较大的医用潜力。
附图说明
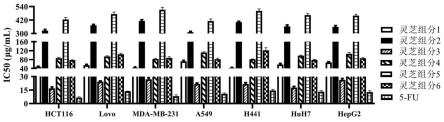
35.图1为灵芝组分抑制肿瘤细胞增殖的ic50;
36.图2为5-fu联合灵芝组分3(灵芝强效应组分)和组分6抑制耐药性hct116细胞增
37.殖的ic50;
38.图3为灵芝组分3(灵芝强效应组分)通过抑制脂滴分解诱导hct116细胞凋亡图;
39.图4为灵芝组分3(灵芝强效应组分)和组分6对小鼠体重的影响
40.图5为灵芝组分3(灵芝强效应组分)和组分6对肿瘤体积的影响与con组相比,*p<0.05,**p<0.01;
41.图6为灵芝组分3(灵芝强效应组分)和组分6对肿瘤重量的影响与con组相比,*p<0.05,**p<0.01;
42.图7为灵芝组分3(灵芝强效应组分)和组分6对中性粒细胞的影响与con组相比,***p<0.001;与模型组相比,
#
p<0.05,
##
p<0.01;
43.图8为灵芝组分3(灵芝强效应组分)和组分6对巨噬细胞形成的影响与con组相比,**p<0.01;与模型组相比,
#
p<0.05;
44.图9为灵芝组分3(灵芝强效应组分)和组分6对巨噬细胞吞噬功能的影响与con组相比,**p<0.01;与模型组相比,
#
p<0.05;
45.图10为灵芝组分3(灵芝强效应组分)和组分6对icr小鼠体重的影响
46.图11:(a)为灵芝组分3(灵芝强效应组分)和组分6对胸腺重量的影响(b)
为灵芝组分3和组分6对胸腺指数的影响与con组相比,***p<0.001;与模型组相比,
#
p<0.05,
##
p<0.01;
47.图12为灵芝组分3(灵芝强效应组分)和组分6急性毒性给药对icr小鼠体重的影响
48.图13为灵芝组分3(灵芝强效应组分)和组分6连续给药26周对sd大鼠体重的影响
具体实施方式
49.值得说明的是,本发明中使用的原料均为普通市售产品,对其来源不做具体限定。
50.实施例1
51.取氯化胆碱、乙二醇和水按摩尔比1:2:15的比例均匀混合,保持温度在60℃,持续搅拌1h,直至形成透明无色的液体,冷却至室温,得低共熔溶剂。取1份灵芝药材粉碎成粗粉,过16目筛,等量分成2份,分别加入10倍体积(m/v)的低共熔溶剂,50℃提取2h,收集提取液并浓缩。取1份浓缩液上预处理好的d-101苯乙烯型大孔树脂,树脂用量为10kg,上样流速为2.0bv/h;上样完成后先用5倍柱体积去离子水洗脱,洗脱流速为3bv/h,弃去水洗脱液;然后用6倍柱体积95%的乙醇洗脱,洗脱流速为1.5bv/h,收集洗脱液,得灵芝组分1。另取1份浓缩液上预处理好的d-101苯乙烯型大孔树脂,树脂用量为10kg,上样流速为2.0bv/h;上样完成后先用5倍柱体积去离子水洗脱,洗脱流速为3bv/h,弃去水洗脱液;然后依次用6倍柱体积50%、70%、95%的乙醇梯度洗脱,洗脱流速为2.0bv/h,弃去50%洗脱液,收集70%的乙醇洗脱液得灵芝组分2,收集95%的乙醇洗脱液得灵芝组分3(灵芝强效应组分)。将3种组分于55℃下减压浓缩至适量后冷冻干燥48h,得灵芝组分1粉末408.62份,灵芝组分2粉末103.62份,灵芝组分3(灵芝强效应组分)粉末161.95份。
52.实施例2(现有技术)
53.以文献(灵芝子实体中不同极性的三萜体外抗肿瘤及抗炎活性比较[j].菌物学报,2019,38(6):917-925)作为最接近的技术,制备相应组分,具体制备方法如下:
[0054]
取1份灵芝药材粉碎成粗粉,过20目筛。加入10倍体积(m/v)95%的乙醇常温浸提3次,每次24h,合并提取液并浓缩至粘稠的液体。加入等体积的乙酸乙酯萃取,萃取3次。取上层乙酸乙酯部分浓缩干燥(灵芝组分4)。将干燥样品用50%乙醇溶解为混悬液,上预处理好的d-101苯乙烯型大孔树脂,树脂用量为10kg。依次用4倍柱体积50%、60%、70%、80%、90%、95%的乙醇洗脱,洗脱流速为2.0bv/h,合并50%和60%的乙醇洗脱液得灵芝组分5,合并90%和95%的乙醇洗脱液得灵芝组分6。将3种灵芝组分过聚酰胺柱脱色,聚酰胺用量为15kg,流速为3bv/h,收集脱色后的3种组分,于55℃下减压浓缩至适量后冷冻干燥48h,得灵芝组分4粉末373.31份,灵芝组分5粉末72.68份,灵芝组分6粉末117.73份。
[0055]
实施例3
[0056]
分别取由实施例1、2制备的灵芝组分1-6约10份,置于15ml离心管中,精密加入甲醇溶解为1mg/ml样品溶液,超声处理30min,取上清至离心管中,13000rpm离心15min,再次取上清即为供试品溶液,采用hplc检测样品溶液中灵芝醇、甾体、脂肪酸、灵芝酸、杂萜的含量。
[0057]
色谱条件:色谱柱为waters acquity uplc hss t3(2.1mm
×
100mm,1.8μm)。流动相a为0.1%甲酸水溶液;流动相b为乙腈。梯度洗脱条件为0min,20% b;0-2min,20-26.5%b;2-9min,26.5% b;9-19min,26.5-35% b;19-28min,35-60% b;28-32min,60-70% b;32-37min,70-90% b;37-40min,90-100% b;40-45min,100% b。流速0.45ml/min,柱温25℃,进样量1μl。
[0058]
本实施例中,6种灵芝组分中灵芝醇、甾体、脂肪酸、灵芝酸、杂萜的百分比相对含量如表1。为了更好地比较6种组分里各类成分的相对含量,我们采用各类成分峰面积百分比的加和计算各类成分的相对总含量,并以两个近似组分总峰面积高的组分作为分母计算峰面积百分比。
[0059]
表1 6种灵芝组分中灵芝醇、甾体、脂肪酸、灵芝酸、杂萜的百分比相对含量
[0060][0061]
注:“/”表示未检出。
[0062]
结果显示,灵芝组分3中灵芝醇、甾体、脂肪酸、杂萜的百分比含量均高于灵芝组分1和组分2,而灵芝组分1、组分2和组分3中灵芝醇、甾体、脂肪酸、灵芝酸、杂萜的百分比含量均高于灵芝组分4、组分5和组分6,表明与现有技术相比,所述方法提取灵芝有效成分的效率更高。
[0063]
实施例4
[0064]
本实施例说明灵芝组分3和组分6的化学组成。
[0065]
各取灵芝组分3和组分6(由实施例1和2方法制备)样品约10mg,置于15ml离心管中,精密加入甲醇溶解为1mg/ml样品溶液,超声处理30min,取上清至离心管中,13000rpm离心15min,再次取上清即为供试品溶液,采用uplc-ms检测灵芝组分3和组分6的化学组成。
[0066]
色谱条件:色谱柱为waters acquity uplc hss t3(2.1mm
×
100mm,1.8μm)。流动相a为0.1%甲酸水溶液;流动相b为乙腈。梯度洗脱条件为0min,20% b;0-2min,20-26.5%b;2-9min,26.5% b;9-19min,26.5-35% b;19-28min,35-60% b;28-32min,60-70% b;32-37min,70-90% b;37-40min,90-100% b;40-45min,100% b。流速0.45ml/min,柱温25℃,进样量1μl。
[0067]
质谱条件:离子源为esi源。
[0068]
负离子模式:离子源温度140℃;雾化压力6.0bar;锥孔电压40v;碰撞能量20-50ev;雾化气温度400℃;雾化气流量600l/h;毛细管电压2.5kv;扫描范围50-1200m/z。
[0069]
正离子模式:离子源温度140℃;雾化压力6.0bar;锥孔电压35v;碰撞能量20-50ev;雾化气温度400℃;雾化气流量600l/h;毛细管电压3kv;扫描范围50-1200m/z。
[0070]
本实施例中,灵芝组分3和组分6的化学成分鉴定结果如表2。
[0071]
表2灵芝组分3和组分6的化学成分鉴定结果
[0072]
[0073][0074]
结果显示,灵芝组分3中灵芝醇、甾体、脂肪酸、灵芝酸、杂萜的种类均高于灵芝组分6,同样表明与现有技术相比,所述方法提取灵芝有效成分的效率更高。
[0075]
实施例5
[0076]
本实施例说明灵芝组分的体外抗肿瘤效果。
[0077]
(1)实验材料及处理
[0078]
细胞系:人结肠癌细胞(hct116、lovo)、人乳腺癌细胞(mda-mb-231)、人肺腺癌细胞(a549、h441)、人肝癌细胞(huh7、hepg2)购自中国科学院上海细胞生物学研究所。贴壁生长于含10%胎牛血清、100u/ml青霉素、100μg/ml链霉素的dmem培养基中。于37℃、5%co2和饱和湿度的细胞培养箱中培养,每2-3天换液传代一次。
[0079]
实验药物:灵芝组分用无水乙醇或dmem溶解配制成10-60mg/ml的贮存液,过滤除菌后于-20℃保存,5-氟尿嘧啶用无菌水溶解配制成1mg/ml的贮存液。临用前用dmem培养液稀释至实验浓度。6种组分由实施例1和2方法制备。
[0080]
(2)方法与结果
[0081]
取对数生长期的细胞,用0.25%的胰酶消化1分钟,1000rpm离心5min。吸除上清,加含10%胎牛血清的dmem重悬,进行细胞计数,调整细胞密度为2.5
×
104/ml。将细胞均匀分散在96孔板中,每孔200μl细胞悬液。待细胞长至40-50%融合度时,将细胞分为空白对照组、溶剂对照组、阳性对照组(本实施例中以5-氟尿嘧啶作为阳性对照)、灵芝组分组,其中,组分1、组分3、组分4和组分6的终浓度为500、250、125、62.5、31.25、15.625μg/ml,组分2和组分5的终浓度为1000、750、500、250、125、62.5μg/ml,5-氟尿嘧啶(5-fu)的终浓度为10.0、7.5、5.0、2.5、1.25、0.625、0.3125μg/ml,空白对照组加入dmem培养基,溶剂对照组加入200μl无水乙醇(无水乙醇的浓度为1%),每组设6个复孔。继续培养24h,培养结束后,吸除原培养液,加入90μl新鲜dmem和10μl cck-8,于37℃、5%co2、饱和湿度的培养箱中孵育4h,采用酶联免疫检测仪于450nm波长下检测各孔的光吸收值(a),按公式:细胞活力(%)=[(a
样品组-a
空白组
)/(a
对照组-a
空白组
)]
×
100%计算各组细胞的存活率,并计算生长抑制率和半数抑制浓度(ic50)。检测结果如图1所示。
[0082]
结果显示,灵芝组分3和组分6对多种肿瘤细胞的生长抑制作用均强于组分1、组分2、组分4和组分5,且与组分6相比,组分3抑制肿瘤细胞增殖的ic50明显降低。表明与现有技术相比,所述方法提取得到的灵芝组分具有更强的抗肿瘤效果。此外,结果还显示,在部分肿瘤细胞中,灵芝组分3的抗肿瘤活性与阳性药5-fu的抗肿瘤活性相当,处于同一个数量级。
[0083]
实施例6
[0084]
本实施例说明灵芝组分3(灵芝强效应组分)和组分6逆转肿瘤耐药的作用。
[0085]
(1)实验材料
[0086]
细胞系:人结肠癌hct116细胞株购自中国科学院上海细胞生物学研究所。细胞贴壁生长于含10%胎牛血清、100u/ml青霉素、100μg/ml链霉素的dmem培养液中。于37℃、5%co2和饱和湿度的培养箱中培养,每2-3天换液传代一次。
[0087]
实验药物:灵芝组分3(由实施例1方法制备)、灵芝组分6(由实施例2方法制备)、5-氟尿嘧啶(5-fu)。
[0088]
(2)肿瘤细胞耐药模型构建
[0089]
将matrigel基质胶母液于4℃过夜溶解,dmem、96孔板和枪头在4℃预冷,matrigel基质胶用冷的dmem按1:1(v/v)的比例稀释。将96孔板置于冰上,每孔加入30μl冷的稀释后的matrigel基质胶,轻晃使基质胶均匀覆盖孔底,37℃放置30min使其胶化。取对数生长期的hct116细胞,用dmem调整细胞密度为2
×
104/ml的单细胞悬液,接种于铺有基质胶的96孔板中,每孔100μl,置于饱和湿度、5% co2及37℃的细胞培养箱内培养。每2d更换一次dmem,连续培养6d。
[0090]
(3)药物处理
[0091]
吸除原培养液,对照组加入200μl dmem,灵芝组分3和组分6的给药终浓度为10μg/ml,5-fu的给药终浓度为6.25、12.5、25、50、75、100μg/ml,以1%无水乙醇作为溶剂对照,每组设6个复孔。继续培养24h,培养结束后,吸除原培养液,加入90μl新鲜dmem和10μl cck-8,于37℃、5%co2、饱和湿度的培养箱中孵育4h,吸取90μl上清液于新的96孔板中,采用酶联免疫检测仪于450nm波长下检测各孔的光吸收值(a),按公式:细胞活力(%)=[(a
样品组-a
空白组
)/(a
对照组-a
空白组
)]
×
100%计算各组细胞的存活率,并计算生长抑制率和半数抑制浓度(ic50)。检测结果如图2所示。
[0092]
以上结果显示,与常规细胞培养相比(实施例5),5-fu抑制耐药性hct116细胞增殖的ic50为124.76
±
6.13μg/ml,提高了约51.98倍。而5-fu联合灵芝组分3抑制耐药性hct116细胞增殖的ic50为66.27
±
5.37μg/ml,联合灵芝组分6抑制耐药性hct116细胞增殖的ic50为107.14
±
8.52μg/ml,分别提高了约27.61倍和44.64倍。与5-fu单独处理相比,5-fu联合灵芝组分3、灵芝组分6逆转耐药的系数分别为1.88和1.16。表明灵芝组分3逆转肿瘤耐药的作用明显优于灵芝组分6。
[0093]
实施例7
[0094]
本实施例说明灵芝组分3(灵芝强效应组分)的抗肿瘤机制。
[0095]
(1)实验材料
[0096]
细胞系:人乳腺癌mda-mb-231细胞株购自中国科学院上海细胞生物学研究所。细胞贴壁生长于含10%胎牛血清、100u/ml青霉素、100μg/ml链霉素的dmem培养液中。于37℃、5%co2和饱和湿度的培养箱中培养,每2-3天换液传代一次。
[0097]
实验药物:灵芝组分3(由实施例1方法制备)。
[0098]
(2)方法与结果
[0099]
取对数生长期的细胞,用0.25%的胰酶消化1分钟,离心(1000rpm,5min)。吸除上清,加含10%胎牛血清的dmem重悬,进行细胞计数,调整细胞密度为2.5
×
104/ml。将细胞均
匀分散在96孔板中,每孔200μl细胞悬液。待细胞长至40-50%融合度时,将细胞分为空白对照组、灵芝组分3组(给药浓度为10和5.0μg/ml)。处理结束后,吸除原培养液,pbs漂洗2遍,加入细胞裂解液提取总蛋白,免疫印迹检测蛋白表达情况。检测结果如图3所示。
[0100]
分解细胞内储存的脂滴是肿瘤细胞获得能量的途径之一,而脂滴分解由两个过程组成:一是大脂滴通过atgl介导的脂解途径形成小脂滴,二是小脂滴通过自噬-溶酶体途径进一步降解并释放脂肪酸。以上结果显示,灵芝组分3可呈浓度依赖性抑制atgl和自噬标志蛋白lc3b的表达,上调atgl和lc3b的表达均可减弱灵芝组分3诱导的细胞凋亡。表明灵芝组分3抑制脂滴分解是其发挥抗肿瘤作用的机制之一。
[0101]
实施例8
[0102]
本实施例说明灵芝组分3(灵芝强效应组分)和组分6的体内抗肿瘤效果。
[0103]
(1)细胞系
[0104]
人结肠癌hct116细胞株购自中国科学院上海细胞生物学研究所。贴壁生长于含10%胎牛血清、100u/ml青霉素、100μg/ml链霉素的dmem培养基中。于37℃、5%co2和饱和湿度的培养箱中培养,每2-3天换液传代一次。
[0105]
(2)实验药物
[0106]
灵芝组分3(由实施例1方法制备)、灵芝组分6(由实施例2方法制备)。
[0107]
(3)实验动物
[0108]
清洁级健康雄性balb/c裸鼠60只,体重20
±
2g,由浙江省医学科学院实验动物中心提供,动物饲养于浙江省中药研究所有限公司。
[0109]
(4)荷瘤小鼠造模
[0110]
调整hct116细胞密度为2
×
107个/ml,用酒精棉球对小鼠右侧腋窝皮肤消毒后,用无菌注射器吸取0.2ml细胞悬液,接种于右侧腋窝皮下,每天检查肿瘤生长情况,待肿瘤长至60mm3时开始给药。
[0111]
(5)分组及给药
[0112]
将荷瘤小鼠随机分为5组,每组12只,分别为:模型对照组(给予等量生理盐水)、灵芝组分3低剂量组(50mg/kg/天)、灵芝组分3高剂量组(100mg/kg/天)、灵芝组分6低剂量组(50mg/kg/天)、灵芝组分6高剂量组(100mg/kg/天)。均采用经口灌胃方式给药,连续给药28天。
[0113]
(6)小鼠体重及肿瘤体积检测
[0114]
用游标卡尺测量并记录肿瘤的最长直径l(cm)和最短直径s(cm),按公式:v=ls2/2计算肿瘤体积,每周2次,同时记录小鼠体重,连续测量4周。给药结束后,处死裸鼠,剥离肿瘤组织并称重,计算肿瘤抑制率,肿瘤抑制率=(1-灵芝组分组平均肿瘤体积/模型组平均肿瘤体积)
×
100%。检测结果见图4-6。
[0115]
由图4-6可知,灵芝组分3和组分6对小鼠体重均无显著影响;灵芝组分3和组分6对小鼠结肠癌hct116细胞移植瘤均有较强的抑制作用(p《0.05);但与相同给药剂量的组分6相比,组分3的抑瘤率更高,对小鼠结肠癌hct116细胞移植瘤显示出更强的抑制作用。
[0116]
实施例9
[0117]
本实施例说明灵芝组分3(灵芝强效应组分)和组分6的免疫调节功能(天然免疫)。
[0118]
(1)实验药物
[0119]
灵芝组分3(由实施例1方法制备)、灵芝组分6(由实施例2方法制备)。
[0120]
(2)实验动物
[0121]
转基因中性粒细胞荧光斑马鱼,黑色素等位基因突变型albino系斑马鱼。
[0122]
(3)模型构建
[0123]
a.斑马鱼中性粒细胞减少症模型:随机选取受精后2天(2dpf)转基因中性粒细胞荧光斑马鱼于六孔板中,每孔30尾斑马鱼,模型组静脉注射给予长春瑞滨1ng/尾剂量建立斑马鱼中性粒细胞减少症模型,正常对照组(con)不做处理。
[0124]
b.斑马鱼巨噬细胞减少症模型:随机选取受精后2天(2dpf)黑色素等位基因突变型albino系斑马鱼于六孔板中,每孔30尾斑马鱼,模型组静脉注射给予长春瑞滨0.25ng/尾剂量建立斑马鱼巨噬细胞减少症模型,正常对照组(con)不做处理。
[0125]
c.斑马鱼巨噬细胞吞噬模型:随机选取3dpf黑色素等位基因突变型albino系斑马鱼300尾于六孔板中,每孔(每浓度组)30尾,模型组静脉注射给予纳米活性炭粒子(acnp,2.3mg/ml)建立巨噬细胞吞噬模型,正常对照组(con)不做处理。
[0126]
(4)药物处理
[0127]
将各模型组斑马鱼随机分为模型对照组(model)、灵芝组分3组、灵芝组分6组,给药浓度为25、50和100μg/ml,灵芝组分3和组分6均溶于水中与斑马鱼于28℃共孵育24h,随后各组随机选取10尾斑马鱼进行检测。
[0128]
(5)实验检测
[0129]
a.中性粒细胞形成评价:斑马鱼置于多功能变焦显微镜(nikon,multizoom az100)下观察、拍照并保存图片,用尼康nis-elements d 3.10高级图像处理软件,定量分析斑马鱼全身中性粒细胞数量。
[0130]
b.巨噬细胞形成评价:向斑马鱼培养液中加入中性红溶液对斑马鱼进行活体染色,染色结束后于显微镜(nikon,smz645)下观察巨噬细胞数量并记录。
[0131]
巨噬细胞吞噬功能评价:向斑马鱼培养液中加入中性红溶液对斑马鱼进行活体巨噬细胞染色,染色结束后于显微镜(nikon,smz645)下观察并统计斑马鱼头部吞噬acnp的巨噬细胞数量,定量评价灵芝提取物对巨噬细胞吞噬功能的影响。检测结果见图7-9。
[0132]
由图7-9可知,与con组相比,model组斑马鱼中性粒细胞(图7)和巨噬细胞(图8)均显著减少,且吞噬acnp的巨噬细胞数量明显降低(图9);与model组相比,灵芝组分3(中、高剂量)可显著提高中性粒细胞和巨噬细胞的数量,并增加吞噬acnp的巨噬细胞数量,但灵芝组分6只有在高剂量时可以显著提高中性粒细胞、巨噬细胞和吞噬acnp的巨噬细胞数量,且效果低于同剂量的灵芝组分3。表明灵芝组分3的免疫调节活性优于灵芝组分6。
[0133]
实施例10
[0134]
本实施例说明灵芝组分3(灵芝强效应组分)和组分6的免疫调节功能。
[0135]
(1)实验药物
[0136]
灵芝组分3(由实施例1方法制备)、灵芝组分6(由实施例2方法制备)。
[0137]
(2)实验动物
[0138]
清洁级健康雌性icr小鼠70只,体重20
±
2g,由浙江省医学科学院实验动物中心提供,动物饲养于浙江省中药研究所有限公司。
[0139]
(3)构建小鼠胸腺萎缩模型
[0140]
小鼠每次腹腔注射苯甲酸雌二醇(eb,0.1mg/只/2天),共6次,诱导小鼠胸腺萎缩模型。
[0141]
(4)分组及给药
[0142]
将icr小鼠随机分为7组,分别为:正常对照组(con)、模型对照组(给予等量生理盐水,model)、阳性对照组(给予乌苯美司,ube,5mg/kg)、灵芝组分3低剂量组(50mg/kg/天)、灵芝组分3高剂量组(100mg/kg/天)、灵芝组分6低剂量组(50mg/kg/天)、灵芝组分6高剂量组(100mg/kg/天),每组10只。灵芝组分组和ube组在造模前开始经口灌胃给药,每天给药1次,共14天;除con组外,其余6组小鼠于给药后第4天开始腹腔注射eb(2天/次,共6次)。con组灌胃给予等量生理盐水。
[0143]
(5)小鼠体重及胸腺指数检测
[0144]
给药第1天、第7天和第15天称量小鼠体重,末次给药24h后(第15天)眼内眦取血,托颈椎处死后取胸腺组织,称重,计算胸腺指数,胸腺指数=胸腺重量(mg)/10*体重(g)。检测结果见图10-11。
[0145]
由图10-11可知,模型组在第7天和第14天出现显著的体重下降,而各灵芝提取物组小鼠的体重未出现明显的下降,表明灵芝提取物对胸腺萎缩小鼠的体重具有保护作用;灵芝组分3(低、高剂量)和灵芝组分6(高剂量)还可显著改善苯甲酸雌二醇诱导的胸腺萎缩,提高胸腺指数,从而加强胸腺的功能;但在相同剂量下,灵芝组分3改善胸腺萎缩的效果优于灵芝组分6。
[0146]
实施例11
[0147]
本实施例说明灵芝组分3(灵芝强效应组分)和组分6的毒理学。
[0148]
(1)实验药物
[0149]
灵芝组分3(由实施例1方法制备)、灵芝组分6(由实施例2方法制备)。
[0150]
(2)实验动物
[0151]
清洁级健康icr小鼠,体重20
±
2g;清洁级健康sd大鼠,体重55
±
5g,由浙江省医学科学院实验动物中心提供,动物饲养于浙江省中药研究所有限公司。
[0152]
(3)实验方法
[0153]
a.急性毒性试验:60只小鼠随机分为灵芝组分3组、灵芝组分6组和溶媒对照组,各20只,雌雄各半。采用最大耐受量法(mtd),灵芝组分3和组分6以0.5%羧甲基纤维素钠为溶媒,按20g/kg
·
bw的浓度连续灌胃给药2次(间隔6小时),连续观察14天,观察小鼠生长状态并记录体重。结果如图12。
[0154]
由图12可知,雌、雄性小鼠按20g/kg
·
bw的剂量连续灌胃给予灵芝组分2次(间隔6小时)后的14天内,未出现小鼠死亡,与溶媒对照组相比,灵芝组分3和组分6组小鼠的体重均无明显差异,表明雌雄小鼠对灵芝组分的日最大耐受量均达到100g以上,按急性毒性剂量分级标准,灵芝组分3和组分6属于实际无毒级物质。
[0155]
b.6个月重复给药毒性试验:140只大鼠随机分为灵芝组分3组(60只)、灵芝组分6组(60只)和溶媒对照组(20只),雌雄各半。灵芝组分3和组分6按0.1g/kg/天、0.3g/kg/天、1.0g/kg/天剂量连续灌胃6个月,每天1次,观察小鼠生长状态并记录体重。给药结束后,检测大鼠各脏器变化情况。结果如图13。
[0156]
由图13可知,灵芝组分3和组分6按0.1g/kg/天、0.3g/kg/天、1.0g/kg/天剂量连续
灌胃6个月(26周),各组未出现动物死亡。给药期间仅组分6高剂量组雄性大鼠出现体重增长减缓、摄食减少(图13);各组脏器重量与脏器系数未见明显异常变化,组织病理学检查未发现毒性病理学变化,表明灵芝组分3连续灌胃给药6个月的安全剂量大于1.0g/kg,未观察到不良反应剂量(noael)为1.0g/kg;而组分6连续灌胃给药6个月的安全剂量为1.0g/kg,未观察到不良反应剂量(noael)为0.3g/kg。也表明灵芝组分3的安全性较组分6好。
[0157]
最后应当说明的是,以上内容仅用以说明本发明的技术方案,而非对本发明保护范围的限制,本领域的普通技术人员对本发明的技术方案进行的简单修改或者等同替换,均不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1