基于DNA折纸和阿霉素前药构筑的递药纳米体系及方法
本发明属于生物医药,具体涉及基于dna折纸和阿霉素前药构筑的递药纳米体系及方法,尤其涉及一种搭载有nqo1酶激活型前药的dna框架核酸精准递药体系及其构筑方法。
背景技术:
1、传统化疗是临床上治疗癌症的主要手段之一,其是通过全身给药途径对患者进行抗肿瘤治疗的,但是由于用于治疗的小分子药物具有非特异性分布的特性,所以在给药过程中常存在快速清除、脱靶效应等瓶颈问题。靶向肿瘤给药的纳米系统通过被动或主动靶向的策略促进肿瘤累积,可在一定程度上减轻药物的脱靶效应。目前,已有一些纳米药物(如abraxane和doxil)获得了fda的临床批准。然而,最近的研究强调,由于复杂的肿瘤生物学和生物障碍(如网状内皮系统、肾脏代谢),在小鼠模型中,平均只有0.7%的给药纳米颗粒最终能到达实体肿瘤。注射的纳米药物很容易被网状内皮系统清除,并主要分布在富含巨噬细胞的肝脏和脾脏中,因此存在纳米制剂的生物利用度过低的问题。这种在健康器官中高富集和在病变器官中低积累的现象导致了纳米药物与正常组织的相互作用,这可能会引起潜在的全身毒性问题。
2、应用纳米技术发展抗肿瘤药物靶向运输和可控释放的药物运载系统是解决该问题的关键之一。不同于传统小分子抗癌药物,多功能纳米载体借助肿瘤的高通透性长滞留效应在病灶处累积,可改善药物的药代动力学行为,提高药物的生物利用度,降低系统毒性。其中,dna框架核酸技术是一种新颖而独特的dna自组装纳米技术,它利用数百个dna订书钉链作为短链,折叠一条长链dna(通常是长达7000多个碱基的m13噬菌体基因组dna),通过梯度降温自组装成结构明确的二维或三维结构。这些数量众多的短链彼此不同,赋予了dna折纸易修饰性和空间可寻址性,使其具备成为小分子抗肿瘤药物载体的可能。此外,已有研究表明,dna折纸纳米结构具有良好的生物稳定性和低免疫原性,从而拓宽了其在生物传感、生物成像和生物医学方面的应用。一些具有平面或近平面结构的芳香环小分子(如阿霉素、柔红霉素等)则可嵌入到dna双链的相邻碱基对中,使dna折纸成为诊断和治疗试剂的优良载体,能够促进抗肿瘤药物在肿瘤组织中的富集、降低抗肿瘤药物对动物的全身毒性。中国专利cn 104368004a曾公开过一种用于运载抗肿瘤药物的核酸纳米结构,细胞水平和动物水平的实验证明其不但能够保证其运载的抗肿瘤药物的抗肿瘤活性,而且能够提高抗肿瘤药物的靶向性,使抗肿瘤药物在肿瘤组织中富集,显著降低抗肿瘤药物由于非特异性而产生的全身毒性。
3、但是,仅对载体进行改进还不能达到理想的治疗效果,在此基础上,选取高特异性的肿瘤标志物为靶点,构筑可激活式纳米治疗体系,对改善药物的作用选择性、规避脱靶风险、降低抗肿瘤药物因非特异性而产生的全身毒性同样具有重要意义。
4、前体药物是指经过化学结构修饰后得到的在体外无活性或活性较小、在体内经酶或非酶的转化释放出活性药物而发挥药效的化合物。针对癌细胞独特的分子缺陷(如过表达、突变)设计前药有利于改善药代动力学,同时降低脱靶效应。然而,相当多的前药可通过非特异性刺激源(如酯酶、磷酸酯酶、溶酶体低ph)进行全身前药激活,这可能会带来严重的不良反应,例如,癌症细胞和健康细胞中都存在溶酶体酸化和细胞内氧化还原环境。这种非特异性刺激会引起全身药效恢复,引发系统毒副作用。
5、nad(p)h醌氧化还原酶1(nqo1酶)是一种胞质同型二聚体黄素酶,在nad(p)h存在下催化醌类的双电子还原以保护细胞免受氧化应激的侵害。由于其在许多癌细胞中异常高表达。因此,靶向nqo1的前体药物的设计有望实现唯靶点处药效激活,可大幅降低脱靶效应,改善抗肿瘤药物因非特异性而产生的全身毒性。在此基础上,如能将设计出的靶向nqo1的前体药物与纳米载体有效结合将会为肿瘤的精准临床干预提供新的有效策略。
技术实现思路
1、本发明的目的是改进现有技术中的不足,提供一种基于dna折纸和阿霉素前药构筑的递药纳米体系及方法,利用dna框架核酸材料搭载nqo1酶激活型前药对肿瘤细胞进行高特异性治疗。
2、本发明是这样来实现的:基于dna折纸和阿霉素前药构筑递药纳米体系的方法,包括如下步骤:
3、1)以阿霉素为模型,合成肿瘤细胞靶点激活的前体药物醌丙酸结构-阿霉素偶联分子;
4、2)制备定制化设计的矩形dna折纸;
5、3)将矩形dna折纸和分散于乙醇中的前体药物混合,前体药物嵌入dna双链实现前药的负载。
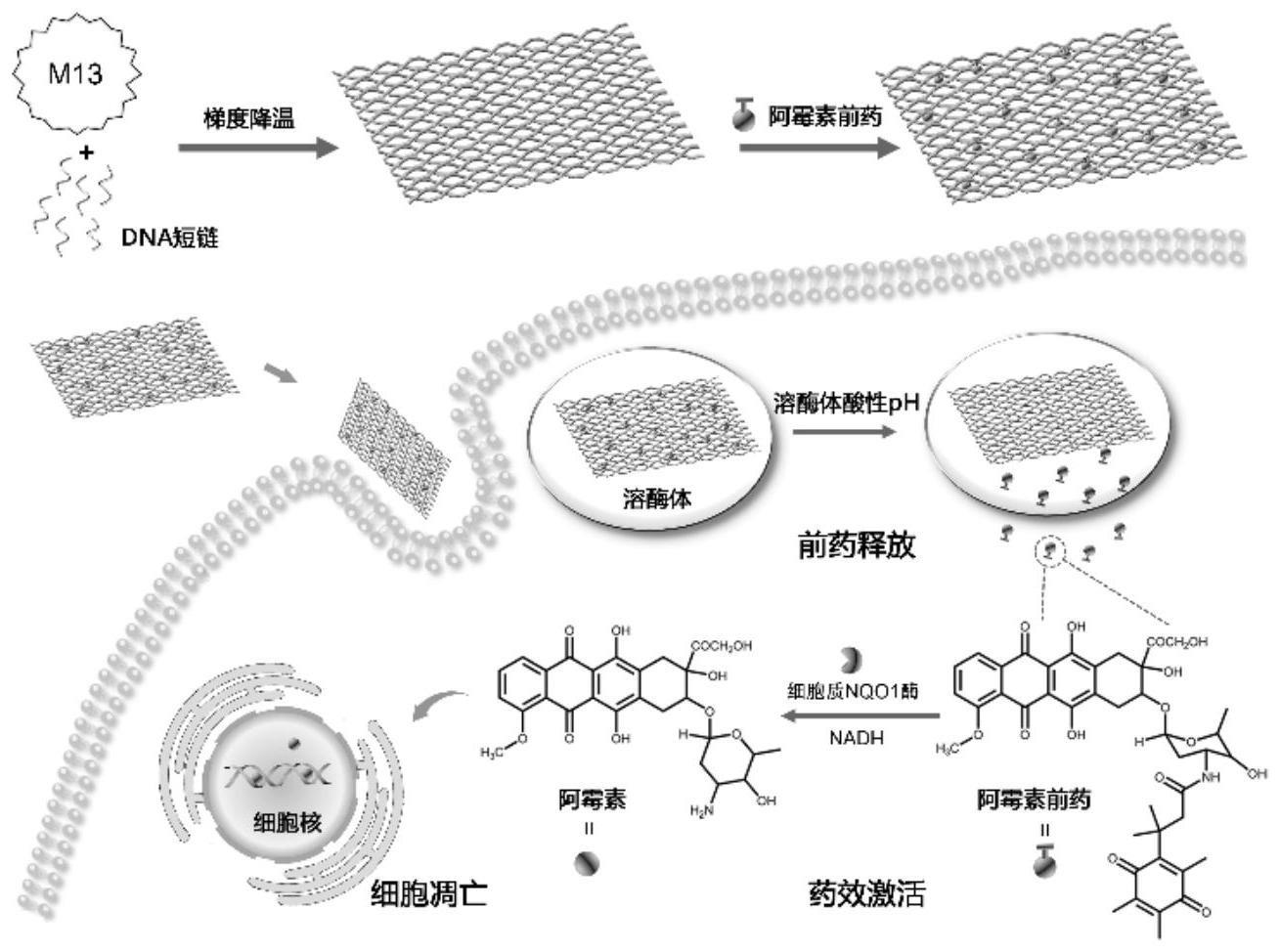
6、进一步地,矩形dna折纸是dna支架链和dna订书钉链通过碱基互补配对原则进行杂交完成自组装而形成的核酸纳米结构,制备时,将m13mp 18dna支架链和dna订书钉链在1×tae-mg2+缓冲液中混合,于热循环仪中,在2小时内从95℃程序化退火至25℃,超滤,洗涤完成制备。
7、进一步地,m13mp 18dna支架链和dna订书钉链的摩尔比为1:5-10,所得矩形dna折纸的长宽高近似尺寸为90×60×2nm。
8、进一步地,醌丙酸结构-阿霉素偶联分子是利用碳二亚胺类缩合剂活化含醌丙酸配体3-甲基-3-(2,4,5-三甲基-3,6-二氧代环己-1,4-二烯-1-基)丁酸形成活性酯中间体,再与阿霉素发生酰胺缩合反应后生成的,具体制备过程为:在恒定搅拌下,将阿霉素与3-甲基-3-(2,4,5-三甲基-3,6-二氧代环己-1,4-二烯-1-基)丁酸活性酯混合加入无水dmf中,向混合物中加入dipea,通氮气,室温下搅拌混合,反应结束后,减压旋蒸,柱色谱法纯化以收集前体药物。
9、进一步地,阿霉素与3-甲基-3-(2,4,5-三甲基-3,6-二氧代环己-1,4-二烯-1-基)丁酸活性酯的摩尔比为1:1-3。
10、进一步地,合成的前体药物具有嵌入dna双链结构的能力,前体药物的负载量高达236mg·g–1,负载效率达到94%。
11、进一步地,所述肿瘤细胞靶点为肿瘤相关的nqo1酶。
12、一种递药纳米体系,其是根据上述基于dna折纸和阿霉素前药构筑递药纳米体系的方法构筑完成的,该递药纳米体系具有酸响应前药释放行为,在溶酶体内酸性ph刺激下前药释放,并扩散至细胞质中,经细胞质中nqo1酶生物转化后释放本体药物,并到达细胞核发挥药效。
13、有益效果:
14、(1)针对大多数抗癌药物或前药作用选择性差、毒副作用大的问题,本技术从正常细胞和肿瘤细胞分子生物学上的差异性出发,选取肿瘤相关、且在肿瘤细胞中异常高表达的生物酶nqo1为刺激源,设计可激活式前体物,利用肿瘤相关酶的生物激活作用精准调控药物的活性,改善药物的作用选择性,减轻药物的脱靶效应;
15、(2)与单链或双链dna相比,矩形dna折纸具有增强的生理稳定性,暴露于10%胎牛血清24小时后,仍能保持约61%的结构完整性,是生物医学应用中优良的药物载体;
16、(3)以生物相容性好的矩形dna折纸为纳米载体,以少量乙醇助溶疏水前药,帮助前药更顺利地嵌入dna双链,实现前药的高效负载,待乙醇挥发后,游离前药由于自身的疏水性发生沉降,加载前药的dna框架核酸则均匀分散于溶液中,通过低速离心即可去除游离前药,这为难溶性药物的负载提供了一种便捷的新策略;
17、(4)装载有前药的dna纳米结构具有酸响应前药释放行为,在溶酶体内酸性ph刺激下前药释放,并扩散至细胞质中,经细胞质中nqo1酶生物转化后释放本体药物,最后到达细胞核发挥药效,这种药效发挥模式有助于减轻抗癌药物对人正常细胞的毒副作用,可帮助小分子抗癌药物直达病灶,并在病灶部位累积,对nqo1酶高表达的癌细胞产生更为明显的抑制作用;
18、(5)矩形dna折纸生物相容性较好,对正常细胞无明显毒副作用;得益于dna矩形折纸的高效前药装载和前药的nqo1酶响应性,加载有阿霉素前药的dna纳米结构有效缓解了阿霉素对人正常肝细胞细胞l02的损伤,而对nqo1过表达的人乳腺癌细胞mcf-7表现出显著的抑制效果,为精确治疗纳米药物提供了新的思路。
- 还没有人留言评论。精彩留言会获得点赞!