一种TriAz-CyC偶联物产物及其制备方法与在抗肿瘤药物生产中的应用
一种triaz-cyc偶联物产物及其制备方法与在抗肿瘤药物生产中的应用
技术领域
1.本发明涉及抗肿瘤药物技术领域,具体涉及一种triaz-cyc偶联物产物及其制备方法与在抗肿瘤药物生产中的应用。
背景技术:
2.癌症治疗的进展提高了无癌生存率,减少了恶性相关死亡。尽管取得了这些进展,但是癌症治疗引起的毒性机制均为潜在的事件。细胞凋亡的信号和机制有助于开发更好的癌症化疗和放疗方案。细胞色素c从线粒体中释放到细胞胞质是细胞凋亡过程中的标志性事件之一。胞质中游离的细胞色素c随后会诱导caspase的激活,最终引起细胞凋亡。因此,以胞质细胞色素c为对象的相关研究是癌症诊疗领域的热点。
3.国内学者华中科技大学朱锦涛团队[guo chen,zhang yamin,li yuce,zhang lianbin jiang hao,tao juan,zhu jintao.gold nanoparticle-guarded large-pore mesoporous silica nanocomposites for delivery and controlled release of cytochrome c.[j].journal of colloid and interface science,2021,589:]研究金纳米粒子保护的大孔介孔二氧化硅纳米复合材料用于细胞色素c的释放和控制释放。该团队提出了一种基于大孔介孔二氧化硅纳米颗粒(lpmsn)的蛋白质输送系统,可向癌细胞输送活性细胞色素c、电荷反转诱导蛋白质释放以及在体外启动癌细胞凋亡机制。研究表明,纳米复合材料显著抑制肿瘤生长,延长生存率,且无明显副作用。
[0004]
国外马普所tanja weil教授团队[david yuen wah ng,fahrer,yuzhou wu,klaus eisele,seah ling kuan,holger barth,tanja weil.efficient delivery of p53 and cytochrome c by supramolecular assembly of a dendriticdomain delivery system[j].advanced healthcare materials,2013,2(12):]研究树突状多结构域传递系统的超分子组装对p53和细胞色素c的高效传递。该团队利用树状化蛋白质支架作为蛋白质细胞转运的高效杂交传递系统,如p53肿瘤抑制蛋白和细胞色素c所示。结果表明,细胞色素c内化的促凋亡作用显著增强,在癌症中发挥重要作用。
[0005]
然而,这些方式均将cy c蛋白输送到癌细胞中,通过胞吞作用摄入合成物质,以囊泡的形式,从细胞膜输送到胞内体,进而诱导细胞凋亡。现在缺乏一种将cy c蛋白直接输送到癌细胞的胞质中,进而高效诱导癌细胞凋亡的方式。
[0006]
公布号为cn108822052a的中国专利申请文献,公开了一种非肽类多胍小分子和基于非肽类多胍小分子-蛋白质偶联体的蛋白质运输技术,提供一种高效、毒性低和稳定性好的载体小分子,所述载体小分子能够将生物活性蛋白分子递送到细胞内部,但依然有待进一步改进。
技术实现要素:
[0007]
本发明所要解决的技术问题在于如何将cy c蛋白直接输送到癌细胞的胞质中,避
免溶酶体的包裹,维持细胞色素c的蛋白活性,从而实现高效诱导癌细胞凋亡。
[0008]
本发明通过以下技术手段实现解决上述技术问题的:
[0009]
一种triaz-cy c偶联物产物在抗肿瘤药物生产中的应用,其特征在于,所述triaz-cy c偶联物产物通过以下工艺制备:
[0010]
(1)将细胞色素c(cy c)巯基化,得到修饰产物cy c-sh;
[0011]
(2)将cy c-sh溶于pbs缓冲液中,再加入至装有化合物triaz的容器中,室温搅拌,用超滤管进行分离纯化,得到triaz-cy c偶联物产物;
[0012]
所述化合物triaz的结构式为:
[0013]
其中r1=n[(ch2)6nh(c=nh)nh2]2,r2=n(ch2)2nh(c=o)ch2br或n(ch2)2nh(c=o)ch2sso3na。
[0014]
反应式如下:
[0015][0016]
以上triaz-cy c-1与triaz-cy c-2统称为triaz-cy c。
[0017]
有益效果:本发明的设计采用的三嗪类载体(triaz)是一种血清稳定且低毒的分子转运蛋白,可同时提供小分子和大活性蛋白质有效地进入细胞质中,避免了溶酶体的包裹,维持了细胞色素c的蛋白活性,高效地将细胞色素c直接递送到癌细胞的胞质当中,实现了高效诱导癌细胞凋亡。
[0018]
本发明还提供一种triaz-cy c偶联物产物的制备方法,包括以下步骤:
[0019]
(1)将细胞色素c(cy c)巯基化,得到修饰产物cy c-sh;
[0020]
(2)将cy c-sh溶于pbs缓冲液中,再加入至装有化合物triaz的容器中,室温搅拌,用超滤管进行分离纯化,得到triaz-cy c偶联物产物;
[0021]
所述化合物triaz的结构式为:
[0022]
其中r1=n[(ch2)6nh(c=nh)nh2]2,
[0023]
r2=n(ch2)2nh(c=o)ch2br或n(ch2)2nh(c=o)ch2sso3na。
[0024]
优选的,所述步骤(2)中化合物triaz,r1=n[(ch2)6nh(c=nh)nh2]2,
[0025]
r2=n(ch2)2nh(c=o)ch2br,通过以下工艺制备:
[0026]
s1:将二乙醇胺(化合物1)和二碳酸二叔丁酯溶解在二氯甲烷中,室温反应,经柱色谱纯化分离得到化合物2(n-叔丁氧酰基-二乙醇胺);
[0027]
s2:将步骤s1得到的化合物2溶于1,4-二氧六环中,在koh作用下,加入丙烯腈,室温搅拌反应,柱色谱纯化后得到化合物3(二(2-(2-氰基乙氧基)乙基)氨基甲酸叔丁酯);
[0028]
s3:将步骤s2得到的化合物3和六水合氯化镍溶于甲醇中,分批加入固态硼氢化钠粉末,室温反应,柱色谱纯化,然后加入三氟乙酸脱除叔丁氧酰基保护基,得到化合物4(二(2-(3-氨基丙氧基)乙基)氨);
[0029]
s4:将步骤s3得到的化合物4和o-甲基异脲硫酸盐溶解在水中,室温搅拌反应完毕;将溶液过滤除去不溶物,滤液置于4℃冰箱,析出白色固体,过滤,依次用冰水、乙醇洗涤,干燥即得到化合物5(二(2-(3-胍基丙氧基)乙基)氨);
[0030]
s5:将三聚氯氰溶于乙腈中,冷却至0℃,得到混合溶液a;将步骤s4得到的化合物5溶于水,然后与碳酸氢钠依次加入到溶液a中,0℃反应1h,然后加热至化合物5反应完毕;反应结束后得到化合物6,冷却至室温;
[0031]
s6:向步骤s5得到的化合物6中加入n-(2-氨基乙基)-2-溴乙酰胺,加热反应至化合物6反应完全,得到结构式为的化合物7。
[0032]
优选的,所述步骤(2)中化合物triaz,r1=n[(ch2)6nh(c=nh)nh2]2,
[0033]
r2=n(ch2)2nh(c=o)ch2sso3na,通过以下工艺制备:
[0034]
向上述方法制得的化合物7中加入硫代硫酸钠,反应至化合物7反应完全,浓缩,用制备色谱分离,得到结构式为化合物8。
[0035]
反应式如下:
[0036][0037]
优选的,所述步骤s1中二乙醇胺与二碳酸二叔丁酯的摩尔比为1:2,所述二乙醇胺的摩尔量与二氯甲烷的体积比为1mmol/2.5ml。
[0038]
优选的,所述步骤s2中化合物2与丙烯腈的摩尔比为1:5,所述化合物2的摩尔量与1,4-二氧六环的体积比为1mmol/3ml。
[0039]
优选的,所述步骤s2中koh的质量分数为40%。
[0040]
优选的,所述步骤s3中化合物3、六水合氯化镍和硼氢化钠的摩尔比为1:2:10,所述化合物3的摩尔量与甲醇的体积比为1mmol/15ml。
[0041]
优选的,所述步骤s4中化合物4与o-甲基异脲硫酸盐的摩尔比为5:11,所述化合物4的摩尔量与h2o的体积比为1.5mmol/7ml。
[0042]
优选的,所述步骤s5中三聚氯氰、化合物5与nahco3的摩尔比为1:2.2:4,所述三聚氯氰的摩尔量与乙腈的体积比为1mmol/5ml,所述乙腈与h2o的体积比为1:2。
[0043]
优选的,所述步骤s6中n-(2-氨基乙基)-2-溴乙酰胺与三聚氯氰的摩尔比为5:1;加热的温度为70-90℃,时间为4-6h。
[0044]
本发明还提供一种采用上述制备方法制备的抗肿瘤药物。
[0045]
本发明还提供一种采用上述制备方法制备的抗肿瘤药物在诱导肿瘤细胞凋亡上的应用。
[0046]
本发明的优点在于:
[0047]
(1)本发明的设计采用的三嗪类载体(triaz)是一种血清稳定且低毒的分子转运蛋白,可同时提供小分子和大活性蛋白质有效地进入细胞质中,避免了溶酶体的包裹,维持了细胞色素c的蛋白活性,高效地将细胞色素c直接递送到癌细胞的胞质当中,实现了高效诱导癌细胞凋亡。
[0048]
(2)在形成triaz-cy c的过程中,对细胞凋亡起作用的为共价偶联修饰的单体、二聚体以及多聚体,也是本发明的重点保护点。
[0049]
(3)凋亡蛋白细胞色素c在caspase凋亡机制中起重要调控作用。本发明利用三嗪类载体修饰细胞色素c蛋白直接将cy c蛋白输送到癌细胞中的胞质中从而诱导细胞凋亡。这种设计思路是成功制备具有高效诱导癌细胞凋亡的蛋白的关键点,也是本发明的重点保护点。
[0050]
(4)依照本专利中给出实验方法合成的triaz-cy c可以将cy c蛋白直接输送到癌细胞的胞质中的方法,避免溶酶体的包裹,维持细胞色素c的蛋白活性。并且本发明已确认该triaz-cy c诱导细胞凋亡的机制为caspase 3。本发明高效的胞内递送对抗肿瘤的药物的开发和潜在临床应用具有重大意义。其合成方式以及凋亡机制均是关键点和欲保护点。
[0051]
(5)本发明采将三嗪类载体修饰在cy c蛋白上,三嗪类穿膜多肽将cy c蛋白输送到癌细胞的胞质中,进而诱导细胞凋亡。本发明先采取三种癌细胞,宫颈癌细胞系(hela)、腺癌细胞系(a549)和肝癌细胞系(hepg2)细胞进行测试。triaz-cy c对于三种癌细胞的凋
亡均有显著的影响,其中triaz-cy c对于hepg2细胞和hela细胞的增殖率产生了巨大影响。并且,本发明的triaz-cy c诱导hela细胞凋亡的ic50值为0.03μg/ml。除此之外,本发明的triaz-cy c诱导细胞凋亡的机制确认为caspase 3。现在亟需一种将cy c蛋白直接输送到癌细胞的胞质中的方法,避免溶酶体的包裹,维持细胞色素c的蛋白活性。所以本发明高效的胞内递送对抗肿瘤的药物的开发和潜在临床应用具有重大意义。
附图说明
[0052]
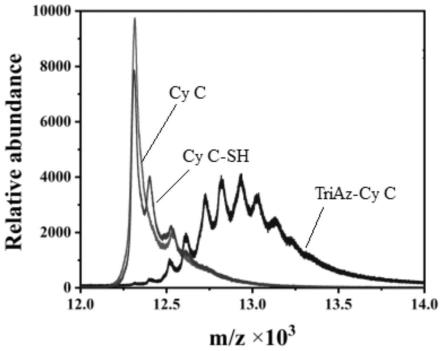
图1为本发明实施例3制得的triaz-cy c偶联物产物的质谱图;
[0053]
图2为本发明实施例4采用triaz-cy c、cy c和cy c-sh诱导hela细胞凋亡的mtt实验结果对比图;
[0054]
图3为本发明实施例5采用triaz-cy c、cy c和cy c-sh诱导hela细胞凋亡的流式细胞仪检测分析图;
[0055]
图4为本发明实施例6采用triaz-cy c诱导不同癌细胞凋亡的mtt实验结果对比图;
[0056]
图5为本发明实施例6采用triaz-cy c诱导hela细胞凋亡的ic50值显示图;
[0057]
图6a为80μm的ac-devd-cho对hela细胞增殖的影响图;
[0058]
图6b为ac-devd-cho对缓解triaz-cy c诱导hela细胞凋亡起作用的浓度区间图;
[0059]
图7为本发明实施例9采用jc-1检测triaz-cy c诱导细胞凋亡的机理图;
[0060]
图8为本发明实施例10采用0.3μg/ml的triaz-cy c、20μm的devd与0.3μg/ml的triaz-cy c、0.3μg/ml的cy c诱导细胞凋亡的对比图;
[0061]
图9为本发明实施例11采用devd和不采用devd情况下,triaz-ctyc诱导细胞凋亡的对比图。
具体实施方式
[0062]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0063]
一般来说,细胞色素c通过分子中的半胱氨酸巯基与其它分子相结合。本发明为了更好的合成triaz-cy c,先将巯基修饰细胞色素c蛋白,再将小分子triaz交联在该物质上并将其叫作triaz-cy c。实施例中通过maldi-tof检测triaz-cy c分子量;通过mtt验证triaz-cy c诱导hela细胞凋亡;利用facs验证triaz-ctyc诱导hela细胞凋亡;采用mtt法检测triaz-cy c对不同细胞系的杀伤作用。利用mtt法、jc-1、免疫荧光和wb检测triaz-cy c诱导hela细胞凋亡的通路。
[0064]
以下实施例具体的解释了本发明的内容,包括maldi-tof检测triaz-cy c分子量,验证triaz-cy c诱导癌细胞凋亡和检测triaz-cy c诱导hela细胞凋亡的通路,但本发明的保护范围不仅限于下述的实例。
[0065]
实施例1:
[0066]
一种结构式为r1=n[(ch2)6nh(c=nh)nh2]2,的化合物triaz(化合物7),其制备方法,包括以下步骤:
[0067]
s1:将triaz化合物1(二乙醇胺,0.45g,4.0mmol,1eq)和二碳酸二叔丁酯(boc)2o(1.79g,8.0mmol,2eq)溶解在二氯甲烷(10ml)中,室温反应12h,反应完毕;经硅胶柱色谱纯化分离,得到化合物2(n-叔丁氧酰基-二乙醇胺);
[0068]
s2:将步骤s1获得的化合物2(0.41g,2.0mmol,1eq)溶于1,4-二氧六环(6ml)中,在koh(质量分数40%)作用下,加入丙烯腈(0.55g,10mmol,5eq),室温搅拌12h,硅胶柱色谱纯化后得到化合物3(二(2-(2-氰基乙氧基)乙基)氨基甲酸叔丁酯);
[0069]
s3:将步骤s2获得的化合物3(0.64g,2.0mmol,1eq),六水合氯化镍(4.0mmol,2eq)溶于甲醇(30ml)中,分批加入固态硼氢化钠粉末(0.74g,20mmol,10eq),室温反应8h,硅胶柱色谱分离纯化,将纯化后的产物溶于ch2cl2中,加入三氟乙酸脱除叔丁氧酰基保护基boc,得到化合物4(二(2-(3-氨基丙氧基)乙基)氨);
[0070]
s4:将步骤s3获得的化合物4(0.34g,1.5mmol,1eq)和o-甲基异脲硫酸盐(0.39g,3.3mmol,2.3eq)溶解在h2o(7ml)中,室温搅拌反应完毕;将溶液过滤除去不溶物,滤液放置于4℃冰箱,析出白色固体,过滤,依次用冰水、乙醇洗涤,干燥即得到化合物5(二(2-(3-胍基丙氧基)乙基)氨);
[0071]
s5:将三聚氯氰(0.19g,1mmol,1eq)溶于乙腈(5ml)中,冷却至0℃,得到混合溶液a;将步骤s4获得的化合物5(0.48g,2.2mmol,2.2eq)溶于10ml h2o,然后与nahco3(0.35g,4mmol,4eq)依次加入混合溶液a中,0℃反应1h,然后加热至35℃搅拌1.5h,用高效液相色谱(hplc)跟踪反应;反应结束后得到化合物6,冷却至室温;
[0072]
s6:向步骤s5获得的化合物6中加入n-(2-氨基乙基)-2-溴乙酰胺(5mmol,5eq),加热至80℃搅拌5h,用高效液相色谱(hplc)跟踪反应,反应完毕,即得结构式为的化合物7。
[0073]
实施例2:
[0074]
一种结构式为r1=n[(ch2)6nh(c=nh)nh2]2,的化合物triaz(化合物8),其制备方法,包括以下步骤:
[0075]
向实施例1制得的化合物7中加入硫代硫酸钠,反应至化合物7反应完全,浓缩,用
制备色谱分离,即得结构式为的化合物8。
[0076]
实施例3:triaz-cy c的合成
[0077]
该实施例用于说明triaz-cy c的合成。
[0078]
一种triaz-cy c偶联物产物的制备方法,包括以下步骤:
[0079]
(1)将细胞色素c(cy c)巯基化,得到修饰产物cy c-sh;
[0080]
(2)将cy c-sh溶于pbs缓冲液中,再加入至装有实施例1制得的化合物triaz(即化合物7)的容器中,室温搅拌,用超滤管进行分离纯化,得到triaz-cy c偶联物产物。
[0081]
将本实施例制得的triaz-cy c偶联物产物用maldi-tof(bruker)进行表征,结果如图1所示,从图1中可以看出,-sh修饰细胞色素c在质谱图中呈现的信号峰与细胞色素c相近,表明巯基有效交联在细胞色素c上。triaz-cy c在12.5k-13k质荷比下有多个信号峰,表明细胞色素c上交联了至少4个triaz分子。从图1质谱图中证明我们已经成功合成triaz-cy c。
[0082]
实施例:4:triaz-cy c诱导宫颈癌细胞系(hela细胞)凋亡
[0083]
该实施例用于说明triaz-cy c诱导宫颈癌细胞系(hela细胞)凋亡。
[0084]
用实施例3制得的triaz-cy c诱导癌细胞凋亡,并进行mtt法实验检测,具体步骤如下:
[0085]
(1)将宫颈癌细胞系(hela细胞)接种于96孔板中,每孔8
×
103个细胞;
[0086]
(2)培养24h后,加入10μg/ml以两倍稀释至0.0001μg/ml浓度的triaz-cy c、cy c和cy c-sh;每孔10μl,同一浓度重复3孔并培养24h;
[0087]
(3)加入0.5mg/ml的mtt孵育4h后,在各孔中加入200μl的二甲基亚砜,放进摇床15min后取出,在酶标仪上用492nm读取光密度。
[0088]
实验结果如图2所示,从图2中可以看出,cy c-sh、cy c对hela细胞没有明显发生凋亡,而用triaz-cy c处理hela细胞有明显发生凋亡情况,通过mtt实验结果表明,triaz-cy c可以有效诱导hela细胞凋亡。
[0089]
实施例5:
[0090]
该实施例用于说明triaz-cy c诱导癌细胞凋亡。
[0091]
(1)用去离子水将10x pbs缓冲液稀释至1x,然后用pbs分别轻轻洗涤cy c处理的hela细胞、实施例3制得的triaz-cy c处理的hela细胞和cy c-sh处理的hela细胞两次;
[0092]
(2)接着用200ul结合缓冲液重新悬浮步骤(1)处理的hela细胞并使其浓度为2-5
×
105个/ml;
[0093]
(3)取195ul的细胞悬液加入5ul annexin v-fitc,轻轻混匀后室温避光孵育10分钟;
[0094]
(4)用200ul结合缓冲液洗涤细胞,再用190ul结合缓冲液重悬细胞,加入10ul浓度为20ug/ml的碘化丙锭溶液,轻轻混匀后上流式细胞仪(facs)进行检测分析。
[0095]
检测结果如图3所示,从图3中可以看出,图3a显示的是门;图3b为未处理细胞作为对照;图3c使用细胞色素c处理细胞;图3d为triaz-cy c处理细胞;图3e为细胞色素c巯基化
修饰处理细胞。从图中可以看出未处理细胞的早期凋亡细胞数量为9.88%,分别采用细胞色素c、triaz-cy c、cy c-sh处理细胞得到早期凋亡细胞数量分别为10.86%、14.34%和8.04%。未处理细胞的凋亡晚期细胞数量为2.88%,分别采用细胞色素c、triaz-cy c、cy c-sh处理细胞得到凋亡晚期细胞数量分别为4.73%、6.41%和3.44%。结果分析得出triaz-cy c处理细胞凋亡细胞数量与坏死细胞最多,即triaz-cy c能够诱导hela细胞的凋亡。
[0096]
实施例6:
[0097]
该实施例用于说明triaz-cy c诱导不同癌细胞凋亡。
[0098]
(1)将宫颈癌细胞系(hela细胞)、人肺腺癌细胞系(a549)、肝癌细胞系(hepg2)细胞接种于96孔板中,每孔8
×
103个细胞;
[0099]
(2)培养24h后,加入以10μg/ml为最高浓度,两倍稀释至0.0005μg/ml实施例3制得的triaz-cy c,每孔10μl,同一浓度重复3孔并培养24h;
[0100]
(3)加入0.5mg/ml的mtt孵育4h后,在各孔中加入200μl的二甲基亚砜,放进摇床15min后取出,在酶标仪上用492nm读取光密度。
[0101]
如图4所示,在hela细胞中加入不同浓度的cy c,在hepg2、a549、hela细胞中分别加入triaz-cy c处理24h后的细胞存活率变化。结果表明,在hela细胞中加入cyc对细胞凋亡的影响不大;triaz-cy c对于三种癌细胞的凋亡均有显著的影响,其中triaz-cy c对于hepg2细胞和hela细胞的增殖率产生了巨大影响。由图5可得,triaz-cyc诱导hela细胞凋亡的ic50值为0.03μg/ml,即杀死细胞一般所需要的浓度为0.03μg/ml,是试验过程中重要的数据指标,0.03μg/ml数值较低,说明triaz-cy c诱导hela细胞凋亡的能力较强,下述实验采用hela细胞为实验对象,采用ic50的值为0.03μg/ml探究triaz-cy c诱导hela细胞凋亡的机理。
[0102]
实施例7:
[0103]
该实施例用于说明triaz-cy c诱导细胞凋亡的机理,并且探究小分子ac-devd-cho是否具有毒性。
[0104]
(1)将宫颈癌细胞系(hela细胞)用含有10%胎牛血清、1%青霉素-链霉素的dmem培养液、在37℃、5%co2的培养箱条件下进行培养;
[0105]
(2)将hela细胞接种于96孔板,每孔5
×
103个细胞;
[0106]
(3)培养24h后,加入80μm caspase-3的小分子抑制剂ac-devd-cho(devd)孵育2h,加入0.1μg/ml、0.3μg/ml实施例3制得的triaz-cy c以及不加入triaz-cy c的孔作为对照组;
[0107]
(4)孵育完毕后,加入0.5mg/ml的mtt孵育4h后,在各孔中加入200μl的二甲基亚砜,放进摇床15min后取出,在酶标仪上用492nm读取光密度。
[0108]
实验结果如图6所示。
[0109]
实施例8:
[0110]
该实施例用于说明triaz-cy c诱导细胞凋亡的机理。
[0111]
(1)将宫颈癌细胞系(hela细胞)用含有10%胎牛血清、1%青霉素-链霉素的dmem培养液、在37℃、5%co2的培养箱条件下进行培养;
[0112]
(2)将hela细胞接种于96孔板,每孔5
×
103个细胞;
[0113]
(3)培养24h后,加入10μm、20μm、40μm caspase-3的小分子抑制剂ac-devd-cho(devd)孵育2h,留有未加入小分子抑制剂的孔作为对照组;
[0114]
(4)孵育完毕后,加入0.03μg/ml、0.06μg/ml以及0.015μg/ml实施例3制得的triaz-cy c孵育细胞;除此之外,采用相同浓度的cy c作对照试验;
[0115]
(5)加入0.5mg/ml的mtt孵育4h后,在各孔中加入200μl的二甲基亚砜,放进摇床15min后取出,在酶标仪上用492nm读取光密度。
[0116]
实验结果如图6所示,如图6a所示,在96孔板中加入80μm的devd孵育两小时后,除去培养基。在其加入终浓度为0.3μg/ml和0.1μg/ml的triaz-cy c,对照组为未加triaz-cy c的正常细胞。结果表明,devd对细胞并没有影响。如图6b为在96孔板中加入40μm、20μm、10μm和0μm的devd孵育两小时后,除去培养基。再用ic50为0.03μg/ml、0.06μg/ml以及0.015μg/ml的triaz-cy c孵育细胞。
[0117]
除此之外,采用相同浓度的cy c作对照试验。因为要探究杀伤一半细胞时所采用的devd浓度,我们采取ic50值即在0.03μg/ml的triaz-cy c作为探究对象,为了确保抑制剂的最佳效果和准确性,我们选择0.015-0.06μg/ml的浓度范围进行实验。在摸索小分子抑制剂的浓度期间,抑制剂高于40μm对抑制细胞的凋亡都起到了明显的抑制作用,我们进一步降低抑制剂的浓度以求在低抑制剂浓度的情况下可对凋亡细胞有抑制作用。所以我们根据实验设置了0-40μm的浓度区间。mtt结果表明devd的浓度在0-10μm阶段中,三个不同浓度的triaz-cy c处理的细胞增殖率在稳步增长。在10-20μm阶段中,0.06μg/ml的triaz-cy c因浓度过高未有太多变化,而0.03μg/ml和0.015μg/ml的triaz-cy c处理的细胞增值率显著提高。在20-40μm阶段中,0.06μg/ml的triaz-cy c处理的细胞增殖率因抑制剂浓度的倍数增长而提高。与此同时,0.03μg/ml和0.015μg/ml的triaz-cy c处理的细胞增殖率稳步提高。通过两张图可分析得出,devd可以有效抑制triaz-cy c诱导hela细胞凋亡。devd为caspase 3凋亡通路的小分子抑制剂,进一步分析可得,triaz-cy c诱导hela细胞凋亡的通路为caspase 3。
[0118]
图6a为80μm的ac-devd-cho对hela细胞增殖的影响图;图6b为ac-devd-cho对缓解triaz-cy c诱导hela细胞凋亡起作用的浓度区间图。
[0119]
实施例9:
[0120]
该实施例用于说明triaz-cy c诱导细胞凋亡的机理。
[0121]
(1)在5个玻底细胞培养皿里分别加入含有10%血清的酚红培养基,种1x105个hela细胞,然后放入37℃细胞培养箱孵育24h;
[0122]
(2)37℃培养箱孵育结束后,加入ac-devd-cho孵育2h,吸除培养液分别加入1ml无血清的酚红培养基和3μg/ml实施例3制得的triaz-cy c;
[0123]
(3)再取两个小皿培养hela细胞24h后,直接吸除培养液分别加入1ml无血清的酚红培养基和3μg/ml的triaz-cy c、3μg/ml的cyt c;
[0124]
(4)最后两个加入1ml无血清的酚红培养基放入37℃培养箱孵育1h;
[0125]
(5)取其中一个小皿加入1ml无血清的酚红培养基的培养皿拿出,加入10μmcccp,放进37℃培养箱处理20min;
[0126]
(6)均孵育完成后,吸除培养液,用pbs溶液洗涤细胞一次,加入500μl细胞培养基;
[0127]
(7)再加入500μl由5μl jc-1(200x)加入1ml jc-1染色缓冲液的比例稀释jc-1混
合而成jc-1工作液,充分混匀,放入37℃孵育20min;
[0128]
(8)孵育结束后,吸除上清,用jc-1染色缓冲液洗涤2次;加入1ml细胞培养基,放在荧光显微镜下观察。
[0129]
在线粒体膜电位较高时,jc-1聚集在线粒体的基质中,形成聚合物,可以产生红色荧光;在线粒体膜电位较低时,jc-1不能聚集在线粒体的基质中,此时jc-1为单体,可以产生绿色荧光。通过jc-1从红色荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,同时也可以用jc-1从红色荧光到绿色荧光的转变作为细胞凋亡早期的一个检测指标。
[0130]
实验结果如图7所示,从图7(a1/b1/c1)可得阳性对照中的细胞绿色荧光显著强于红色荧光。对比可知:图7(a2/b2/c2)加入triaz-cy c的细胞线粒体膜电位发生了下降,红色荧光显著降低,绿色荧光显著增强。表明细胞发生了凋亡。图7(a2/b2/c2)加入小分子抑制剂devd孵育2h后加入triaz-cy c(0.3μg/ml)孵育1h,绿色荧光减弱,红色荧光增强,阻止了细胞的凋亡。图7d为将五组图片放进image j软件中进行分析。将得到的红色荧光强度比上绿色荧光强度的数据进行分析,比率越小,凋亡程度越大。由图可知,加入triaz-cy c的值与cccp阳性对照的组相近,其他三组数据相近,细胞凋亡程度低。总的来说,由jc-1的实验结果可以明显得出,triaz-cy c诱导hela细胞凋亡的通路为caspase 3。
[0131]
图7(a1/b1/c1)为正常培养hela细胞;图7(a2/b2/c2)为培养hela细胞24h后,加入0.3μg/ml的triaz-cy c孵育1h;图7(a3/b3/c3)为培养hela细胞24h后,在培养基中加入终浓度为20μm的devd孵育2h后加入0.3μg/ml的triaz-cy c孵育1h;图6(a4/b4/c4)培养hela细胞24h后,加入0.3μg/ml的triaz-cy c孵育1h;图7(a5/b5/c5)为正常hela细胞中加入cccp进行阳性对照;图7d为五组图片通过image j荧光强度分析得到的柱状图。
[0132]
实施例10:
[0133]
该实施例用于说明triaz-cy c诱导细胞凋亡的机理。
[0134]
(1)将0.2
×
10 6
个hela细胞接种于载玻片上,培养24h后,在室内避光下处理细胞;
[0135]
(2)图8(a1/b1/c1/d1)为培养hela细胞24h后,直接加入0.3μg/ml实施例3制得的triaz-cy c孵育1h;图8(a2/b2/c2/d2)为培养hela细胞24h后,在培养基中加入终浓度为20μm的devd孵育2h后加入0.3μg/ml的triaz-cy c孵育1h;图8(a3/b3/c3/d3)为培养hela细胞24h后,直接加入0.3μg/ml的cy c孵育1h;
[0136]
(3)用pbs清洗三次后加入1ml 4%甲醛,固定20分钟;然后用pbs清洗后加入1ml含有0.1%triton x-100,1%bsa,5%goat serum的pbs,穿孔、封闭1小时;
[0137]
(4)用pbs洗涤,加入200μl一抗mitochondria monoclonal antibody(mtc02)和cytochrome c rabbit recombinant mab;然后把它们放在4℃孵育一夜;
[0138]
(5)0.02%吐温20洗涤后,加入200μl二抗goat anti-mouse igg(h+l)highlycross-adsorbed secondary antibody,alexa fluor
tm
plus 555和alexa fluor 488标记山羊抗兔igg(h+l),37℃孵育1h;
[0139]
(6)用0.02%tween 20清洗三次;接着,我们在载玻片上滴加10μl无气泡antifadewith dapi,将细胞爬片倒扣在载玻片上,然后用指甲油封片;
[0140]
(7)最后通过共聚焦显微镜观察荧光情况,检测triaz-cy c是否将细胞色素c蛋白转到进入细胞胞质中和进一步验证triaz-cy c诱导细胞凋亡的机制。
[0141]
图8(a2/b2/c2/d2)和图8(a3/b3/c3/d3)当中的绿色荧光标记的多为线粒体,而图8(a1/b1/c1/d1)中的绿色荧光除了在线粒体中,还出现在细胞胞质中。由此可得,triaz-ctyc进入细胞胞质中,进而诱导hela细胞凋亡。由图8(a1/b1/c1/d1)和图8(a2/b2/c2/d2)相对比可得,devd有效阻止了细胞凋亡,即triaz-ctyc诱导细胞凋亡的通路确认为caspase 3。
[0142]
图8(a1/b1/c1/d1)为培养hela细胞24h后,加入0.3μg/ml的triaz-cy c孵育1h;图8(a2/b2/c2/d2)为培养hela细胞24h后,在培养基中加入终浓度为20μm的devd孵育2h后加入0.3μg/ml的triaz-cy c孵育1h;图8(a3/b3/c3/d3)培养hela细胞24h后,加入0.3μg/ml的cy c孵育1h。
[0143]
实施例11:
[0144]
该实施例用于说明triaz-cy c诱导细胞凋亡的机理。
[0145]
(1)细胞处理方式与实施例9一致;
[0146]
(2)用pbs清洗细胞,然后用胰酶细胞消化液消化细胞并用pbs收集细胞;离心机600g,4℃的条件下离心5分钟沉淀细胞并弃上清;
[0147]
(3)加入线粒体分离试剂和pmsf,并使得pmsf的最终浓度为1mm。轻轻悬浮细胞,冰浴放置15分钟;把细胞悬液转移到1ml大小的玻璃匀浆器中,匀浆15下后转移至ep离心管;
[0148]
(3)然后把细胞匀浆液在1000g,4℃离心10分钟;小心把上清转移到另一离心管中,在11,000g,4℃离心10分钟;得到的沉淀即为分离得到的细胞线粒体,按照蛋白量加入裂解液;
[0149]
(4)为得到细胞浆蛋白,我们收集上清,随后在12,000g,4℃离心10分钟;离心后得到的上清即为细胞浆蛋白;然后使用bca试剂盒标定蛋白;
[0150]
(5)组装好仪器进行蛋白上样,接通电源后设置80v电泳30min,转120v 50min;电泳后进行转膜,并与220ma转60min;
[0151]
(6)转pvdf膜后进行丽春红染色,并用pbs进行漂洗;接着用5%脱脂牛奶,将pvdf膜放进脱脂奶粉中,室温摇床上封闭120min;用pbst润洗pvdf膜3次,每次10min;
[0152]
(7)一抗孵育过夜,再用pbst润洗pvdf膜3次,每次10min,然后孵育相应的二抗,室温下摇床孵育60min;再用pbst润洗pvdf膜3次,每次10min;最后用显影仪显影。
[0153]
细胞质中的内参为actin,线粒体的内参为tom20。atin蛋白量在42-43kd,tom20蛋白量在17kd,cy chrome c蛋白量在15kd。由图9结果可得,细胞质中,未处理组与加入cy c组的细胞色素c蛋白量几乎没有;只加入triaz-cy c组的细胞色素c含量最高,加入deve组的细胞色素c含量较少。在线粒体中,未处理组与加入cy c组的细胞色素c蛋白量;只加入triaz-cy c组的细胞色素c含量最少;加入deve组的细胞色素c含量较少。结果可得,triaz-cy c的cy c释放到细胞胞质中,并激发线粒体中的细胞色素c释放到细胞胞质中,激活caspase 3通路,诱导细胞凋亡。
[0154]
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1