一种小分子活性肽在制备防治干眼制品中的应用
1.本发明涉及生物医药领域,尤其涉及一种小分子活性肽在改善干眼中的应用。
背景技术:
2.干眼(dry eye disease,ded),也称角膜综合症,是一种多因素诱导的眼科慢性疾病。患者眼睛常伴有异物感、灼烧感、干涩、畏光等症状,致患者生活质量下降,甚至产生抑郁等心理问题。干眼是眼科门诊最常见的疾病之一。另外,据《中国干眼专家共识(2020)》统计,我国的干眼发病率约为21%~30%,即我国平均每5人就有一人患干眼。干眼已严重危害人类生活和健康。
3.目前国内外尚无彻底治愈干眼的理想药物,当前临床上治疗干眼的药物存在引起眼表疼痛、骨质疏松、只能暂时缓解干眼症状、停药可引起病情反弹等弊端。此外,某些治疗干眼的临床一线药物,如环孢素,虽然疗效快,但高昂的药价也给患者带来了巨大的经济压力。因此,急需开发一种高效、低副作用和低成本的防治干眼的药物。
4.罗非鱼皮肽作为天然的食源性生物活性物质,具有抗炎、抗氧化、抗高血压、抗菌、降血糖、抗皮肤光老化、促成骨细胞增殖分化、促进伤口愈合、改善卵巢功能等多种生物活性。同时,作为食源性生物活性物质,它具有安全、吸收好等特点,因而倍受科研人员的青睐。目前,我国的罗非鱼加工模式比较粗放,大量的罗非鱼皮被直接丢弃或加工成低值饲料,造成了严重的环境污染和资源的极大浪费。迄今为止,尚未见罗非鱼皮肽改善干眼的相关报导。
技术实现要素:
5.本发明的目的在于提供一种高效、低副作用和低成本且具有防治干眼作用的小分子活性肽。
6.为实现上述目的,本发明所采取的技术方案为:一种小分子活性肽在制备防治干眼的制品中的应用,所述小分子活性肽为罗非鱼皮肽。
7.一方面,本发明提供了一种小分子活性肽在制备防治干眼的制品中的应用,所述小分子活性肽为罗非鱼皮肽。
8.罗非鱼皮肽来源于罗非鱼皮,而罗非鱼来源广,养殖简单,因此罗非鱼皮的产量也较高,同时,罗非鱼作为食源性生物活性物质,具有安全、无害等特点。进一步地,本发明经过体内外实验验证发现,罗非鱼皮肽具有防治干眼的作用,这扩大了罗非鱼皮肽的使用范围和提高了罗非鱼皮肽的经济价值和利用率,减少了因罗非鱼皮的粗放加工导致的资源浪费。
9.作为本发明所述小分子活性肽在制备防治干眼的制品中的应用的优选实施方式,所述小分子活性肽分子量小于6.00kda。
10.本发明经过特定制备方法,获得分子量小于6.00kda的罗非鱼皮肽,并通过体内外实验验证,所述罗非鱼皮肽具有良好的改善干眼的作用。
11.作为本发明所述小分子活性肽在制备防治干眼的制品中的应用的优选实施方式,所述小分子活性肽的分子量为0.40kda~2.00kda。
12.本发明所述罗非鱼皮肽经葡聚糖凝胶g-25分离后一共得到了5个组分,分别命名为tsp
‑ⅰ
、tsp
‑ⅱ
、tsp
‑ⅲ
、tsp
‑ⅳ
和tsp
‑ⅴ
。通过对上述组分的体外抗干眼活性,实验发现,罗非鱼皮肽的抗干眼活性成分主要集中于tsp
‑ⅱ
和tsp
‑ⅲ
中。通过lc/ms/ms分析,tsp
‑ⅱ
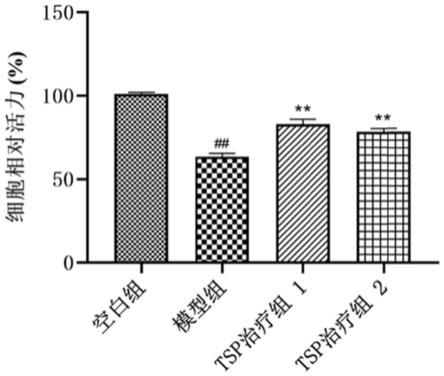
的分子量分布于0.61kda~1.93kda之间,其中大部分位于1.00kda~1.50kda之间。tsp
‑ⅲ
的分子量分布主要集中于0.50kda~1.00kda之间,其中最大的分子量为1.52kda,最小的分子量为0.44kda。因此,在0.40kda~2.00kda分子量范围内的罗非鱼皮肽具有更好的防治干眼的效果。
13.作为本发明所述小分子活性肽在制备防治干眼的制品中的应用的优选实施方式,所述罗非鱼皮肽的制备方法包括以下步骤:
14.(a)样品前处理:将罗非鱼皮去鳞、脱脂、干燥得到罗非鱼皮干粉;
15.(b)罗非鱼皮干粉溶解后进行酶解、离心,取上清液;
16.(c)使用超滤膜对步骤(b)所得上清液进行超滤处理。
17.上述制备方法制备成本低,操作简单,罗非鱼皮肽提取效率高,可实现量化生产。
18.作为本发明所述小分子活性肽在制备防治干眼的制品中的应用的优选实施方式,所述防治干眼的制品包括眼用注射剂、滴眼剂、眼用片剂、眼用凝胶、眼用药膏、眼用喷雾剂或眼贴。
19.另一方面,本发明提供了一种防治干眼的制品,所述防治干眼的制品包含上述小分子活性肽。
20.作为本发明所述防治干眼的制品的优选实施方式,所述防治干眼的制品为滴眼剂;所述滴眼剂中,小分子活性肽的浓度为1~2000μg/ml。
21.本发明所制得滴眼剂,在小分子活性肽的浓度为1~2000μg/ml时,均具有防治干眼的作用。
22.作为本发明所述防治干眼的制品的优选实施方式,所述滴眼剂中,小分子活性肽的浓度为250~1000μg/ml。
23.本发明经实验证明,所述滴眼剂中小分子活性肽的浓度为250~1000μg/ml时,其防治干眼的综合效果较好。其中,当滴眼剂中的小分子活性肽的浓度为1000μg/ml时,其防治干眼的效果最优。
24.相比于现有技术,本发明的有益效果为:
25.(1)本发明制得的抗干眼活性肽来源于罗非鱼皮,属食源性肽,安全无毒且提高了罗非鱼皮资源的利用率;
26.(2)本发明制得的抗干眼活性肽提取自罗非鱼皮,原料来源广且价格低廉,易于规模化扩大生产;
27.(3)本发明制备的抗干眼活性肽,具有良好的抗干眼活性,对其在防治干眼的药品、功能性食品及其它产品开发中具有重要的社会价值和指导性意义。
附图说明
28.图1为测试例1所述nacl诱导的人角膜上皮细胞干眼模型的mtt结果图(n=4,
):其中,与空白组相比,
#
p<0.05,
##
p<0.01。
29.图2为测试例1所述罗非鱼皮抗干眼活性肽对人角膜上皮细胞的细胞毒性的mtt结果图(n=5,):其中,与空白组相比,
#
p<0.05,
##
p<0.01。
30.图3为测试例1所述罗非鱼皮抗干眼活性肽抗干眼活性的mtt结果图(n=4,):其中,与空白组相比,
#
p<0.05,
##
p<0.01,与模型组相比,
*
p<0.05,
**
p<0.01。
31.图4为测试例2所述小鼠泪液分泌结果图(n=16,):其中,与空白组相比,
#
p<0.05,
##
p<0.01,与模型组相比,
*
p<0.05,
**
p<0.01。
32.图5为测试例2所述小鼠泪液蕨类结晶评分结果图(n=17,比例尺=50μm):其中,与空白组相比,
#
p<0.05,
##
p<0.01,与模型组相比,
*
p<0.05,
**
p<0.01。
33.图6为测试例2所述小鼠角膜组织形态学染色结果及角膜上皮厚度变化结果图(n=9,比例尺=50μm):其中,与空白组相比,
#
p<0.05,
##
p<0.01,与模型组相比,
*
p<0.05,
**
p<0.01。
34.图7为测试例2所述小鼠结膜组织形态学染色结果及杯状细胞计数结果图(n=7,比例尺=50μm),其中,与空白组相比,
#
p<0.05,
##
p<0.01,与模型组相比,
*
p<0.05,
**
p<0.01。
35.图8为测试例3测试结果图,其中,图8a为测试例3中tsp的凝胶过滤层析结果图,图8b为测试例3中tsp的体外抗干眼活性测试结果图(n=4,8b为测试例3中tsp的体外抗干眼活性测试结果图(n=4,)。
36.图9为测试例3中tsp的体内抗干眼活性检测图(n=14,)。
37.图10为测试例3中tsp的lc/ms/ms分析图,其中图10a和图10b为tsp
‑ⅱ
的lc/ms/ms分析图;图10c和图10d为tsp
‑ⅲ
的lc/ms/ms分析图。
具体实施方式
38.为更好地说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明,但本发明的保护范围及实施方式不限于此。
39.实施例1
40.本发明所述罗非鱼皮肽在制备防治干眼制品中的应用的一种实施例。
41.罗非鱼皮肽的制备方法包括以下步骤:
42.(i)样品前处理。首先,将罗非鱼皮去鳞,流水冲洗干净后沥干水分。用组织捣碎匀浆机将罗非鱼皮绞碎,每次匀浆3分钟,持续4次。向匀浆中加入4倍体积的异丙醇脱脂4小时,期间换液4次。整个脱脂过程在磁力搅拌器上进行,设置搅拌速度为100转/分,搅拌温度为55℃。脱脂结束后用高速离心机离心(离心参数:12000rpm,10min),收集滤渣,于电热恒温烘箱中50℃烘干,得到罗非鱼皮干粉。
43.(ⅱ)酶解。加入5倍体积的超纯水浸泡罗非鱼皮干粉,添加鱼皮干粉质量的3%的中性蛋白酶,维持溶液体系ph为7.0
±
0.2,50
±
5℃下酶解2h。2h后,添加0.3%的鱼皮干粉质量的碱性蛋白酶,维持溶液体系ph为9.0
±
0.2,50
±
5℃下酶解2h。所有酶解过程每隔
15min在磁力搅拌器上搅拌1min。酶解结束后将酶解液温度加热至100℃,持续10min以中断酶解进程。将酶解液离心,收集滤液于-80℃保存备用。
44.(ⅲ)超滤。将前述滤液解冻后按1:5的比例添加超纯水,将溶液倒入pellicon切向流超滤系统进液缸中,调节进口压力30psi,回流压力10psi,4℃环境下采用10kda超滤膜进行超滤处理,收集超滤液,使用旋转蒸发仪,设置水浴温度55℃进行浓缩。浓缩液于-50℃,0.20mbar工作参数下使用labconco冷冻干燥机进行冷冻干燥,得到罗非鱼皮肽(tiliapia skin peptides,tsp)粉末。测试例1罗非鱼皮肽体外抗干眼活性测试。
45.(1)人角膜上皮细胞的培养。
46.基于添加10%的胎牛血清和1%的青霉素和链霉素的mem(modified eagle’smedium)培养基培养人角膜上皮细胞。人角膜上皮细胞在37℃,5%的co2的细胞培养箱中培养。每两天更换一次培养基,人角膜上皮细胞生长至对数期时,按1:2的比例进行传代。
47.(2)干眼细胞模型的构建。
48.采用国际通用的干眼细胞模型(park b,et al.nutrients,2018,10(10)1550)。取对数生长期的人角膜上皮细胞,以2
×
104个/ml的密度接种到96孔板中。将细胞随机分为空白组、nacl实验组1(含20mm的nacl)、nacl实验组2(含40mm的nacl)、nacl实验组3(含60mm的nacl)、nacl实验组4(含80mm的nacl)和nacl实验组5(含100mm的nacl)。每组设置5个复孔。人角膜上皮细胞在孔板中培养24h后,用100μl维持液(含1%的胎牛血清的mem培养基)培养空白组,其余各实验组分别用含20mm,40mm,60mm,80mm,100mm的100μl nacl的维持液培养。培养12h后,采用mtt法检测各组细胞相对活力。
49.细胞相对活力测试方法(mtt检测方法):
①
培养时间结束后,吸弃孔板中的上清液,使用pbs(磷酸盐缓冲液)清洗人角膜上皮细胞;
②
加入100μl 0.5mg/ml的mtt溶液,在细胞培养箱中继续孵育4h后吸弃孔板中的上清液;
③
加入150μl的二甲基亚砜,室温摇床震荡3min,使用分光光度计在波长为490nm下检测各组od值,并按下述公式(i)计算各组细胞相对活力。
50.细胞相对活力(%)=(od
实验组
/od
空白组
)
×
100%公式(i)
51.(3)tsp的细胞毒性的检测。
52.取对数生长期的人角膜上皮细胞,以2
×
104个/ml的密度接种到96孔板中。将细胞随机分为空白组、tsp实验组1(含250μg/ml的tsp)、tsp实验组2(含500μg/ml的tsp)、tsp实验组3(含1000μg/ml的tsp)和tsp实验组4(含2000μg/ml的tsp)。每组设置5个复孔。人角膜上皮细胞在孔板中培养24h后,用100μl维持液(含1%的胎牛血清的mem培养基)培养空白组,其余各实验组分别用含250μg/ml、500μg/ml、1000μg/ml和2000μg/ml tsp的100μl维持液培养。培养12h后,采用上述mtt法检测各组细胞相对活力。
53.(4)罗非鱼皮肽的抗干眼活性的检测。
54.取对数生长期的人角膜上皮细胞,以2
×
104个/ml的密度接种到96孔板中。将细胞随机分为空白组、模型组(含100mm的nacl)、tsp治疗组1(含250μg/ml的tsp)和tsp治疗组2(含500μg/ml的tsp)。每组设置5个复孔。人角膜上皮细胞在孔板中培养24h后,用100μl维持液(含1%的胎牛血清的mem培养基)培养空白组和模型组2h,其余各组分别用含250μg/ml和500μg/ml tsp的100μl维持液培养。培养结束后,吸弃孔内液体,空白组以新鲜的维持液(含1%的胎牛血清的mem培养基)培养,模型组以含100mm nacl的维持液培养,其余各组分别加
入终浓度为100mm nacl+250μg/ml tsp和100mm nacl+500μg/ml tsp的维持液溶液,各组每孔加溶液体积为200μl。处理12h后,按前述mtt方法检测细胞相对活力,以细胞相对活力反映罗非鱼皮肽的抗干眼活性。
55.(5)数据处理。
56.各组之间使用graphpadprism 8.0进行单因素方差分析再使用dunnett法进行多重比较,所有数据以平均值
±
标准误()表示。与空白组相比,
#
p<0.05,
##
p<0.01;与模型组相比,
*
p<0.05,
**
p<0.01。
57.(6)实验结论。
58.上述实验结果表明,与空白组相比,100mm的nacl处理人角膜上皮细胞12h后,其细胞活力降至70.47%(p《0.01,图1),是构建干眼细胞模型的理想浓度,后续相关实验基于此浓度进行。在罗非鱼皮肽浓度小于500μg/ml范围内,其对人角膜上皮细胞无细胞毒性,这表明罗非鱼皮肽可继续用于后续抗干眼研究(图2)。与模型组相比,人角膜上皮细胞分别经250μg/ml和500μg/ml的罗非鱼皮肽治疗后,其细胞相对活力显著性回升,分别上升至81.27%和75.32%(p《0.05,p《0.01,图3),这表明罗非鱼皮肽在干眼细胞模型上具有抗干眼效果。测试例2罗非鱼皮肽体内抗干眼活性测试。
59.(1)模式生物的饲养。
60.本实验采用7~8周龄的c57bl/6雄鼠,每只体重约为20-23g。动物实验方案经广东海洋大学动物伦理委员会批准,并遵照《广东海洋大学实验动物护理和使用指南》的要求进行。
61.(2)动物分组及药物干预。
62.本实验按照中华中医药学会中药实验药理专业委员会推荐的干眼动物造模方法构建干眼动物模型(中华中医药学会中药实验药理专业委员会.中国实验方剂学杂志,2018,24(19):6-9)。将小鼠随机分成空白组、模型组、tsp治疗组和阳性药组,每组各9只(n=18只眼睛/组)。空白组小鼠每只眼睛滴注5μl生理盐水作为对照,模型组小鼠每只眼睛滴注5μl 0.3%的苯扎氯铵(benzalkoniumchloride,bac)以诱导小鼠眼表干眼样损伤,tsp治疗组小鼠每只眼睛分别滴注5μl 0.3%的bac和实施例1所制备的0.1%的罗非鱼皮肽,阳性药组小鼠每只眼睛分别滴注5μl 0.3%的bac和市售玻璃酸钠滴眼液(玻璃酸钠浓度为0.1%)。所有滴眼程序每天进行两次,分别于早上9:00和晚上19:00进行,持续14天。实验结束后分别于第15、16天对小鼠进行泪液分泌量和泪液蕨样结晶检测。第17天对小鼠进行安乐死后取下完整的眼球及其附属器官(包括角膜、结膜和上下眼睑),并进行石蜡切片。石蜡切片用于苏木精-伊红染色(h&e)和过碘酸-雪芙染色(pas)。
63.(3)泪液分泌量测定。
64.在第15天早上9:00开始进行泪液分泌量测定。具体操作如下:在一间光线良好,空气湿度控制在55%~60%的干净的实验室内,对小鼠腹腔注射10mg/kg的戊巴比妥钠。待其完全麻醉后用眼科无菌镊子轻轻拉下小鼠下眼睑,将泪液检测酚红棉线轻轻置入结膜囊1/3处,30s后取出棉线,测量棉线变红的长度以评价泪液分泌情况。
65.(4)泪液蕨类结晶评分。
66.在第16天早上9:00开始进行泪液蕨类结晶测定。具体操作如下:在一间光线良好,空气湿度控制在55%~60%的干净的实验室内,吸取3μl洗液(生理盐水)洗涤小鼠眼表3次
(为防止洗液损失和损伤眼表,洗涤过程中避免接触眼表组织且动作要轻柔缓慢),轻轻吸走洗液并涂布于洁净的玻片上,室温干燥1h后在徕卡显微镜下观察泪液蕨样结晶情况。
67.泪液蕨样结晶情况的标准评分如下:
68.1级:整个观察范围内可见均匀、致密的蕨样结晶,结晶分支间间隔很小;
69.2级:结晶分支数目减少,形态变小,分支间空隙增大;
70.3级:结晶分支明显减少,分支间空隙明显增大且分支难以形成新的、完整的结晶;
71.4级:整个观察范围内观察不到蕨样结晶或结晶数目非常少。
72.(5)角膜上皮细胞形态学变化。
73.本试验通过对石蜡切片进行h&e染色,用徕卡显微镜及其成像系统对小鼠角膜上皮区域拍照,并用image j软件测量角膜上皮厚度。
74.(6)结膜病理学检查。
75.本试验通过对石蜡切片进行pas染色,用徕卡显微镜及其成像系统对小鼠角膜上皮区域拍照,并用image pro plus 8.0软件测量结膜杯状细胞数目。
76.(7)数据处理。
77.各组之间使用graphpadprism 8.0进行单因素方差分析再使用dunnett法进行多重比较,所有数据以平均值
±
标准误()表示。与空白组相比,
#
p<0.05,
##
p<0.01;与模型组相比,
*
p<0.05,
**
p<0.01。
78.(8)实验结论。
79.泪液分泌结果如图4所示,与空白组相比,模型组小鼠泪液分泌量显著下降,表明0.3%的bac诱导干眼模型成功;与模型组相比,tsp治疗组和阳性药组小鼠泪液分泌量显著增加,表明罗非鱼皮肽能改善bac诱导的干眼小鼠的泪液分泌功能且罗非鱼皮肽在改善小鼠泪液分泌功能上与阳性药效果相当。
80.蕨类结晶实验结果如图5所示:从结晶形态和数目上看,与空白组相比,模型组整个观察视野内结晶形态不完整,只能观察到少数的残缺的结晶;与模型组相比,tsp治疗组和阳性药组结晶形态较为完整,结晶数目明显增加。从数据统计分析结果来看,模型组蕨样结晶评级显著高于空白组,tsp治疗组和阳性药组蕨样结晶评级显著低于模型组。这表明罗非鱼皮肽可恢复经bac诱导的干眼小鼠的眼泪蕨样结晶形态,罗非鱼皮肽在改善小鼠眼泪蕨样结晶形态上与阳性药效果相当。
81.角膜上皮细胞形态学变化结果如图6所示,空白组角膜上皮细胞缘光滑,角膜上皮细胞呈4~6层分布;模型组与空白组相比较而言,角膜上皮细胞出现脱落和缺失的情况,整个角膜上皮细胞层变薄;与模型组相比,经罗非鱼皮肽和阳性药治疗后,角膜上皮细胞层厚度增加,边缘也较为光滑。同时,tsp治疗组的效果与阳性药差别不大。
82.结膜杯状细胞形态学变化结果如图7所示,空白组具有较多完整的结膜杯状细胞,而模型组几乎没有结膜杯状细胞,罗非鱼皮肽治疗组和阳性药组结膜杯状细胞明显多于模型组,且罗非鱼皮肽在防止小鼠结膜杯状细胞丢失上与阳性药效果相当。
83.本发明所述罗非鱼皮肽可以显著恢复经100mm的nacl诱导的角膜上皮细胞的细胞活力,明显改善经0.3%的bac诱导的干眼小鼠的泪液分泌功能、恢复角膜上皮细胞完整性和结膜杯状细胞数目。罗非鱼皮肽在体内实验中表现出了与阳性药相似的潜力。
84.测试例3罗非鱼皮抗干眼活性肽的分离纯化。
85.(1)sephdex g-25层析及各组分抗干眼活性测试。
86.将tsp干粉配置成50mg/ml的水溶液,过0.45μm滤膜,滤液上样至sephdex g-25层析柱,以无菌超纯水为流动相,洗脱速度为0.45ml/min,在280nm监测波长下收集各色谱峰组分。并按测试例1中的方法检测分离组分的体外抗干眼活性,各组分所用的浓度均为250μg/ml。
87.进一步按测试例2中的方法检测tsp
‑ⅱ
和tsp
‑ⅲ
的体内抗干眼活性,以泪液分泌量为指标反映tsp
‑ⅱ
和tsp
‑ⅲ
的体内抗干眼活性。体内实验中所用tsp
‑ⅱ
和tsp
‑ⅲ
的浓度均为500μg/ml。
88.(2)lc/ms/ms分析。
89.将上述所得tsp
‑ⅱ
和tsp
‑ⅲ
进行lc/ms/ms分析,以获取其分子量及其他相关信息。
90.(3)数据处理。
91.各组之间使用graphpadprism 8.0进行单因素方差分析再使用dunnett法进行多重比较,所有数据以平均值
±
标准误()表示。与空白组相比,
#
p<0.05,
##
p<0.01;与模型组相比,
*
p<0.05,
**
p<0.01。
92.(4)实验结论。
93.tsp的凝胶过滤层析结果如图8a所示,tsp经葡聚糖凝胶g-25分离后一共得到了5个组分,分别命名为tsp
‑ⅰ
、tsp
‑ⅱ
、tsp
‑ⅲ
、tsp
‑ⅳ
和tsp
‑ⅴ
。进一步研究各组分的体外抗干眼活性,结果如图8b所示,tsp的抗干眼活性成分主要集中于tsp
‑ⅱ
和tsp
‑ⅲ
中,其中tsp
‑ⅱ
是抗干眼活力最强的组分。
94.对tsp
‑ⅱ
和tsp
‑ⅲ
进行体内抗干眼活性检测,结果如图9所示,500μg/ml的tsp
‑ⅱ
和tsp
‑ⅲ
均能显著恢复干眼小鼠的泪液分泌量,其改善小鼠泪液分泌功能的能力同阳性药相当。
95.对tsp
‑ⅱ
和tsp
‑ⅲ
进行lc/ms/ms分析,结果如图10所示。tsp
‑ⅱ
的分子量分布于0.61kda~1.93kda之间,主要集中于0.50kda~1.50kda之间(图10a和b)。tsp
‑ⅲ
的分子量分布主要集中于0.50kda~1.00kda之间,其中最大的分子量为1.52kda,最小的分子量为0.44kda(图10c和d)。综上所述,在分子量为0.44kda~2.00kda范围内的罗非鱼皮肽具有更好的防治干眼的效果。
96.综上,本发明所述的罗非鱼皮肽经g-25凝胶柱分离后得到了五个组分,经体外实验证明tsp
‑ⅱ
和tsp
‑ⅲ
分别在250μg/ml剂量下能显著恢复人角膜上皮细胞的细胞活力;动物实验证明tsp
‑ⅱ
和tsp
‑ⅲ
分别在500μg/ml剂量下能显著干眼小鼠的干眼症状。
97.实施例2
98.本发明所述防治干眼制品中的一种实施例,所述防治干眼的制品为滴眼剂。所述滴眼剂由实施例1所制得的罗非鱼皮肽、ph 7.2~7.4的磷酸缓冲液和注射用水组成。其中,罗非鱼皮肽的有效浓度为2000μg/ml,磷酸缓冲液的配置方法为:称取0.10g的kcl,0.10g的kh2po4,4.00g的nacl和1.45g的na2hpo4·
12h2o2溶于注射用水中,用1m的hcl或1m的naoh调节溶液ph至7.2~7.4,定容至500ml。
99.实施例3
100.本发明所述防治干眼制品中的一种实施例,与实施例2的区别仅在于在本实施例
中,所述罗非鱼皮肽的有效浓度为1000μg/ml。
101.实施例4
102.本发明所述防治干眼制品中的一种实施例,与实施例2的区别仅在于在本实施例中,所述罗非鱼皮肽的有效浓度为500μg/ml。
103.实施例5
104.本发明所述防治干眼制品中的一种实施例,与实施例2的区别仅在于在本实施例中,所述罗非鱼皮肽的有效浓度为250μg/ml。
105.对比例1
106.本对比例与实施例2的区别仅在于对比例1所述滴眼剂不含罗非鱼皮肽(使用等量生理盐水代替实施例2所述滴眼剂中的罗非鱼皮肽)。
107.对比例2
108.本对比例为测试例2中所用的阳性药滴眼剂,即玻璃酸钠滴眼剂(玻璃酸钠浓度为0.1%)。
109.测试例4
110.按测试例2所述的方法将老鼠随机分为7个组。其中选取一组小鼠作为空白对照组,仅使用生理盐水滴眼;其余各组使用0.3%的bac诱导小鼠干眼的同时分别施用实施例2~5和对比例1~2所述滴眼剂治疗小鼠。每鼠每眼每次点滴眼剂5μl,每天点眼两次,点眼治疗14天。
111.各实施例与对比例所述滴眼剂的作用效果如表1所示。其中,与空白对照组相比,
#
p《0.05;
##
p《0.01,与对比例1相比,
*
p《0.05;
**
p《0.01。
112.表1受试样品防治干眼的测试结果(n=12,)
[0113][0114][0115]
如表1所示,本发明所制得的罗非鱼皮肽滴眼剂(实施例2-5)均具有防治干眼的作用,其中,使用本发明实施例3的滴眼剂时,小鼠的泪液分泌量可达4.17
±
0.27mm,其防治干眼的综合效果最佳,优于阳性药物组(对比例2)。
[0116]
综上,本发明所述罗非鱼皮肽具有较好的改善干眼的作用,可用于制备防治干眼的制品之中,其中防治干眼的制品包含1~2000μg/ml的本发明实施例1所制备的罗非鱼皮肽。所述防治干眼的制品,无论其给药方式、剂型如何变化,只要含有本发明所述的罗非鱼皮肽,均能发挥改善干眼的作用。
[0117]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,但并不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1