一种AAV眼用注射液及其制备方法和应用与流程
一种aav眼用注射液及其制备方法和应用
技术领域
1.本发明涉及腺相关病毒制剂技术领域,具体涉及一种aav眼用注射液及其制备方法和应用。
背景技术:
2.基因治疗已成为治疗各种遗传性疾病的关键手段。基因治疗是指用正常的基因导入细胞,以纠正或补充基因缺陷和异常所引起的疾病,是一种治疗遗传病的根本性策略。腺相关病毒(aav)因其能够感染广泛的组织且具有较低的免疫原性、整合能力,被认为具有较好的安全性,从而成为在体基因治疗领域最前沿、最有潜力和最常用的病毒载体之一。aav载体携带的治疗基因进入细胞后,能够将转录翻译为功能蛋白,从而达到治疗一系列疾病的目的。
3.眼睛体积小,较小剂量的aav载体即可实现稳健转导。由于血视网膜屏障的存在,眼睛相对封闭并具备免疫赦免特性,局部给药安全性相对较高,而且眼底疾病多为单基因遗传疾病,因此眼部成为基因治疗中非常热门的器官。目前眼科基因治疗的适应症主要是与单个基因突变相关的遗传性视网膜疾病(inherited retinal diseases,irds),包括视网膜色素变性、无脉络膜症、leber遗传性视神经病变(lhon)、leber先天性黑蒙(lca)、stargardt病、色盲症(achm)、x连锁视网膜劈裂症(xlrs)和年龄相关性黄斑变性(amd)等,这些疾病使患者的独立生活和日常活动能力受到极大损害,具有极大的医疗需求。因此,针对眼部的基因治疗研究一直处于基因治疗研究的前沿。
4.根据治疗目的不同,aav载体介导的眼部基因转导途径主要有玻璃体腔注射、视网膜下腔注射、前房注射、结膜下注射等,其中比较常用的是玻璃体腔注射和视网膜下腔注射。
5.aav眼用注射液通过aav8转导的血管内皮生长因子受体基因在靶细胞中表达,形成可溶性的诱饵受体,竞争性抑制血管内皮细胞生长因子与血管内皮细胞膜上的受体结合,进而发挥抑制血管生成的作用。该治疗策略具有靶向性好、安全性高、副作用小等优点,可一次性治疗提高患者的最佳矫正视力,同时降低不良反应的发生率。该药物采用玻璃体注射方式,由于眼睛腔体小且所需病毒滴度高,所以对aav眼科制剂提出了更高的要求,需保证aav在1
×
10
12
vg/ml滴度下不产生聚集。
6.cn110300591a公开了一种腺相关病毒制剂,该药物组合物包含:约5mm至约25mm的l-组氨酸、约0mm至约150mm的氯化钠、约0.001%(w/v)至约0.01%(w/v)的聚山梨酯80(ps80)、约1%至约10%(w/v)的蔗糖、海藻糖或它们的组合,以及aav。但是,该腺相关病毒制剂产品用于出血性病症的治疗,为静脉注射给药,不适用于aava眼用注射剂;而且,该制剂配方包含表面活性剂聚山梨酯80,眼睛注射较高浓度聚山梨酯80存在安全风险。
7.cn20058001761公开了一种防止aav载体聚集的组合物和方法,其使用高价盐如柠檬酸钠来获得高离子强度和适度摩尔渗透压浓度的结合,使用该制剂可获得高达6.4
×
1013vg/ml的aav储液,甚至在十次冻-融循环后观察到没有聚集。但是,该制剂用于制备浓
缩aav病毒粒子储液,不是用于最终的注射;其使用的aav病毒血清型为aav2,aava眼用注射液血清型为aav8;该制剂还加入了核酸酶(benzonase),无法直接用于眼科注射。
8.目前,尚无针对aav8眼用注射液制剂方法的相关报道。
技术实现要素:
9.为解决上述技术问题,本发明的目的在于提供一种aav眼用注射液及其制备方法和应用,以获得稳定的溶液体系,不影响aav8病毒结构稳定性,反复冻融和室温运输过程中病毒颗粒不产生聚集且不影响病毒基因组滴度和感染能力,减轻aav眼用注射液储存和运输压力。
10.为达到上述目的,本发明提供一种aav眼用注射液,其原料包括:含目的序列的aav8病毒、氯化钠、氯化钾、磷酸二氢钾、十二水磷酸氢二钠、柠檬酸钠、泊洛沙姆188;其中,所述含目的序列的aav8病毒的滴度为2-5
×
10
12
vg/ml,所述目的序列包括血管内皮生长因子受体1型和2型的胞外结构域。
11.包含aav8的目的序列主要包括血管内皮生长因子受体1型和2型(vegfr-1和vegfr-2)的胞外结构域,通过aav8转导的血管内皮生长因子受体基因在靶细胞中表达,形成可溶性的诱饵受体,竞争性抑制血管内皮细胞生长因子与血管内皮细胞膜上的受体结合,进而发挥抑制血管生成的作用。
12.上述aav眼用注射液中,优选地,所述柠檬酸钠的摩尔浓度为5-10mmol/l。在本发明中,柠檬酸钠作为冻融保护剂,保证本发明的aav眼用注射液在反复冻融后仍然保持稳定。
13.上述aav眼用注射液中,优选地,所述氯化钠的摩尔浓度为136-276mmol/l,所述氯化钾的摩尔浓度分别为2.7-5.4mmol/l。
14.上述aav眼用注射液中,优选地,所述磷酸二氢钾的摩尔浓度为2-4mmol/l,所述十二水磷酸氢二钠的摩尔浓度为8-16mmol/l。
15.上述aav眼用注射液中,优选地,所述泊洛沙姆188的含量为0.005-0.01g/l。
16.上述aav眼用注射液中,优选地,所述aav眼用注射液的ph值为7-7.6。
17.上述aav眼用注射液中,优选地,以所述aav眼用注射液的总体积为基准,其组分包括:以滴度计的含目的序列的aav8病毒2-5
×
10
12
vg/ml,以摩尔浓度计的氯化钠136-276mmol/l、氯化钾2.7-5.4mmol/l、磷酸二氢钾2-4mmol/l、十二水磷酸氢二钠8-16mmol/l、柠檬酸钠5-10mmol/l,以及泊洛沙姆188 0.005-0.01g/l,溶剂为水。
18.本发明还提供一种上述aav眼用注射液的制备方法,其包括如下步骤:
19.s1:配制磷酸盐缓冲液和柠檬酸钠溶液,所述磷酸盐缓冲液包含氯化钠、氯化钾、磷酸二氢钾、十二水磷酸氢二钠;
20.s2:使用taqman探针法检测病毒原液滴度;
21.s3:按配比将aav8病毒原液、磷酸盐缓冲液和柠檬酸钠溶液混合,得到所述的aav眼用注射液。
22.上述aav眼用注射液的制备方法中,优选地,s2中检测病毒原液滴度保证病毒基因组滴度为2-5
×
10
12
vg/ml。
23.本发明还提供一种上述aav眼用注射液在制备用于治疗视网膜色素变性、无脉络
膜症、leber遗传性视神经病变(lhon)、leber先天性黑蒙(lca)、stargardt病、色盲症(achm)、x连锁视网膜劈裂症(xlrs)和年龄相关性黄斑变性(amd)的眼科制剂中的应用。
24.本发明的aav眼用注射液的稳定性的检测方法包括如下步骤:
25.s1:采用taqman探针法检测aav眼用注射液的基因组滴度;
26.s2:使用粒径分析仪对aav眼用注射液进行病毒粒径检测;
27.s3:感染滴度测定:使用所述aav眼用注射液感染人脐静脉内皮细胞,感染复数为1
×
105,感染后清洗所述人脐静脉内皮细胞,加入裂解液对感染后的细胞进行基因组提取,通过taqman探针法检测感染进细胞内的病毒拷贝数,再进行感染滴度换算。
28.更优选地,s3所述感染滴度测定的具体方法包括如下步骤:
29.使用感染复数(moi)为1
×
105病毒量感染人脐静脉内皮细胞,感染1-2h后清洗细胞,在96孔板的每个孔中加入100-200μl裂解液对细胞进行基因组提取,通过taqman探针法检测感染进细胞内的病毒拷贝数,标准品稀释、样品处理和加样方式同s1,之后进行感染滴度换算。
30.上述aav眼用注射液的稳定性的检测方法与上述aav眼用注射液共同应用,衡量并确保aav制剂稳定性,可作为行业质量控制标准,保证药效。该方法还适用于多种aav血清型制剂的稳定性检测,包括aav2、aav8、aav1、aav5、aav6、aav9、aavphp.b、aavphp.eb、aavphp.s、aavdj等。
31.本发明提供的技术方案,具有如下有益效果:
32.本发明提供的aav眼用注射液,通过优化制剂组分及配比,形成稳定的溶液体系,不影响aav结构稳定性,在反复冻融和室温运输过程中,病毒颗粒不产生聚集且不影响病毒基因组滴度和感染能力,减轻储存和运输压力。
附图说明
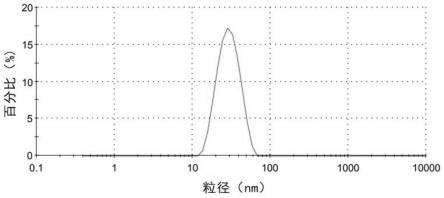
33.图1为实施例1的aav眼用注射液在-80℃储存14天后的粒径分布图;
34.图2为实施例1的aav眼用注射液在4℃储存14天后的粒径分布图;
35.图3为实施例1的aav眼用注射液在25℃储存14天后的粒径分布图;
36.图4为实施例1的aav眼用注射液在-80℃储存180天后的粒径分布图;
37.图5为实施例2的aav眼用注射液在-80℃冻融3次后的粒径分布图;
38.图6为实施例1的aav眼用注射液在-80℃冻融5次后的粒径分布图;
39.图7为实施例3的aav眼用注射液在-80℃冻融5次后的粒径分布图;
40.图8为对比例1的aav眼用注射液在-80℃冻融5次后的粒径分布图;
41.图9为对比例2的aav眼用注射液在-80℃冻融5次后的粒径分布图;
42.图10为对比例3的aav眼用注射液在-80℃冻融5次后的粒径分布图;
43.图11为对比例4的aav眼用注射液在-80℃冻融5次后的粒径分布图。
具体实施方式
44.为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。
45.本发明实施例所使用的包含目的序列的aav8病毒中,目的序列包括血管内皮生长
因子受体1型和2型的胞外结构域。
46.实施例1
47.本实施例提供一种aav眼用注射液,其包含如下原料:136mmol/l氯化钠、2.7mmol/l氯化钾、2mmol/l磷酸二氢钾、8mmol/l十二水磷酸氢二钠、2.5
×
10
12
vg/ml包含目的序列的aav8病毒、0.01g/l泊洛沙姆188、5mmol/l柠檬酸钠,以及水(溶剂);该制剂的ph为7.4。
48.实施例2
49.本实施例提供一种aav眼用注射液,其包含如下原料:172mmol/l氯化钠、3.4mmol/l氯化钾、3mmol/l磷酸二氢钾、12mmol/l十二水磷酸氢二钠、2.5
×
10
12
vg/ml包含目的序列的aav8病毒、0.005g/l泊洛沙姆188、10mmol/l柠檬酸钠,以及水(溶剂);该制剂ph为7.2。
50.实验例1
51.本实验例用于评价实施例1的aav眼用注射液的运输、存储稳定性。
52.取三组实施例1制备的aav眼用注射液样品,分别放置于25℃恒温培养箱、4℃冷库和-80℃冰箱中14天,再取一组该样品于-80℃冰箱中储存180天。
53.分别对上述4组样品的基因组滴度、感染滴度和粒径(采用粒径分析仪)进行检测,并观察溶液聚集情况。
54.其中,基因组滴度的检测方法采用使用taqman探针法,具体包括如下步骤:
55.(1)标准品稀释:标准线性化质粒浓度为109vg/ml(st0),随后依次10倍梯度稀释,浓度为108vg/ml、107vg/ml、106vg/ml、105vg/ml、104vg/ml、103vg/ml、102vg/ml,分别标记为st1,st2,st3,st4,st5,st6,st7。
56.(2)制剂样品处理:将获得的制剂样品加入裂解液提取病毒基因组,后稀释1000焙。
57.(3)实时荧光定量反应体系:
58.反应孔数=(7个标品+样品+1个ntc)
×359.反应mix总量20ul,包括mix 10μl,引物f/r 0.4μl,probe 0.4μl,无酶水6.8μl,稀释后的样品2μl。
60.(4)上机检测,具体包括以下程序:
61.a、空白新程序,选择绝对定量检测模板;
62.b、创建新文件,选择报告荧光基团为fam,猝灭荧光基团为none;创建新检测探针,命名为ipc,选择报告荧光基团为vic,猝灭荧光基团为none;检测参比荧光为rox;
63.c、设置两步法反应程序:95℃预变性10min;95℃变性15s,60℃变性1min,40个循环;反应体积20μl;
64.d、加样,分别加入st1,st2,st3,st4,st5,st6,st7各三个复孔,阴性对照ntc三个复孔,样品各三个复孔;
65.e、数据处理:在results的plate中,将标准曲线孔的task一栏设置为standard,并且在quantity一栏分别赋值,在results的standard curve面板中,读取标准曲线的斜率(slope)、截距(intercept),得到的标准品扩增曲线的斜率为-3.412,扩增效率为95%,决定系数(r2)为0.9985;在results的report面板中,mean quantity一栏可读取无模板对照ntc、待测样品,单位为vg/μl;
66.感染滴度的检测方法具体如下:
67.使用感染复数(moi)为1
×
105病毒量感染人脐静脉内皮细胞,感染2h后清洗细胞,并在96孔板的每个孔中加入100-200μl裂解液对细胞进行基因组提取,通过taqman探针法检测感染进细胞内的病毒拷贝数,标准品稀释、样品处理和加样方式同基因组滴度测试,之后进行感染滴度换算。其中,得到的标准品扩增曲线的斜率为-3.496,扩增效率为93.2%,r2为0.9996;
68.本实验例对实施例1的aav眼用注射液样品的基因组滴度、感染滴度检测结果及聚集情况见表1,粒径分布测试结果见图1-图4。
69.表1实施例1的aav眼用注射液的稳定性测试结果
[0070][0071]
由表1可知,本发明的aav眼用注射液可以在-80℃至少稳定储存6个月,在4℃
[0072]
和25℃可稳定储存14天,此时基因组滴度无变化,感染能力不受影响,且不产生聚5集,减轻了运输压力。
[0073]
由图1-图4可知,本发明的aav眼用注射液在-80℃储存6个月,4℃和25℃储存14天时病毒颗粒未发生聚集,粒径仍约为25nm。
[0074]
实验例2
[0075]
0本实验例用于评价实施例2的aav眼用注射液在反复冻融后的运输、存储稳定性。
[0076]
取两组实施例2的aav眼用注射液,在-80℃下分别冻融3次和5次,分别对两组样品的基因组滴度、感染滴度和粒径(采用粒径分析仪)进行检测,并观察溶液聚集情况。
[0077]
5具体检测方法同实验例1。其中,基因组滴度检测中得到的标准品扩增曲线的斜率为-3.513,扩增效率为92.6%,r2为0.9948;感染滴度检测中得到的标准品扩增曲线的斜率为-3.265,扩增效率为102.4%,r2为0.9956。
[0078]
本实验例对反复冻融后的实施例2的aav眼用注射液样品的基因组滴度、感染滴度检测结果及聚集情况见表2,粒径分布测试结果见图5-图6。
[0079]
0表2实施例2的aav眼用注射液反复冻融后的稳定性测试结果
[0080][0081]
由表2可知,本发明的aav眼用注射液在-80℃至少可以冻融5次不影响制剂稳定性,此时基因组滴度无变化,感染能力不受影响,且不产生聚集。
[0082]
由图5-图6可知,本发明的aav眼用注射液可以在-80℃冻融3次和5次时,病毒颗粒未发生聚集,粒径仍约为25nm。
[0083]
实施例3
[0084]
本实施例提供一种aav眼用注射液,其包含如下原料:136mmol/l氯化钠、5.4mmol/
l氯化钾、2mmol/l磷酸二氢钾、16mmol/l十二水磷酸氢二钠、2
×
10
12
vg/ml包含目的序列的aav8病毒、0.01g/l泊洛沙姆188、10mmol/l柠檬酸钠,以及水(溶剂);该制剂ph为7.6。
[0085]
对比例1
[0086]
本对比例提供一种aav眼用注射液,其包含如下原料:136mmol/l氯化钠、5.4mmol/l氯化钾、4mmol/l磷酸二氢钾、8mmol/l十二水磷酸氢二钠、2
×
10
12
vg/ml包含目的序列的aav8病毒、0.01g/l泊洛沙姆188、5mmol/l柠檬酸钠,以及水(溶剂);该制剂ph值为6.8。
[0087]
对比例2
[0088]
本对比例提供一种aav眼用注射液,其包含如下原料:276mmol/l氯化钠、2.7mmol/l氯化钾、4mmol/l磷酸二氢钾、16mmol/l十二水磷酸氢二钠、2
×
10
12
vg/ml包含目的序列的aav8病毒、0.01g/l泊洛沙姆188、以及水(溶剂);该制剂ph值为7.2。
[0089]
本对比例aav眼用注射液的原料中不含柠檬酸钠。
[0090]
对比例3
[0091]
本对比例提供一种aav眼用注射液,其包含如下原料:136mmol/l氯化钠、5.4mmol/l氯化钾、2mmol/l磷酸二氢钾、8mmol/l十二水磷酸氢二钠、2
×
10
12
vg/ml包含目的序列的aav8病毒、0.005g/l泊洛沙姆188、5mmol/l柠檬酸钠,以及水(溶剂);该制剂ph值为7.8。
[0092]
对比例4
[0093]
本对比例提供一种aav眼用注射液,其原料与实施例3相同,区别仅在于,原料还包括蔗糖。
[0094]
本对比例的aav眼用注射液包含如下原料:136mmol/l氯化钠、5.4mmol/l氯化钾、2mmol/l磷酸二氢钾、16mmol/l十二水磷酸氢二钠、2
×
10
12
vg/ml包含目的序列的aav8病毒、0.01g/l泊洛沙姆188、10mmol/l柠檬酸钠、40g/l蔗糖,以及水(溶剂);该制剂ph为7.6。
[0095]
实验例3
[0096]
本实验例用于评价实施例3以及对比例1-4的aav眼用注射液在反复冻融后的运输、存储稳定性。
[0097]
取实施例3以及对比例1-4的aav眼用注射液,在-80℃下分别冻融5次,分别对这5组样品的基因组滴度、感染滴度和粒径(采用粒径分析仪)进行检测,并观察溶液聚集情况。
[0098]
具体检测方法同实验例1。其中,基因组滴度检测中得到的标准品扩增曲线的斜率为-3.49,扩增效率为93.4%,r2为0.9978;感染滴度检测中得到的标准品扩增曲线的斜率为-3.38,扩增效率为97.6%,r2为0.998。
[0099]
本实验例还对反复冻融后的实施例3以及对比例1-4的aav眼用注射液样品的基因组滴度、感染滴度检测结果及聚集情况见表3,粒径分布测试结果见图7-图11。
[0100]
表3实施例3以及对比例1-4的aav眼用注射液反复冻融后的稳定性测试结果
[0101]
[0102]
由表3以及图7-图11可知,实施例3的aav眼用注射液反复冻融后不影响制剂稳定性,此时基因组滴度无变化,感染能力不受影响,且不产生聚集。
[0103]
对比例1和3的aav眼用注射液因ph值偏低或偏高,不影响基因组滴度和感染滴度,但反复冻融后病毒颗粒产生聚集。对比例2的aav眼用注射液没有添加柠檬酸钠,不影响基因组滴度和感染滴度,但反复冻融后病毒颗粒产生聚集。对比例4的aav眼用注射液加入蔗糖,不影响基因组滴度和感染滴度,但反复冻融后病毒颗粒产生聚集。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1