抑制分节段RNA病毒的药物、药物制剂及应用
抑制分节段rna病毒的药物、药物制剂及应用
技术领域
1.本发明涉及药学技术领域,具体而言,涉及抑制分节段rna病毒的药物、药物制剂及应用。
背景技术:
2.发热伴血小板减少综合征病毒(severe fever with thrombocytopenia syndrome virus,sftvs)和其同科病毒腹地病毒(heartland virus,hrtv)及古尔图病毒(guertu virus,gtv)均是基因组为分节段rna、外形为球形且带有囊膜的虫媒病毒,主要通过节肢动物如蚊、蜱、白蛉等传播,对一些脊椎动物具有感染性和致病性。sftsv全球平均致死率高达10%,sftsv在《人间传染的病原微生物名录》2022修订版中被定为第三类病原。此类病毒目前没有正式批准的特异性预防和治疗手段。核苷类似物法匹拉韦(t705)在临床前研究中被证明具有抗布尼亚病毒效果,其临床效果待观察,且此类药物具有潜在致畸作用,因此新的布尼亚病毒治疗性药物亟需被开发。
3.淋巴细胞脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus,lcmv)是单股负链分节段的rna病毒,是沙粒病毒科的一员。lcmv的自然宿主为野鼠和家鼠,lcmv的自然宿主在南极洲以外的所有大洲均存在。吸入啮齿动物尿液,粪便或唾液的感染性雾化颗粒,摄入被病毒污染的食物或直接暴露于感染的体液,人即可能被感染,也可通过母婴垂直传播。lcmv感染可导致流产或胎儿颅脑先天畸形,眼部和神经病变,脑膜炎等。lcmv普通型为第二类病原,亲神经型为第三类病原。目前lcmv无特效药,主要治疗方式是对症治疗和支持性治疗。
4.流行性感冒病毒是带囊膜的分阶段单股负链rna病毒,具有多个亚型,变异度大。人群普遍易感,曾引发多次世界性大流行,造成严重损失,其中甲型流感病毒(influenza a virus,iav)对人类的影响最大。iav以空气飞沫传播为主,接触污染的用具或密切接触也会造成传染,传播速度和人群密度有关,冬季发病率较高。感染后常见发热,头痛,肌痛,咳嗽,流涕等,严重者并发肺炎,对有其他严重并发症者可造成死亡。因流感病毒变异速度快,针对流感的疫苗需每年或季节性接种,靶向保守靶点且药效明确的临床药物种类有限,且极易因产生快速耐药性而药效降低,开发新型广谱抗流感药仍是研发重点。
5.中药材丹参(salvia miltiorrhiza bunge)是双子叶植物唇形科鼠尾草属多年生直立草本植物,分布于我国河北,山西,陕西,山东等地,种根入药。丹参的活性成分包括丹参酮、丹参醇、丹参酚等脂溶性成分,以及水溶性的丹参素、丹参素儿茶酸等,具有活血化瘀的作用,常用于治疗一些心脑血管疾病。其中丹参酮又包括丹参酮i、iia,隐丹参酮,二氢丹参酮等。中药单体化合物丹参酮i和iia在抗病毒应用方面鲜有报道,靶点明确的中药单体化合物作为广谱抗病毒药物亟需被挖掘。
6.鉴于此,特提出本发明。
技术实现要素:
7.本发明的目的在于提供抑制分节段rna病毒的药物、药物制剂及应用。
8.本发明是这样实现的:
9.第一方面,本发明提供一种抑制分节段rna病毒的药物,包括丹参酮i或其药物可接受盐;和/或丹参酮iia或其药物可接受盐。
10.在可选的实施方式中,对核酸内切酶的活性具有抑制作用。
11.分节段rna病毒,其转录依赖独特的“夺帽”(cap-snatching)机制。夺帽过程由病毒编码的l蛋白执行,n端区域包含核酸内切酶(endonuclease,en)结构域,中段rna依赖的rna聚合酶(rna-dependent rna polymerase,rdrp),c端包含帽子结合域(cap binding domain,cbd),在cbd的协同作用下,由en实现宿主mrna5’cap的切割。由于切割得到的含5'cap结构的寡核苷酸可被用作rdrp转录的引物起始基因组的转录和复制,对病毒的复制来说至关重要,因此en可作为重要的病毒干预靶点用于药物研发。
12.在可选的实施方式中,分节段rna病毒来自白纤病毒科、沙粒病毒科或正黏液病毒科。
13.在可选的实施方式中,分节段rna病毒包括sftsv、hrtv、gtv、lcmv和iav。
14.在可选的实施方式中,分节段rna病毒为h1n1病毒。
15.第二方面,本发明提供丹参酮i在制备抑制分节段rna病毒药物中的应用。
16.第三方面,本发明提供丹参酮iia在制备抑制分节段rna病毒药物中的应用。
17.第四方面,本发明提供一种抑制分节段rna病毒的药物制剂,包括丹参酮i或其药物可接受盐;和/或丹参酮iia或其药物可接受盐。
18.在可选的实施方式中,所述药物制剂为口服剂或注射剂。
19.在可选的实施方式中,还包括药学上可接受的辅料。
20.本发明具有以下有益效果:
21.引发发热伴血小板减少综合征的sftsv以及同科腹地病毒hrtv、古尔图病毒gtv和引发病毒性脑炎的淋巴细胞性脉络丛脑膜炎病毒lcmv缺少治疗性药物,靶标明确的流感药物品种也较少,本发明所述丹参酮i和iia来源于中药材丹参的天然单体化合物具有多重药理活性,该化合物靶向分节段rna病毒的5’cap依赖的en而发挥广谱抗病毒作用,是靶点明确的广谱抗病毒候选药物,可为传染病的防治药物研发提供借鉴。
附图说明
22.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
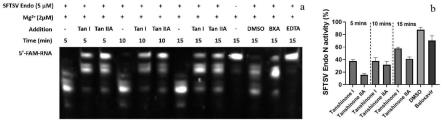
23.图1为实施例1中丹参酮i和iia的en酶活抑制作用;
24.图2为实施例2中丹参酮i和iia的en酶活抑制作用;
25.图3为实施例3-5中丹参酮i和iia对sftsv、hrtv、gtv、lcmv和iav的广谱抗病毒活性;
26.图4为实施例6中丹参酮i和iia的体内抗sftsv感染效果。
具体实施方式
27.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
28.以下结合实施例对本发明的特征和性能作进一步的详细描述。
29.以下实施例主要通过体外和体内病毒感染模型评价丹参酮i和丹参酮iia抗sftsv、hrtv、gtv、lcmv和iav的活性,并验证药物作用靶点。提供丹参酮i和丹参酮iia在制备抗病毒药物中的应用。
30.本发明实施例中采用的丹参酮i、丹参酮iia、t-705和baloxavir购自mce,纯度》99%。
31.本发明实施例中采用的sftsv、hrtv、gtv、lcmv和iav(h1n1)由武汉病毒研究所制备与扩增。
32.本发明实施例中采用的细胞生长培养液组成为:dmem培养基含10%胎牛血清和1%的氨苄/链霉素抗生素,4℃储存。
33.实施例目的:下述实施例的目的在于通过利用丹参酮i和丹参酮iia抑制内切酶en,进一步影响目的片段的获得。
34.实施例1
35.目标化合物丹参酮i和丹参酮iia对内切酶en的酶活抑制效果检测(凝胶电泳法)
36.实验步骤:
37.1.实验中所用的rna底物单链为seq id no1:5
’‑
fam-auuuuguuuuuaauauuuc-3’;
38.2.配置sftsv en反应的含mn
2+
的反应缓冲液:20mm tris-hcl(ph=8.0),150mm nacl,1mm tcep,2mm mncl2;
39.3.配制实验反应体系:反应总体积为20μl,取10μl由反应缓冲液稀释的核酸内切酶蛋白,然后添加10μl溶解于反应缓冲液的药物稀释液(2
×
),使核酸内切酶蛋白反应浓度为5μm,混匀后在37℃孵育30min;
40.4.反应与终止:将rna底物稀释为1μm,在每个反应体系中添加2μl稀释后的底物,37℃孵育5、10、15min时,取5μl反应液与终止液(loading buffer:100%甲酰胺,10mm edta)进行1:1混合,置于95℃金属浴中孵育8min;
41.5.配制20%聚丙烯酰胺/8m尿素胶:将下述所有试剂混合后于42℃水浴锅水浴加热至完全溶解,搅拌均匀后,加入4-6μl temed,快速搅拌均匀,加入胶板之中,插入梳子直至胶体凝固;
42.凝胶组分
[0043][0044]
6.电泳:在正式电泳前,将所配制的尿素胶进行恒功率15w,30min的预跑。每孔点样5μl,15w恒功率条件下,电泳15min,采用image lab成像系统曝光,保存图像;
[0045]
7.通过image j软件对底物rna条带进行灰度分析,计算药物对en的抑制率。
[0046]
如图1结果所示,在5、10和15min时,丹参酮i和丹参酮iia均表现出对en酶的活性抑制作用。
[0047]
实施例2
[0048]
目标化合物丹参酮i和丹参酮iia对sftsv内切酶en的酶活抑制效果检测(fret法)
[0049]
实验步骤:
[0050]
1.实验中所用rna单链底物为seq id no2:5
’‑
fam-aggaagauua auaauuuuccu-bhq1-3’;
[0051]
2.配置sftsv en反应的含mn
2+
的反应缓冲液:50mm hepes ph7.8,150mm kcl and 1mm mncl2;
[0052]
3.配制实验反应体系:反应总体积为95μl,取42.5μl由反应缓冲液稀释的核酸内切酶蛋白,然后添加42.5μl溶解于反应缓冲液的药物稀释液(2
×
),使核酸内切酶蛋白反应浓度为1μm,于酶标板中混匀后在3
[0053]
7℃孵育30min;
[0054]
4.提前将酶标仪(biotek synergy h1 microplate reader)打开,设置λex/λem=485nm/535nm,并进行37℃预热;
[0055]
5.反应:将rna底物稀释为1μm,每个反应体系中添加5μl,使rn a的反应浓度为50nm。混匀后放入酶标仪,每两分钟检测一次荧光强度;
[0056]
6.以反应饱和时空白组荧光值作为参照,计算药物处理组抑制率。根据不同浓度药物处理组抑制率,运用prism 8.0软件,拟合药物对酶活抑制率曲线,并计算出丹参酮i和丹参酮iia作用于en的半数有效抑制浓度。
[0057]
如图2结果所示,丹参酮i和丹参酮iia对en的切割抑制作用具有浓度梯度依赖效应。经计算后,通过此检测体系测得的酶活抑制ec
50
分别为0.308mm和0.917mm。
[0058]
实施例3
[0059]
目标化合物丹参酮i和丹参酮iia对sftsv、hrtv和gtv的抗病毒活性检测
[0060]
将对数生长期的vero细胞按4
×
104细胞/孔接种于48孔板细胞培养板中,于37℃,5%co2培养箱中培养14-18h。抗sftsv药物初始浓度为50μm,抗gtv和hrtv药物起始浓度为100μm,采用含2%胎牛血清的dm em三倍倍比稀释药物,共6-8个浓度梯;设置药物溶剂二甲
基亚砜(dms o,0.1%含2%胎牛血清的dmem稀释)对照组;阳性药物组(t-705,起始浓度为500μm,三倍倍比稀释7个浓度)。去除细胞上清后取200μl药物溶液加入细胞,置37℃孵育1h。每孔加入10μl病毒稀释液(感染复数moi=1),置细胞于37℃感染1h。充分去除感染物,细胞用200μl pbs洗一遍。重新在孔中加入200μl对应浓度的药物培养基或含dmso的培养基,继续培养36h,收取150μl细胞培养上清。采用qrt-pcr测定病毒拷贝数。使用dna/rna extraction kit(prepackaged,诺唯赞)提取病毒核酸,用hiscript ii one step qrt-pcr sybr green kit(诺唯赞)进行拷贝数的检测。拷贝数的检测采用标准曲线法:sftsv用已知拷贝数的sftsv np质粒作为标准品,特异性引物靶向np(seq id no3(sftsv-np-f):tgccttc accaagactatcaatgt;seq id no4(sftsv-np-r):gggtccctga aggagttgtaaa);gtv和hrtv使用sftsv的rdrp质粒作为标准品,特异性引物靶向rdrp保守区(seq id no5(sftsv-rdrp-f):atycacacm agaytrgatggaac;seq id no6(sftsv-rdrp-r):twtgcatccat wghtctwgcct)。根据标准曲线,计算出每个样品的拷贝数。以dmso组拷贝数作为参照,计算药物处理组抑制率。根据不同浓度药物处理组抑制率,运用prism 8.0软件,拟合药物抑制率曲线,并计算出丹参酮i和丹参酮iia作用于sftsv、gtv和hrtv的半数有效抑制浓度。结果如图3中sfts v的抑制曲线所示,随着药物剂量的增高,对病毒的抑制率逐渐升高。丹参酮i对sftsv、hrtv和gtv的ec
50
分别为:2.03μm、0.32μm和0.45μm,丹参酮iia对的sftsv、hrtv和gtv的ec
50
分别为:2.86μm、1.64μm和1.60μm,与对照药t-705的ec
50
=47.18μm相比较,达到相相同抑制率的情况下,使用药物浓度更低。
[0061]
实施例4
[0062]
目标化合物丹参酮i和丹参酮iia对lcmv的抗病毒活性检测
[0063]
抗lcmv病毒的活性检测方式参照实施例3,细胞变更为a549细胞,moi为0.01,抗lcmv药物起始浓度为100μm,三倍倍比稀释药物,共6个药物梯度;设置药物溶剂二甲基亚砜(dmso,0.1%含2%胎牛血清的dmem稀释)对照组。感染病毒后48h收取上清液进行后续检测。lcmv用已知拷贝数的l片段质粒做标准品,特异性引物靶向l保守区域(seq id no7(lcmv-l-f):gtagtggtcatggcatcttacc;seq id no8(lcmv-l-r):gagaggagaaaggcaccaatag)。给药方式,检测方式,抑制率计算方法与实施例3中保持一致。结果如图3中lcmv的抑制曲线所示,丹参酮i和丹参酮iia显著抑制lcmv的活性,经计算,ec
50
分别为2.92μm和4.64μm。
[0064]
实施例5
[0065]
目标化合物丹参酮i和丹参酮iia对iav(h1n1)的抗病毒活性检测
[0066]
抗iav病毒的活性检测方式参照实施例3,细胞变更为mdck细胞,moi为0.01,感染病毒后24h收取上清液进行后续检测。iav用已知拷贝数的ha片段质粒做标准品,检测引物为seq id no9(iav-ha-f):gggtccctgaaggagttgtaaa;seq id no10(iav-ha-r):gaagcagtgggtcgcattct。药物稀释倍数,给药方式,检测方式,抑制率计算方法同实施例3中保持一致。结果如图3中iav的抑制曲线所示,丹参酮i和丹参酮iia显著抑制iav的活性,经计算,ec
50
分别为1.04μm和4.02μm。
[0067]
根据前述实施例1-5显示丹参酮i和丹参酮iia对布尼亚病毒科三个病毒sftsv、hrtv、gtv以及lcmv和iav均具有抑制作用,可以看出丹参酮i和丹参酮iia对多种病毒具有广谱抗病毒作用。
[0068]
实施例6
[0069]
目标化合物丹参酮i和丹参酮iia的体内抗病毒活性检测
[0070]
本实验采用6-8周龄的雌性c57bl/6小鼠,每组设置4只小鼠,通过腹腔注射感染1
×
105或5
×
105ffu sftsv病毒。小鼠攻毒后2小时尾静脉注射给药100μl,每只小鼠丹参酮i剂量为18.75mg/kg,丹参酮iia剂量为50mg/kg,对照组给相同体积的溶剂(5%dmso+5% solutol hs 15+5% peg 400+85%生理盐水),之后连续两天于同一时间,以相同方式给药,并记录体重的变化。攻毒后第三天对照组小鼠达到血液病毒载量高峰时收集血液用于检测。通过qrt-pcr法检测病毒拷贝数,检测方式同实施例3中的标准曲线法。所有小鼠实验均在动物生物安全等级二级(animal biosafety level 2,absl-2)的环境下操作,整个实验流程严格遵守实验动物伦理委员会批准的伦理方案。
[0071]
实验结果如图4所示,经腹腔注射攻毒的小鼠,在第三天时,对照组血液病毒载量可达5
×
105拷贝以上,经尾静脉注射丹参酮i或丹参酮iia治疗后,病毒载量明显降低,可降到1
×
105拷贝以下,显示丹参酮i和丹参酮iia在体内对sftsv具有抗病毒作用。
[0072]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1