一种多肽在制备降低血管内皮功能损伤的保护剂中的应用
一种多肽在制备降低血管内皮功能损伤的保护剂中的应用
1.本案为分案申请,原申请的发明名称为:一种用于降低血管内皮功能损伤的保护剂,原申请的申请日为:2022-03-18,原申请的申请号为:cn202210267904.5。
技术领域
2.本发明属于生物医学技术领域,尤其涉及一种多肽在制备降低血管内皮功能损伤的保护剂中的应用。
背景技术:
3.动脉粥样硬化是在40岁以上的男性和绝经期后的女性中常见的血管病变,其是心脑血管疾病的主要病理学基础。目前的研究发现,动脉粥样硬化患者的病理进展通常开始于血管内皮细胞损伤和脂质代谢紊乱。血管内皮是由一层联系覆盖在血管官腔内表面的内皮细胞,在解刨上,它是血流和血管壁之间的一道天然屏障。在功能上,血管内皮是调节血管的结构和功能,维持机体内各项生理病理功能中发挥着重要的功能。
4.血管内皮细胞是覆盖在血管内膜,用于分隔血液、血管壁以及多种组织,并构成血管连续光滑内壁的一层单核细胞。其是多种细胞的一个关键性物理屏障,内皮细胞的损伤会导致内皮功能障碍,从而导致出现动脉粥样硬化的情况,因此,有效的降低内皮细胞的损伤,将有助于动脉粥样硬化患者的治疗。
技术实现要素:
5.本发明的目的在于提供一种可以有效降低血管内皮功能损伤的保护剂。
6.为实现上述目的,本发明提供了如下的技术方案:
7.本发明提供了藤壶肽在制备用于降低血管内皮损伤的保护剂中的应用,其特征在于,所述藤壶肽由藤壶软体部分制备得到,每100g所述藤壶软体部分制备藤壶肽的制备方法包括如下步骤:
8.(1)将100g藤壶软体部分在添加液氮的研磨器中研磨为粉末;
9.(2)加入500ml的蒸馏水,混匀后,调节ph值为6-7,加入10g木瓜蛋白酶,55-65℃水解4-6h;
10.(3)水解结束之后,90-95℃进行水浴加热20-30分钟,离心收集上清,得到藤壶酶解液;
11.(4)使用5kda的超滤膜对所述藤壶酶解液进行过滤,收集滤过液,得到藤壶肽提取液;
12.(5)将所述藤壶肽提取液进行冷冻干燥,得到藤壶肽。
13.优选地,所述保护剂可以降低胆固醇导致的人脐静脉内皮细胞活力下降。
14.优选地,所述保护剂可以降低胆固醇导致的人脐静脉内皮细胞中凋亡增加。
15.其次,本发明提供了藤壶肽在制备用于改善胆固醇引起的人脐静脉内皮细胞活力下降的生物制剂中的应用,所述藤壶肽由藤壶软体部分制备得到,每100g所述藤壶软体部
分制备藤壶肽的制备方法包括如下步骤:
16.(1)将100g藤壶软体部分在添加液氮的研磨器中研磨为粉末;
17.(2)加入500ml的蒸馏水,混匀后,调节ph值为6-7,加入10g木瓜蛋白酶,55-65℃水解4-6h;
18.(3)水解结束之后,90-95℃进行水浴加热20-30分钟,离心收集上清,得到藤壶酶解液;
19.(4)使用5kda的超滤膜对所述藤壶酶解液进行过滤,收集滤过液,得到藤壶肽提取液;
20.(5)将所述藤壶肽提取液进行冷冻干燥,得到藤壶肽。
21.其次,本发明提供了藤壶肽在制备用于改善胆固醇引起的人脐静脉内皮细胞凋亡增加的生物制剂中的应用,所述藤壶肽由藤壶软体部分制备得到,每100g所述藤壶软体部分制备藤壶肽的制备方法包括如下步骤:
22.(1)将100g藤壶软体部分在添加液氮的研磨器中研磨为粉末;
23.(2)加入500ml的蒸馏水,混匀后,调节ph值为6-7,加入10g木瓜蛋白酶,55-65℃水解4-6h;
24.(3)水解结束之后,90-95℃进行水浴加热20-30分钟,离心收集上清,得到藤壶酶解液;
25.(4)使用5kda的超滤膜对所述藤壶酶解液进行过滤,收集滤过液,得到藤壶肽提取液;
26.(5)将所述藤壶肽提取液进行冷冻干燥,得到藤壶肽。
27.其次,本发明提供了藤壶肽在制备用于降低胆固醇引起的人脐静脉内皮细胞促细胞凋亡蛋白bax蛋白表达升高的生物制剂中的应用,其特征在于,所述藤壶肽由藤壶软体部分制备得到,每100g所述藤壶软体部分制备藤壶肽的制备方法包括如下步骤:
28.(1)将100g藤壶软体部分在添加液氮的研磨器中研磨为粉末;
29.(2)加入500ml的蒸馏水,混匀后,调节ph值为6-7,加入10g木瓜蛋白酶,55-65℃水解4-6h;
30.(3)水解结束之后,90-95℃进行水浴加热20-30分钟,离心收集上清,得到藤壶酶解液;
31.(4)使用5kda的超滤膜对所述藤壶酶解液进行过滤,收集滤过液,得到藤壶肽提取液;
32.(5)将所述藤壶肽提取液进行冷冻干燥,得到藤壶肽。
33.其次,本发明提供了藤壶肽在制备用于提高胆固醇引起的人脐静脉内皮细5胞抑细胞凋亡蛋白bcl-2蛋白表达降低的生物制剂中的应用,其特征在于,
34.所述藤壶肽由藤壶软体部分制备得到,每100g所述藤壶软体部分制备藤壶肽的制备方法包括如下步骤:
35.(1)将100g藤壶软体部分在添加液氮的研磨器中研磨为粉末;
36.(2)加入500ml的蒸馏水,混匀后,调节ph值为6-7,加入10g木瓜蛋0白酶,55-65℃水解4-6h;
37.(3)水解结束之后,90-95℃进行水浴加热20-30分钟,离心收集上清,得到藤壶酶
解液;
38.(4)使用5kda的超滤膜对所述藤壶酶解液进行过滤,收集滤过液,得
39.到藤壶肽提取液;
40.5(5)将所述藤壶肽提取液进行冷冻干燥,得到藤壶肽。
41.除此之外,本发明提供了一种用于降低血管内皮功能损伤的保护剂,其特征在于,所述保护剂的有效成分为藤壶肽,所述藤壶肽由藤壶软体部分制备得到,每100g所述藤壶软体部分制备藤壶肽的制备方法包括如下步骤:
42.(1)将100g藤壶软体部分在添加液氮的研磨器中研磨为粉末;0(2)加入500ml的蒸馏水,混匀后,调节ph值为6-7,加入10g木瓜蛋
43.白酶,55-65℃水解4-6h;
44.(3)水解结束之后,90-95℃进行水浴加热20-30分钟,离心收集上清,得到藤壶酶解液;
45.(4)使用5kda的超滤膜对所述藤壶酶解液进行过滤,收集滤过液,得到藤壶肽提取液;
46.(5)将所述藤壶肽提取液进行冷冻干燥,得到藤壶肽。
47.本发明的有益效果是:
48.本发明发现,通过本发明所提供的藤壶肽处理人脐静脉内皮细胞后,可以有效的逆转胆固醇所导致的细胞活力下降,并且可以有效的降低胆固醇所导致的促细胞凋亡蛋白bax上调和升高胆固醇所导致的抑细胞凋亡蛋白bcl-2下调,从而可以有效的血管内皮损伤,并且可将其用于治疗高脂饮食所导致的动脉粥样硬化。
附图说明
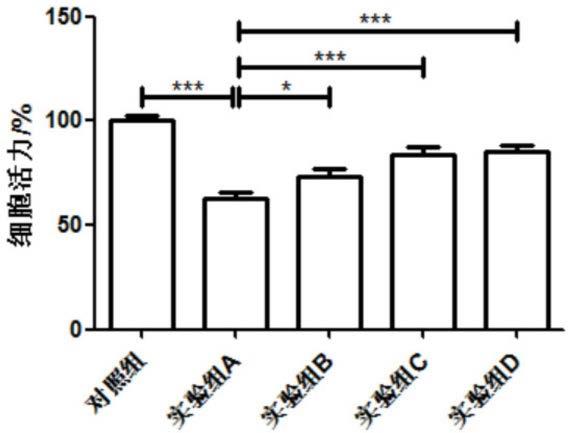
49.图1藤壶肽对于胆固醇导致的huvec的细胞活性下降的影响;
50.图2藤壶肽对于胆固醇导致的促细胞凋亡蛋白bax的蛋白表达上调和抑细胞凋亡蛋白bcl-2的蛋白表达下调的影响。
具体实施方式
51.为能清楚说明本方案的技术特点,下面通过具体实施方式,对本方案进行阐述。
52.实施例1
53.(1)将100g藤壶软体部分在添加液氮的研磨器中研磨为粉末;
54.(2)加入500ml的蒸馏水,混匀后,调节ph值为6.5,加入10g木瓜蛋白酶,60℃水解4-6h;
55.(3)水解结束之后,95℃进行水浴加热30分钟,离心收集上清,得到藤壶酶解液;
56.(4)使用5kda的超滤膜对藤壶酶解液进行过滤,收集滤过液,得到藤壶肽提取液;
57.(5)将藤壶肽提取液进行冷冻干燥,得到藤壶肽。
58.实施例2
59.(1)使用dmem培养基将藤壶肽配置为50mg/ml,100mg/ml和150mg/ml的藤壶肽试剂;
60.(2)将100ul对数生长期的1
×
104/ml的huvec(人脐静脉内皮细胞)于96孔培养板
中,置于细胞培养箱中;
61.(3)培养1d后,去除培养基,使用pbs清洗细胞2次,对照组:加入无血清的dmem培养基,处理24h,实验组a:无血清的dmem培养基处理4h后,加入含有10μmol/l胆固醇的无血清培养基处理20h;实验组b:加入含有50mg/ml的藤壶肽处理4h后,加入含有10μmol/l胆固醇的无血清培养基处理20h;实验组c:加入含有100mg/ml的藤壶肽处理4h后,加入含有10μmol/l胆固醇的无血清培养基处理20h;实验组d:加入含有150mg/ml的藤壶肽处理4h后,加入含有10μmol/l胆固醇的无血清培养基处理20h,同时,设置空白对照,每组设置3个重复;
62.(4)处理结束后,加入mtt试剂,细胞培养箱中放置4h;
63.(5)去除上清,加入dmso,摇床避光震荡20min;
64.(6)置于酶标仪570nm检测吸光度,并计算细胞活力,得到的实验结果如图1所示。
65.从图中,可以得到,实验组a的细胞活力为62.84
±
2.84,实验组b的细胞活力为73.12
±
3.61,实验组c的细胞活力为84.09
±
3.10,实验组d的细胞活力为84.99
±
3.12,从该结果可以看出,使用藤壶肽预处理后,可以有效的改善胆固醇所造成的huvec细胞活力下降,差异具有统计学意义。
66.实施例2
67.(1)将对数生长期的1
×
105/ml的huvec(人脐静脉内皮细胞)于96孔培养板中,置于细胞培养箱中进行培养;
68.(2)待细胞密度达到90%时,去除培养基,使用pbs清洗细胞2次,对照组:加入无血清的dmem培养基,处理24h,实验组1:无血清的dmem培养基处理4h后,加入含有10μmol/l胆固醇的无血清培养基处理20h;实验组2:加入含有100mg/ml的藤壶肽处理4h后,加入含有10μmol/l胆固醇的无血清培养基处理20h;
69.(3)处理结束后,去除培养基,使用pbs清洗6孔板中的细胞3次,随后每孔加入100ul裂解液;
70.(4)使用细胞刮刀将细胞刮下后,使裂解液和细胞充分混合,冰上裂解30min;
71.(5)裂解30min后,用移液枪把细胞碎片和裂解液的混合物吸入2ml离心管中;
72.(6)12000g,4℃离心10min,去上清于新的离心管中并测量蛋白浓度,加入蛋白上样缓冲液后,100℃煮蛋白10min,得到蛋白样品;
73.(7)安装电泳槽,进行蛋白样品上样,并在第一孔中加入蛋白标准品marker;
74.(8)先用80v电压恒压电泳,当蓝色上样缓冲液到达分离胶时,上调电压为130v,当上样缓冲液达到底部边缘的时候,停止电泳;
75.(9)将pvdf膜于甲醇中浸泡1min后,从阴极到阳极依次放入海绵垫-滤纸-分离胶-膜-滤纸-海绵垫,将转膜夹夹紧后,放入转膜槽中,加入冰盒和转膜缓冲液后,250ma恒流转膜90min;
76.(10)转膜结束后,取出pvdf膜,使用tbsr洗涤3次,用tbst配置5%脱脂奶粉,将膜放入封闭液中,室温轻微震荡封闭1h;
77.(11)将封闭玩的膜用tbst漂洗3次,每次10min,去除tbst后加入bax,bcl-2和β-actin,4℃孵育过夜;
78.(12)吸走一抗后,使用tbst漂洗3次,每次10min,加入二抗,室温轻摇1h;
79.(13)tbst漂洗3次后,进行化学发光和显影,得到的结果如图2所示。
80.从图中,可以得到,实验组1中,促细胞凋亡蛋白bax的蛋白表达上调,而抑细胞凋亡蛋白bcl-2的蛋白表达下调;实验组2中,通过藤壶肽处理之后,胆固醇导致的促细胞凋亡蛋白bax的蛋白表达上调和抑细胞凋亡蛋白bcl-2下调明显逆转,说明藤壶肽可以有效的逆转胆固醇引起的huvec的凋亡增加。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1