用于治疗下泌尿道症状、良性前列腺肥大、勃起功能障碍的组合物和方法与流程
用于治疗下泌尿道症状、良性前列腺肥大、勃起功能障碍的组合物和方法
1.本专利申请要求2013年11月11日提交的美国临时专利申请no.61/902,376的优先权,将其全部内容通过引用并入本文。
2.发明领域
2.本发明总地涉及治疗、预防和缓解下泌尿道症状(luts)、良性前列腺增生(bph)、勃起功能障碍(ed)、尿失禁及其它疾病或症状。
3.
背景技术:
3.下泌尿道症状(luts)随男性年龄增大而变得越来越令人烦恼,在八十几岁的男性中,中度至重度症状的患病率上升至接近50%。luts可能与良性前列腺增生(bph)有关或无关,良性前列腺增生是一种以尿道周围的前列腺组织的非恶性过度生长为特征的组织学病症,其出现在50%的五十几岁的男性中,且出现在90%的八十几岁的男性中。luts也可由年龄相关的膀胱逼尿肌功能障碍及其它交感神经病症引起。luts进一步分类为排尿症状或蓄尿症状,并且按照国际前列腺症状评分(ipss)来定义,ipss是一种在医学和科学团体中广泛使用的已验证的工具。
4.排尿症状包括排尿踌躇、启动排尿延迟、间歇现象、排尿的非自主中断、尿流慢、用力排尿、感觉未完全排空、尿末滴沥,并且可以由前列腺肿大或组织炎症引起。蓄尿症状可以包括尿频、夜尿、尿急、失禁和膀胱疼痛或排尿困难,并且可以由膀胱逼尿肌活动过度引起。与bph的风险增加有关的生理学标志物包括高水平的睾酮、二氢睾酮、脱氢表雄酮和雌二醇、胰岛素样生长因子和炎症标志物。
5.尽管luts和bph引起的luts不是危害生命的病症,但是luts对于生活质量(qol)的影响可能是显著的,且在大多数情况下必需治疗以避免并发症。危险因素包括年龄、前列腺体积和最大尿流率以及生活方式、膳食结构、酒精消耗、体育活动或遗传因素。在美国,在约34%的病例中在诊断时推荐观察等待。对于luts的已注册的药物治疗可引起多种副作用,因此有必要研究新的治疗方法。
6.根据美国泌尿协会,未受luts烦扰的具有轻度烦恼(ipss《8)的患者或具有中度至重度症状(ipss≥8)的患者可以用观察等待和生活方式改变来控制。如果在采取保守措施时显著令人烦恼的症状仍然持续存在,则指示开始医学控制,并且在某些情况下,可推荐外科手术。
7.国立卫生研究所(the national institutes of health)估计在美国勃起功能障碍(ed)影响多达3千万男性。发病率随年龄上升:约4%的50几岁男性和几乎17%的60几岁男性发生勃起的完全失能。对于超过75岁的男性,发病率猛增至47%。
8.良性前列腺增生(bph)是一种老年男性的常见问题,且引起明显的失能。组织学诊断的前列腺增生的患病率从31至40岁男性的8%增加至51岁至60岁男性的40至50%,在超过80岁的男性中增加至高于80%。
9.尿失禁是一种随年龄增加的较少被诊出(underdiagnosed)且较少被报道的(underreported)问题。其影响处于长期护理机构中的50-84%的老年人。在任何年龄,其在女性中比在男性中常见性高2倍。
10.膀胱过度活动症(oab)普遍存在于10至18%的人群中,几乎同等地影响男性和女性。oab对于患者的生活质量具有负面影响。与oab有关的luts引起显著的社会、心理、职业、家庭和身体上的难堪(stigmas)。
11.4.发明简述
12.本发明部分地基于发现向干燥的蔓越橘(cranberry)粉末中添加蔓越橘种子或蔓越橘种子粉(seed meal)提供了有效地对抗下泌尿道症状(luts)及其它疾病或症状而没有现有治疗的副作用的治疗组合物。
13.在一个方面,本发明提供包含干燥的蔓越橘粉末和干燥的蔓越橘种子的治疗组合物。
14.在另一个方面,本发明提供包含干燥的蔓越橘粉末和蔓越橘种子粉的治疗组合物。
15.在某些实施方案中,蔓越橘为大果越橘(vaccinium macrocarpon)。
16.在某些实施方案中,蔓越橘为小果越橘(vaccinium microcarpon)。
17.在某些实施方案中,蔓越橘为vaccinium oxycoccus。
18.在某些实施方案中,蔓越橘种子的存在量为干燥的蔓越橘粉末的约5%至约50%重量。
19.在某些实施方案中,蔓越橘种子的存在量为干燥的蔓越橘粉末的约15%至约25%重量。
20.在某些实施方案中,蔓越橘种子的存在量为所述干燥的蔓越橘粉末的约20%重量。
21.在某些实施方案中,蔓越橘种子粉的存在量为所述干燥的蔓越橘粉末的约5%至约50%重量。
22.在某些实施方案中,蔓越橘种子粉的存在量为所述干燥的蔓越橘粉末的约15%至约25%重量。
23.在某些实施方案中,蔓越橘种子粉的存在量为所述干燥的蔓越橘粉末的约20%重量。
24.在某些实施方案中,组合物包含小于约12%重量的有机酸。
25.在某些实施方案中,组合物包含小于10%重量的有机酸。
26.在某些实施方案中,组合物包含小于约5%至约8%重量的有机酸。
27.在某些实施方案中,组合物包含小于约15%重量的糖。
28.在某些实施方案中,组合物包含小于约12%重量的糖。
29.在某些实施方案中,组合物包含约1%至约5%重量的奎尼酸。在某些实施方案中,组合物包含约2.2%至约3.2%重量的奎尼酸。
30.在某些实施方案中,组合物包含约0.4%至约4%重量的苹果酸。
31.在某些实施方案中,组合物包含约0.8%至约1.8%重量的苹果酸。
32.在某些实施方案中,组合物包含约1%至约5%重量的柠檬酸。
33.在某些实施方案中,组合物包含约1.8%至约3.2%重量的柠檬酸。
34.在某些实施方案中,组合物包含∶以重量计,0.5%至5.0%的原花色素(proanthocyanidin)、0.05%至1.5%的栎精、0.001%至0.1%的栎精-3-葡糖苷、0.001%至0.1%的栎精-3-鼠李糖苷、0.001%至0.1%的栎精-3-木糖苷、0.001%至0.1%的栎精-3-阿拉伯糖苷(arabinoside)、0.001%至0.5%的杨梅素(myricetin)、0.001%至0.1%的芍药素(peonidin)-3-半乳糖苷、0.001%至0.1%的芍药素-3-葡糖苷、0.001%至0.1%的芍药素-3-阿拉伯糖苷、0.001%至0.1%的花青素-3-葡糖苷、0.001%至0.1%的花青素-3-半乳糖苷、0.001%至0.1%的花青素-3-阿拉伯糖苷、0.001%至0.1%的原儿茶酸、0.001%至0.1%的对-香豆酸、0.001%至0.1%的咖啡酰基(caffeoyl)-葡糖苷、0.001%至0.1%的香豆酰基(coumaroyl)-葡糖苷、0.001%至0.1%的咖啡酸、0.001%至0.1%的绿原酸或0.01至1.5%的熊果酸。
35.在某些实施方案中,组合物包括:以重量计,1.0%至1.2%的原花色素、0.16%至0.20%的栎精、0.07%至0.09%的栎精-3-葡糖苷、0.03%至0.04%的栎精-3-鼠李糖苷、0.019%至0.025%的栎精-3-木糖苷、0.025%至0.035%的栎精-3-阿拉伯糖苷、0.010%至0.014%的杨梅素、
36.0.022%至0.030%的芍药素-3-半乳糖苷、0.0025%至0.0035%的芍药素-3-葡糖苷、0.010%至0.020%的芍药素-3-阿拉伯糖苷、0.0005%至0.0015%的花青素-3-葡糖苷、0.015%至0.030%的花青素-3-半乳糖苷、0.010%至0.025%的花青素-3-阿拉伯糖苷、0.019%至0.025%的原儿茶酸、0.04%至0.06%的对-香豆酸、0.015%至0.025%的咖啡酰基-葡糖苷、0.005%至0.015%的香豆酰基-葡糖苷、0.010%至0.015%的咖啡酸或0.03%至0.04%的绿原酸。
37.在某些实施方案中,组合物大致包括:以重量计,1.1%的原花色素、0.18%的栎精、0.083%的栎精-3-葡糖苷、0.034%的栎精-3-鼠李糖苷、0.022%的栎精-3-木糖苷、0.030%的栎精-3阿拉伯糖苷、0.012%的杨梅素、0.027%的芍药素-3-半乳糖苷、0.003%的芍药素-3-葡糖苷、0.014%的芍药素-3-阿拉伯糖苷、0.001%的花青素-3-葡糖苷、0.022%的花青素-3-半乳糖苷、0.018%的花青素-3-阿拉伯糖苷、0.022%的原儿茶酸、0.052%的对-香豆酸、0.021%的咖啡酰基-葡糖苷、0.011%的香豆酰基-葡糖苷、0.014%的咖啡酸、0.034%的绿原酸或0.92%的熊果酸。
38.在某些实施方案中,组合物包含以重量计每100g组合物1至100μg的落叶松树脂醇(lariciresinol)、1至100μg的开环异落叶松树脂酚(secoisolariciresinol)或1至100μg的松脂醇(pinoresinol)。
39.在某些实施方案中,组合物包含以重量计每100g组合物约51μg的落叶松树脂醇、约12μg的开环异落叶松树脂酚或约78μg的松脂醇。
40.在另一个方面,本发明提供包含上述治疗组合物的固体口服剂型。
41.在某些实施方案中,固体口服剂型为片剂。
42.在其它实施方案中,固体口服剂型为胶囊。
43.在某些实施方案中,固体口服剂型为软胶囊。
44.在某些实施方案中,固体口服剂型包含100mg至500mg的治疗组合物。
45.在某些实施方案中,固体口服剂型包含250mg的治疗组合物。
46.在某些实施方案中,固体口服剂型包含500mg的治疗组合物。
47.在另一个方面,本发明提供一种用于缓解受试者的下泌尿道症状(luts)的方法,包括向有需要的受试者给药有效量的上述组合物。
48.在另一个方面,本发明提供一种用于缓解受试者中良性前列腺增生(bph)的症状的方法,包括向有需要的受试者给药有效量的上述组合物。
49.在另一个方面,本发明提供一种用于治疗受试者的勃起功能障碍(ed)的方法,包括向有需要的受试者给药有效量的上述组合物。
50.在另一个方面,本发明提供一种用于治疗受试者的尿失禁的方法,包括向有需要的受试者给药有效量的上述组合物。
51.在另一个方面,本发明提供一种用于治疗受试者的膀胱过度活动症(ed)的方法,包括向有需要的受试者给药有效量的上述组合物。
52.在其它方面,本发明提供一种用于治疗受试者的膀胱阻塞、间质性膀胱炎、膀胱活动不足、前列腺炎、膀胱和前列腺炎症、前列腺纤维化或骨盆痛的方法,包括向有需要的受试者给药有效量的上述组合物。
53.在某些实施方案中,受试者为人类。
54.在某些实施方案中,所述人类为男性。
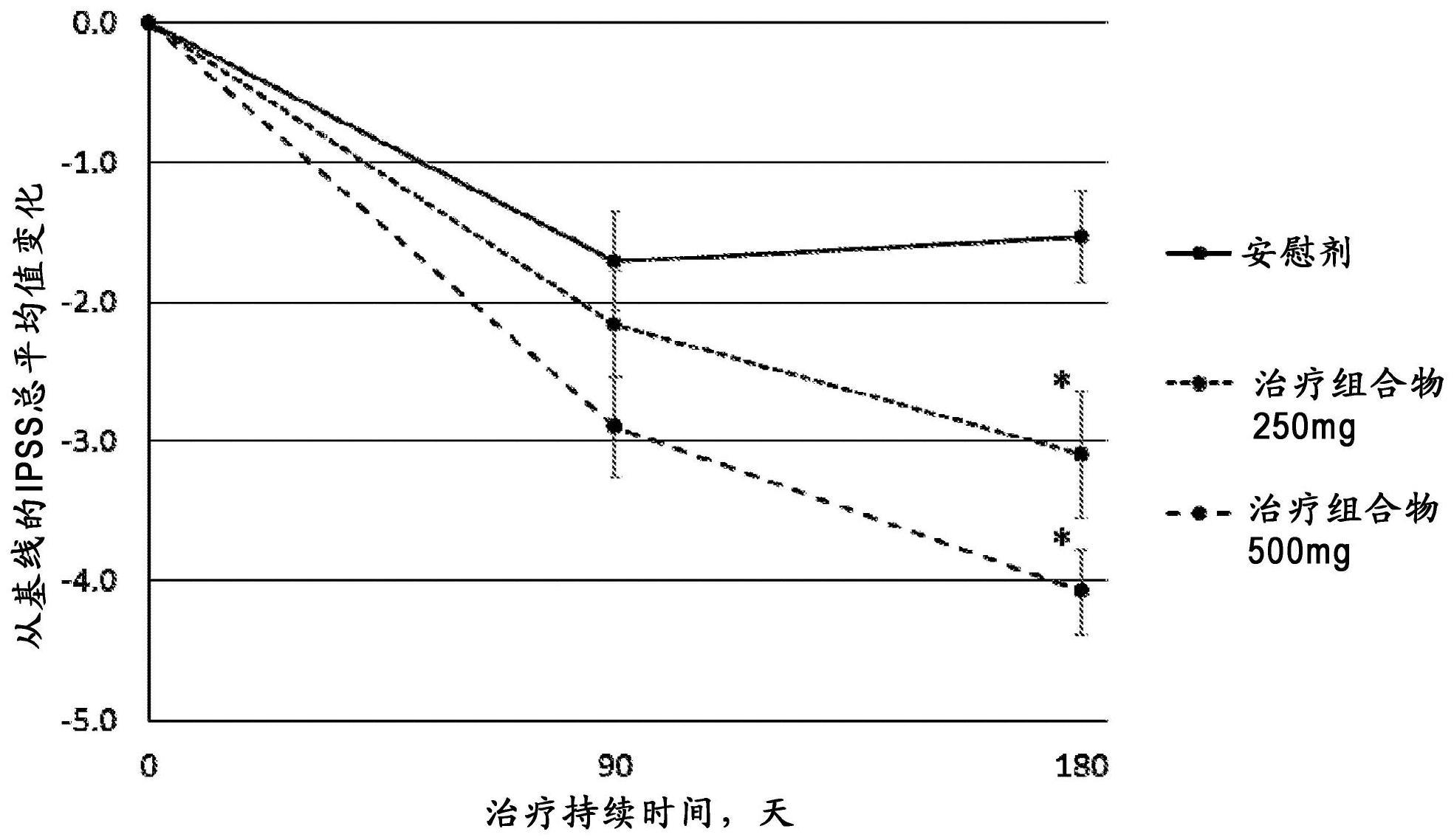
55.在某些实施方案中,所述人类为女性。
56.5.附图简述
57.参照下述附图阐述本发明,所述附图仅提供用于说明目的而不打算限制本发明。
58.图1图解了参与luts研究中第一次筛选访问的148名男性的consort图。
59.图2图解在luts研究中,对于安慰剂组、治疗组合物250mg组和治疗组合物500mg组,在开始、3个月和6个月时国际前列腺症状评分(ipss)的平均差异和相应95%置信区间的图。
60.6.详细说明
61.6.1定义
62.本文提及的专利和科学文献建立了本领域技术人员可获得的知识。将本文引用的已批准的美国专利、允许的申请、公布的外国申请和参考文件以如同将其各自特别地和分别地表明通过引用并入的相同程度而通过引用并入本文。
63.如本文使用的,对于变量的数值范围的列举是用于表达本发明可以以等于该范围之内任何值的变量来实施。因此,对于固有地不连续的变量,该变量可以等于该数值范围之内的任何整数值,包括该范围的端点值。类似地,对于固有地连续的变量,该变量可以等于该数值范围之内的任何实值,包括该范围的端点。作为一个实例而不限于此,描述为具有在0至2之间的值的变量可以取值0、1、或2(如果该变量是固有地不连续的),且可以取值0.0、0.1、0.01、0.001或任何其它≥0和≤2的实值(如果该变量是固有地连续的)。
64.如本文使用的,除非另外特别地指明,否则术语“或”是用于“和/或”的包括性含义而不是“任一/或(either/or)”的排它性含义。
65.如本文使用的“约”指在
±
10%之内。例如,“约1”指“0.9至1.1”、“约2%”指“1.8%至2.2%”、“约2%至3%”指“1.8%至3.3%”,和“约3%至约4%”指“2.7%至4.4%”。
66.6.2蔓越橘果实
67.蔓越橘果实,例如大果越橘,被认为是有机酸和酚酸、黄酮醇、黄烷-3-醇、花色素、原花色素(pac)和五环三萜类化合物(包括熊果酸和齐墩果酸)的丰富来源。
68.蔓越橘果实中可能存在的药物活性化合物的非穷举性列表列在表1中。
69.表1
70.71.72.73.74.[0075][0076]
6.3基于蔓越橘果实组分的治疗组合物
[0077]
本文所述治疗组合物可以包括下面提供范围中的一种或多种如下所述组分。
[0078]
在某些实施方案中,本文所述治疗组合包含干燥的蔓越橘粉末和干燥的蔓越橘种子。在其它实施方案中,本文所述治疗组合物包含干燥的蔓越橘粉末和蔓越橘种子粉。
[0079]
用于制备组合物的蔓越橘物种可以是大果越橘、小果越橘或vaccinium oxycoccus。然而,其它种类的蔓越橘也可以用于制备本文所述组合物。
[0080]
蔓越橘种子在治疗组合物中的存在量可以为干燥的蔓越橘粉末的约5%至约50%、约15%至约25%或约20%重量。蔓越橘种子粉在治疗组合物中的存在量可以为干燥的蔓越橘粉末的约5%至约50%、约15%至约25%或约20%重量。
[0081]
治疗组合物可以包含小于约12%、小于约10%、或约5%至约8%重量的有机酸。示例性的有机酸包括,但不限于奎尼酸、苹果酸和柠檬酸。
[0082]
可以使用下述名称为quinic,malic and citric acids in cranberry juice cocktail and apple juice(得自aoac international,www.aoac.org)方案aoac 986.13的改进形式测定有机酸含量。分析柱为c18反相柱(具有5μm粒径、25cm
×
4.6mm),其与c18反相净化滤芯(reverse phase cartridge)串联且后接c18反相净化滤芯(具有5μm粒径且长10cm。使用磷酸盐缓冲液,0.2m kh2po4,ph 2.4。流速为0.80ml/min,在环境温度下进行分析,且检测波长为214nm。可以在流动相中进行测试剂的稀释。标准品的cas#_如下∶cas-77-92-9(柠檬酸),cas-6915-15-7(苹果酸),cas-77-95-2(奎尼酸)。用于计算每种有机酸的浓度的公式如下:(pa/pa’)
×
(v’/v)
×
c,其中分别地pa和pa’=测试溶液和标准品的峰面积;分别地v和v’=测试溶液和标准品的体积;和c=标准品的浓度,%。也可以用该方法检测莽
草酸和抗坏血酸。
[0083]
治疗组合物可以包含以重量计约1%至约5%或约2.2%至约3.2%的奎尼酸。
[0084]
治疗组合物可以包含以重量计约0.4%至约4%或约0.8%至约1.8%的苹果酸。
[0085]
治疗组合物可以包括以重量计约1%至约5%或约1.8%至约3.2%的柠檬酸。
[0086]
治疗组合物可以包括以重量计小于约15%或小于约12%的糖。果糖、葡萄糖和蔗糖为蔓越橘中通常发现的糖的实例。糖含量反映总糖量,并且没有提供关于这些批次(lots)中的单独分析(individual breakdown)。
[0087]
可以通过hplc测定糖含量,使用下述方案aoac 977.20的改进形式。使用的柱为μ-bondapak/碳水化合物(waters associates,no.84038),具有保护柱或等效物。流动相由用水稀释的非光谱乙腈(乙腈/水:83/17,v/v)组成。糖标准溶液由果糖(cas#_57-48-7)、葡萄糖(cas#50-99-7)和蔗糖(cas#57-50-1)组成。将样品稀释在水中,并通过45μm过滤器过滤。在室温下,将10μl的样品注射到柱中。流速为在等度(isocratic)条件下为1.0ml/min,20分钟。使用折光率检测器。如下由积分器值或由峰高计算葡萄糖、果糖和蔗糖的量:糖的重量%=100
×
(ph/ph’)
×
(v/v’)
×
(w’/w),其中分别地ph和ph’=样品和标准品的峰高(或积分器值);分别地v和v’=ml样品和标准品(50和100)溶液;且分别地w和w’=g样品(5.000)和标准品。
[0088]
在某些实施方案中,治疗组合物包含∶以重量计,0.5%至5.0%的原花色素、0.05%至1.5%的栎精、0.001%至0.1%的栎精-3-葡糖苷、0.001%至0.1%的栎精-3-鼠李糖苷、0.001%至0.1%的栎精-3-木糖苷、
[0089]
0.001%至0.1%的栎精-3-阿拉伯糖苷、0.001%至0.5%的杨梅素、0.001%至0.1%的芍药素-3-半乳糖苷、0.001%至0.1%的芍药素-3-葡糖苷、0.001%至0.1%的芍药素-3-阿拉伯糖苷、0.001%至0.1%的花青素-3-葡糖苷、0.001%至0.1%的花青素-3-半乳糖苷、0.001%至0.1%的花青素-3-阿拉伯糖苷、0.001%至0.1%的原儿茶酸、0.001%至0.1%的对-香豆酸、0.001%至0.1%的咖啡酰基-葡糖苷、0.001%至0.1%的香豆酰基-葡糖苷、0.001%至0.1%的咖啡酸、0.001%至0.1%的绿原酸或0.01至1.5%的熊果酸。
[0090]
可以通过hplc-荧光,使用如下的develosil diol柱或等同物测定原花色素和一种或多种其它组分的含量。柱室保持在35℃。使用的溶剂如下∶(a)在乙腈中的2%乙酸,和(b)为95:3:2的甲醇/水/乙酸。使用的线性梯度为在35min内,0%至40% b;在40min内,40%至100%b;在45min内,100%等度b;和在50min内,100%至0%的b。
[0091]
可以通过hplc-uv,在535nm波长下测定花色素类(芍药素-3-半乳糖苷、芍药素-3-葡糖苷、芍药素-3-阿拉伯糖苷、花青素-3-葡糖苷、花青素-3-半乳糖苷、花青素-3-阿拉伯糖苷)的含量。柱为synergi hydro-rp或等同物。柱室保持在室温。流动相a由5%甲酸水溶液组成,流动相b为甲醇。施用的梯度为0-2min,5% b;2-10min,5-20%b;10-15min,20% b;15-30min,20-25% b;30-35min,25% b;35-50min,25-33% b;50-55min,33% b;55-65min,33-36% b;65-70min,36-45% b;70-75min,45-53% b;75-80min,53-55% b;80-84min,55-70% b;84-88min,70-5% b;88-90min,5% b。
[0092]
可以使用下述方法,通过uplc-ms/ms测定某些其它酚类的含量。使用acquity t3柱(waters associates)或等同物,并放入保持在30℃温度的uplc柱室中。使用的溶剂为0.1%甲酸(a)和乙腈(b)。施用的线性梯度为5% b;0-4.5min,5-20% b;4.5-6.45min,等
度的20%b;6.45-13.5min,20-45% b;13.5-16.5min 45-100% b;16.5-19.5min等度的100% b;19.5-19.52min 100-5% b;19.52-22.5min。通过ms/ms进行检测,并且所有标准化合物单独地调整。
[0093]
在某些实施方案中,治疗组合物包含∶以重量计,1.0%至1.2%的原花色素、0.16%至0.20%的栎精、0.07%至0.09%的栎精-3-葡糖苷、0.03%至0.04%的栎精-3-鼠李糖苷、0.019%至0.025%的栎精-3-木糖苷、0.025%至0.035%的栎精-3-阿拉伯糖苷、0.010%至0.014%的杨梅素、0.022%至0.030%的芍药素-3-半乳糖苷、0.0025%至0.0035%的芍药素-3-葡糖苷、0.010%至0.020%的芍药素-3-阿拉伯糖苷、0.0005%至0.0015%的花青素-3-葡糖苷、0.015%至0.030%的花青素-3-半乳糖苷、0.010%至0.025%的花青素-3-阿拉伯糖苷、0.019%至0.025%的原儿茶酸、0.04%至0.06%的对-香豆酸、0.015%至0.025%的咖啡酰基-葡糖苷、0.005%至0.015%的香豆酰基-葡糖苷、0.010%至0.015%的咖啡酸或0.03%至0.04%的绿原酸。
[0094]
在某些实施方案中,治疗组合物大致包含∶以重量计,1.1%的原花色素、0.18%的栎精、0.083%的栎精-3-葡糖苷、0.034%的栎精-3-鼠李糖苷、0.022%的栎精-3-木糖苷、0.030%的栎精-3阿拉伯糖苷、0.012%的杨梅素、0.027%的芍药素-3-半乳糖苷、0.003%的芍药素-3-葡糖苷、0.014%的芍药素-3-阿拉伯糖苷、0.001%的花青素-3-葡糖苷、0.022%的花青素-3-半乳糖苷、0.018%的花青素-3-阿拉伯糖苷、0.022%的原儿茶酸、0.052%的对-香豆酸、0.021%的咖啡酰基-葡糖苷、0.011%的香豆酰基-葡糖苷、0.014%的咖啡酸、0.034%的绿原酸或0.92%的熊果酸。
[0095]
在某些实施方案中,治疗组合物包含每100g组合物1至100μg或约51μg的落叶松树脂醇。在某些实施方案中,治疗组合物包含每100g组合物1至100μg或约12μg的开环异落叶松树脂酚。在某些实施方案中,治疗组合物包含每100g组合物1至100μg或约78μg的松脂醇。
[0096]
可以通过uplc-ms/ms,使用acquity beh c18反相柱或等同物如下测定木脂素类的含量。柱室保持在30℃。使用的溶剂为(a)甲酸0.1%和(b)乙腈。梯度为5% b,8.0min,30% b,9.0min,30% b,10.0min,50% b,12.0min,50% b,15.0min,95% b,17.0min,95% b,17.5min,5% b,23.0min,5% b。通过ms/ms进行检测,并且所有标准化合物单独地调整。
[0097]
在某些实施方案中,可以在没有蔓越橘果实的情况下制备上述治疗组合物,例如,通过将得自天然来源或化学合成的成分组合到治疗组合物中。
[0098]
6.4固体剂型和使用方法
[0099]
在某些实施方案中,包括本文所述治疗组合物的固体口服剂型为片剂、胶囊或软胶囊。在某些实施方案中,这种固体口服剂型包含50mg至500mg的治疗组合物,例如50mg,100mg,150mg,200mg,250mg,300mg,350mg,400mg,450mg或500mg。
[0100]
包括本文所述治疗组合物的固体剂型任选地包含合适量的一种或多种药学上可接受的赋形剂,以提供用于适当地给药于受试者的形式。
[0101]
这样的药物赋形剂可以是液体,比如水和油类,包括石油、动物、植物或合成来源的那些油,比如花生油、大豆油、矿物油、芝麻油等。药物赋形剂可以是盐水、阿拉伯树胶、明胶、淀粉糊、滑石、角蛋白、胶体二氧化硅、脲等。另外,可以使用助剂、稳定剂、增稠剂、润滑剂和着色剂。在一个实施方案中,当向受试者给药时,药学上可接受赋形剂为无菌的。合适
的药物赋形剂也包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂乳、甘油、丙二醇、水、乙醇等。如果需要,本发明的治疗组合物也可以含有少量润湿剂或乳化剂或者ph缓冲剂。在一个实施方案中,组合物为胶囊的形式(参见,例如美国专利no.
[0102]
5,698,155)。合适的药物赋形剂的其它实例描述在remington’spharmaceutical sciences 1447-1676(alfonso r.gennaro编著,第19版,1995)中。
[0103]
在某些实施方案中,根据常规方法将本文所述治疗组合物配制成适合于口服给药至人类的组合物。例如,用于口服递送的组合物可以为片剂、锭剂、水性或油性悬浮液、颗粒、粉末、乳液、胶囊、软胶囊、糖浆或酏剂的形式。口服给药的组合物可以含有一种或多种试剂,例如甜味剂如果糖、阿司帕坦或糖精,矫味剂如薄荷、冬青油或樱桃,着色剂和防腐剂,以提供药学上适口的制剂。而且,当为片剂或丸剂形式时,组合物可以被包衣以延迟在胃肠道中的崩解和吸收,从而提供在延长时间段内的持续作用。包围渗透活性治疗组合物的选择性渗透膜也适合于口服给药的组合物。在这些后述的平台(platform)中,来自胶囊周围环境的液体被驱动化合物(driving compound)吸入,该化合物溶胀以通过孔排放药剂或药剂组合物。与立即释放制剂的尖峰分布(spiked profiles)不同,这些递送平台可以提供基本上零阶递送分布。时间延迟物质比如单硬脂酸甘油酯或硬脂酸甘油酯也可是有用的。口服组合物可以包括标准赋形剂比如甘露醇、乳糖、淀粉、麦芽糖糊精、环糊精、藻酸盐、阿拉伯树胶或瓜尔胶、硬脂酸镁、糖精钠、纤维素和碳酸镁。在一个实施方案中,赋形剂是药用级的。
[0104]
用于口服的药学剂型可以通过如下获得:将本文所述治疗组合物与固体赋形剂组合,任选地研磨得到的混合物,并加工该颗粒混合物(如果需要的话,在加入合适的另外的化合物之后)以得到片剂或糖丸(dragee)核心。除了之前提及的那些之外,合适的固体赋形剂为碳水化合物或蛋白质填充剂,其包括但不限于糖类,包括乳糖、蔗糖、甘露醇或山梨醇;来自玉米、小麦、稻、马铃薯或其它植物的淀粉;纤维素,比如甲基纤维素、羟丙基甲基纤维素或羧甲基纤维素钠;和树胶类,包括阿拉伯树胶和黄蓍胶;以及蛋白质,比如明胶和胶原蛋白。也可以使用麦芽糖糊精和环糊精。如果需要的话,可以加入崩解剂或增溶剂,比如交联聚乙烯吡咯烷酮、琼脂、海藻酸或其盐,如海藻酸钠。
[0105]
用于口服使用的胶囊包括其中活性成分与固体稀释剂混合的硬明胶胶囊,和其中活性成分与水或油如花生油、液体石蜡或橄榄油混合的软明胶胶囊。
[0106]
用于口服使用的软胶囊可以由包围液体填充物的明胶基壳组成。软胶囊壳可以由明胶、水、遮光剂和增塑剂如甘油和/或山梨醇的组合制成。
[0107]
糖丸核心具有合适的包衣。为此目的,可以使用浓的糖溶液,其可以任选地包含阿拉伯树胶、滑石、聚乙烯吡咯烷酮、卡波普胶、聚乙二醇和/或二氧化钛、漆溶液以及合适的有机溶剂或溶剂混合物。可以将染料或颜料加入到片剂或糖丸包衣中以识别或表征活性化合物剂量的不同组合。
[0108]
本文所述治疗组合物可以通过控制释放或持续释放手段或通过本领域技术人员熟知的递送装置给药。实例包括,但不限于美国专利号5,674,533;5,059,595;5,120,548;5,073,543;5,639,476和5,354,556中描述的那些,将其各自的全部内容通过引用并入本文。这样的剂型可用于提供一种或多种活性成分的控制释放或持续释放,其使用例如羟丙
基甲基纤维素、其它聚合基质、凝胶、渗透膜、渗透系统、多层包衣、微粒、脂质体、微球或其组合以按照不同比例提供期望的释放特性。可以容易地选择本领域技术人员已知的合适的控制或持续释放制剂(包括本文所述那些)用于本发明的活性成分。因此,本发明涵盖适于口服给药的单一单位剂型,比如但不限于适应于控制或持续释放的片剂、胶囊、软明胶胶囊(gelcaps)和囊片。
[0109]
在某些实施方案中,控制或持续释放组合物包含在一定时期内缓解患者中的如下疾病的症状、治疗或预防如下疾病的最小量的治疗剂组合物:下泌尿道症状(luts)、良性前列腺增生(bph)、勃起功能障碍(ed)、尿失禁、膀胱阻塞、间质性膀胱炎、膀胱过度活动症(oab)、膀胱活动不足、前列腺炎、膀胱和前列腺炎症、前列腺纤维化或骨盆痛。控制或持续释放组合物的优点包括延长的药物活性、降低的剂量频率和提高的受试者顺应性。另外,控制或持续释放组合物可以有利地影响起效时间或其它特征,比如治疗组合物中存在的活性成分的血液水平,并且因此可以减少不良副作用的发生。
[0110]
控制或持续释放组合物可以最初释放治疗组合物中存在的一定量的活性成分(其迅速产生期望的治疗或预防作用),并且逐步和连续地释放治疗组合物中存在的其它量的活性成分以在延长的时间段内保持该治疗或预防作用的水平。为了保持治疗组合物中存在的活性成分在体内的恒定水平,该治疗组合物中存在的活性成分可以以替代被身体代谢或排泄的治疗组合物中存在活性成分量的速率从剂型释放。活性成分的控制或持续释放可受各种条件刺激,包括但不限于ph变化、温度变化、酶的浓度或有效性、水的浓度或有效性、或其它生理条件或化合物。
[0111]
可以通过标准临床技术确定有效地缓解如下疾病的症状、治疗或预防如下疾病的治疗组合物的量:下泌尿道症状(luts)、良性前列腺增生(bph)、勃起功能障碍(ed)、尿失禁、膀胱阻塞、间质性膀胱炎、膀胱过度活动症(oab)、膀胱活动不足、前列腺炎、膀胱和前列腺炎症、前列腺纤维化或骨盆痛。另外,可以任选地采用体外或体内试验来帮助确定最佳剂量范围。施用的精确剂量也可取决于给药途径和待治疗的病症的严重性,并可以参考例如已公布的临床研究,根据执业医师的判断和每个受试者的情形来确定。然而,合适的有效剂量的量为约每24小时约1mg至约5克,虽然它们通常为每24小时约500mg或更低。在一个实施方案中,有效剂量为每24小时约50mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约600mg、约700mg、约800mg、约900mg、约1g、约1.2g、约1.4g、约1.6g、约1.8g、约2.0g、约2.2g、约2.4g、约2.6g、约2.8g、约3.0g、约3.2g、约3.4g、约3.6g、约3.8g、约4.0g、约4.2g、约4.4g、约4.6g、约4.8g和约5.0g。可以以各种不同时间段,包括但不限于约每2小时、约每4小时、约每6小时、约每8小时、约每24小时、约每36小时、约每48小时、约每72小时、约每周、约每两周、约每三周、约每个月和约每两个月,给药等同(equivalent)剂量。本文所述的有效剂量的量指给药总量;即,如果给药多于一种治疗组合物,则有效剂量相当于给药的总量。
[0112]
只要症状持续或存在更长时间,就可以给药所述治疗组合物。在某些实施方案中,给药所述治疗组合物3、4、5、6、7、8、9、10、11、12、13或14天。
[0113]
利用本文描述的治疗组合物的剂量方案可以根据多种因素选择,包括受试者的类型、人种、年龄、体重、性别和医学状况;待治疗病症的严重程度;给药途径;及受试者的肾脏或肝脏功能。
[0114]
本文所述治疗组合物可以以单一日剂量给药,或者总日剂量可以以每日两次、三次或四次的分开剂量给药。
[0115]
在用于人类之前,可以在体外或体内测定本文所述治疗组合物的期望治疗或预防活性。可以使用动物模型系统证实安全性和功效。
[0116]
5.试剂盒
[0117]
本文描述可以简化给药本文所述治疗组合物至受试者的试剂盒。典型的试剂盒包括本文所述治疗组合物的单位剂型和标签或印刷的说明书。在某些实施方案中,所述标签或印刷的说明书指导使用所述单位剂型缓解如下疾病的症状、或治疗或预防如下疾病:下泌尿道症状(luts)、良性前列腺增生(bph)、勃起功能障碍(ed)、尿失禁、膀胱阻塞、间质性膀胱炎、膀胱过度活动症(oab)、膀胱活动不足、前列腺炎、膀胱和前列腺炎症、前列腺纤维化或骨盆痛。
[0118]
试剂盒也可以进一步包括另外的预防剂或治疗剂的单位剂型。其它预防剂或治疗剂的实例包括但不限于上列那些。
[0119]
6.4治疗组合物的制备方法
[0120]
可以如下制备本文所述治疗组合物。称重蔓越橘浆果(berry)、果皮(skin)、浆汁(juice)或果渣(pomace)并混合以得到浆料。如果该组合物富含蔓越橘种子,则将种子加入到浆料中。将水加入到浆料中以达到约5%-15%重量的固体。使浆料通过14目筛、剪切泵、喷雾干燥并研磨。如果治疗组合物富含蔓越橘种子粉,则在研磨期间将种子粉加入。使研磨的组合物通过筛网、密封并造粒(pelletized)。
[0121]
6.5治疗组合物的使用方法
[0122]
6.5.1用于治疗下泌尿道症状(luts)
[0123]
本文所述治疗组合物可用于缓解下泌尿道症状(luts)的症状、治疗或预防下泌尿道症状。因此,本文描述用于在受试者中缓解、治疗或预防下泌尿道症状(luts)的方法,包括向有需要的受试者给药有效量的本文所述治疗组合物。luts可能与良性前列腺增生(bph)有关或可能无关,良性前列腺增生是一种以尿道周围的前列腺组织的非恶性过度生长为特征的组织学病症。可以通过比较在给药治疗组合物或用治疗组合物治疗之前的同一受试者显示出症状的缓解。受试者可以为人类,例如男性或女性。在某些实施方案中,所述人类年龄大于45岁、大于50岁、大于55岁、大于60岁、大于65岁、大于70岁、大于75岁或大于80岁。
[0124]
6.5.2用于治疗良性前列腺增生(bph)
[0125]
良性前列腺增生(bph),是一种以尿道周围的前列腺组织的非恶性过度生长为特征的组织学病症。
[0126]
本文所述治疗组合物可用于缓解良性前列腺增生(bph)的症状、治疗或预防良性前列腺增生。因此,本文描述用于在受试者中缓解的良性前列腺增生(bph)的症状、治疗或预防良性前列腺增生的方法,包括向有需要的受试者给药有效量的本文所述治疗组合物。可以通过比较在给药治疗组合物或用治疗组合物治疗之前的同一受试者显示良性前列腺增生(bph)症状的缓解。受试者可以为人类,例如男性。在某些实施方案中,所述人类年龄大于45岁、大于50岁、大于55岁、大于60岁、大于65岁、大于70岁、大于75岁或大于80岁。
[0127]
6.5.3用于治疗勃起功能障碍(ed)
[0128]
本文所述治疗组合物可用于缓解良性勃起功能障碍(ed)的症状、治疗或预防良性勃起功能障碍。因此,本文描述用于在受试者中缓解勃起功能障碍(bph)的症状、治疗或预防勃起功能障碍的方法,包括向有需要的受试者给药有效量的本文所述治疗组合物。可以通过比较在给药治疗组合物或用治疗组合物治疗之前的同一受试者显示出勃起功能障碍(ed)的症状的缓解。受试者可以为人类,例如男性。在某些实施方案中,所述人类年龄大于45岁、大于50岁、大于55岁、大于60岁、大于65岁、大于70岁、大于75岁或大于80岁。
[0129]
6.5.4用于治疗尿失禁
[0130]
本文所述治疗组合物用于缓解尿失禁的症状、治疗或预防尿失禁。因此,本文描述用于在受试者中缓解尿失禁的症状、治疗或预防尿失禁的方法,包括向有需要的受试者给药有效量的本文所述治疗组合物。可以通过比较在给药治疗组合物或用治疗组合物治疗之前的同一受试者显示出尿失禁症状的缓解。受试者可以为人类,例如男性或女性。在某些实施方案中,所述人类年龄大于45岁、大于50岁、大于55岁、大于60岁、大于65岁、大于70岁、大于75岁或大于80岁。
[0131]
6.5.5用于治疗膀胱过度活动症(oab)
[0132]
本文所述治疗组合物可用于缓解膀胱过度活动症(oab)的症状、治疗或预防膀胱过度活动症。因此,本文描述用于在受试者中缓解的膀胱过度活动症的症状、治疗或预防膀胱过度活动症的方法,包括向有需要的受试者给药有效量的本文所述治疗组合物。可以通过比较在给药治疗组合物或用治疗组合物治疗之前的同一受试者显示出膀胱过度活动症(oab)症状的缓解。受试者可以为人类,例如男性或女性。在某些实施方案中,所述人类年龄大于45岁、大于50岁、大于55岁、大于60岁、大于65岁、大于70岁、大于75岁或大于80岁。
[0133]
6.5.6用于治疗其他疾病或症状
[0134]
本文所述治疗组合物可用于缓解如下疾病的症状、治疗或预防如下疾病:膀胱阻塞、间质性膀胱炎、膀胱活动不足、前列腺炎、膀胱和前列腺炎症、前列腺纤维化或骨盆痛。可以通过比较在给药治疗组合物或用治疗组合物治疗之前的同一受试者显示出这些疾病或病症的症状的缓解。受试者可以为人类,例如男性或女性。在某些实施方案中,所述人类年龄大于45岁、大于50岁、大于55岁、大于60岁、大于65岁、大于70岁、大于75岁或大于80岁。
[0135]
7.实施例
[0136]
通过下述实施例进一步阐述本发明,其不应当被看作是限制。本领域技术人员可认识到或仅使用常规实验就能够确定本文所述特定物质和过程的许多等同物。这样的等同物都旨在被包含于如下实施例之后的权利要求书的范围中。
[0137]
7.1实施例1
[0138]
使用蔓越橘种子粉制备治疗组合物
[0139]
可以如下制备本文所述治疗组合物。称重蔓越橘浆果、果皮、浆汁或果渣并混合以得到浆料。如果该组合物富含蔓越橘种子,则将种子加入到浆料中。将水加入到浆料中实现约5%-15%重量的固体。使浆料通过14目筛、剪切泵,喷雾干燥并研磨。如果治疗组合物富含蔓越橘种子粉,则在研磨期间将种子粉加入。使研磨的组合物通过筛网,密封并进行造粒。
[0140]
7.2实施例2
[0141]
治疗组合物的表征
[0142]
如上所述制备治疗组合物并表征。表2显示5个样品的有机酸分布,如使用改良的名称为quinic,malic and citric acids in cranberry juice cocktail and apple juice的aoac(986.13)测定的。分析柱为c18反相柱(具有5μm粒径,25cm x4.6 mm),其与c18反相纯化芯(具有5μm粒径且长10cm)串联且后接c18反相纯化芯。使用磷酸盐缓冲液,0.2m kh2po4,ph 2.4。洗脱是等度的,流速0.80ml/min,环境温度和波长214nm。方法最初对于蔓越橘汁给出且适应于粉末,其中在流动相中进行测试试剂的稀释。标准品的cas#如下:cas-77-92-9(柠檬酸)、cas-6915-15-7(苹果酸)、cas-77-95-2(奎尼酸)。用于计算每种有机酸的浓度的公式如下:(pa/pa’)x(v’/v)x c,其中分别地pa和pa’=测试溶液和标准品的峰面积;分别地v和v’=测试溶液和标准品的体积;和c=标准品的浓度,%。结果呈现在下表2中。
[0143]
表2
[0144]
样品奎尼酸(%)苹果酸(%)柠檬酸(%)总量(%)12.431.542.386.3522.310.931.945.1832.991.432.997.4142.401.362.155.9152.751.653.007.40平均值
±
sd2.58
±
0.281.38
±
0.282.49
±
0.486.45
±
0.97
[0145]
表3显示5个样品的糖含量,如使用改良的aoac方法aoac977.20通过hplc测定的。使用的柱为300
×
4(id)mm μ-bondapak/碳水化合物(waters associates,no.84038),具有保护柱。流动相由用水稀释的非光谱乙腈(乙腈/水:83/17,v/v)组成。糖标准溶液由果糖(cas#57-48-7)、葡萄糖(cas#50-99-7)和蔗糖(cas#57-50-1)组成。将样品稀释在水中,并通过45μm过滤器过滤。在室温下,将10μl样品注入到柱中。流速为1.0ml/min,在等度条件下20分钟。使用折光率检测器。如下由积分器值或由峰高计算葡萄糖、果糖和蔗糖∶糖重量%=100
×
(ph/ph’)
×
(v/v’)
×
(w’/w),其中分别地ph和ph’=样品和标准品的峰高(或积分器值);分别地v和v’=ml样品和标准品(50和100)溶液;且分别地w和w’=g样品(5.000)和标准品。结果呈现在下表3中。
[0146]
表3
[0147][0148][0149]
通过hplc-荧光、使用develosil diol或等同物分析原花色素的浓度。柱尺寸为250mm
×
4,6mm,粒径5微米。柱室保持在35℃。使用的溶剂如下:(a)在乙腈中2%乙酸,和(b)
为95:3:2的甲醇/水/乙酸。使用的线性梯度为在35min内,0%至40% b;在40min内,40%至100% b;在45min内,100%等度b;和在50min内,100%至0%的b。
[0150]
通过hplc-uv、在535nm波长下分析花色素类(芍药素-3-半乳糖苷、芍药素-3-葡糖苷、芍药素-3-阿拉伯糖苷、花青素-3-葡糖苷、花青素-3-半乳糖苷、花青素-3-阿拉伯糖苷)。柱为synergi hydro-rp 250mm x 4,6mm,粒径4μm。柱室保持在室温。流动相a由水性5%甲酸溶液组成,流动相b为甲醇。应用的梯度为0-2min,5% b;2-10min,5-20% b;10-15min,20% b;15-30min,20-25% b;30-35min,25%b;35-50min,25-33% b;50-55min,33% b;55-65min,33-36% b;65-70min,36-45% b;70-75min,45-53% b;75-80min,53-55% b;80-84min,55-70% b;84-88min,70-5% b;88-90min,5% b。
[0151]
通过uplc-ms/ms、使用下述方法分析其余酚类。使用来自waters associates的acquity t3柱(150mm
×
2.1mm id,粒径1.8μm),并放入保持在30℃的温度的uplc柱室中。使用的溶剂为0.1%甲酸(a)和乙腈(b)。应用的线性梯度为5% b;0-4.5min,5-20% b;4.5-6.45min,等度的20% b;6.45-13.5min,20-45% b;13.5-16.5min 45-100%b;16.5-19.5min等度的100% b;19.5-19.52min 100-5% b;19.52-22.5min。通过ms/ms进行检测,并且所有标准化合物单独地调整。结果显示在表4中。
[0152]
表4
enzymology,volume 299,“oxidants and antioxidants part a”pages152-178,1999(modified)),或当使用改良的欧洲药典方法(european pharmacopoeia 6.0;01/2008:1220)测量时为>5%,以及当通过hplc-荧光测量时为>1%。
[0156]
通过uplc-ms/ms,使用2.1mm
×
150mm acquity beh c18反相1.7μm粒径柱分析木脂素类。柱室保持在30℃。使用的溶剂为(a)甲酸0.1%,和(b)乙腈。梯度为5% b,8.0min,30% b,9.0min,30% b,10.0min,50% b,12.0min,50% b,15.0min,95% b,17.0min,95% b,17.5min,5% b,23.0min,5% b。通过ms/ms进行检测,并且所有标准化合物单独地调整。结果显示在表5中。
[0157]
表5
[0158][0159][0160]
7.3实施例3
[0161]
治疗组合物对抗luts的功效的测定
[0162]
使用naturex-dbs llc.,usa提供的治疗组合物。胶囊由500mg的治疗组合物、或250mg的治疗组合物和250mg的安慰剂的组合、或500mg的安慰剂组成。安慰剂的组成如下∶低密度star-1015a麦芽糖糊精、芥花油、red 40色淀、硅酸铝钠和blue 1色淀。胶囊在外观上不能区别。所有胶囊提供在具有安全密封的相同塑料箱中。
[0163]
研究为6个月、单中心、随机、双盲、安慰剂对照试验,由三个平行的治疗组组成。纳入标准由下述组成:ipss评分在8至19之间,个体年龄大于45岁,并且前列腺特异性抗原(psa)值低于2.5ng/ml。排除标准包括食物过敏、近期前列腺炎、慢性肝或肾疾病、以及神经、胃肠或代谢紊乱或任何其它慢性健康状况比如糖尿病、过量咖啡因或酒精消耗。如果他们经过之前的用于bph的侵入性治疗,近期的用α-阻断剂(在1个月之内)或5α-还原酶抑制剂(在6个月之内)的治疗,包括锯叶棕、β-谷甾醇、臀果木(pygeum)的植物疗法或其它辅助疗法(在3个月之内),则受试者也不合格。主要结果量度为在基线、3个月和6个月时评价的ipss。次要结果量度包括在基线、3个月和6个月时的生活质量(qol),以及在基线和6个月时的膀胱排空容量(vol)、最大尿流率(qmax)、平均尿流率(qave)和超声估计的排空后残余尿量(pvr)、血清psa、硒、白细胞介素-6(il-6)和c-反应蛋白(crp)。
[0164]
将参与者随机分配为每日消耗500mg的治疗组合物(n=40)、250mg的治疗组合物(n=43)或安慰剂(n=41),持续6个月。治疗分配于受试者的随机计划是用在线软件quickcalcs(graphpad software inc.,usa,在2014年7月2日最后获取)产生,并由研究团队实施。
[0165]
在基线、第90天(3个月)和第180天(6个月)时观察参与者。在第一天和第180天进行健康检查期间,需要下述动作并评价健康参数∶(i)详细病史,(ii)评价所有同时进行的医学药物和治疗,(iii)饮食习惯,(iv)完成ipss调查表,包括询问qol,(v)尿分析,(vi)尿
流率测定,(vii)肾和膀胱超声,和(viii)血液实验室分析,包括psa。在第90天,仅进行体检和ipss评分。在第90天和研究结束时收集治疗组合物瓶。通过进行剩余胶囊计数评价顺应性。
[0166]
尿流率测定数据:使用flowmic(medkonsult,czech republic)测量qmax和qave。在测试前通知受试者不小便几小时,并饮用至少1l的液体以确保膀胱充满。通过测量每单位时间的vol计算qmax和qave。使用具有腹部探头3-7mhz的超声装置bk medical viking 2400评价pvr。使用用于长椭圆体的公式(宽度
×
长度
×
高度
×
0.523)计算vol和pvr。在第0天和第180天,测量qmax、qave、vol和pvr。
[0167]
使用hitachi modular evo p分析仪(hitachi,japan)测定所有样品中的基础生化和血液学参数。使用architect类型leia分析仪(abbott laboratories,abbott park,il,usa)测定血清psa。通过quikread 101测定crp,并通过系统analytics测定il-6。使用aa6300仪器(shimadzu,japan),通过原子吸收光谱估计血浆中的硒。测定na2edta血液中的血红蛋白(hb)、血细胞比容(htc)、红细胞(rbc)、血小板(plt)和白细胞(wbc)。
[0168]
使用wilcoxon配对检验相对于基线测量比较处理组的数据。主要和次要分析是基于每个方案群体(包括在整个研究长度期间治疗的所有合格参与者)。使用mann-whitney u检验比较两种治疗剂量与安慰剂的数据。p-值《0.05被认为是显著的。
[0169]
使用协方差分析来测试剂量对于治疗结束时的结果量度是否存在影响。该协方差分析使用250mg的日剂量单位作为连续变量,且使用结果的基线测量作为协变量。检查残差(residual)对于剂量(0、250、500mg)的方形图(box plot),以确定残差是否是正态的(bell-shaped)的和是否存在非线性剂量效应的指征。
[0170]
pvr被认为遵循二步法,因为一些比例的参与者没有可测量的pvr。将该比例作为二项式分布建模。使用截断泊松分布对具有pvr的参与者之间的尿量建模。使用运行r版本3.0.0的
‘
pscl’程序包(stanford university)中的hurdle函数拟合该两步模型。剂量/250mg、基线pvr和基线ipss进入该模型中。
[0171]
对于该研究,预筛选总共148名男性。图1提供参与第一次筛选访问的148人的consort图。将总共124名男性随机化,安慰剂组41名,治疗组合物250mg组43人和治疗组合物500mg组40人。在治疗组合物500mg组中,2名参与者随访丧失,且不能包括在每个方案分析中。
[0172]
表6呈现三个分析组中基线特征和lut功能测量的概述。结果呈现为平均值
±
标准偏差(sd)。
[0173]
表6
[0174]
[0175][0176]
参与者具有53.3
±
5.4岁的平均年龄,9.4
±
2.4的平均ipss评分。预定随访的坚持性(adherence)为98.4%。治疗的顺应性为100%。
[0177]
在6个月治疗期期间具有排尿症状或蓄尿症状分项分数(subscore)的ipss数据和qol数据呈现在表7中。排尿或蓄尿分项分数分别对应于问题1(不完全排空)、3(间歇现象)、5(尿流慢)、6(用力排尿)和问题2(尿频)、4(尿急)、7(夜尿)。在6个月期结束时,服用250mg和500mg的治疗组合物的组中ipss评分存在下降,相对于安慰剂具有显著性差异(使用mann-whitney u检验,分别为p=0.05和p《0.001)。
[0178]
将服用安慰剂、250mg或500mg的治疗组合物之后在基线(0天)、3个月(第90天)和6个月(第180天)时的参加者ipss评分、排尿和蓄尿症状评分和生活质量评分显示在表7和表8中。在表7中,结果呈现为平均值
±
sd,并且中值以及第一和第三四分位值。
[0179]
表7
[0180]
[0181]
[0182][0183]
*表示在各个单独的时间点使用mann-whitney u检验相对于安慰剂的显著性差异(p《0.05)。
[0184]
在表8中,结果表示为平均值
±
平均值的标准误差(sem)。
[0185]
表8
[0186][0187]
*表示在各个单独的时间点使用mann-whitney u检验相对于安慰剂的显著性差异(p《0.05)。
[0188]
将三个组在基线、3个月和6个月之间ipss的平均差异在图2中绘图。数据点代表平均差异
±
平均值的标准误差。星号指示在治疗结束时基于协方差分析的相对于安慰剂的p《0.05。在6个月时,平均差异和相应的95%置信区间(ci)为-1.5(-2.2,-0.89)(对于安慰剂组)、-3.1(-4.0,-2.2)(对于治疗组合物250mg组)和-4.1(-4.7,-3.5)(对于治疗组合物500mg组)。
[0189]
在6个月时的ipss与作为协变量输入的基线ipss的协方差分析显示显著的剂量效应(t119=-4.8,p《0.0001)和显著的基线评分的影响(t119=8.3,p《0.0001)。
[0190]
开始治疗后3个月且直到6个月,在治疗组合物500mg组中与安慰剂相比时,ipss排尿分项分数显著地降低(分别为p=0.03和p《0.001),而仅在研究结束时ipss蓄尿分项分数相对于安慰剂显著地降低。在用250mg治疗组合物治疗的组中,ipss蓄尿分项分数没有统计学显著的改善。对于两个剂量,qol调查表没有变化。
[0191]
在用500mg剂量的治疗组合物介入结束时,研究的所有尿流率测定参数相对于基线存在显著地改善(p《0.05)。表9显示在安慰剂、治疗组合物250mg或500mg之后,在基线(第
0天)和6个月(第180天)时的lut功能测量。表9中的结果呈现为平均值
±
sd。
[0192]
表9
[0193][0194][0195]
*表示使用wilcoxon配对检验相对于基线的显著性差异。
[0196]
进行进一步分析以评价在介入结束时是否存在剂量-响应效应和数据是否可以基于基线数据进行调整。
[0197]
一大部分参与者没有报告可测量的pvr(对于0mg剂量,17/41;对于250mg剂量,22/43;和对于500mg剂量,19/38)。虽然在250和500mg组中非零pvr的存在名义上较低,但是没有发现剂量效应。然而,考虑到存在残余体积,该体积与剂量显著相关(z=-3.0,p=
[0198]
0.003)。该模型表明对于给定的基线pvr和ipss,在具有非零pvr的参与者中,预期剂量每增加250mg,残余尿量减少0.09倍(95% ci∶0.03-0.14)。
[0199]
因此,临床血液病学参数在研究开始和结束时在正常范围内,证实了介入产品的安全性。
[0200]
该双盲、随机、安慰剂对照研究证实了在患有luts的人中每日服用治疗组合物250或500mg 6个月的功效和安全性。在研究结束时,相对于安慰剂组(-1.5),ipss评分的降低是显著的和剂量依赖性的(在250mg和500mg组中分别为-3.1和-4.1,p=0.05和p《0.001),
而没有观察到副作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1