中枢多肽血管紧张素-(5-7)在制备降压药物中的应用的制作方法
1.本发明属于生物医药领域,涉及一种中枢小分子多肽血管紧张素5-7在制备高血压药物中的应用。
背景技术:
2.高血压是心血管疾病的重要危险因素,尽管目前已有多种降压药物已广泛应用于临床,并取得了良好的降压效果,但是卒中、心力衰竭、慢性肾病等高血压严重并发症的发生率仍然是较高的。因此,了解和明确高血压的发病机制具有重要的临床意义。交感神经过度异常增强是高血压的主要特征和病理基础。血压和交感神经活动主要受交感中枢头端延髓腹外侧区(rvlm)关键核团的调节,其功能异常是交感神经活动亢进和高血压形成的重要机制。因此,探究rvlm在高血压条件下交感神经兴奋性增强的作用和机制,对高血压的预防和治疗具有重要的现实意义,也可以为高血压的临床治疗提供新的理论依据。
3.血管紧张素-(5-7)[ang-(5-7)]是肾素血管紧张素系统中一个新发现的多肽片段。在二肽基肽酶3(dpp3)的催化下,血管紧张素ii(ang ii)或血管紧张素(1-7)[ang-(1-7)]可被水解成血管紧张素-(3-7)[ang-(3-7)]和ang-(5-7)。研究表明交感中枢rvlm微注射ang-(3-7)可显著升高血压。ang-(3-7)在dpp3的催化下进一步产生的ang-(5-7),但是ang-(5-7)在血压中枢调控中的作用和高血压形成方面的作用尚未明确。本发明重点针对ang-(5-7)的心血管效应开展研究,并与ang ii的升压效应进行比较,发现第四脑室连续七天灌流ang ii或ang-(5-7)后,血压和心率变异性均明显升高,而灌注ang-(5-7)后压力反射功能下降比灌流ang ii更加明显。
技术实现要素:
[0004]
本发明的目的在于针对现有高血压高发病率和长期并发症居高不下等问题,提出一种中枢多肽ang-(5-7)在制备降压药物中的应用。ang-(5-7)的氨基酸序列为:脯氨酸-组氨酸-异亮氨酸(p-h-i)。
[0005]
原发性高血压以交感神经活动亢进为主要特征,其与rvlm内前交感神经神经元的异常兴奋密切相关。ang-(5-7)作为肾素血管紧张素系统新发现的多肽片段。在dpp3的催化下,ang ii或ang-(1-7)可被水解成ang-(3-7)和ang-(5-7)。研究表明交感中枢rvlm微注射ang-(3-7)可显著升高血压。ang-(3-7)在dpp3的催化下进一步产生的ang-(5-7),但ang-(5-7)在血压中枢调控中的作用和高血压形成方面的作用尚未明确。因此,本发明旨在研究rvlm中ang-(5-7)在血压中枢调控中的作用和高血压形成中的作用。
[0006]
研究表明,wky大鼠rvlm内ang-(5-7)可增强交感输出、升高血压,其中ang-(5-7)部分作用于at1受体参与血压中枢调节。进一步探究交感中枢ang-(5-7)的作用机制,发现wky大鼠rvlm内ang-(5-7)可通过氧化应激途径增强交感输出、升高血压,而高血压病理状态下靶向干扰rvlm内dpp3表达内源性减少ang-(5-7),改善氧化应激,降低shr大鼠血压。综上所述,本发明研究表明ang-(5-7)通过氧化应激途径增强交感输出、升高血压,参与了高
血压患者心血管活动的中枢调控。
附图说明
[0007]
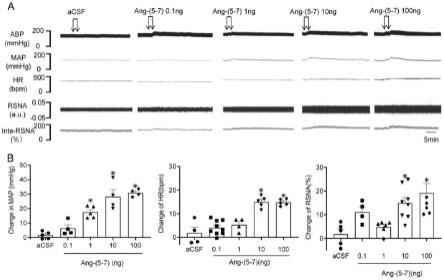
图1:在rvlm内急性微量注射ang-(5-7)增加肾交感活性升高血压。a:wky大鼠rvlm内微量注射ang-(5-7)后平均动脉压(map)、心率(hr)和肾交感神经活性(rsna)记录的原始图;b:是wky大鼠rvlm内微量注射ang-(5-7)后血压、心率和肾交感活性统计图。*p《0.05vs acsf,n=4-8/组。acsf:人工脑脊液;abp:动脉血压;map:平均动脉压;hr:心率;rsna:肾交感神经活性;bpm:每分钟心跳次数。
[0008]
图2:在rvlm内慢性灌流ang-(5-7)增强交感输出、升高血压,促进高血压的发生发展。a:wky大鼠第四脑室灌流ang ii和ang-(5-7)对心血管活动作用的对比。上方是wky大鼠第四脑室灌流ang ii和ang-(5-7)后麻醉状态下血压和心率记录的原始图;下方是wky大鼠第四脑室灌流ang ii和ang-(5-7)后麻醉状态下,血压和心率统计图。*p《0.05vs acsf,n=7/组。b:wky大鼠第四脑室灌流ang ii和ang-(5-7)后压力反射功能的对比。上方是wky大鼠第四脑室灌流ang ii和ang-(5-7)后静脉注射苯肾上腺素(40μg/kg),血压和心率记录的原始图;下方是wky大鼠第四脑室灌流ang ii和ang-(5-7)后麻醉状态下静脉注射苯肾上腺素,压力反射功能统计图。*p《0.05vs acsf,n=7/组。acsf:人工脑脊液;abp:动脉血压;map:平均动脉压;hr:心率;bpm:每分钟心跳次数;ang ii:血管紧张素ii;hrv:心率变异性;lf/hf:低频/高频;brs:压力敏感性反射;δmap:平均动脉压变化值;δrr:rr间期变化值。
[0009]
图3:在rvlm内阻断at1受体后微量注射ang-(5-7)交感输出被抑制、血压升高被抑制。上方是wky大鼠rvlm内微量注射氯沙坦(losatan)后再注射ang-(5-7),血压、心率和肾交感活性记录的原始图;下方是wky大鼠微量注射losatan后再注射ang-(5-7),血压、心率和肾交感活性统计图。*p《0.05vs acsf,n=4-8/组。at1受体:1型血管紧张素ii受体;losatan:氯沙坦;abp:动脉血压;map:平均动脉压;hr:心率;rsna:肾交感神经活性;bpm:每分钟心跳次数。
[0010]
图4:在rvlm内ang-(5-7)通过氧化应激影响血压。上方是wky大鼠rvlm内微量注射超氧化物歧化酶拟似物(tempol)后再注射ang-(5-7),血压、心率和肾交感活性记录的原始图;下方是wky大鼠微量注射tempol后再注射ang-(5-7),血压、心率和肾交感活性统计图。*p《0.05vs acsf,n=4-8/组。tempol:超氧化物歧化酶拟似物;abp:动脉血压;map:平均动脉压;hr:心率;rsna:肾交感神经活性;bpm:每分钟心跳次数。
[0011]
图5:第四脑室灌流ang-ii和ang-(5-7)对rvlm内氧化应激的影响。a:wky大鼠第四脑室灌流ang-ii和ang-(5-7)后,超氧化物阴离子荧光探针(dhe)试剂盒检测rvlm内活性氧ros生成的荧光图;上方为wky大鼠第四脑室灌流ang-ii和ang-(5-7)后,rvlm内活性氧ros水平。白色矩形框内为rvlm,左侧图片中标尺为500μm,右侧图片中标尺为100μm;b:为wky大鼠第四脑室灌流ang-ii和ang-(5-7)后ros含量的统计图,*p《0.05vs acsf,n=7/组。rvlm:头端延髓腹外侧区;acsf:人工脑脊液;dhe:超氧化物阴离子荧光探针;ros:活性氧簇。
[0012]
图6:第四脑室灌流ang-ii和ang-(5-7)对rvlm内氧化应激相关通路的影响。左侧是western blot检测wky大鼠第四脑室灌流ang-(5-7)后rvlm内核转录因子红系2相关因子2(nrf2)、kelch样环氧氯丙烷相关蛋白1(keap1)、血红素氧合酶1(ho1)以及nad(p)h:醌氧化还原酶1(nqo1)表达水平原始蛋白条带;右侧是nrf2、keap1、ho1以及nqo1表达的统计
图。*p《0.05vs acsf,n=4/组。acsf:人工脑脊液。
[0013]
图7:rvlm过表达二肽基肽酶3(dpp3)内源性增加ang-(5-7)对rvlm内氧化应激的影响。上方是wky大鼠rvlm内过表达dpp3后,dhe试剂盒检测rvlm内活性氧ros生成的荧光图;下方为rvlm内活性氧ros水平的统计图。*p《0.05vs wky-gfp,n=6/组。ros:活性氧簇。dpp3:二肽基肽酶3;dhe:超氧化物阴离子荧光探针;ros:活性氧簇。
[0014]
图8:自发性高血压大鼠(shr)rvlm内干扰dpp3后氧化应激的影响。上方是shr大鼠rvlm内干扰dpp3后,dhe试剂盒检测rvlm内活性氧ros生成的荧光图;下方为rvlm内活性氧ros水平的统计图。*p《0.05vs wky-gfp;#p《0.05vs shr-gfp相比,n=7/组。dpp3:二肽基肽酶3;dhe:超氧化物阴离子荧光探针;ros:活性氧簇。
具体实施方式
[0015]
本发明将结合附图,通过以下实施例作进一步说明。
[0016]
实施例
[0017]
(一)实验步骤。
[0018]
(1)动物选取。
[0019]
12周大的雄性wistar-kyoko(wky)大鼠和本研究中使用的自发性高血压大鼠(shrs)购自维通利华实验动物技术有限公司(北京,中国),体重在180-200克之间,分别在12小时的光照室和12小时的黑暗动物室中饲养。实验老鼠被允许随意获得食物和水。
[0020]
(2)大鼠rvlm的病毒微量注射。
[0021]
1)诱导麻醉及维持:将实验动物置于气体麻醉诱导盒中,设置氧流量为1ml/min,麻醉剂浓度为5ml/dm3,待5分钟左右动物诱导麻醉后,将其置于立体定位仪并维持麻醉,麻醉剂浓度为2ml/dm3。
[0022]
2)备皮:用电推剪将颅顶毛发剃去,暴露枕骨皮肤。
[0023]
3)手术区域术前消毒:用碘伏棉球对术区进行叠瓦式消毒两遍,再用75%医用酒精脱碘。
[0024]
4)暴露颅骨表面:用手术剪逐层剪开皮肤、皮下组织,之后用电刀将颅骨表面组织进行切除,使颅骨表面充分暴露,并止血,酒精棉球进行消毒。
[0025]
5)确定lambda点:找到后囟人字缝,三条线的切线交点即为lambda点。并用黑色签字笔进行标记。
[0026]
6)定平:将微量注射针,安装到注射泵的持针槽内,之后将微量注射针移至lambda点正上方,距离颅骨表面0.1ml左右。然后,根据大鼠解剖图谱以及预实验结果,移动立体定位仪(距lambda点尾端x-6.5mm;角度h+0.25mm;旁开y
±
2mm),在颅骨表面确定注射点,并做好标记,若微量注射针距离注射点颅骨表面距离在0.2mm以内,则表明颅骨表面水平,可进行下步操作。
[0027]
7)开颅:根据上步确定的注射点位置,用颅骨钻垂直颅骨表面进行开颅,当有落空感时,则表明颅骨已打穿。并用酒精棉球进行消毒。
[0028]
8)微量注射:将微量注射针,安装到注射泵的持针槽内,之后将微量注射针移至lambda点正上方,距离颅骨表面0.1ml左右。然后,调节立体定位仪,使针尖至注射点上方。之后缓慢进针,至rvlm(深度z:+9.5mm)停针1min,启动微量注射泵,缓慢将病毒悬液注入核
团(约5min),注射完毕,静止5min,待病毒扩散充分,则可撤针。对侧,步骤类似。
[0029]
9)缝合:待双侧核团病毒注射完毕,间断缝合切口,并用碘伏棉球消毒2遍,酒精棉球脱碘1遍。最后肌肉注射抗生素,置于保温垫上,待其苏醒。
[0030]
(3)大鼠麻醉状态下的动脉血压监测。
[0031]
1)麻醉及备皮:将实验动物秤量体重后,用混合脲脂按0.5ml/100g麻醉,用止血钳挤压动物脚趾动物不动表明麻醉完成,并固定。之后每小时补充首剂量1/3的混合麻醉剂维持麻醉。用电推剪将颈部,下腹部毛发剃去,暴露皮肤。
[0032]
2)气管插管:纵向剪开皮肤,逐层暴露气管,将丝线从气管背侧穿过,在环状软骨下5mm处,呈倒“t”字剪开气管,最后将气管插管插入气管约1cm。
[0033]
3)股动、静脉插管:拎起髂区皮肤,沿血管走行方向剪开约3cm长的切口。暴露肌肉后,用弯镊钝性分离出动静脉。将丝线从动脉背侧穿过,远心端结扎,近心端打活结,并用动脉夹夹闭近心端。在动脉夹与远心端线的动脉之间,用显微剪在远心端剪开一个小口,之后用显微镊将开口扩开。最后,左手用显微镊夹住动脉壁,右手旋转将导管送入股动脉,之后将动脉导管连接powerlab血压监测系统。静脉插管方法同动脉插管。
[0034]
(4)大鼠rsna监测。
[0035]
1)麻醉及气管、动静脉插管麻醉及气管、动静脉插管:步骤同上所述。
[0036]
2)肾交感神经分离:经大鼠左腰部纵行切口剪开皮下筋膜,沿腹膜后路径暴露左侧肾脏、肾动脉和肾神经,于接近腹主动脉和肾动静脉肾门附近仔细游离出肾交感神经,并小心用玻璃分针放置在银丝电极上。电信号分别以1000和100hz的高频和低频截止频率进行放大。
[0037]
3)肾交感神经活性记录及计算:使用powerlab(adinstruments,australia)记录并集成整流输出。之后观察示波器中肾交感神经放电波形,判断神经放电信号是否为肾交感神经放电。若确定所分神经为肾交感神经时,使用wacker胶混合物将神经、电极与周围组织电隔离。待肾交感神经电信号波形平稳后,记录rsna的基础值。然后静脉快速注射2ml混合麻醉剂将大鼠安乐死,则可诱导出大鼠rsna最大值,待大鼠肾交感神经放电完全消失后即为rsna的背景噪声。因此rsna水平=(基础值-背景噪声)/(最大值-背景噪声)。
[0038]
(5)大鼠rvlm的药物微量注射。
[0039]
1)麻醉及气管、动静脉插管:同大鼠麻醉状态下动脉血压监测的操作步骤。
[0040]
2)设置动物呼吸机参数并连接:将呼吸机设置为辅助/控制通气模式,呼吸频率:60-85bpm,潮气量:2-2.5ml,吸气末压(pip):15cmh2o,呼气末正压(peep):1cmh2o。按0.1ml/100g静脉注射三碘季胺酚溶液(之后每小时补充),最后将气管插管连接呼吸机。
[0041]
3)设置静脉输液泵参数并连接:将装满0.9%氯化钠注射液的50ml注射器连接静脉导管,输液速度设为1ml/h。
[0042]
4)暴露颅骨表面及枕骨大孔:用电刀逐层将后颈部肌肉剥离,直至暴露枕骨以及枕骨大孔。最后将后囟尾侧颅骨表面组织一并剥离。
[0043]
5)开颅:用颅骨钻先将颅骨边缘打薄,之后可用咬骨钳剥离颅骨,最后用咬骨钳将周围的骨刺进行修饰。注意在打薄颅骨过程中时刻观察血压,防止血压过低。
[0044]
6)剪开脑膜并展开:用显微剪从下往上,从左往右将脑膜剪开,之后用显微镊将脑膜展开,覆盖于颅骨边缘。此操作在显微镜下进行,并尽量减少出血。
[0045]
7)吸引部分小脑组织:用电动吸引器将小脑组织自下往上吸去,直至暴露obex点及rvlm上方脑干区域。吸引结束,应用生理盐水棉球覆盖脑组织面及其他肌肉组织,防止机体失水过多。
[0046]
8)微量注射:用1ml注射器将药物注入玻璃移液微管,手指弹去管内气泡。之后将玻璃电极固定于立体定位仪,并连接上气泵。之后根据图谱,以obex点为参考,头端移动2.5mm,左右旁开2mm,深度3.5mm,将玻璃移液微管定位至rvlm。最后根据显微镜刻度,启动气泵,缓慢注射100nl药物,等待5分钟后缓慢拔出玻璃移液微管。注射完毕,用标准人工脑脊液棉球覆盖脑干表面。
[0047]
(6)第四脑室灌流。
[0048]
组装微渗透泵:在生物安全柜的无菌条件下,将流量调节器和alzet微渗透泵按照说明书进行药物灌注并组装。
[0049]
诱导麻醉及维持:将实验动物置于气体麻醉诱导盒中,设置氧流量为1ml/min,麻醉剂浓度为5ml/dm3,待5分钟左右动物诱导麻醉后,将其置于立体定位仪并维持麻醉,麻醉剂浓度为2ml/dm3。
[0050]
备皮:用电推剪将颈背部毛发剃去,暴露枕骨皮肤。
[0051]
手术区域术前消毒:用碘伏棉球对术区进行叠瓦式消毒两遍,再用75%医用酒精脱碘。
[0052]
暴露枕骨大孔膜:使用手术剪逐层剪开皮肤、钝性分离颈部皮下组织,需能放下alzet微渗透泵。之后用电刀将颈部肌肉逐层切开,直到使枕骨大孔膜表面充分暴露,并用酒精棉签进行消毒。
[0053]
固定微渗透泵:用1ml注射器针尖刺破枕骨大孔膜,见清亮的脑脊液流出后即可将微渗透泵放于颈部皮下组织,并将流量调节器的出液端经枕骨大孔膜针孔刺入脑室。之后使用组织固定胶,固定微渗透泵和流量调节器。
[0054]
缝合:小心对合切口,间断缝合,并用碘伏棉球消毒2遍,酒精棉球脱碘1遍。最后肌肉注射抗生素,置于保温垫上,待其苏醒。术后三天连续肌肉注射抗生素。
[0055]
(7)rvlm组织提取。
[0056]
①
rvlm组织提取。
[0057]
1)取材:用断头器将安乐死后大鼠的头部分离,之后迅速用咬骨钳将颅骨从枕骨大孔处小心全部剥除,最后用弯镊挑断大脑出颅神经和剥离小脑暴露脑干obex点,棉球蘸干血迹并置于35mm细胞培养皿中,用锡箔纸包裹完好后小心置于液氮罐中。若保存,需转移至-80℃冰箱。
[0058]
2)标本复温:将冰冻切片机提前预冷至-20℃,之后将大脑标本放置于冰冻切片机内复温10分钟左右,至脑组织呈粉红色,便于切片。
[0059]
3)rvlm组织提取:用刀片沿冠状面切除大脑前半部分,将大脑后半部分及脑干用oct包埋剂垂直固定于底座上。待组织固定后,将底座安装到切片机固定槽内,之后按50μm的切片厚度先将脑干组织切到obex点后,继续向前切20次,即到达rvlm的尾端。最后用针头内径为1mm的注射器根据大鼠脑解剖图谱位置,按5mm左右的深度戳取rvlm内脑组织,并迅速转移到预冷的1.5ml离心管中。
[0060]
4)裂解:往装有rvlm脑组织的离心管中,滴加提前配制好的100μl混合裂解液。设
置超声波细胞粉碎机的功率为10%,工作时间3s,工作间隙9s,冰上进行组织超声粉碎,循环5次,最后冰上静置裂解10min。裂解结束后,将组织裂解液置于低温离心机以12000rpm 4℃离心20min。离心结束后,用100ml移液器小心吸取上清液,即得到裂解后蛋白上清液。
[0061]
②
蛋白浓度测定与变性。
[0062]
1)蛋白浓度测定:首先准备96孔板和配制好的0.5mg/ml的bca蛋白标准品。具体步骤如下:
①
依次在第一竖列孔中加入0、2、4、8、12、16、20μl蛋白标准品,在待测蛋白孔内,依次加入1μl蛋白上清液,每个蛋白样本做2个副孔,最后依次加入pbs稀释液将各个加样孔液体体积补充至20μl。
②
按a试剂:b试剂50:1的比例现用现配bca工作液,每个加样孔加入200μl工作液。
③
将96孔板转移至37℃恒温孵育箱孵育约25min。
④
使用多功能酶标仪测定在560nm波长下的蛋白吸光度值,并计算标准曲线(相关系数r2》0.99),将各组织样本蛋白吸光度平均值代入公式中计算得样本蛋白浓度。
[0063]
2)蛋白变性:按5μg/μl的蛋白浓度,计算各样本蛋白上清液中需加5x蛋白上样缓冲液和ddh2o体积,稀释各蛋白样本至相同蛋白浓度。然后将各离心管样本混匀、离心,100℃金属浴10min。最后将蛋白样本冷却至室温后,于-20℃保存。
[0064]
(8)western blot。
[0065]
1)制胶(两块1.5mm的mini胶):
①
首先提前准备2套清洗干净的配套玻璃长板和玻璃短板,安装于卡槽内,并用ddh2o检漏,密闭性良好即可干燥备用。
②
将10%sds-page凝胶快速制备试剂盒(上海雅酶)中的下层胶a、b液各8ml于烧杯中混合,加入促凝剂160ul并充分吹打均匀。
③
将下层胶从玻璃短板一端灌入,期间避免气泡产生,之后用ddh2o进行液封15min左右,下层胶凝固期间准备好梳齿和1x电泳液。
④
待下层胶与ddh2o之间出现折射亮线时,表示下层胶凝固,小心倒去上层ddh2o。
⑤
分别取上层胶a、b液各2ml于烧杯中,加入40ul的促凝剂,充分吹打均匀。
⑥
将上层胶灌入玻璃夹板中,插入梳齿,待上层胶凝固,期间准备好蛋白样本。
[0066]
2)加样:
①
待上层胶充分凝固后,将玻璃夹板小心取下,安装于电泳槽中。
②
于电泳槽中倒满电泳液,垂直缓慢拔出梳齿。
③
将融化后的蛋白样本和蛋白marker吹打均匀,依序取5ul垂直加入加样孔内。
[0067]
3)电泳:按正负极标识,正确接通电泳装置,设置电泳参数为恒压80v,电泳时间2h。
[0068]
4)转膜:
①
电泳结束前,将合适大小的pvdf膜用甲醇浸泡至少1min,并配制好快速转膜液,将转膜滤纸、海绵用转膜液浸泡充分。
②
电泳结束后,取出玻璃夹板,小心掀开玻璃短板后切去上层胶,将下层胶按电泳原方向转移到滤纸上。
③
将激活的pvdf膜完全覆盖于下层胶上,并用滚轮排除二者间气泡。
④
pvdf膜上继续覆盖滤纸和海棉呈三明治结构,将转膜夹安装于转膜槽中,并倒满转膜液。
⑤
设定转膜参数,恒流400ma,转膜时间30min。
[0069]
5)封闭:提前配制好5%的脱脂牛奶或者bsa,转膜结束后,将pvdf膜放入其中,置于水平摇床室温封闭2h。
[0070]
6)一抗孵育:pvdf膜封闭完成后,tbst液洗膜5min,重复3次。按产品说明书推荐最佳比例,用tbst液配制一抗稀释液。然后将pvdf膜放入含一抗溶液的封闭袋中,在4℃孵育过夜。
[0071]
7)二抗孵育:一抗孵育结束后,tbst液洗膜5min,重复3次。用tbst液配制二抗稀释
液,于孵育盒中,使pvdf膜充分与二抗接触,常温孵育2h。最后tbst洗膜5min,重复3次。
[0072]
8)发光成像:提前配制显影液,将pvdf膜平铺于黑色发光板中央,用移液枪均匀快速滴加显影液后,放入显影仪。使用tanon成像系统对pvdf膜进行发光显影并保存照片。
[0073]
(9)大鼠rvlm区域活性氧检测。
[0074]
1)取材、冰冻切片:
①
取材步骤同上。
②
进行rvlm冰冻切片时,设置切片厚度为20μm,将脑切片展平后,贴于粘附载玻片上。
[0075]
2)孵育:本操作全程避光,每张脑切片上滴加50μl的dhe染液,37℃孵育30分钟后在装有pbs溶液的玻璃皿中漂洗3次,每次1分钟。待玻片晾干后,滴加抗荧光淬灭封片剂(含dapi)约50ul。最后,在盖玻片边缘滴加少量指甲油固定,并置于湿盒中保存。
[0076]
3)荧光成像:利用荧光显微镜成像并统计rvlm区域荧光强度。
[0077]
(10)统计方法。
[0078]
所有值均表示为均数
±
标准误(mean
±
sem),统计分析使用graphpad prism 8.0version(graphpad软件,圣地亚哥,ca,美国)进行。对于大鼠rvlm微量注射ang-(5-7)后各指标,采用用单因素方差分析(one-way anova)对数据进行分析;对于大鼠rvlm干扰dpp3后各指标,采用双因素方差分析(two-way anova(or mixed model))进行检验。当p《值为0.05时,本发明认为差异有统计学意义。
[0079]
(二)实验分析:
[0080]
1.rvlm中ang-(5-7)对心血管活动调控的影响。
[0081]
1.1rvlm内微量注射ang-(5-7)增加肾交感活性升高血压。
[0082]
如图1所示,本发明在双侧rvlm内急性微量注射不同浓度(0.1、1、10、100ng/100nl)的ang-(5-7),观察其对心血管活动(血压bp、心率hr和肾交感活性rsna)的作用(图1a),结果表明1、10、100ng/100nl的ang-(5-7)微量注射于rvlm后血压明显升高;10、100ng/100nl的ang-(5-7)微量注射于rvlm后心率和肾交感活性均显著升高(图1b)。
[0083]
1.2ang-(5-7)在中枢神经系统对高血压发生发展的影响。
[0084]
如图2所示,在wky大鼠的第四脑室利用alzet微渗透泵(1007d)连续七天灌流ang-(5-7)(24ug/d),观察其对心血管活动的作用,结果表明第四脑室连续七天灌流ang-(5-7)后血压和心率均明显升高(图2a)。为明确ang-(5-7)在中枢神经系统对血压调控作用的效能,在wky大鼠的第四脑室分别灌流ang ii和ang-(5-7),观察二者对血压bp、心率hr、心率变异性hrv以及压力反射brs的影响。结果表明第四脑室连续七天灌流ang ii或ang-(5-7)后,血压和心率变异性均明显升高(图2a),压力反射功能明显下降(图2b),且两组之间无统计学差脑室灌流ang-(5-7)增加肾交感活性升高血压
[0085]
1.3rvlm内ang-(5-7)部分作用于at1受体影响血压。
[0086]
如图3所示,在wky大鼠rvlm预先注射氯沙坦(losatan,1nmol)阻断at1受体后,再注射ang-(5-7),结果发现ang-(5-7)的升压效应以及肾交感活性可被部分阻断,而心率没有明显的统计学差异。
[0087]
2.rvlm中ang-(5-7)对心血管活动调控的作用机制。
[0088]
2.1rvlm内ang-(5-7)通过氧化应激影响血压。
[0089]
为进一步明确rvlm内ang-(5-7)升高血压的调控机制,本发明在wky大鼠rvlm预先微量注射tempol阻断活性氧ros的合成后,再注射ang-(5-7)结果发现ang-(5-7)的升压效
应以及肾交感活性可被部分阻断(图4),而心率没有明显的统计学差异。在wky大鼠的第四脑室利用alzet微渗透泵(1007d)连续七天灌流ang-(5-7)(24ug/d),通过western blot和活性氧检测试剂盒观察其对rvlm内氧化应激的作用,结果表明第四脑室连续七天灌流ang ii或ang-(5-7)后,两组的活性氧ros水平均明显升高(图5a和5b),而nrf2、keap1、ho1以及nqo1表达水平无显著差异(图6)。
[0090]
2.2rvlm内过表达dpp3内源性增加ang-(5-7)导致氧化应激增强。
[0091]
在wky大鼠双侧rvlm内过表达dpp3后,利用活性氧检测试剂盒检测rvlm内活性水平,结果表明dpp3过表达后ros水平明显升高(图7)。
[0092]
2.3rvlm内干扰dpp3内源性减少ang-(5-7)可减轻高血压大鼠氧化应激。
[0093]
在shr大鼠双侧rvlm内干扰dpp3后,利用活性氧检测试剂盒检测rvlm内活性水平,结果发现dpp3干扰内源性减少ang-(5-7)后ros水平明显减少(图8)。
[0094]
虽然为了说明而披露了本发明的优选实施例,但本领域的普通技术人员明白,在不脱离本发明所附权利要求所限定的范围和精神的情况下,各种改进、增添和替代都是可能的,都在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1