蛋白质的液体调配物及其制备方法与流程
本发明涉及蛋白质的液体调配物及其制备方法。本技术主张于2021年1月27日向韩国知识产权局提出的韩国专利申请号10-2021-0011802的优先权,该韩国专利申请的公开内容通过引用以其全文并入本文中。
背景技术:
1、粒细胞集落刺激因子(granulocyte-colony stimulating factor,g-csf)是一种细胞激素,其刺激骨髓干细胞及白血球的分裂及分化,并且促进骨髓外细胞的分裂和分化。g-csf是一种糖蛋白,其具有18,000至19,000道尔顿的分子量以及6.1的介电点(dielectric point,pl)(pi值的范围为5.5至6.1,取决于糖基化的程度)。
2、重组dna技术确立g-csf的分子及遗传特性。自从用从chu-2细胞和人类膀胱癌细胞株5637分离的mrna所建构的cdna库来克隆人类g-csf基因以来,从哺乳动物细胞和原核细胞产生g-csf已成为可能。
3、就包括诸如上述g-csf的蛋白质的医药蛋白质调配物的商业可行性和效率而言,可以通过将额外的分子并入至该调配物中来实现调配物的稳定性。可以通过并入赋形剂以保持蛋白质的稳定性、可溶性、和非聚集性来改善蛋白质的稳定性,其中所述赋形剂与蛋白质在溶液中相互作用。举例而言,盐化合物和其他离子物质可以是蛋白质调配物中的添加剂。
4、这些添加剂通过以非特异性方式结合至该蛋白质来帮助防止该蛋白质的变性,因此增加该蛋白质的热稳定性。盐化合物(例如,nacl、kcl)已成功地被用于市售胰岛素调配物中以防止聚集和沉淀。当被使用作为调配物添加剂时,氨基酸(例如,组氨酸和精氨酸)可降低蛋白质的二级结构的变化。常用的添加剂的其他实例包括诸如甘油和糖醇的多元醇材料,以及非离子(例如,吐温(tween)、普朗尼克(pluronic))表面活性剂。
5、医药添加剂应该是可溶的且无毒的,并且应该在特定浓度下使用,所述特定浓度提供稳定特定治疗性蛋白质的效果。由于稳定添加剂的效果是蛋白质依赖性的和浓度依赖性的,因此将用于医药调配物中的每种添加剂应该被仔细地测试,以免导致相应调配物的化学或物理组成的不稳定性或其他不利影响。用于稳定蛋白质的成分可能会随着时间导致蛋白质稳定性方面的问题,或者在储存期间因环境变化导致蛋白质稳定性方面的问题。
6、此外,医药蛋白质调配物应该以高浓度调配以增强治疗效果。高浓度蛋白质调配物可具有较小的体积剂量并且在包装和储存方面较为经济,并且因此在治疗上有利。然而,随着高浓度蛋白质调配物的发展,在制备、稳定性和患者疼痛等等方面存在问题。举例而言,通常蛋白质的聚集或不可溶性会随着调配物中蛋白质浓度增加而增加(shire,s.j.etal.,j.pharm.sci.,93,1390(2004))。因此,高蛋白质调配物表现出低蛋白质调配物不会出现的不利影响,诸如蛋白质以非天然形式的聚集以及微粒的形成,在低蛋白质调配物中使用可提供有利影响的添加剂也可能发生此情况。此外,高浓度蛋白质的高黏度可能会干扰使用过滤的制备过程,并且可能会在注射期间导致患者疼痛或额外的不利影响,并且因此较不患者友好(patient-friendly)。因此,需要维持医药蛋白质调配物的成分与浓度的平衡以改善蛋白质稳定性、患者友好性和治疗要求,同时仔细地限制任何不利影响。
7、因此,关于一种含有具有高聚集潜力的高浓度非天然蛋白质的蛋白质调配物,需要开发可用于治疗用途、在可溶性和稳定性方面有利、以及患者友好的调配物。
技术实现思路
1、技术问题
2、在一个方面中,本公开提供一种蛋白质的液体调配物,其包括高浓度的依弗拉培格司亭(eflapegrastim)和缓冲材料。
3、在另一个方面中,本公开提供一种制备该液体调配物的方法。
4、在另一个方面中,本公开提供一种包括该液体调配物的制品。
5、额外的方面将部分地在以下描述中阐述,从该描述中将变得显而易见,或者可通过实践本公开的经呈现的实施方案而习得。
6、解决问题的技术手段
7、根据一个方面,提供一种水性依弗拉培格司亭调配物,其为一种包含依弗拉培格司亭和缓冲材料的液体调配物,其中该依弗拉培格司亭的浓度为约6mg/ml至约150mg/ml;该液体调配物的由等式1所表示的患者友好(patient-friendly,pf)指数为10或更小,
8、[等式1]
9、患者友好(pf)指数=osm(mosm/kg)/100+mgf(n)
10、其中,在等式1中,osm指示该液体调配物的渗透压(osmolarity)值,并且mgf指示当使用29规格(29g)注射器以2.835mm/s的速率注射该液体调配物时的最大滑动力(maximum gliding force)值;
11、该液体调配物的渗透压为约100mosm/kg至约1000mosm/kg;
12、当使用29规格(29g)注射器以约2.835mm/s的速度注射时,该液体调配物的最大滑动力(mgf)为7n或更小,或者以约4.725mm/s的速度注射时为10n或更小;以及
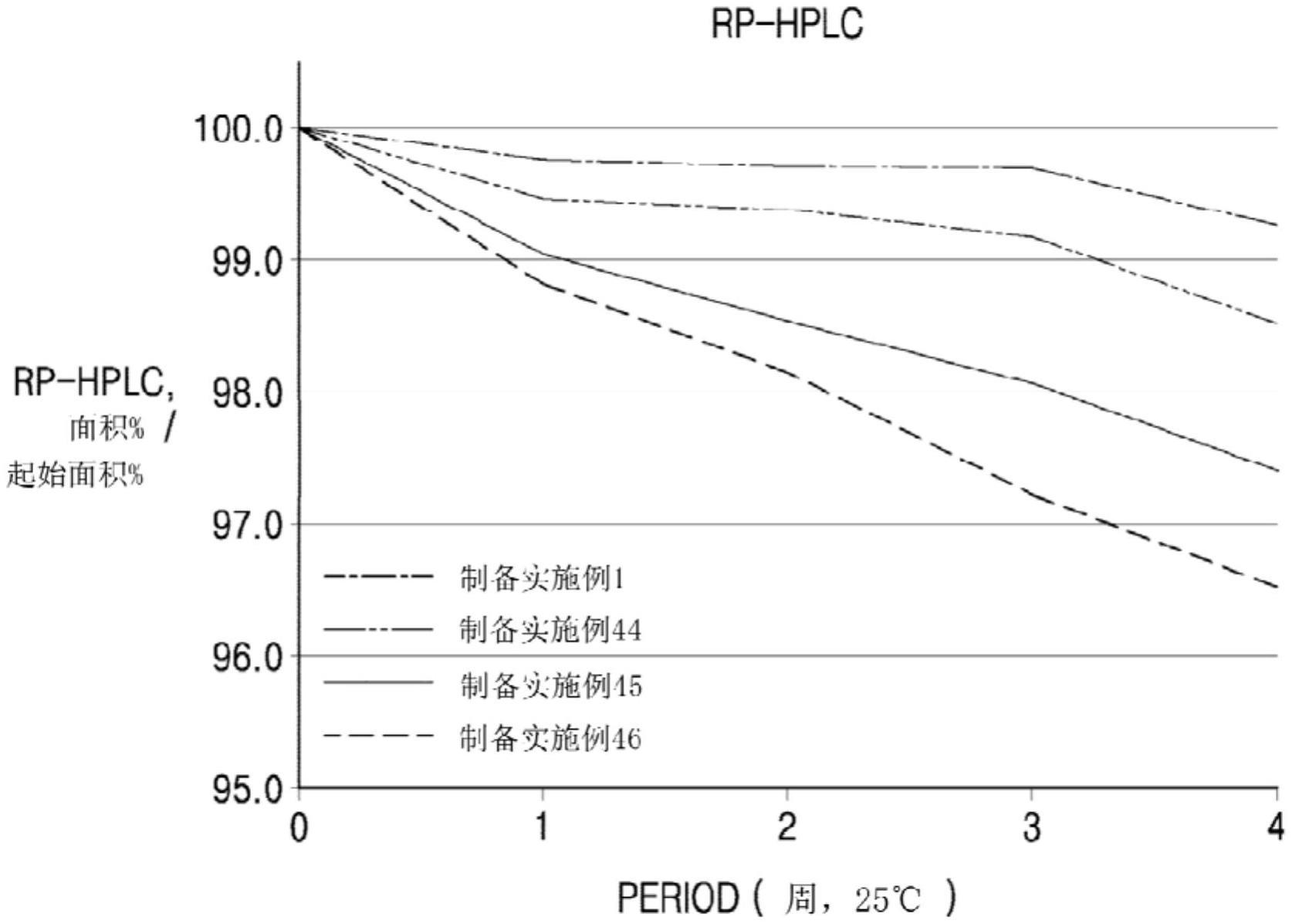
13、在23℃至27℃的温度和约55%至65%的相对湿度下储存之后,如通过反相高效液相色谱法(rp-hplc)或尺寸排阻高效液相色谱法(se-hplc)所测量,该依弗拉培格司亭的残留率为95%或更大。
14、在一些实施方案中,该液体调配物具有15ms/cm或更小的传导率。在一些实施方面中,依弗拉培格司亭的残留率为98%或更大。
15、在一些实施方案中,该液体调配物在20℃至25℃的室温下具有4cp或更小的黏度。
16、在一些实施方案中,该缓冲材料的浓度为约5mm至约100mm。在一些实施方案中,该缓冲材料为柠檬酸和/或柠檬酸盐。
17、在一些实施方案中,该液体依弗拉培格司亭调配物进一步包含稳定剂。在一些实施方面中,该稳定剂包括甘露醇。在一些实施方面中,该甘露醇的浓度为该液体调配物的约1%至约20%(w/v)。
18、在一些实施方案中,该液体依弗拉培格司亭调配物进一步包含表面活性剂。在一些实施方案中,该表面活性剂为基于聚山梨醇酯的非离子表面活性剂。在一些实施方案中,该基于聚山梨醇酯的非离子表面活性剂为选自由聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、和聚山梨醇酯80所构成的群组。在一些实施方案中,在该液体调配物被浓缩之后,该基于聚山梨醇酯的非离子表面活性剂的最终浓度为该总液体调配物的约0.0001%至约0.5%(w/v)。
19、在一些实施方案中,该液体调配物具有约4至约8的ph。
20、在一些实施方案中,该液体依弗拉培格司亭调配物进一步包含张力调节剂。在一些实施方案中,该张力调节剂为氯化钠。在一些实施方案中,该张力调节剂的浓度为约5mm至约200mm。
21、在一些实施方案中,使用纯化柱预处理该液体调配物。在一些实施方案中,该经预处理的液体调配物在使用缓冲液进行缓冲液交换之后被浓缩,所述缓冲液不含有基于聚山梨醇酯的非离子表面活性剂。
22、在另一个方案中,本公开提供一种液体依弗拉培格司亭调配物,其包含依弗拉培格司亭、缓冲材料和表面活性剂,其中
23、该依弗拉培格司亭的浓度为约11mg/ml至约66mg/ml;该缓冲材料的浓度为约5mm至约100mm;并且
24、在该液体调配物被浓缩之后,该表面活性剂的浓度为该总液体调配物的约0.001%至约5%(w/v),且在该液体调配物被浓缩之后,该表面活性剂的浓度为该总液体调配物的约0.001%至约5%(w/v)。
25、在一些实施方案中,该表面活性剂为基于聚山梨醇酯的非离子表面活性剂。
26、在一些实施方案中,该液体调配物包含:
27、约11mg/ml至约66mg/ml的依弗拉培格司亭;约5mm至约100mm的柠檬酸和/或柠檬酸盐;以及约0.001%至约5%(w/v)的基于聚山梨醇酯的非离子表面活性剂。
28、在一些实施方案中,该基于聚山梨醇酯的非离子表面活性剂选自由聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、和聚山梨醇酯80所构成的群组。
29、在一些实施方案中,该液体调配物包含:
30、约11mg/ml至约66mg/ml的依弗拉培格司亭;约5mm至约100mm的柠檬酸钠;约0.001%至约0.5%(w/v)的聚山梨醇酯80;约1%至约20%(w/v)的甘露醇;以及约5mm至约200mm的氯化钠。
31、在一些实施方案中,该液体调配物的渗透压为约100mosm/kg至约800mosm/kg。在一些实施方案中,该液体调配物具有15ms/cm或更小的传导率。
32、根据另一个方面,提供一种制备该液体调配物的方法。
33、根据另一个方面,提供一种包括该液体调配物的制品。
34、在又另一个方面中,本公开提供一种预防、减缓、或治疗具有白血球生成受损的患者中的嗜中性白血球低下症(neutropenia)的方法,所述方法包含向该患者施用治疗有效量的如本文所述的液体依弗拉培格司亭调配物。
35、在一些实施方案中,该嗜中性白血球低下症为严重慢性嗜中性白血球低下症或者发热性嗜中性白血球低下症。
36、在一些实施方案中,在以辅助或新辅助化学疗法治疗该患者之后施用该液体依弗拉培格司亭调配物。在一些实施方案中,在以辅助或新辅助化学疗法治疗该患者之后的1天与5天之间施用该液体依弗拉培格司亭调配物。在一些实施方案中,其中该辅助或新辅助化学疗法为多烯紫杉醇(docetaxel)与环磷酰胺的组合。
37、在一些实施方案中,在向该患者施用该液体依弗拉培格司亭调配物的第一剂量之后的15天与25天之间施用该液体依弗拉培格司亭调配物的第二剂量。
38、在一些实施方案中,该治疗有效量为选自以下的单位剂量形式:25μg/kg、50μg/kg、100μg/kg、和200μg/kg。
39、在一些实施方案中,该治疗有效量是0.6ml剂量体积中的13.2mg该液体依弗拉培格司亭调配物。
40、在一些实施方案中,该方法进一步包含向该患者施用治疗有效量的第二药剂。在一些实施方案中,该第二药剂为抗癌剂。
41、在一些实施方案中,在化学疗法完成约6小时、约5小时、约2小时、约1小时内向该患者施用该液体依弗拉培格司亭调配物。
42、本发明的技术效果
43、根据本公开的方面,在包含高浓度依弗拉培格司亭的液体调配物及其制备方法中,该液体调配物可具有优异的可溶性和稳定性,甚至当含有高浓度蛋白质时也是如此,并且可降低施用部位的刺激/疼痛或者患者不适感,因此可以患者友好的方式注射。
- 还没有人留言评论。精彩留言会获得点赞!