作为临时栓塞剂的藻酸盐基颗粒的制作方法
本公开提供了制备使用二价离子和/或光交联而交联的藻酸盐微球的组合物和方法。在一些方面,藻酸盐微球中包封藻酸盐裂解酶和/或抗炎剂以用于栓塞应用。在一些方面,藻酸盐微球的制备后处理(例如灭菌和冻干)用于改进保存期限。
背景技术:
1、器官中血管的人工阻塞或栓塞可以用于例如(a)控制由于创伤引起的出血,(b)防止血液流入异常血管(例如动脉瘤),和/或(c)治疗器官(例如切除肿瘤、用于移植或用于手术)。在许多情况下,不需要血管的永久栓塞。对于这样的医疗干预,使用临时的和生物再吸收的栓塞剂是期望的。例如,尺寸范围为10μm至80μm的imp/cs(亚胺培南/ciliastatin)抗生素颗粒已经被用作临时栓塞剂,然而,这种材料可能需要近一个月才能被完全吸收(例如参见okuno等人;“midterm clinical outcomes and mr imaging changes aftertranscatheter arterial embolization as a treatment for mild to moderateradiographic knee osteoarthritis resistant to conservative treatment”,j.vasc.interv.radiol.2017;28:995-1002)。类似地,也已经使用其它栓塞剂,例如胶原和凝血酶(例如参见vaidya等人;“an overview of embolic agents”,semin.intervent.radiol.2008;25:204-15)。然而,现有的药剂具有许多缺点,例如不可预测的再吸收速率、缺乏选择性降解上述基质的药剂和/或引起非特异性闭塞的栓塞剂的迁移(例如参见美国专利申请公开号20130211249)。此外,一些栓塞剂在其在体内使用之前需要处理或制备步骤。例如,必须将可吸收的明胶海绵切成棉絮或浆化。同样地,必须收集形成的自体血凝块并再次注射。
2、因此,需要可以选择性降解上述基质和/或表现出可预测的溶解速率而不在体内产生任何非特异性闭塞的栓塞剂。
技术实现思路
1、在一方面,本公开涉及在再水化时能够自降解的藻酸盐微球,其包含:通过变化的温度、通过变化的ph和/或用金属离子酶抑制剂预处理的藻酸盐裂解酶;藻酸盐分子,其具有以下的一种或两者:(i)预定的分子量,和(ii)预定比率的β-d-甘露糖醛酸(m)嵌段与α-l-古罗糖醛酸(g)嵌段;和使所述藻酸盐分子交联的二价金属离子,其中所述藻酸盐微球基本上不含水和/或被灭菌。在一个实施方案中,所述藻酸盐微球的降解通过以下的一种或多种控制:所述藻酸盐裂解酶的预处理、所述微球中所述藻酸盐酶的量、所述藻酸盐分子的预定的分子量,和所述藻酸盐分子的m:g嵌段的预定的比率,以及胶凝浴的组成,包括所述胶凝浴中一种或多种离子的量和/或电荷。在一个实施方案中,(i)-(iii)中的至少一个适用:(i)所述金属离子酶抑制剂是选自cu2+、zn2+和fe3+的可逆抑制剂,(ii)所述前体溶液中所述藻酸盐酶的所述预处理允许预定量的酶(以单位u测量)与所述藻酸盐分子混合,和(iii)通过调节胶凝浴的ph、所述胶凝浴的温度和所述藻酸盐微球中所述金属离子酶抑制剂的量中的一种或多种来调整所述藻酸盐裂解酶的活性。在一个实施方案中,(i)-(v)中的至少一个适用:(i)所述藻酸盐分子的预定的分子量在大于约100kda至小于约800kda的范围内,(ii)所述m:g嵌段的预定的比率为约50:50、约55:45、约60:40、约65:35、约70:30、约75:25、约80:20、约85:15、约90:10或约95:5,(iii)所述m:g嵌段的预定的比率为约50:50、约45:55、约40:60、约35:65、约30:70、约25:75、约20:80、约15:85、约10:90或约5:95,(iv)所述藻酸盐裂解酶的活性在约0.05mu(毫单位)至约2.5mu/微球之间,和(v)所述藻酸盐裂解酶的活性在约0.05nu(纳单位)至约0.05mu/微球之间。在一个实施方案中,(a)-(d)中的至少一个适用:(a)所述m:g嵌段的预定的比率为约50:50、约55:45、约60:40、约65:35、约70:30、约75:25、约80:20、约85:15、约90:10或约95:5,并且所述藻酸盐微球在小于约5天或大于约2天的时间段内降解,(b)所述m:g嵌段的预定的比率为约50:50、约45:55、约40:60、约35:65、约30:70、约25:75、约20:80、约15:85、约10:90或约5:95,并且所述藻酸盐微球在约5天至约30天之间的时间段内降解,(c)所述藻酸盐裂解酶的活性在约0.05mu(毫单位)至约2.5mu/微球之间,并且所述藻酸盐微球在小于约5天的时间段内降解,和(d)所述藻酸盐裂解酶的活性在约0.05nu(纳单位)至约0.05mu/微球之间,并且所述藻酸盐微球在约5天至约30天之间的时间段内降解。在一个实施方案中,(i)-(vii)中的至少一个适用:(i)所述微球进一步包含生物活性剂,(ii)所述微球进一步包含选自以下的冷冻保护剂:羟丙基-β环糊精、海藻糖、40kda的聚乙烯吡咯烷酮(pvp40kda)、葡聚糖(70kda分子量)、葡萄糖、乳糖、麦芽糊精、甘露醇、乙二醇和聚乙二醇,(iii)将所述藻酸盐微球冻干,(iv)所述藻酸盐微球的球形度为至少约0.7、至少约0.75、至少约0.8、至少约0.85、至少约0.9、至少约0.95或至少约0.99,(v)将所述藻酸盐微球灭菌,或将所述藻酸盐微球冻干并灭菌,(vi)当在给定的温度下储存时,所述藻酸盐微球的保存期限为至少约3个月、至少约6个月、至少约12个月、至少约18个月、至少约24个月、至少约36个月、至少约48个月或至少约60个月,和(vii)将冻干的藻酸盐微球在生理ph下在盐水或盐水不透射线的造影剂中重构。在一个实施方案中,(a)-(d)中的至少一个适用:(a)所述微球进一步包含生物活性剂,其中所述生物活性剂包含抗炎剂、麻醉药、抗癌剂或抗血管生成剂,(b)将所述藻酸盐微球冻干,其中所述冻干的藻酸盐微球的残余的水含量在约1%至约3质量%的范围内,(c)将所述藻酸盐微球灭菌,或将所述藻酸盐微球冻干并灭菌,其中所述灭菌包含高能辐射灭菌、γ射线灭菌或电子束灭菌,和(d)当在给定的温度下储存时,所述藻酸盐微球的保存期限为至少约3个月、至少约6个月、至少约12个月、至少约18个月、至少约24个月、至少约36个月、至少约48个月或至少约60个月,其中所述给定的温度在约2℃至约8℃之间或约室温(rt)。在一个实施方案中,所述微球进一步包含抗炎剂生物活性剂,其中所述抗炎生物活性剂包含分子量在约1百万(m)至约5m道尔顿之间的透明质酸。在一个实施方案中,将所述藻酸盐微球灭菌,或将所述藻酸盐微球冻干并灭菌,其中所述灭菌包含根据iso 11137-1:2006的约15至约25kgy之间的来自钴60同位素的γ辐射的γ射线灭菌或约25kgy的电子束辐射。
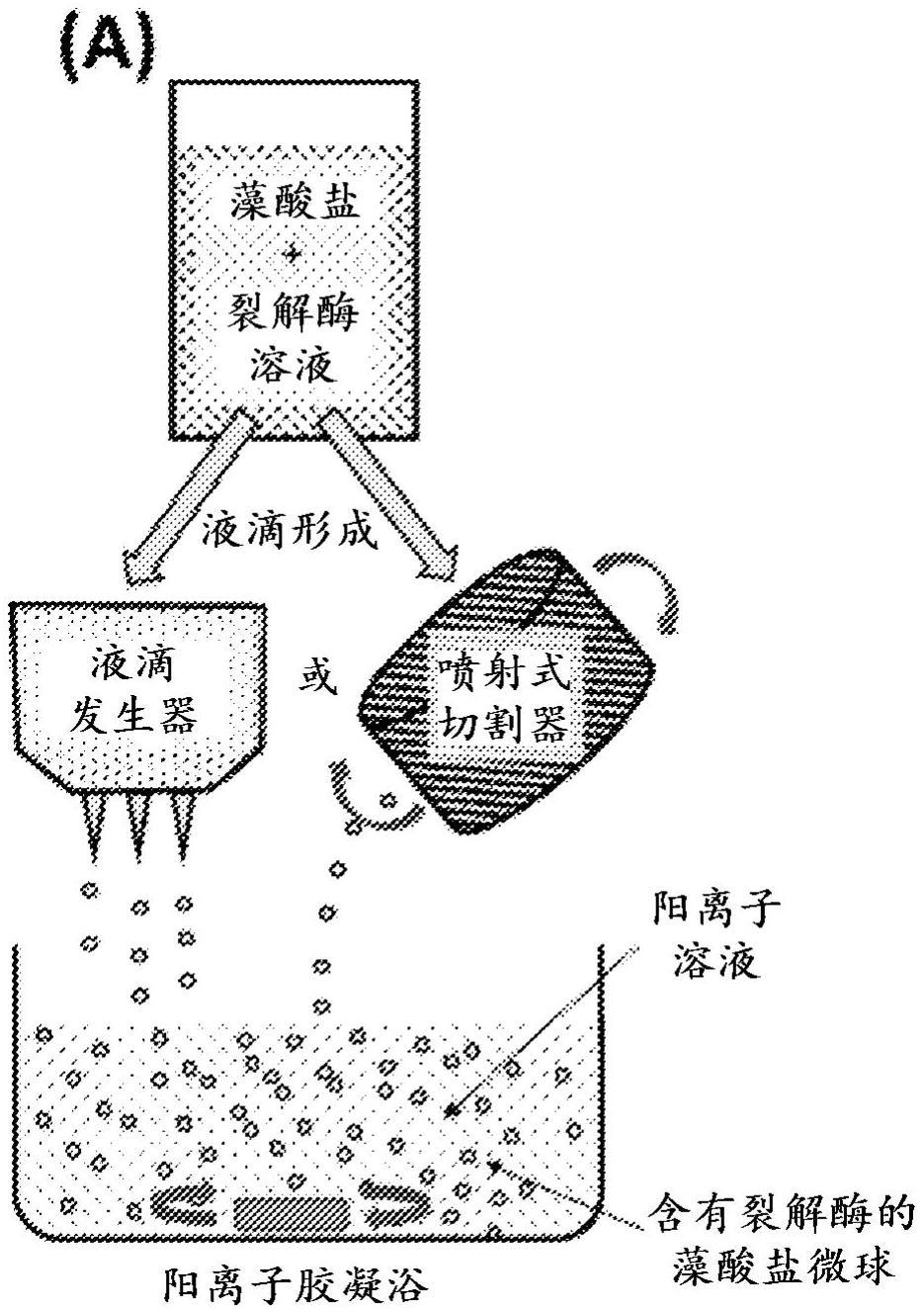
2、在另一方面,本公开涉及制备在再水化时能够自降解的藻酸盐微球的方法,所述方法包括:由前体溶液形成液滴,所述前体溶液包含:(i)通过变化的温度、通过变化的ph和/或用金属离子酶抑制剂预处理的藻酸盐裂解酶;和(ii)藻酸盐分子,其具有以下的一种或两者:(a)预定的分子量,和(b)预定比率的β-d-甘露糖醛酸(m)嵌段与α-l-古罗糖醛酸(g)嵌段;使所述液滴与包含二价金属离子的胶凝浴接触,从而使所述藻酸盐分子交联以形成藻酸盐微球;和将所述藻酸盐微球脱水并任选地灭菌,从而从所述微球基本上去除水。在一个实施方案中,(i)-(x)中的至少一个适用:(i)所述前体溶液包含一种或多种冷冻保护剂,(ii)所述胶凝浴包含一种或多种冷冻保护剂,(iii)含有藻酸盐裂解酶和藻酸盐的所述前体溶液中所述藻酸盐裂解酶的ph在ph 3.0-6.4的范围内,(iv)所述金属离子酶抑制剂是选自cu2+、zn2+和fe3+的可逆抑制剂,(v)所述前体溶液的温度在1-4℃的范围内,(vi)所述前体溶液中所述藻酸盐酶的所述预处理允许预定量的酶(以单位u测量)与所述藻酸盐分子混合,(vii)通过调节所述胶凝浴的ph、所述胶凝浴的温度和所述藻酸盐微球中所述金属离子酶抑制剂的量中的一种或多种来调整所述藻酸盐裂解酶的活性,(viii)所述胶凝浴的ph小于约6.5,(ix)所述胶凝浴的ph等于或约等于所述前体溶液的ph,和(x)所述前体溶液和/或所述胶凝浴进一步包含生物活性剂。在一个实施方案中,(i)-(iv)中的至少一个适用:(i)所述脱水包含将所述藻酸盐微球冻干,(ii)使用选自以下的方法进行形成所述液滴:液滴流延、喷雾冻凝/喷雾冷却、喷雾干燥、微流体液滴产生和喷射切割,(iii)所述藻酸盐微球的球形度为至少约0.7、至少约0.75、至少约0.8、至少约0.85、至少约0.9、至少约0.95或至少约0.99,和(iv)当在给定的温度下储存时,所述藻酸盐微球的保存期限为至少约3个月、至少约6个月、至少约12个月、至少约18个月、至少约24个月、至少约36个月、至少约48个月或至少约60个月。在一个实施方案中,所述前体溶液和/或所述胶凝浴包含一种或多种冷冻保护剂,其中所述冷冻保护剂各自独立地选自羟丙基-β环糊精、海藻糖、40kda的聚乙烯吡咯烷酮(pvp 40kda)、葡聚糖(70kda分子量)、葡萄糖、乳糖、麦芽糊精、甘露醇、乙二醇和聚乙二醇。在一个实施方案中,所述前体溶液包含浓度为约0.1%w/v至约20%w/v的海藻糖冷冻保护剂、浓度为约0.1%w/v至约1%w/v的pvp 40kda冷冻保护剂、或浓度为约0.1%w/v至约1%w/v的葡聚糖(分子量70kda)冷冻保护剂。在一个实施方案中,所述前体溶液和/或所述胶凝溶液包含浓度为约0.1%w/v至约2%w/v的羟丙基-β环糊精冷冻保护剂。在一个实施方案中,所述前体溶液和所述胶凝浴两者均包含相同的冷冻保护剂。在一个实施方案中,所述前体溶液和所述胶凝浴两者均包含相等或约相等浓度的相同的冷冻保护剂。在一个实施方案中,所述脱水包含将所述藻酸盐微球冻干,其中所述冻干的藻酸盐微球的残余的水含量在约1%至约3质量%的范围内。在一个实施方案中,所述方法进一步包括至少一个选自(i)-(iv)的步骤:(i)将所述藻酸盐微球或已经通过冻干脱水的所述藻酸盐微球灭菌,(ii)当在给定的温度下储存时,将所述藻酸盐微球储存至少约3个月、至少约6个月、至少约12个月、至少约18个月、至少约24个月、至少约36个月、至少约48个月或至少约60个月,(iii)将所述藻酸盐微球或已经通过冻干脱水的所述藻酸盐微球施用于受试者,和(iv)在生理ph下使用盐水或盐水不透射线的造影剂重构所述藻酸盐微球或已经通过冻干脱水的所述藻酸盐微球。在一个实施方案中,(a)-(d)中的至少一个适用:(a)所述方法进一步包括将所述藻酸盐微球或已经通过冻干脱水的所述藻酸盐微球灭菌的步骤,其中所述灭菌包含高能辐射灭菌、γ射线灭菌或电子束灭菌,(b)所述方法进一步包括将所述藻酸盐微球或已经通过冻干脱水的所述藻酸盐微球灭菌的步骤,其中所述灭菌包含根据iso 11137-1:2006的约15至约25kgy之间的来自钴60同位素的γ辐射或约25kgy的电子束辐射,(c)所述方法进一步包括当在给定的温度下储存时,将所述藻酸盐微球储存至少约3个月、至少约6个月、至少约12个月、至少约18个月、至少约24个月、至少约36个月、至少约48个月或至少约60个月的步骤,其中所述给定的温度在约2℃至约8℃之间或所述给定的温度为约室温(rt)。在一个实施方案中,所述藻酸盐微球的降解通过以下的一种或多种控制:所述藻酸盐裂解酶的预处理、所述微球中所述藻酸盐酶的量、所述藻酸盐分子的预定的分子量,和所述藻酸盐分子的m:g嵌段的预定的比率,以及胶凝浴的组成,包括所述胶凝浴中一种或多种离子的量和/或电荷。在一个实施方案中,(i)-(vii)中的至少一个适用:(i)所述藻酸盐分子的预定的分子量在大于约100kda至小于约800kda的范围内,(ii)所述m:g嵌段的预定的比率为约50:50、约55:45、约60:40、约65:35、约70:30、约75:25、约80:20、约85:15、约90:10或约95:5,(iii)所述m:g嵌段的预定的比率为约50:50、约45:55、约40:60、约35:65、约30:70、约25:75、约20:80、约15:85、约10:90或约5:95,(iv)在具有0.0025u/mg至1u/mg藻酸盐范围的酶活性的所述前体溶液中混合所述预处理的藻酸盐裂解酶,(v)在具有0.125u/mg至0.250u/mg藻酸盐范围的酶活性的所述前体溶液中混合所述预处理的藻酸盐裂解酶,(vi)在具有0.025u/mg至0.125u/mg藻酸盐范围的酶活性的所述前体溶液中混合所述预处理的藻酸盐裂解酶,和(vii)在具有0.0025u/mg至0.005u/mg藻酸盐范围的酶活性的所述前体溶液中混合所述预处理的藻酸盐裂解酶。在一个实施方案中,(a)-(e)中的至少一个适用:(a)所述m:g嵌段的预定的比率为约50:50、约55:45、约60:40、约65:35、约70:30、约75:25、约80:20、约85:15、约90:10或约95:5,并且所述藻酸盐微球在小于约5天或大于约2天的时间段内降解,(b)所述m:g嵌段的预定的比率为约50:50、约45:55、约40:60、约35:65、约30:70、约25:75、约20:80、约15:85、约10:90或约5:95,并且所述藻酸盐微球在约5天至约30天之间的时间段内降解,(c)在具有0.125u/mg至0.250u/mg藻酸盐范围的酶活性的所述前体溶液中混合所述预处理的藻酸盐裂解酶,并且所述藻酸盐微球在小于约5天的时间段内降解,(d)在具有0.025u/mg至0.125u/mg藻酸盐范围的酶活性的所述前体溶液中混合所述预处理的藻酸盐裂解酶,并且所述藻酸盐微球在约5天至约30天之间的时间段内降解,和(e)在具有0.0025u/mg至0.005u/mg藻酸盐范围的酶活性的所述前体溶液中混合所述预处理的藻酸盐裂解酶,并且所述藻酸盐微球在大于约30天的时间段内降解。在一个实施方案中,所述前体溶液和/或所述胶凝浴进一步包含生物活性剂,其中所述生物活性剂包含抗炎剂、麻醉剂、抗癌剂或抗血管生成剂。在一个实施方案中,所述前体溶液和/或所述胶凝浴包含抗炎生物活性剂,其中所述抗炎剂包含分子量在约1百万(m)至约5m道尔顿之间的透明质酸。
3、参考引用
4、本文的所有出版物、专利和专利申请均通过引用并入本文,其程度如同明确且单独地指示将每篇单独的出版物、专利或专利申请通过引用并入本文。在本文的术语与并入的参考文献中的术语之间存在冲突的情况下,以本文的术语为准。
- 还没有人留言评论。精彩留言会获得点赞!