用于预防或治疗高脂血症的蛋白激酶D抑制剂
本发明涉及一种用于预防或治疗高脂血症的pkd蛋白激酶抑制剂。本发明还涉及pkd蛋白激酶抑制剂用于与他汀类药物组合施用的用途。
背景技术:
1、饮食的类型在调节生物代谢中起主要作用。含有升高的脂肪含量的饮食通常更能量密集,这促进正能量平衡,并因此导致肥胖症。消化系统是与饮食中的脂肪接触的第一位置。摄入的脂肪被胆汁酸乳化后,甘油三酯在小肠腔中被胰脂肪酶分解成甘油、甘油单酯和脂肪酸(fa)(hussain,2014,lowe,2002)。然后,甘油单酯和fa通过被动扩散或通过涉及fa转运体,诸如分化簇36(cd36)的主动机制被肠细胞吸收(hussain,2014,xu,jay等人,2013)。在肠细胞中,fa和甘油单酯或甘油在内质网(er)处被再酯化。这些甘油单酯和甘油3-磷酸酯途径负责肠细胞中的大部分甘油三酯(tg)合成(yang和nickels,2015)。再酯化后,tg通过微粒体转移蛋白(mttp)与脂蛋白诸如载脂蛋白b48(apob48)和载脂蛋白a4(apoa4)一起被包装成前乳糜微粒(mansbach和siddiqi,2016)。apob48是在er处形成前乳糜微粒的绝对必要条件(mansbach和siddiqi,2016),而apoa4可能负责确定最终乳糜微粒大小(kohan,wang等人,2012,kohan,wang等人,2015,lu,yao等人,2006,weinberg,gallagher等人,2012)。前乳糜微粒在组装后被转运到高尔基体以进行进一步化学修饰,并被指定用于分泌(hesse,jaschke等人,2013)。
2、增加的膳食脂肪含量导致对于脂质摄取、fa再酯化、tg包装以及组装前乳糜微粒所需的脂蛋白关键的酶的表达和活性升高(clara,schumacher等人,2017,hern á ndezvallejo,alqub等人,2009,petit,arnould等人,2007)。有趣的是,乳糜微粒大小的增加可能是决定肠细胞处理过量膳食脂肪能力提高的主要因素(uchida,whitsitt等人,2012)。然而,驱动肠细胞适应肠腔中增加的脂质负荷的信号传导级联在很大程度上仍然是未知的。
3、能量密集型饮食的过度消耗是肥胖症发生的主要原因。通常,脂质是饮食中最有活力的组分之一;并且增加的脂肪消耗通常促进正能量平衡。消化系统吸收脂质的能力响应于饮食中升高的脂肪含量而增加(clara等人,2017,hern á ndez vallejo等人,2009,petit等人,2007)。这一过程涉及刺激消化酶(其将tg降解成ffa、甘油单酯和甘油)以及负责ffa摄取、tg再合成、将tg包装成乳糜微粒和将它们分泌到淋巴循环中的酶促机制的组分的表达和功能(clara等人,2017,hern á ndez vallejo等人,2009,petit等人,2007)。虽然减少肠中的脂肪吸收代表了一种有吸引力的减轻体重增加的策略,但现有的药理学策略却很有限。
4、wo2007/125331a2公开了用于治疗肥胖症的pkd蛋白激酶抑制剂,包括pkd2抑制剂。pkd抑制剂可以以每天0.1-25mg/kg体重的剂量经口施用。pkd2抑制剂与降低脂质吸收或高脂血症治疗无关。
5、高脂血症,尤其是高水平的胆固醇和甘油三酯,是促进动脉粥样硬化并因此导致心血管并发症的主要因素,心血管并发症是全世界发病率和死亡率的主要原因。高脂血症最常与营养过剩和肥胖症相关,但也可在苗条的非糖尿病受试者中观察到。在血液中,胆固醇和甘油三酯以与蛋白质复合的形式转运。可区分脂蛋白的四个主要类别:极低密度脂蛋白(vldl)、低密度脂蛋白(ldl)、高密度脂蛋白(hdl)和乳糜微粒残留物(cr)。胆固醇在不同类别的脂蛋白上的分布对于其促动脉粥样化作用是至关重要的。通常,vldl和ldl的高血液水平容易诱发动脉粥样硬化的发生(rader等人,2008)。此外,最近出现了多种其他不依赖于营养过剩和肥胖症的风险因素;这些因素包括环境因素,包括空气污染、应激、睡眠障碍,其通过改变炎症反应和肠微生物组的组成而促进动脉粥样硬化(libby,2021)。高血压也被认为是动脉粥样硬化发生的危险因素(libby,2021)。目前可用的治疗集中于使用他汀类药物降低胆固醇水平,使高血压正常化,以及使用血液抗凝剂(诸如低剂量阿司匹林或氯吡格雷)预防血栓形成事件。此外,存在几种改善血栓形成事件影响的外科手术可用(weber等人,2011)。然而,这些方法对于减少或预防动脉粥样硬化斑块的发生通常是无效的,尤其是在患有额外的合并症(如肥胖症或糖尿病)的患者中。还应注意,高脂血症并非仅存在于肥胖人群中的病状,它也发生在bmi增加的超重人群中。然而,超重人群不被归类为肥胖症人群的治疗对象。此外,预防或治疗高脂血症可导致预防或治疗以下疾病:动脉粥样硬化、肥胖症、2型糖尿病、脂肪肝病、非酒精性脂肪肝病(nafld)、心肌病、胰腺炎、心血管疾病(cvd);视网膜脂血症、高血压、高尿酸血症。
6、他汀类药物是羟甲基戊二酰辅酶a(hmg-coa)还原酶的抑制剂,是来源于真菌的分子。通过抑制固醇生物合成途径中的关键步骤,他汀类药物是有力的胆固醇降低性药物并且已经为预防心血管疾病提供了突出的贡献(sirtori,2014)。值得注意的是,他汀类药物在斑块消退中起到降低脂质含量的作用。这些药物进一步稳定动脉粥样硬化斑块,使其纤维帽增厚并大钙化,从而起到稳定动脉粥样硬化的作用(almeida等人,2019)。他汀类药物分为两组:发酵来源的和合成的。除了天然产物洛伐他汀之外,几种半合成和完全合成的hmg-coa还原酶抑制剂已经被批准用于药物用途。用于本发明的他汀类药物的实例包括但不限于阿托伐他汀、西立伐他汀、氟伐他汀、洛伐他汀、匹伐他汀、普伐他汀、辛伐他汀、瑞舒伐他汀或其药学上可接受的盐。
7、尽管他汀类药物被认为是相对安全的药物组,但根据最近的研究,在约18%的患者中观察到他汀类药物相关事件(zhang等人,2013)。最常见的是他汀类药物相关的肌肉症状(sams)。sams是一种不明原因的肌肉疼痛、虚弱或痉挛(肌痛),伴有或不伴有他汀类药物疗法后血液中的肌酸激酶(ck)增加(camerino等人,2021)。因此,他汀类药物疗法与监测ck水平相关,这对患者来说是个负担,而pkd抑制剂则不需要。尽管由他汀类药物引起的低密度脂蛋白(ldl)结合的胆固醇的降低通常防止心血管并发症的发生,但他汀类药物也可能由于心肌细胞中不期望的细胞内信号传导级联的活化而诱发心脏病(camerino等人,2021)。心肌和骨骼肌相关的他汀类药物副作用通常由蛋白激酶c(pkc)的活性增加和amp活化的蛋白激酶(ampk)的活化减弱引起。pkd是pkc的效应器(kolczynska等人,2020)。此外,pkd1抑制ampk活性(等人,2018)。因此,在达到经口给予的pkd的周身循环抑制剂的剂量下,将改善他汀类药物的副作用。事实上,pkd抑制剂已被证明可防止病理性心脏肥大并恢复心脏功能(simsek等人,2018)。最后,将pkd抑制剂与他汀类药物组合使用或单独使用可防止多种类型癌症的发生(roy等人,2017)。
8、另一方面,使用低剂量的pkd抑制剂(其不会达到周身循环,而是仅在肠中局部起作用,以降低脂质吸收)应防止具有周身性多器官副作用(其可与例如pkd对胰岛素分泌的影响相关)。相反,对于他汀类药物,循环性药物水平才是关键。但是以这种方式,它到达体内的大部分器官和细胞。
9、蛋白激酶d(pkd、prkd)是3个相关激酶(pkd1、pkd2和pkd3)的家族,所述相关激酶涉及调节各种基本生物过程,包括正常和病理状况下的信号转导、膜运输、分泌、细胞增殖和分化、免疫调节、心脏肥大和收缩、血管生成和癌症。可以观察到不同pkd同种型在空间和时间定位上的动态变化,并与它们在各种生理条件下的不同底物特异性组合。
10、pkd还与调节细胞代谢和细胞病理生理学的若干方面相关(fielitz,kim等人,2008,ittner,block等人,2012,kim,fielitz等人,2008,kleger,loebnitz等人,2011,kolczynska等人,2020,konopatskaya,matthews等人,2011,等人,2018,mayer等人,2019,mayer,valdes等人,2020,rozengurt,2011,sumara等人,2009)。本发明人最近的研究表明,pkd可能响应于游离脂肪酸(ffa)或dag而被活化。此外,高脂肪饮食(hfd)饲喂活化肝脏中的pkd(mayer等人,2019)。先前的研究已经表明,蛋白激酶d家族,特别是蛋白激酶d1(pkd1或prkd1),调节β胰腺细胞的代谢(sumara g.等人,cell,2009)以及脂肪细胞以热量形式耗散能量。重要的是,从脂肪细胞中去除pkd1使得小鼠对肥胖症和2型糖尿病的发生具有抗性(loeffler m.等人,embo j.,2018)。类似地,从小鼠肝细胞中去除蛋白激酶d3使得这些动物对2型糖尿病的发生具有部分抗性。然而,迄今为止,尚未研究pkd活性对肠中脂质代谢的影响。
11、除其他外,蛋白激酶d家族的成员先前在与葡萄糖和脂质代谢的调节相关的不同生理过程的上下文中讨论。这些包括对骨骼肌、肝脏和脂肪组织中葡萄糖摄取和胰岛素敏感性的调节(pkd1和pkd3)(kolczynska等人,2020)。pkd1和pkd2还参与胰腺β细胞对胰岛素分泌的调节(kolczynska等人,2020)。pkd1抑制脂肪组织的能量消耗并促进这些细胞中脂质的从头合成(脂肪生成)和甘油三酯储存(等人,2018)。相反,肝脏中的pkd3抑制脂肪生成并防止肝细胞中过量的甘油三酯和胆固醇储存(mayer等人,2019)。然而,没有证据表明激酶pkd家族的任何成员可能参与调节脂质吸收或通过细胞,尤其是在肠中的转运。而且,如开始所提到的,由于pkd家族的成员是不同的激酶并且呈现不同的表达模式,pkd家族的一个成员在给定过程中的牵连不能被视为这些家族的其他激酶在该过程中的影响的指示器,或这些激酶的参与将朝着相同的方向进行的指示器。例如,pkd1和pkd3分别以相反的方向调节脂肪细胞和肝细胞中的脂肪生成速率。
12、本发明人已经表明,pkd2在肠中加载脂质时被活化并促进乳糜微粒生长,并因此促进人和小鼠肠细胞分泌tg。有趣的是,pkd2直接磷酸化与乳糜微粒相关的载脂蛋白之一,即apoa4。在小鼠肠或人肠细胞中pkd2的缺失导致细胞内和分泌的apoa4的丰度增加。人肠中pkd2的活性与血液中tg的水平相关。与此同时,抑制pkd2或特异性去除肠中的这种激酶导致脂肪吸收减少、粪便能量排泄增加和对由高脂肪饮食诱发的肥胖症的抗性以及对糖尿病或肠微生物群中的病理变化的抗性。特别地,本发明人已经表明,经口施用pkd抑制剂(包括pkd2,诸如crt0066101和cid 755673)不仅显著减少由高脂肪饮食诱发的肥胖症,而且预防高脂血症、糖尿病的发生和改善小鼠的肠微生物群落分布。本发明人发现,在动物模型中使用pkd特异性抑制剂可减少脂肪吸收并有效治疗高脂血症和相关病状。
13、本发明人还表明,pkd2的失活与肠微生物群落中的阳性变化相关。肠微生态失调,定义为微生物多样性(包括特定类型的微生物)的丧失,与肥胖症、糖尿病和心血管疾病相关(henao-mejia,elinav等人,2012,qin,li等人,2012,wilkins,monga等人,2019)。然而,本文提供的数据表明,在缺乏pkd2的情况下,微生物多样性的稳定性有所提高。此外,在十二指肠中检测到属于拟杆菌(bacteroides)属的细菌分类的变化。据报道,在各种肥胖症模型中以及响应于高脂肪饮食,这种类型会衰退,并且这里显示的结果表明pkd2的缺失可防止不利的微生物群落变化(参见martinez-guryn,hubert等人,2018,turnbaugh等人,2006)。
14、在此应当注意的是,用低剂量的在此使用的抑制剂获得的pkd的抑制仅在肠中而不在其他器官中导致失活。在不受理论束缚的情况下,这一现象可以解释在用pkd抑制剂治疗的小鼠中能量消耗仅少量增加的事实。
15、此外,本发明人已经表明,pkd家族成员的抑制剂限制通过上皮细胞单层的脂质转运。为了评估不同pkd抑制剂的效率,将caco2细胞用crt0066101(5μm),cid2011756(20μm)、cid755673(20μm)、1-nm-pp1(20μm)或对照溶剂溶液(dmso)处理24小时(与放射性fa混合物一起添加)。与所有pkd抑制剂一起预温育导致通过caco2单层的脂质转运显著减少。
16、此外,本发明人已经表明,在小鼠中pkd2的基因失活可防止动脉粥样硬化发生。还定量了相对斑块面积。值得注意的是,ldlr-/-小鼠中pkd2的失活导致动脉粥样硬化斑块对主动脉的占据减少。此外,在ldlr缺陷型小鼠中pkd2的失活导致血液胆固醇和甘油三酯水平的降低。
17、本发明人进一步研究了crt0066101化合物对pkd的抑制是否也足以减少动脉粥样硬化斑块形成。将高胆固醇饮食饲喂的ldlr-/-小鼠用作模型。从饲喂的第7周至第17周,用经口剂量的crt0066101(每天10mg/kg体重)或溶剂对照饲喂动物。pkd的抑制导致胆固醇水平的降低以及较小尺寸的动脉粥样硬化斑块。
18、上述结果证明了胆固醇和甘油三酯的血浆水平与动脉粥样硬化的发生之间的相关性。本发明人已经表明,降低胆固醇和甘油三酯可逆转或至少延迟动脉粥样化形成,从而预防心血管疾病。
19、本发明人还预期利用pkd抑制剂与100mg/kg体重的阿托伐他汀的组合来测试这些物质的组合是否具有叠加效应。由于膳食脂质和从头合成的胆固醇都有助于动脉粥样硬化的发生,因此该策略可通过预防或治疗高脂血症而导致动脉粥样硬化斑块发生的最高衰减。
20、因此,本发明的主题是抑制pkd(特别是pkd2)的活性以减少肠中的脂肪吸收(特别是当食用高脂肪饮食时)的用途。在减少肠中的脂肪吸收的同时,施用pkd蛋白激酶抑制剂可改善葡萄糖耐量和胰岛素敏感性(特别是在食用高脂肪饮食时)。这些激酶活性的抑制通过经口施用抑制剂来实现,其中抑制作用应仅限于或主要限于消化系统中,特别是肠中的局部作用。因此,用于减少受试者肠中的脂肪吸收的pkd蛋白激酶抑制剂被靶向成在消化系统中局部起作用,这意味着其对受试者血流的吸收是有限的。将对pkd活性(特别是pkd2)的抑制限制为局部或主要局部作用,优选仅在小肠中,允许获得治疗或预防高脂血症的有益效果,从而限制副作用的可能性。因此,本发明的另一个主题也是一种用于预防或治疗受试者的高脂血症的pkd蛋白激酶抑制剂,其中所述pkd蛋白激酶抑制剂经口施用,其中所述pkd蛋白激酶抑制剂被靶向成在消化系统中,优选地在小肠中局部起作用。例如,通过使用低剂量的抑制剂,可以实现将抑制剂的作用仅限于或主要限于消化系统,特别是肠中。例如,可以将pkd抑制剂以0.1-20mg/kg体重范围内的剂量每日一次施用于人。优选地,可以将pkd抑制剂以5-20mg/kg体重范围内、更优选例如5-10mg/kg体重范围内的剂量每日一次施用于人。pkd抑制剂直接在肠中局部吸收和发挥作用的主要优点是缺乏药物的全身效应和较少的潜在副作用。此外,这使得更容易施加药物。可替代地,特别参考抑制剂crt0066101(式i化合物):
21、
22、可以将pkd抑制剂以0.1-5mg/kg体重的范围每日一次施用于人。适当的剂量将取决于患者(例如,性别、年龄、医疗状况、饮食)和高脂血症的阶段,并且技术人员将考虑其他因素。确保不进入血流或使进入血流最小化的pkd抑制剂的适当剂量可由本领域技术人员在不进行过多实验的情况下(例如通过确定施用后血液中的抑制剂水平)选择,但将优选地落在以上给出的范围内。
23、限制穿过肠屏障的另一种可能性是使用抑制剂的化学修饰,所述化学修饰将限制或防止抑制剂在消化系统中的吸收,特别是穿过肠屏障(例如通过分子的适当电荷)。另一种可能性是将pkd抑制剂与限制消化系统中,特别是肠中的吸收的一种或多种药剂(例如抑制oatp2b1的化合物,例如食品染料,例如偶氮染料,以及苯扎氯铵、对羟基苯甲酸酯类,包括对羟基苯甲酸丁酯,肌苷、表面活性剂和乳化剂,例如sls等)组合使用。另一种可能性是将pkd抑制剂与合适的载体(例如限制消化系统中的吸收,例如穿过肠屏障并渗透到血流中的载体颗粒)组合使用。本领域技术人员将能够指出用于将抑制剂靶向至消化系统中,特别是肠中,特别是小肠中的局部作用的合适方式。
24、通过将对pkd活性的抑制仅靶向或主要靶向至消化系统,特别是肠,有可能在治疗或预防高脂血症方面获得有益的效果,这一意外发现还与利用低脂肪饮食减少脂肪吸收并降低高脂肪饮食中的体重增加的可能性相关。抑制剂剂量。例如,在现有技术中,例如在心血管病症研究中,施用于小鼠的crt0066101抑制剂的剂量为例如80mg/kg体重/天或更多。相反,在本发明中,已经以小至10mg/kg体重/天的剂量提供了减少肠道脂肪吸收、提高apoa4水平和降低高脂肪饮食中的体重增加的效果。在这种抑制剂剂量下,治疗小鼠中已经发生的肥胖症的效果也已显现。
25、本发明人已经表明,为了在高脂血症的治疗或预防中获得有益效果,抑制pkd,特别是pkd2的活性是必要的。抑制该组蛋白的抑制剂是本领域已知的。
26、crt0066101是pkd1/2/3特异性抑制剂。其为式(i)化合物:
27、
28、
29、这种化合物是可商购的,包括来自absource diagnostics gmbh和biozol。
30、cid755673是具有式ii的pkd1、pkd2、pkd3抑制剂:
31、
32、这种化合物也是可商购的,包括来自medchemexpress。所述化合物可以经口施用,例如优选以5-20mg/kg体重(例如5-10mg/kg体重或可替代地10-20mg/kg体重)范围内的剂量每日一次施用于人;
33、用于本发明的其他合适的抑制剂的实例是:
34、-吡唑并[3,4-d]嘧啶类似物,包括3-in-pp1(参见verschueren等人,discoveryof a potent protein kinase d inhibitor:insights in the binding mode ofpyrazolo[3,4-d]pyrimidine an alogue.medchemcomm.2017年3月1日;8(3):640–646);所述化合物可以经口施用,例如优选以5-20mg/kg体重(例如5-10mg/kg体重或可替代地10-20mg/kg体重)范围内的剂量每日一次施用于人;
35、-1-nm-pp1(1-(叔丁基)-3-(萘-1-基甲基)-1h-吡唑并[3,4-d]嘧啶-4-胺)–式iii化合物:
36、
37、所述化合物可以经口施用,例如优选以5-20mg/kg体重(例如5-10mg/kg体重或可替代地10-20mg/kg体重)范围内的剂量每日一次施用于人;
38、-cid2011756–式iv化合物:
39、
40、所述化合物可以经口施用,例如优选以5-20mg/kg体重(例如5-10mg/kg体重或可替代地10-20mg/kg体重)范围内的剂量每日一次施用于人;
41、-kb nb 142-70–式v化合物:
42、
43、所述化合物可以经口施用,例如优选以5-20mg/kg体重(例如5-10mg/kg体重或可替代地10-20mg/kg体重)范围内的剂量每日一次施用于人。
44、迄今为止,仅有一些药理学策略涉及限制肠中脂肪的吸收。靶向胰脂肪酶活性的奥利司他和相关药物目前被批准用于治疗对生活方式干预难治性的肥胖患者(pilitsi等人,2019)。然而,这些药物在长期治疗期间具有有限的功效,并且通常由于相关的副作用(诸如油性粪便、油性斑点、大便急迫、大便失禁、排便过多和胀气带分泌物)而被中断(pilitsi等人,2019)。此外,奥利司他和相关药物不能防止通常与肥胖症相关的心血管并发症,并且它们仅在有限程度上改善糖尿病的发生。如本文所述,小鼠肠中pkd的抑制或动物中pkd2的缺失以及失活导致与先前针对奥利司他所述类似的防止体重增加的保护作用(murtaza等人,2017,zhao等人,2018)。重要的是,尽管已经发现pkd2失活或pkd的抑制增加了粪便脂质含量,但是没有观察到相关的明显胃肠紊乱或症状。
45、应当注意的是,已经表明,pkd的抑制也可以在其他病理状况中产生有益效果。使用特异性抑制剂灭活pkd可改善心脏功能(venardos等人,2015),降低胰腺炎的发生率(thrower等人,2011,yuan等人,2017),并预防不同癌症类型的进展(borges等人,2015,harikumar等人,2010,li等人,2018,sua等人,2019)。抑制pkd途径还可能导致脂肪组织的能量耗散增加(等人,2018)。然而,先前指出,以高于本文所述实验中所用剂量8倍的剂量经口施用crt 0066101在2小时后在胰腺肿瘤中提供最高浓度,但pkd1/2活化的降低达50%(harikumar等人,2010)。同时,本发明人已经表明,可以经口施用抑制剂,包括特别是低得多的剂量,其效果仅限于消化系统。
46、与此同时,迄今为止的许多数据表明,抑制pkd可能引起副作用,诸如增加脂质积聚和肝纤维化、改变胰腺中的β-细胞功能或增加肠渗透性(mayer等人,2019,sumara等人,2009,xiao,wang等人,2018,xiong,zhou等人,2016,zhang,liu等人,2020)。然而,本发明人已经观察到,pkd2活性的抑制(特别是仅限于消化系统,特别是肠,例如经口施用相对低剂量的抑制剂)与此类副作用无关。
47、因此,本发明提供了一种用于预防或治疗受试者的高脂血症(优选地包括相关病状,诸如糖尿病)的pkd蛋白激酶抑制剂,其中所述pkd蛋白激酶抑制剂经口施用,其中所述pkd蛋白激酶抑制剂被靶向至消化系统中,尤其是小肠中的局部作用。
48、优选地,pkd蛋白激酶的抑制剂是pkd2抑制剂,特别是特异性pkd2抑制剂。
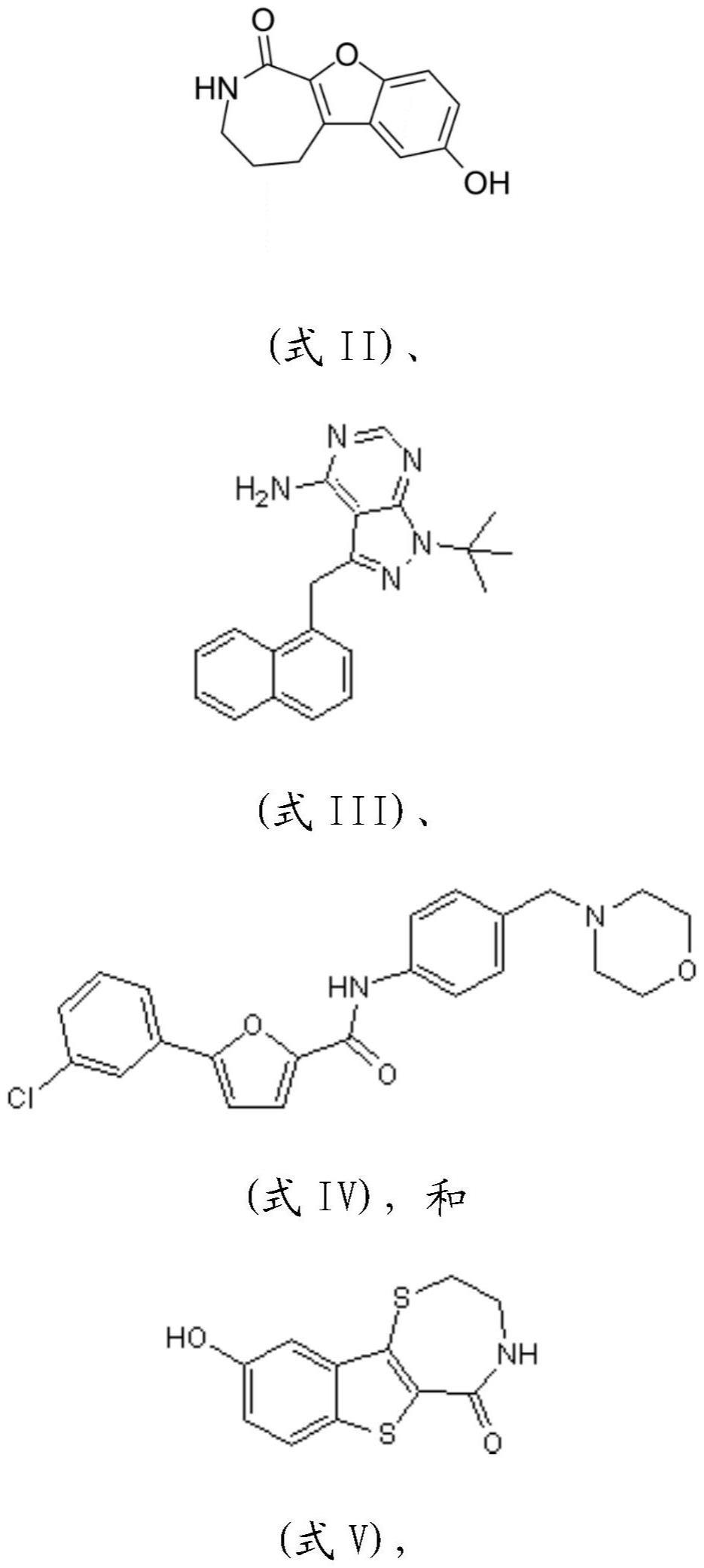
49、如本文所用,pkd2蛋白激酶抑制剂是具有抑制蛋白激酶d活性的活性的化合物,特别地包括特异性抑制pkd2活性的化合物。pkd2蛋白激酶抑制剂的实例是crt0066101(式i)、cid755673(式ii)、3-in-pp1、1-nm-pp1(式iii)、cid2011756(式iv)、kb nb 142-70(式v)等。根据本发明使用的优选的pkd抑制剂是crt0066101(式i)、cid755673(式ii)、1-nm-pp1(式iii)、cid2011756(式iv)。
50、pkd2的特异性抑制剂是抑制活性仅限于pkd2(对其他pkd激酶没有显著影响)的化合物或对pkd2的抑制活性显著高于对其他pkd的抑制活性(例如与ic50值相比)的化合物。
51、靶向消化系统中,特别是小肠中的局部作用,意指以限制或甚至防止肠屏障穿过和全身作用的方式施用抑制剂。这可以例如通过使用低剂量的抑制剂、其化学修饰或如上所述的适当配制品来实现。
52、在一个优选的实施方案中,pkd蛋白激酶抑制剂以限制肠屏障穿过的方式施用。
53、在一个优选的实施方案中,受试者采用高脂肪饮食,即受试者不愿意或无法减少消耗的脂肪量以降低高脂血症。
54、术语“高脂肪饮食”或“高脂肪食物消耗”或“富含脂肪的饮食”或“高脂肪饮食”或“hfd”在本文中可互换使用,并且意指食用提供脂肪的最小能量含量为30%的餐食。“脂肪”意指来自脂质组的营养素,特别是甘油脂肪酸酯和衍生化合物。
55、在一个优选的实施方案中,pkd蛋白激酶抑制剂是具有选自由以下组成的组的式的化合物:
56、
57、
58、或其药学上可接受的盐。
59、在一个优选的实施方案中,受试者是人。
60、在一个优选的实施方案中,pkd蛋白激酶抑制剂以每天0.1-20mg/kg体重的剂量施用。
61、在一个优选的实施方案中,pkd蛋白激酶抑制剂以每天5-20mg/kg体重的剂量施用。
62、在一个优选的实施方案中,pkd蛋白激酶抑制剂以每天5-10mg/kg体重的剂量施用。
63、在一个优选的实施方案中,pkd蛋白激酶抑制剂以每天0.1-5mg/kg体重的剂量施用。
64、本发明还涉及一种用于本发明的含有pkd蛋白激酶抑制剂和药学上可接受的赋形剂或辅助成分的药物组合物。
65、在一个优选的实施方案中,组合物包含至少一种辅助成分以减少在消化系统中,特别是在肠中的吸收。
66、在一个优选的实施方案中,pkd蛋白激酶抑制剂与他汀类药物组合施用。
67、在一个优选的实施方案中,他汀类药物选自由以下组成的组:阿托伐他汀、西立伐他汀、氟伐他汀、洛伐他汀、匹伐他汀、普伐他汀、辛伐他汀、瑞舒伐他汀或其药学上可接受的盐。
68、用于配制合适的药物组合物的方法是本领域已知的并且描述于《波兰药典》或《欧洲药典》中。口服组合物通常包含惰性稀释剂或可食用载体。对于口服治疗施用,活性化合物可以与赋形剂组合,并且以片剂、锭剂或胶囊剂例如明胶胶囊剂的形式施用。片剂、丸剂、胶囊剂、锭剂等可以含有以下成分中的任何成分或者具有类似性质的化合物:粘合剂,诸如微晶纤维素、黄蓍胶或明胶;赋形剂,诸如淀粉或乳糖;崩解剂,诸如海藻酸、primogel或玉米淀粉;润滑剂,诸如硬脂酸镁或sterotes;助流剂,诸如胶体二氧化硅;甜味剂,诸如蔗糖或糖精;或调味剂,诸如薄荷、水杨酸甲酯或橙味调味剂。
69、口服组合物也可以使用用于制备溶液、悬浮液或分散液的液体载体进行制备。组合物也可制备用作漱口剂。药学上可接受的粘合剂和/或佐剂材料作为组合物的一部分。示例性口服溶液或悬浮液可以包含以下成分:水、盐水、不挥发性油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗菌剂,诸如苄醇或对羟基苯甲酸甲酯;抗氧化剂,诸如抗坏血酸或亚硫酸氢钠;螯合化合物,诸如依地酸;缓冲剂,诸如乙酸盐、柠檬酸盐或磷酸盐;以及张力调节剂,诸如氯化钠或右旋糖。可以用酸或碱(诸如盐酸或氢氧化钠)调节ph。
70、在一个实施方案中,一种或多者活性化合物与将保护治疗性化合物免于从体内快速消除的载体(诸如控释制剂,包含植入物和微囊化的递送系统)一起制备。可以使用可生物降解的、生物相容的聚合物,诸如[聚(乙烯-共-乙酸乙烯酯)]、聚酐、聚乙交酯、胶原、聚(原酸酯)和聚丙交酯[聚(乳酸)]。此类制剂可以使用标准技术制备,或可以商业获得,例如从alza corporation和nova pharmaceuticals,inc.获得。它们可以根据本领域技术人员已知的方法,根据《欧洲药典》中描述的要求和规格进行制备。
71、药物组合物可以包含在例如瓶子、泡罩、安瓿瓶、容器、包装或分配器中,并附有例如施用说明书。
72、治疗剂量是足以获得有益或所需治疗结果的化合物的量。该剂量可以与预防剂量相同或不同,预防剂量是预防疾病或疾病的症状发生所需的量。治疗剂量可以以一次或多次施用、施加或剂量进行施用。治疗剂量对每种化合物是特定的,其可以每天施用一次或多次,此外,疗法可以是连续的或者其可以每周施加一次或多次。治疗剂量的选择取决于疾病或病症的严重程度、所施用的先前治疗、总体健康状况以及诸如患者的体重、年龄和其他伴随疾病等因素。因此,治疗剂量将由确定有效实现治疗效果所需的剂量和时间的本领域技术人员选择。
73、化合物的剂量、毒性和治疗功效可通过标准程序确定,所述标准程序是体外细胞培养实验和体内动物实验。为此目的,可以确定参数ld50(对50%的人群致死的剂量)和ed50(对50%的人群治疗有效的剂量)。根据具有毒性和治疗效果的剂量之间的比率确定治疗指数并将其表示为比率ld50/ed50。当化合物的治疗指数高时,认为化合物是治疗有益的。使用的另一个参数可以是ic50(相对于对照,抑制50%肿瘤细胞增殖/活力的浓度)。在疗法中,可以使用表现出毒性的化合物,然而,在设计阶段,然后创建将分子导向疾病部位的适当的药物转运系统。此类系统被设计成使对正常细胞的潜在损害最小化,从而减少副作用。
74、从细胞培养测定和动物研究获得的数据可用于构建人体的剂量范围。此类剂量落在化合物的循环浓度范围内,针对所述循环浓度范围观察到很少毒性或没有毒性。剂量可以根据所使用的剂型和所使用的施用途径在此范围内变化。例如,最初可以根据细胞培养测定估算治疗有效剂量。然后可以在动物模型中测试所述剂量,其中例如确定ic50值(即将症状抑制50%的供试化合物的浓度)。另外,可以将供试化合物的活性与用于针对其他疾病或病理状况的人类疗法中的制剂的活性进行比较。这些信息可用于确定人体的治疗剂量。
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!