生长抑素调节剂用于治疗疾病的用途的制作方法
本文描述了包含生长抑素调节剂的药物组合物和药物、制备此类药物组合物和药物的方法以及使用此类药物组合物和药物治疗将受益于调节生长抑素活性的病状、疾病或病症的方法。
背景技术:
1、生长抑素是一种肽激素,其经由与g蛋白偶联的生长抑素受体相互作用并抑制许多次级激素的释放来调节内分泌系统并影响神经传递和细胞增殖。已经鉴定了六种亚型生长抑素受体蛋白(sstr1、sstr2a、sstr2b、sstr3、sstr4、sstr5),并由五种不同的生长抑素受体基因编码。特定亚型生长抑素受体或其组合的调节对于治疗将受益于调节生长抑素活性的病状、疾病或病症是有吸引力的。
技术实现思路
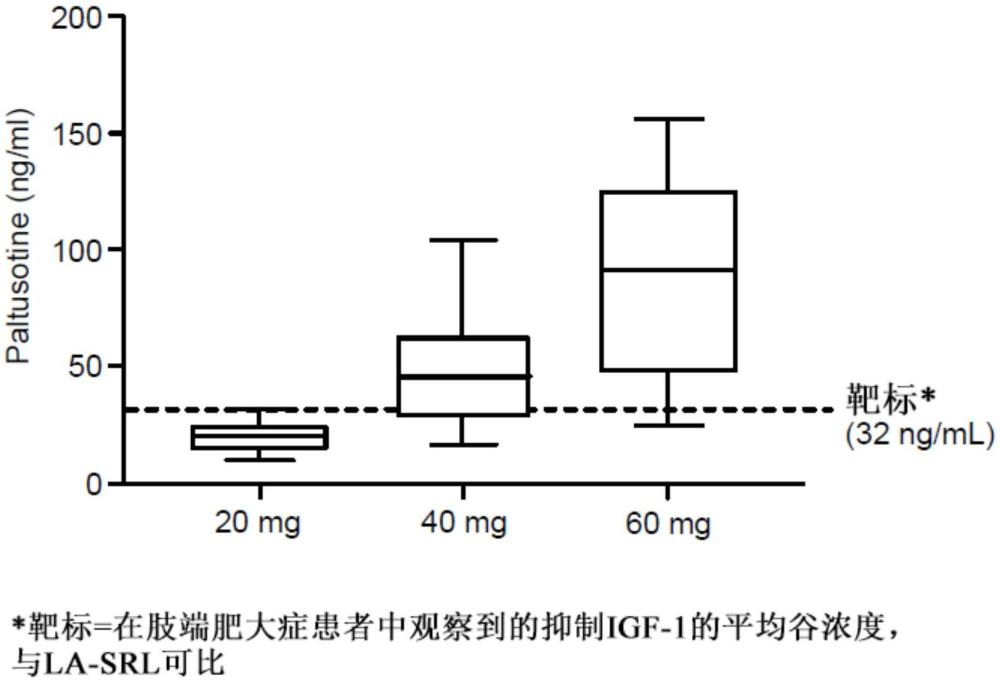
1、在一方面,本文描述了一种治疗人的肢端肥大症的方法,其包括向患有肢端肥大症的人口服施用每日剂量的3-[4-(4-氨基-哌啶-1-基)-3-(3,5-二氟-苯基)-喹啉-6-基)-2-羟基苄腈(化合物a)或其药学上可接受的盐或溶剂化物,足以实现化合物a的血浆谷浓度为至少约20ng/ml、至少约25ng/ml、至少约30ng/ml、至少约35ng/ml或至少约40ng/ml。在一些实施方案中,化合物a的血浆谷浓度为约20ng/ml、约21ng/ml、约22ng/ml、约23ng/ml、约24ng/ml、约25ng/ml、约26ng/ml、约27ng/ml、约28ng/ml、约29ng/ml、约30ng/ml、约31ng/ml、约32ng/ml、约33ng/ml、约34ng/ml、约35ng/ml、约36ng/ml、约37ng/ml、约38ng/ml、约39ng/ml或约40ng/ml。
2、在另一方面,本文描述了一种治疗人的肢端肥大症的方法,其包括:向患有肢端肥大症的人口服施用每日剂量的化合物a或其药学上可接受的盐或溶剂化物;确定人的化合物a的血浆谷浓度;以及如果人不具有化合物a的至少阈值血浆谷浓度,则增加化合物a或其药学上可接受的盐或溶剂化物的每日剂量。在一些实施方案中,化合物a的阈值血浆谷浓度为约20ng/ml、约21ng/ml、约22ng/ml、约23ng/ml、约24ng/ml、约25ng/ml、约26ng/ml、约27ng/ml、约28ng/ml、约29ng/ml、约30ng/ml、约31ng/ml、约32ng/ml、约33ng/ml、约34ng/ml、约35ng/ml、约36ng/ml、约37ng/ml、约38ng/ml、约39ng/ml、约40ng/ml、约41ng/ml、约42ng/ml、约43ng/ml、约44ng/ml、约45ng/ml、约46ng/ml、约47ng/ml、约48ng/ml、约49ng/ml、约50ng/ml、约51ng/ml、约52ng/ml、约53ng/ml、约54ng/ml、约55ng/ml、约56ng/ml、约57ng/ml、约58ng/ml、约59ng/ml或约60ng/ml。在一些实施方案中,化合物a的阈值血浆谷浓度为约20ng/ml、约21ng/ml、约22ng/ml、约23ng/ml、约24ng/ml、约25ng/ml、约26ng/ml、约27ng/ml、约28ng/ml、约29ng/ml、约30ng/ml、约31ng/ml、约32ng/ml、约33ng/ml、约34ng/ml、约35ng/ml、约36ng/ml、约37ng/ml、约38ng/ml、约39ng/ml或约40ng/ml。在一些实施方案中,增加化合物a或其药学上可接受的盐或溶剂化物的每日剂量包括将每日剂量增加相当于约10mg的化合物a-单盐酸盐的量。
3、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物的每日剂量相当于约10mg/天至约80mg/天的化合物a-单盐酸盐。在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物的每日剂量相当于约20mg/天至约60mg/天的化合物a-单盐酸盐。在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物的每日剂量相当于约10mg/天、约20mg/天、约30mg/天、约40mg/天、约50mg/天、约60mg/天、约70mg/天或约80mg/天的化合物a-单盐酸盐。在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物的每日剂量相当于20mg/天、约30mg/天、约40mg/天、约50mg/天或约60mg/天的化合物a-单盐酸盐。
4、在另一方面,本文描述了一种治疗人的肢端肥大症的方法,其包括改善血清胰岛素样生长因子-1(igf-1)浓度、生长激素(gh)浓度或两者,其中所述方法包括每日一次向患有肢端肥大症的人口服施用包含化合物a或其药学上可接受的盐或溶剂化物的药物组合物。在一些实施方案中,血清胰岛素样生长因子-1(igf-1)浓度、生长激素(gh)浓度或两者的改善包括igf-1浓度、gh浓度或两者的降低。在一些实施方案中,改善血清胰岛素样生长因子-1(igf-1)浓度包括实现小于约2.5的igf-1倍正常值上限(uln)。在一些实施方案中,血清胰岛素样生长因子-1(igf-1)浓度、生长激素(gh)浓度或两者的改善包括实现化合物a的血浆谷浓度为至少约20ng/ml、至少约25ng/ml、至少约30ng/ml、至少约35ng/ml或至少约40ng/ml。在一些实施方案中,血清胰岛素样生长因子-1(igf-1)浓度、生长激素(gh)浓度或两者的改善包括实现化合物a的血浆谷浓度为约20ng/ml、约21ng/ml、约22ng/ml、约23ng/ml、约24ng/ml、约25ng/ml、约26ng/ml、约27ng/ml、约28ng/ml、约29ng/ml、约30ng/ml、约31ng/ml、约32ng/ml、约33ng/ml、约34ng/ml、约35ng/ml、约36ng/ml、约37ng/ml、约38ng/ml、约39ng/ml或约40ng/ml。在一些实施方案中,改善血清胰岛素样生长因子-1(igf-1)浓度、生长激素(gh)浓度或两者包括施用每日剂量的化合物a或其药学上可接受的盐或溶剂化物,相当于约10mg/天至约80mg/天的化合物a-单盐酸盐。在一些实施方案中,改善血清胰岛素样生长因子-1(igf-1)浓度、生长激素(gh)浓度或两者包括施用每日剂量的化合物a或其药学上可接受的盐或溶剂化物,相当于约10mg/天、约20mg/天、约30mg/天、约40mg/天、约50mg/天、约60mg/天、约70mg/天或约80mg/天的化合物a-单盐酸盐。
5、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物通过遵循滴定方案口服施用。
6、在另一方面,本文描述了一种治疗人的肢端肥大症的方法,其包括经由滴定方案向患有肢端肥大症的人口服施用包含化合物a或其药学上可接受的盐或溶剂化物的药物组合物。在一些实施方案中,滴定方案包括在初始时间段内每日施用初始剂量的化合物a或其药学上可接受的盐或溶剂化物,随后每日施用高于初始剂量的剂量的化合物a或其药学上可接受的盐或溶剂化物。在一些实施方案中,初始时间段包括一天、约一周、约两周、约三周、约四周、约五周、约六周、约七周或约八周。在一些实施方案中,初始时间段包括约两周。
7、在一些实施方案中,滴定方案包括向上滴定或向下滴定,随后任选地重新向上滴定化合物a或其药学上可接受的盐或溶剂化物。在一些实施方案中,滴定方案包括以初始剂量施用化合物a或其药学上可接受的盐或溶剂化物约一周至约四周,并且如果患者耐受初始剂量,则将剂量增加等于第一增量值的量,或者如果患者不耐受初始剂量,则将剂量减少等于第一增量值的量。
8、在一些实施方案中,滴定方案进一步包括:以增加的剂量施用化合物a或其药学上可接受的盐或溶剂化物约一周至约四周,并且如果患者耐受增加的剂量,则进一步将剂量增加等于第二增量值的量;或者以减少的剂量施用化合物a或其药学上可接受的盐或溶剂化物约一周至约四周,并且如果患者耐受减少的剂量,则任选地将剂量增加等于第二增量值的量。在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物的初始剂量相当于约10mg/天或约20mg/天的化合物a-单盐酸盐。在一些实施方案中,第一增量等于相当于约10mg化合物a-单盐酸盐的化合物a或其药学上可接受的盐或溶剂化物的量。在一些实施方案中,第一增量等于第二增量值。在一些实施方案中,所述方法进一步包括:在每次剂量增加前评估患有肢端肥大症的人的血清胰岛素样生长因子-1(igf-1)浓度;以及如果血清igf-1浓度高于正常值上限(uln),则增加化合物a或其药学上可接受的盐或溶剂化物的每日剂量。在一些实施方案中,所述方法进一步包括:在每次剂量增加前评估患有肢端肥大症的人的血清胰岛素样生长因子-1(igf-1)浓度;以及如果血清igf-1浓度是正常值上限(uln)的约1.1倍、约1.2倍、约1.3倍、约1.4倍、约1.5倍、约1.6倍、约1.7倍、约1.8倍、约1.9倍、约2倍、约2.1倍、约2.2倍、约2.3倍、约2.4倍、约2.5倍或大于2.5倍,则增加化合物a或其药学上可接受的盐或溶剂化物的每日剂量。
9、在一些实施方案中,重复滴定方案直至获得最优化的剂量。在一些实施方案中,最优化的剂量相当于约30mg/天、约40mg/天、约50mg/天、约60mg/天、约70mg/天或约80mg/天的化合物a-单盐酸盐。在一些实施方案中,最优化的剂量提供了约20ng/ml、约21ng/ml、约22ng/ml、约23ng/ml、约24ng/ml、约25ng/ml、约26ng/ml、约27ng/ml、约28ng/ml、约29ng/ml、约30ng/ml、约31ng/ml、约32ng/ml、约33ng/ml、约34ng/ml、约35ng/ml、约36ng/ml、约37ng/ml、约38ng/ml、约39ng/ml或约40ng/ml的化合物a的稳态血浆谷浓度。
10、在另一方面,本文描述了一种治疗人的肢端肥大症的方法,其包括向患有肢端肥大症的人口服施用包含化合物a或其药学上可接受的盐或溶剂化物的药物组合物,其中所述人对用生长抑素类似物的治疗没有响应、耐受治疗或失去响应。在一些实施方案中,生长抑素类似物是奥曲肽、兰瑞肽或帕瑞肽。
11、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物通过遵循滴定方案口服施用。
12、在又另一方面,本文描述了一种评价患有肢端肥大症的受试者中对用化合物a或其药学上可接受的盐或溶剂化物治疗的临床响应的方法,其包括:(a)在开始用化合物a治疗之前,评估患有肢端肥大症的受试者的血清胰岛素样生长因子-1(igf-1)浓度;(b)在初始时间段内,以初始每日剂量施用化合物a或其药学上可接受的盐或溶剂化物;(c)重新评估患有肢端肥大症的受试者的血清igf-1浓度;以及(d)如果步骤(a)中的血清igf-1浓度高于步骤(c)的血清igf-1浓度,则继续每日施用化合物a或其药学上可接受的盐或溶剂化物,并且任选地增加化合物a或其药学上可接受的盐或溶剂化物的每日剂量,或者如果步骤(c)中的血清igf-1浓度与步骤(a)中的血清igf-1浓度基本相似,则任选地停止每日施用化合物a或其药学上可接受的盐或溶剂化物。在一些实施方案中,初始时间段为约两周、约三周或约四周。在一些实施方案中,初始时间段为约两周。
13、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物通过遵循滴定方案施用至受试者。在一些实施方案中,滴定方案包括以下的一个或多个循环:以第一每日量施用化合物a或其药学上可接受的盐或溶剂化物,持续约两周的时间段,随后:以增加的每日量施用化合物a或其药学上可接受的盐或溶剂化物,或者施用化合物a或其药学上可接受的盐或溶剂化物。
14、在一些实施方案中,如果血清igf-1浓度是正常值上限(uln)的约1.1倍、约1.2倍、约1.3倍、约1.4倍、约1.5倍、约1.6倍、约1.7倍、约1.8倍、约1.9倍、约2倍、约2.1倍、约2.2倍、约2.3倍、约2.4倍、约2.5倍或大于2.5倍,则增加化合物a或其药学上可接受的盐或溶剂化物的每日剂量。
15、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物的每日剂量以相当于约10mg/天的化合物a-单盐酸盐的增量剂量增加。在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物的每日剂量以约两周的频率增加。
16、在一些实施方案中,重复增量剂量增加的循环,直至获得最优化的剂量。在一些实施方案中,最优化的剂量相当于约30mg/天、约40mg/天、约50mg/天、约60mg/天、约70mg/天或约80mg/天的化合物a-单盐酸盐。在一些实施方案中,最优化的剂量提供了约20ng/ml、约21ng/ml、约22ng/ml、约23ng/ml、约24ng/ml、约25ng/ml、约26ng/ml、约27ng/ml、约28ng/ml、约29ng/ml、约30ng/ml、约31ng/ml、约32ng/ml、约33ng/ml、约34ng/ml、约35ng/ml、约36ng/ml、约37ng/ml、约38ng/ml、约39ng/ml或约40ng/ml的化合物a的稳态血浆谷浓度。在一些实施方案中,最优化的剂量维持受试者的正常血清igf-1浓度。
17、在一些实施方案中,受试者的正常血清igf-1浓度小于正常值上限(uln)的约1倍。
18、在另一方面,本文描述了一种治疗人的肢端肥大症的方法,其包括向患有肢端肥大症的人口服施用包含3-[4-(4-氨基-哌啶-1-基)-3-(3,5-二氟-苯基)-喹啉-6-基)-2-羟基苄腈(化合物a)或其药学上可接受的盐或溶剂化物的药物组合物;其中所述患有肢端肥大症的人先前用生长抑素类似物治疗过;并且其中治疗以相当于约40mg/天的化合物a-单盐酸盐的每日剂量开始。在一些实施方案中,患有肢端肥大症的人对用生长抑素类似物的治疗有响应并耐受。在一些实施方案中,生长抑素类似物是奥曲肽、兰瑞肽或帕瑞肽。在一些实施方案中,肢端肥大症体征和症状先前通过奥曲肽或兰瑞肽长效单一疗法得到控制。在一些实施方案中,用奥曲肽或兰瑞肽长效单一疗法控制肢端肥大症体征和症状包括igf-1≤1.0×uln。在一些实施方案中,以约一个月的频率评估igf-1水平和肢端肥大症体征和症状。在一些实施方案中,如果igf-1>0.9×uln,则将化合物a或其药学上可接受的盐或溶剂化物的每日剂量增加至相当于约60mg/天的化合物a-单盐酸盐的每日剂量。在一些实施方案中,如果人不能耐受化合物a或其药学上可接受的盐或溶剂化物的每日剂量,则将每日剂量减少相当于约20mg/天的化合物a-单盐酸盐的量。
19、在另一方面,本文描述了一种治疗人的肢端肥大症的方法,其包括向患有肢端肥大症的人口服施用包含3-[4-(4-氨基-哌啶-1-基)-3-(3,5-二氟-苯基)-喹啉-6-基)-2-羟基苄腈(化合物a)或其药学上可接受的盐或溶剂化物的药物组合物;其中患有肢端肥大症的人是初治的;或者其中患有肢端肥大症的人在过去4个月内未接受肢端肥大症治疗;或者其中患有肢端肥大症的人先前用生长抑素类似物治疗过且终止了用生长抑素类似物的治疗,并且经过足够长的时间以使生长抑素类似物从人体内洗脱;并且其中治疗以相当于约20mg/天的化合物a-单盐酸盐的每日剂量开始。在一些实施方案中,生长抑素类似物是奥曲肽、兰瑞肽或帕瑞肽。在一些实施方案中,在约1周、约2周、约3周、约4周、约5周、约6周、约7周、约8周或约9周的时间内,将化合物a或其药学上可接受的盐或溶剂化物的每日剂量增加至相当于约40mg/天的化合物a-单盐酸盐的每日剂量。在一些实施方案中,以约一个月的频率评估igf-1水平和肢端肥大症体征和症状。在一些实施方案中,如果igf-1>0.9×uln,则将化合物a或其药学上可接受的盐或溶剂化物的每日剂量增加至相当于约60mg/天的化合物a-单盐酸盐的每日剂量。在一些实施方案中,如果患有肢端肥大症的人不能耐受化合物a或其药学上可接受的盐或溶剂化物的每日剂量,则将每日剂量减少相当于约20mg/天的化合物a-单盐酸盐的量。在一些实施方案中,每日剂量提供了约20ng/ml、约21ng/ml、约22ng/ml、约23ng/ml、约24ng/ml、约25ng/ml、约26ng/ml、约27ng/ml、约28ng/ml、约29ng/ml、约30ng/ml、约31ng/ml、约32ng/ml、约33ng/ml、约34ng/ml、约35ng/ml、约36ng/ml、约37ng/ml、约38ng/ml、约39ng/ml或约40ng/ml的化合物a的稳态血浆谷浓度。在一些实施方案中,如果在用相当于约60mg/天或更多的化合物a-单盐酸盐的每日剂量的化合物a-单盐酸盐或溶剂化物治疗后,igf-1水平仍高于正常值上限,则停止用化合物a的治疗。
20、在一些实施方案中,如果人不能耐受化合物a、化合物a-单盐酸盐或其溶剂化物,则停止用化合物a或其药学上可接受的盐或溶剂化物的治疗。
21、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物的每日剂量以相当于约10mg/天的化合物a-单盐酸盐的增量剂量增加。
22、在一些实施方案中,在本文所述的用化合物a治疗的任何方法中,所述方法进一步包括测量受试者的血清葡萄糖水平。在一些实施方案中,当开始用化合物a或其药学上可接受的盐或溶剂化物治疗时;当调节化合物a或其药学上可接受的盐或溶剂化物的剂量时;或者两者兼有时,测量受试者的血清葡萄糖水平。在一些实施方案中,所述方法进一步包括当开始用化合物a或其药学上可接受的盐或溶剂化物治疗时;当增加化合物a或其药学上可接受的盐或溶剂化物的剂量时;或者两者兼有时,测量受试者的血清葡萄糖水平。在一些实施方案中,测量受试者的血清葡萄糖水平包括施用口服葡萄糖耐量试验(ogtt)。在一些实施方案中,如果用口服葡萄糖耐量试验(ogtt)所测量的受试者的峰值血清葡萄糖浓度>150mg/dl,则任选地开始抗糖尿病治疗,或任选地调整抗糖尿病治疗。
23、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物以一个或多个胶囊或片剂的形式施用。
24、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物以一个或多个胶囊的形式施用。在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物以一个或多个胶囊的形式施用,其中所述胶囊是本文所述的hmg胶囊。
25、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物以一个或多个片剂的形式施用。在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物以一个或多个片剂的形式施用,其中所述片剂如本文所述。
26、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物以一个或多个片剂的形式施用,其中每个片剂包含:化合物a单盐酸盐或其溶剂化物的喷雾干燥的固体分散体;一种或多种另外的药学上可接受的成分;以及任选的一种或多种膜包衣剂。在一些实施方案中,喷雾干燥的固体分散体包含:(a)化合物a单盐酸盐或其溶剂化物;和(b)药学上可接受的聚合物;其中化合物a单盐酸盐或其溶剂化物分散在由药学上可接受的聚合物形成的聚合物基质中。在一些实施方案中,所述一种或多种药学上可接受的成分选自一种或多种稀释剂、一种或多种崩解剂、一种或多种润滑剂和一种或多种助流剂。在一些实施方案中,所述一种或多种药学上可接受的成分包括微晶纤维素、甘露醇、预胶化淀粉交联羧甲基纤维素钠交联聚维酮、氯化钠、1:1氯化钠:氯化钾、胶体二氧化硅和硬脂酸镁。
27、在一些实施方案中,每个片剂包含约2重量%至约20重量%的化合物a单盐酸盐或其溶剂化物。在一些实施方案中,每个片剂包含约2重量%、约3重量%、约4重量%、约5重量%、约6重量%、约7重量%、约8重量%、约9重量%、约10重量%、约11重量%、约12重量%、约13重量%、约14重量%或约15重量%的化合物a单盐酸盐或其溶剂化物。在一些实施方案中,每个片剂包含约10重量%至约35重量%的由药学上可接受的聚合物形成的聚合物基质。在一些实施方案中,每个片剂包含:约2重量%至约15重量%的化合物a单盐酸盐或其溶剂化物,所述化合物a单盐酸盐或其溶剂化物分散在由药学上可接受的聚合物形成的聚合物基质中,其中在聚合物基质中分散的化合物a单盐酸盐或其溶剂化物为片剂的约20重量%至约35重量%;约40重量%至约80重量%的一种或多种药学上可接受的成分,所述药学上可接受的成分选自由以下组成的组:一种或多种稀释剂、一种或多种崩解剂、一种或多种润滑剂和一种或多种助流剂;和任选的少于约5重量%的一种或多种膜包衣剂。
28、在一些实施方案中,所述片剂包含:约20重量%至约40重量%的化合物a单盐酸盐或其溶剂化物的喷雾干燥的分散体,所述化合物a单盐酸盐或其溶剂化物分散在由药学上可接受的聚合物形成的聚合物基质中;约60重量%至约80重量%的一种或多种药学上可接受的成分,所述药学上可接受的成分选自由以下组成的组:一种或多种稀释剂、一种或多种崩解剂、一种或多种崩解助剂、一种或多种润滑剂和一种或多种助流剂;和任选的少于约5重量%的一种或多种膜包衣剂。
29、在一些实施方案中,喷雾干燥的分散体包含约15/85至约35/65比率的化合物a单盐酸盐或其溶剂化物与醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas)或聚乙烯吡咯烷酮聚醋酸乙烯酯共聚物(pvp/va)的聚合物基质。
30、在一些实施方案中,每个片剂包含:约20重量%至约35重量%的化合物a单盐酸盐或其溶剂化物的喷雾干燥的分散体,所述化合物a单盐酸盐或其溶剂化物分散在由药学上可接受的聚合物形成的聚合物基质中;其中喷雾干燥的分散体包含约15/85至约35/65比率的化合物a单盐酸盐或其溶剂化物与醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas)或聚乙烯吡咯烷酮聚醋酸乙烯酯共聚物(pvp/va)的聚合物基质;约60重量%至约80重量%的一种或多种药学上可接受的成分,所述药学上可接受的成分选自由以下组成的组:微晶纤维素、甘露醇、预胶化淀粉、交联羧甲基纤维素钠、交联聚维酮、氯化钠、1:1氯化钠:氯化钾、二氧化硅和硬脂酸镁;任选的少于约5重量%的一种或多种膜包衣剂。
31、在一些实施方案中,每个片剂包含:约20重量%、约21重量%、约22重量%、约23重量%、约24重量%、约25重量%、约26重量%、约27重量%、约28重量%、约29重量%、约30重量%、约31重量%、约32重量%、约33重量%、约34重量%或约35重量%的化合物a单盐酸盐或其溶剂化物的喷雾干燥的分散体,所述化合物a单盐酸盐或其溶剂化物分散在由药学上可接受的聚合物形成的聚合物基质中;其中喷雾干燥的分散体包含约15/85或约35/65比率的化合物a单盐酸盐或其溶剂化物与醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas)或聚乙烯吡咯烷酮聚醋酸乙烯酯共聚物(pvp/va)的聚合物基质;约60重量%至约80重量%的一种或多种药学上可接受的成分,所述药学上可接受的成分选自由以下组成的组:一种或多种稀释剂、一种或多种崩解剂、一种或多种崩解助剂、一种或多种润滑剂和一种或多种助流剂;和任选的少于约5重量%的一种或多种膜包衣剂。
32、在一些实施方案中,每个片剂包含:约20重量%、约21重量%、约22重量%、约23重量%、约24重量%、约25重量%、约26重量%、约27重量%、约28重量%、约29重量%、约30重量%、约31重量%、约32重量%、约33重量%、约34重量%或约35重量%的化合物a单盐酸盐或其溶剂化物的喷雾干燥的分散体,所述化合物a单盐酸盐或其溶剂化物分散在由药学上可接受的聚合物形成的聚合物基质中;其中喷雾干燥的分散体包含约15/85或约35/65比率的化合物a单盐酸盐或其溶剂化物与醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas)或聚乙烯吡咯烷酮聚醋酸乙烯酯共聚物(pvp/va)的聚合物基质;约60重量%至约80重量%的一种或多种药学上可接受的成分,所述药学上可接受的成分选自由以下组成的组:微晶纤维素、甘露醇、预胶化淀粉、交联羧甲基纤维素钠、交联聚维酮、氯化钠、1:1氯化钠:氯化钾、二氧化硅和硬脂酸镁;任选的少于约5重量%的一种或多种膜包衣剂。
33、在一些实施方案中,每个片剂包含:约2重量%至约15重量%的化合物a单盐酸盐或其溶剂化物,所述化合物a单盐酸盐或其溶剂化物分散在由药学上可接受的聚合物形成的聚合物基质中,其中聚合物基质中分散的化合物a单盐酸盐或其溶剂化物为片剂的约20重量%至约35重量%;约40重量%至约80重量%的一种或多种药学上可接受的成分,所述药学上可接受的成分选自由以下组成的组:一种或多种稀释剂、一种或多种崩解剂、一种或多种润滑剂和一种或多种助流剂;和任选的少于约5重量%的一种或多种膜包衣剂。
34、在一些实施方案中,每个片剂包含:约20重量%至约40重量%的化合物a单盐酸盐或其溶剂化物的喷雾干燥的分散体,所述化合物a单盐酸盐或其溶剂化物分散在由药学上可接受的聚合物形成的聚合物基质中;约60重量%至约80重量%的一种或多种药学上可接受的成分,所述药学上可接受的成分选自由以下组成的组:一种或多种稀释剂、一种或多种崩解剂、一种或多种崩解助剂、一种或多种润滑剂和一种或多种助流剂;和任选的少于约5重量%的一种或多种膜包衣剂。
35、在一些实施方案中,喷雾干燥的分散体包含约15/85至约35/65比率的化合物a单盐酸盐或其溶剂化物与醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas)或聚乙烯吡咯烷酮聚醋酸乙烯酯共聚物(pvp/va)的聚合物基质。
36、在一些实施方案中,每个片剂包含:约20重量%至约35重量%的化合物a单盐酸盐或其溶剂化物的喷雾干燥的分散体,所述化合物a单盐酸盐或其溶剂化物分散在由药学上可接受的聚合物形成的聚合物基质中;其中喷雾干燥的分散体包含约15/85至约35/65比率的化合物a单盐酸盐或其溶剂化物与醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas)或聚乙烯吡咯烷酮聚醋酸乙烯酯共聚物(pvp/va)的聚合物基质;约60重量%至约80重量%的一种或多种药学上可接受的成分,所述药学上可接受的成分选自由以下组成的组:一种或多种稀释剂、一种或多种崩解剂、一种或多种崩解助剂、一种或多种润滑剂和一种或多种助流剂;和任选的少于约5重量%的一种或多种膜包衣剂。
37、在一些实施方案中,每个片剂包含约10mg、约20mg、约40mg、约60mg或约80mg的化合物a单盐酸盐或其溶剂化物。在一些实施方案中,每个片剂包含约10mg的化合物a单盐酸盐或其溶剂化物。在一些实施方案中,每个片剂包含约20mg的化合物a单盐酸盐或其溶剂化物。在一些实施方案中,每个片剂包含约30mg的化合物a单盐酸盐或其溶剂化物。在一些实施方案中,每个片剂包含约40mg的化合物a单盐酸盐或其溶剂化物。在一些实施方案中,每个片剂包含约50mg的化合物a单盐酸盐或其溶剂化物。在一些实施方案中,每个片剂包含约60mg的化合物a单盐酸盐或其溶剂化物。在一些实施方案中,每个片剂包含约70mg的化合物a单盐酸盐或其溶剂化物。在一些实施方案中,每个片剂包含约80mg的化合物a单盐酸盐或其溶剂化物。
38、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物每日一次在餐前至少30分钟施用。在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物每日一次在餐前至少60分钟施用。在一些实施方案中,化合物a每日一次在空腹时施用。在一些实施方案中,化合物a在餐前至少30分钟施用。在一些实施方案中,化合物a在餐前至少60分钟施用。在一些实施方案中,化合物a在餐后至少180分钟施用。在一些实施方案中,化合物a在餐前至少60分钟和餐后至少180分钟施用。在一些实施方案中,化合物a在睡前施用。在一些实施方案中,化合物a每日一次在餐前至少30分钟空腹时用一杯水施用。
39、在一些实施方案中,质子泵抑制剂、组胺h2受体拮抗剂或抗酸剂的共同施用基本上不会影响化合物a单盐酸盐或其溶剂化物的生物利用度。在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物不与改变上胃肠(gi)道的ph的药物共同施用。
40、在一些实施方案中,如果化合物a或其药学上可接受的盐或溶剂化物与改变上胃肠(gi)道的ph的药物共同施用,则施用的化合物a或其药学上可接受的盐或溶剂化物的每日剂量增加。
41、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物的每日剂量增加相当于约10mg/天或约20mg/天的化合物a-单盐酸盐的量。
42、在一些实施方案中,改变上胃肠(gi)道的ph的药物包括质子泵抑制剂、组胺h2受体拮抗剂或抗酸剂。
43、在一些实施方案中,化合物a或其药学上可接受的盐或溶剂化物与多巴胺激动剂共同施用。在一些实施方案中,多巴胺激动剂是卡麦角林或其药学上可接受的盐。在一些实施方案中,多巴胺激动剂是卡麦角林,并以约0.5mg/周至约0.5mg/天的剂量和频率施用。
44、在一方面,本文描述了一种治疗人的肢端肥大症或神经内分泌肿瘤或两者的方法,其包括向患有肢端肥大症或神经内分泌肿瘤的人口服施用本文所述的任一种喷雾干燥的分散体片剂。
45、在一些实施方案中,所述片剂每日施用一次。在一些实施方案中,所述片剂在餐前至少30分钟施用。在一些实施方案中,所述片剂在餐前至少60分钟施用。在一些实施方案中,所述片剂在餐后至少180分钟施用。在一些实施方案中,所述片剂在餐前至少60分钟和餐后至少180分钟施用。在一些实施方案中,所述片剂在空腹时施用。在一些实施方案中,所述片剂在餐前至少30分钟空腹时用一杯水施用。在一些实施方案中,所述片剂在睡前施用。在一些实施方案中,质子泵抑制剂、组胺h2受体拮抗剂或抗酸剂的共同施用基本上不会影响来自片剂的化合物a单盐酸盐或其溶剂化物的生物利用度。
46、通过以下详细描述,本文所述的化合物、方法和组合物的其他目标、特征和优点将变得清楚。然而,应理解,尽管指示特定实施方案,但详细描述和特定实例仅通过说明的方式给出,因为通过此详细描述,本公开的精神和范围内的各种改变和修改对于本领域技术人员来说将变得清楚。
- 还没有人留言评论。精彩留言会获得点赞!