癌症免疫疗法的给药方案的制作方法
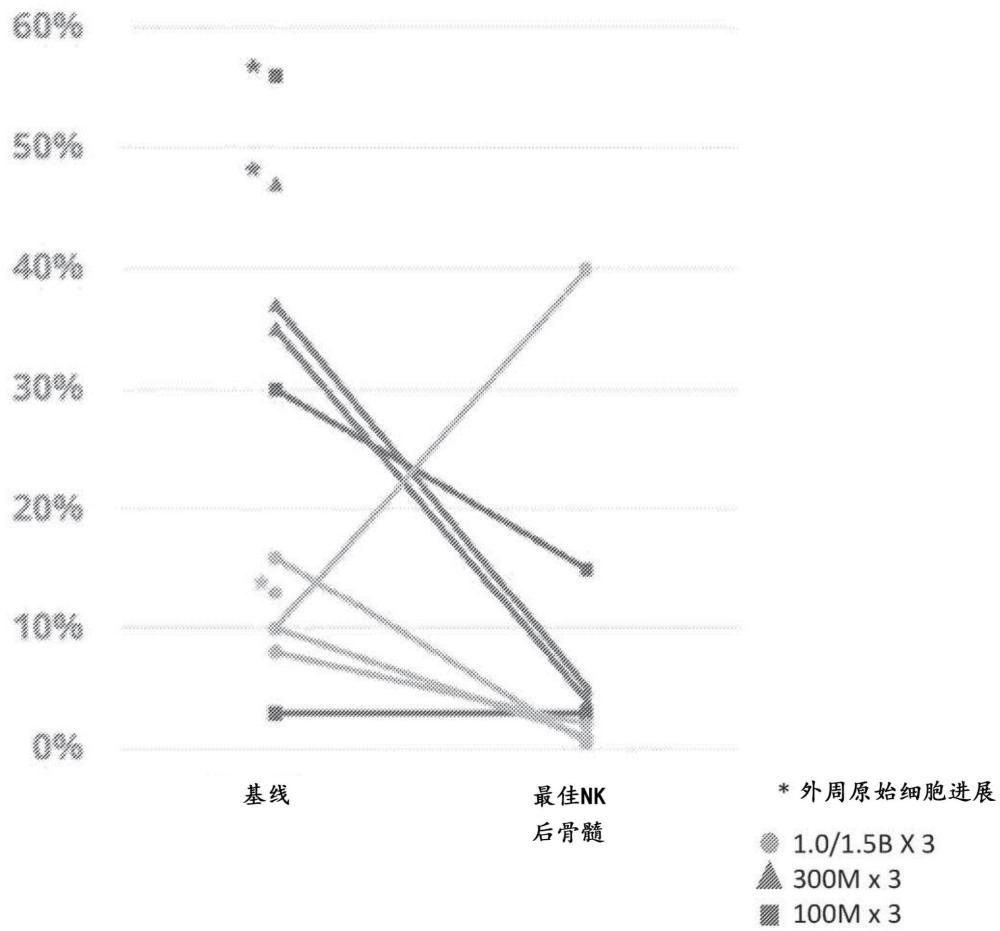
本文公开的若干个实施方案涉及包含用于癌症免疫疗法的基因工程化细胞的方法和组合物。在若干个实施方案中,本公开文本涉及被工程化以表达细胞毒性受体复合物的细胞,以及根据某些给药方案对此类细胞的施用以实现成功的癌症免疫疗法。
背景技术:
1、随着对各种癌症的进一步了解以及癌细胞具有哪些特征可用于将该细胞与健康细胞明确区分开来,正在开发利用癌细胞的独特特征的治疗剂。采用工程化免疫细胞的免疫疗法是治疗癌症的一种方法。
2、将材料通过引用以ascii文本文件的形式并入
3、本技术通过引用并入了同时随同本文提交的以下ascii文本文件中包含的序列表:文件名:nkt.078wo_st25.txt;创建于2022年5月7日,并且大小为27,762字节。
技术实现思路
1、免疫疗法呈现出在疾病治疗中的新的技术进步,其中将免疫细胞工程化以表达特定的靶向分子和/或效应分子,所述靶向分子和/或效应分子特异性地识别患病或受损细胞并且与之反应。这代表了有希望的进展,其至少部分是由于特异性靶向患病或受损细胞的潜力,与更传统的方法(如化学疗法,其中所有细胞都受到影响,并且期望的结局是足够的健康细胞存活以允许患者生存)形成对照。一种免疫治疗方法是在免疫细胞中重组表达嵌合受体,以实现对目的异常细胞的靶向识别和破坏。
2、在若干个实施方案中,本文提供了一种用于癌症免疫疗法的基因工程化自然杀伤(nk)细胞的群体,所述群体包含已在培养物中扩增的多个nk细胞,其中将所述多个nk细胞工程化以表达包含nkg2d配体结合结构域、跨膜结构域和细胞毒性信号传导复合物的细胞毒性受体复合物。
3、在若干个实施方案中,本文提供了用于癌症免疫疗法的给药方案,所述给药方案至少包括第一给药周期,其中所述第一给药周期包括第一剂量的基因工程化自然杀伤(nk)细胞、第二剂量的基因工程化nk细胞和第三剂量的基因工程化nk细胞,其中在第一时间点将所述第一剂量施用于需要癌症免疫疗法的受试者,其中在所述第一时间点之后5-10天之间将所述第二剂量施用于受试者,其中在所述第二剂量之后5-10天之间将所述第三剂量施用于受试者,其中所述第一、第二和第三剂量中的每一个包含至少1.0×109个nk细胞,其中所述工程化nk细胞的至少一部分被工程化以表达结合自然杀伤细胞2族成员d(nkg2d)的配体的嵌合受体。在若干个实施方案中,可以向给药周期中添加另外的剂量,如第四、第五或更多种剂量。
4、在若干个实施方案中,本文提供了用于治疗癌症的方法,所述方法包括向受试者施用至少第一、第二和第三剂量的基因工程化nk细胞,其中在所述第一剂量之后6-8天之间将所述第二剂量施用于受试者,其中在第二剂量之后6-8天之间将所述第三剂量施用于受试者,其中所述第一、第二和第三剂量中的每一个包含至少1.0×109个nk细胞,并且其中所述工程化nk细胞相对于受试者是同种异体的,并且被工程化以表达结合自然杀伤细胞2族成员d(nkg2d)的配体的嵌合受体。
5、在若干个实施方案中,本文提供了表达靶向nkg2d受体的配体的嵌合受体的工程化nk细胞群用于治疗癌症的用途,所述治疗是通过施用至少第一、第二和第三剂量的基因工程化nk细胞,其中在所述第一剂量之后6-8天之间将所述第二剂量施用于受试者,其中在所述第二剂量之后6-8天之间将所述第三剂量施用于受试者,并且其中所述第一、第二和第三剂量中的每一个包含至少1.0×109个工程化nk细胞。
6、在若干个实施方案中,所述第一、第二和第三剂量各自包含约1.5×109个nk细胞。在若干个实施方案中,所述第一、第二和第三剂量各自包含至少1.5×109个nk细胞。在若干个实施方案中,所述第一、第二和第三剂量各自包含更多的细胞数量,如2×109个nk细胞、3×109个nk细胞、4×109个nk细胞、5×109个nk细胞或更多,如1或1.5×109个nk细胞。
7、在若干个实施方案中,所述给药周期在约14天与约35天之间,如约21天或约28天。在若干个实施方案中,在所述第一时间点的约21天内将所述第一、第二和第三剂量的工程化nk细胞施用于受试者。在若干个实施方案中,在所述第一时间点之后约14天内将所述第一、第二和第三剂量的工程化nk细胞施用于受试者。
8、根据一些实施方案,所述第一给药周期在受试者已经经历用以减少天然免疫细胞数量的淋巴细胞清除过程之后开始。取决于所述实施方案,所述第一给药周期任选地之后是一个或多个另外的给药周期,如两个、三个、四个或更多个另外的周期。可以根据受试者的癌症的状态(例如在另外的癌症的进展或发展的情况下),施用另外的周期。在若干个实施方案中,当受试者展现出完全反应(例如,无癌症)时,不需要另外的周期。
9、在若干个实施方案中,所述给药方案和相关方法与用途包括向患有癌症的受试者施用包含至少两个剂量的氟达拉滨的淋巴细胞清除方案。在若干个实施方案中,所述淋巴细胞清除过程包括至少两个剂量的环磷酰胺和至少两个剂量的氟达拉滨。在若干个实施方案中,所述淋巴细胞清除过程包括三个剂量的环磷酰胺和三个剂量的氟达拉滨,其中第一剂量的环磷酰胺和氟达拉滨在给药周期开始之前5天施用,其中第二剂量的环磷酰胺和氟达拉滨在给药周期开始之前4天施用,并且其中第三剂量的环磷酰胺和氟达拉滨在给药周期开始之前3天施用。在若干个实施方案中,在第三剂量的环磷酰胺和氟达拉滨与给药周期开始之间允许经过约两天时间。在若干个实施方案中,将环磷酰胺以约50与约1000mg/m2之间的量施用,并且将氟达拉滨以约5与约100mg/m2之间的量施用。在若干个实施方案中,将环磷酰胺以约100与约600mg/m2之间的量施用,并且将氟达拉滨以约10与约60mg/m2之间的量施用。在若干个实施方案中,将环磷酰胺以约200与约400mg/m2之间的量施用,并且将氟达拉滨以约20与约40mg/m2之间的量施用。在若干个实施方案中,将环磷酰胺以约300mg/m2(例如,约250-350mg/m2)的量施用,并且将氟达拉滨以约30mg/m2(例如,约25-25mg/m2)的量施用。在若干个实施方案中,所述淋巴细胞清除过程包括至少两个剂量的阿糖胞苷(ara-c)和至少两个剂量的氟达拉滨。在若干个实施方案中,所述淋巴细胞清除过程包括5个每日剂量的ara-c和5个每日剂量的氟达拉滨,其中第一剂量的ara-c和氟达拉滨在给药周期开始之前7天施用。在若干个实施方案中,在最后剂量的ara-c和氟达拉滨与给药周期开始之间允许经过约两天时间。在若干个实施方案中,将ara-c以约0.1与约20g/m2/天之间的量施用,并且将氟达拉滨以约5与约100mg/m2/天之间的量施用。在若干个实施方案中,将ara-c以约0.5与约10g/m2/天之间的量施用,并且将氟达拉滨以约10与约60mg/m2/天之间的量施用。在若干个实施方案中,将ara-c以约1与约5g/m2/天之间的量施用,并且将氟达拉滨以约20与约40mg/m2/天之间的量施用。在若干个实施方案中,将ara-c以约2g/m2/天(例如,约1.5-2.5g/m2/天)的量施用,并且将氟达拉滨以约30mg/m2/天(例如,约25-35mg/m2/天)的量施用。
10、在若干个实施方案中,在所述受试者的天然免疫细胞群从所述淋巴细胞清除过程中恢复之前,将所述第一和第二剂量的工程化nk细胞施用于所述受试者。根据实施方案,除环磷酰胺、ara-c和/或氟达拉滨之外,或代替环磷酰胺、ara-c和/或氟达拉滨,还可以使用其他淋巴细胞清除剂,例如,柔红霉素(道诺霉素)或伊达比星、吗替麦考酚酯和/或苯达莫司汀。
11、在若干个实施方案中,所述给药方案和相关方法与用途被配置为治疗其中癌症是血癌的受试者。在若干个实施方案中,所述癌症是复发性/难治性(r/r)急性髓系白血病(aml)或高风险骨髓增生异常综合征(mds)。在若干个实施方案中,所述受试者患有r/r aml并且在给药方案之前已接受至少1种但不超过2种先前标准抗白血病治疗线。在若干个实施方案中,所述受试者患有fms样酪氨酸激酶3(flt3)突变和/或异柠檬酸脱氢酶(idh)1/2突变的疾病,并且在给药方案之前已接受至少1种但不超过3种先前治疗线。在若干个实施方案中,所述受试者被分类为中、高或极高风险mds并且患有复发性和/或难治性mds。在若干个实施方案中,所述受试者在给药方案之前已接受至少1种但不超过2种先前标准抗mds治疗线。在若干个实施方案中,所述受试者在给药方案之前在血液样品中具有少于约5%-10%、少于约5%-8%或少于约5%的原始细胞。在若干个实施方案中,所述受试者在给药方案之前具有小于或等于30×109个wbc/l、小于或等于28×109个wbc/l、或小于或等于约25×109个wbc/l的白细胞计数。在若干个实施方案中,所述受试者没有展现出白血病脑膜炎或已知的活动性中枢神经系统疾病的迹象和/或没有出现外周白细胞增多(具有大于或等于20,000个原始细胞/μl)。
12、在若干个实施方案中,所述给药方案和相关方法与用途被配置为治疗其中癌症是实体瘤的受试者。在若干个实施方案中,所述癌症是肝肿瘤,包括肝内胆管癌和作为来自结直肠癌的继发性转移的肝肿瘤。
13、在若干个实施方案中,所述工程化nk细胞表达由与seq id no:33具有至少85%、至少90%、至少95%或至少98%序列同一性的多核苷酸编码的嵌合受体。在若干个实施方案中,所述工程化nk细胞表达与seq id no:34具有至少85%、至少90%、至少95%或至少98%序列同一性的嵌合受体。在若干个实施方案中,还将所述工程化nk细胞工程化以表达膜结合的白介素15(mbil15)。在若干个实施方案中,所述mbil15与seq id no:36和/或38具有至少85%、至少90%、至少95%或至少98%序列同一性。在若干个实施方案中,所述工程化nk细胞相对于受试者是同种异体的。在若干个实施方案中,所述给药方案、相关方法和/或用途导致原始细胞计数减少、血小板计数增加和中性粒细胞计数增加中的一种或多种。
14、在若干个实施方案中,提供了表达靶向nkg2d受体的配体的嵌合受体的工程化nk细胞群用于治疗受试者的癌症的用途,所述治疗是通过静脉内施用至少三个连续剂量的基因工程化nk细胞,其中在第一时间点将第一剂量的基因工程化nk细胞施用于所述受试者,并且包含至少1.0×109个工程化nk细胞,其中在所述第一剂量之后6-8天之间将第二剂量施用于所述受试者,并且包含至少1.0×109个工程化nk细胞,其中在所述第二剂量之后6-8天之间将第三剂量施用于所述受试者,并且包含至少1.0×109个工程化nk细胞,其中所述第一时间点是淋巴细胞清除过程结束后约两天,所述淋巴细胞清除过程包括(i)三个剂量的环磷酰胺和三个剂量的氟达拉滨,其中将所述环磷酰胺以约300mg/m2的量施用,并且将所述氟达拉滨以约30mg/m2的量施用,或(ii)5个每日剂量的ara-c和5个每日剂量的氟达拉滨,其中将所述ara-c以约2g/m2/天的量施用,并且将所述氟达拉滨以约30mg/m2/天的量施用,并且其中所述工程化nk细胞表达与seq id no:34具有至少95%序列同一性的嵌合受体。在若干个实施方案中,所述第一、第二和第三剂量中的每一个包含至少1.5×109个nk细胞。
15、在若干个实施方案中,本文提供了用于癌症免疫疗法的给药方案,所述给药方案至少包括第一给药周期,其中所述第一给药周期包括第一剂量的基因工程化自然杀伤(nk)细胞、第二剂量的基因工程化nk细胞和第三剂量的基因工程化nk细胞。在若干个实施方案中,在第一时间点将所述第一剂量施用于需要癌症免疫疗法的受试者,在第一时间点之后5-10天之间将所述第二剂量施用于受试者,并且在第二剂量之后5-10天之间将所述第三剂量施用于受试者。在若干个实施方案中,所述第一、第二和第三剂量中的每一个包含至少1.5×109个nk细胞(或对于低于50kg的受试者至少3×107/kg),并且工程化nk细胞的至少一部分被工程化以表达嵌合受体,所述嵌合受体包含结合自然杀伤细胞2族成员d(nkg2d)的配体的结构域、跨膜结构域和细胞毒性信号传导复合物。在若干个实施方案中,所述细胞毒性信号传导复合物包含ox40亚结构域和cd3ζ亚结构域。在若干个实施方案中,所述基因工程化nk细胞还表达膜结合的白介素15(mbil15)。在若干个实施方案中,所述第一给药周期在受试者已经经历用以减少天然免疫细胞数量的淋巴细胞清除过程之后开始,并且任选地之后是一个或多个另外的给药周期。
16、本文还提供了用于癌症免疫疗法的给药方案,所述给药方案至少包括第一给药周期,其中所述第一给药周期包括第一剂量的基因工程化nk细胞、第二剂量的基因工程化nk细胞、第三剂量的基因工程化nk细胞,在第一时间点将所述第一剂量施用于受试者,在第一时间点之后5-10天之间将所述第二剂量施用于受试者,在所述第二剂量之后5-10天之间将所述第三剂量施用于受试者,并且所述第一、第二和第三剂量中的每一个包含至少1.5×109个nk细胞,所述nk细胞的至少一部分表达嵌合受体,所述嵌合受体包含结合自然杀伤细胞2族成员d(nkg2d)的配体的结构域。在若干个实施方案中,第一给药周期在受试者已经经历淋巴细胞清除过程之后开始,并且任选地之后是一个或多个另外的给药周期。
17、在若干个实施方案中,所述给药周期在约14天与约35天之间。在若干个实施方案中,所述给药周期为约21天或约28天(包括21、22、23、24、25、26、27或28天)。在若干个实施方案中,所述淋巴细胞清除过程包括至少两个剂量的阿糖胞苷(ara-c)和至少两个剂量的氟达拉滨。在若干个实施方案中,所述淋巴细胞清除过程包括3、4或5个每日剂量的ara-c和3、4或5个每日剂量的氟达拉滨,其中第一剂量的ara-c和氟达拉滨在给药周期开始之前5至7天施用。在若干个实施方案中,在最后剂量的ara-c和氟达拉滨与给药周期开始之间允许经过一、二或三天时间。在若干个实施方案中,将ara-c以约0.2与20g/m2/天(例如,0.5与10g/m2/天)之间的量施用,并且将氟达拉滨以约5与75mg/m2/天(例如10与60mg/m2/天)之间的量施用。在若干个实施方案中,将ara-c以约1与5g/m2/天之间的量施用,并且将氟达拉滨以约20与40g/m2/天之间的量施用。在若干个实施方案中,将ara-c以约2g/m2/天的量施用,并且将氟达拉滨以约30mg/m2/天的量施用。
18、在若干个实施方案中,所述淋巴细胞清除过程包括至少两个剂量的环磷酰胺和至少两个剂量的氟达拉滨。在若干个实施方案中,所述淋巴细胞清除过程包括三个剂量的环磷酰胺和三个剂量的氟达拉滨,其中第一剂量的环磷酰胺和氟达拉滨在给药周期开始之前5天施用,其中第二剂量的环磷酰胺和氟达拉滨在给药周期开始之前4天施用,并且其中第三剂量的环磷酰胺和氟达拉滨在给药周期开始之前3天施用。在若干个实施方案中,在第三剂量的环磷酰胺和氟达拉滨与给药周期开始之间允许经过一、二或三天时间。在若干个实施方案中,将环磷酰胺以约10与1000mg/m2(例如,约100与600mg/m2)之间的量施用,并且将氟达拉滨以约5与100mg/m2(约10与60mg/m2)之间的量施用。在若干个实施方案中,将环磷酰胺以约200与400mg/m2之间的量施用,并且将氟达拉滨以约20与40mg/m2之间的量施用。在若干个实施方案中,将环磷酰胺以约500mg/m2的量施用,并且将氟达拉滨以约30mg/m2的量施用。
19、在若干个实施方案中,在所述受试者的天然免疫细胞群从所述淋巴细胞清除过程中恢复之前,将所述第一和第二剂量的工程化nk细胞施用于所述受试者。在若干个实施方案中,在所述第一时间点的约21天内将所述第一、第二和第三剂量的工程化nk细胞施用于受试者。在若干个实施方案中,在所述第一时间点之后约14天内将所述第一、第二和第三剂量的工程化nk细胞施用于受试者。
20、另外提供了至少包括第一给药周期的给药方案,其中所述第一给药周期由第一、第二和第三剂量的基因工程化nk细胞构成,其中工程化nk细胞的至少一部分被工程化以表达嵌合受体,所述嵌合受体包含结合自然杀伤细胞2族成员d(nkg2d)的配体的结构域、跨膜结构域和细胞毒性信号传导复合物,其中在第一时间点将所述周期的第一剂量施用于需要癌症免疫疗法的受试者,在第一时间点之后5-10天之间将所述第二剂量施用于受试者,并且在第一时间点之后11-16天之间将所述第三剂量施用于受试者,结果是,第一、第二和第三剂量的组合导致施用约40亿个工程化nk细胞。在若干个实施方案中,所述第一、第二和第三剂量各自包含约1.5×109个nk细胞。
21、在本文提供的给药方案的若干个实施方案中,所述工程化nk细胞表达由与seq idno:33具有至少约90%、95%或98%序列同一性的多核苷酸编码的嵌合受体。在若干个实施方案中,所述工程化nk细胞表达与seq id no:34具有至少约90%、95%或98%序列同一性的嵌合受体。在若干个实施方案中,由nk细胞表达的mbil15与seq id no:36具有至少约90%、95%或98%序列同一性。替代实施方案采用与seq id no:38具有至少95%序列同一性的mbil15。
22、在若干个实施方案中,将所述第一和第二剂量间隔6-8天施用,并且将所述第二和第三剂量间隔6-8天施用。在若干个实施方案中,每个剂量包含1.5×109个nk细胞,并且其中所述第二剂量在所述第一剂量之后约7天施用,并且其中所述第三剂量在所述第二剂量之后约7天施用。
23、在若干个实施方案中,本文提供的给药方案用于治疗癌症,如血癌。在若干个实施方案中,所述癌症是复发性/难治性(r/r)急性髓系白血病(aml)或高风险骨髓增生异常综合征(mds)。在若干个实施方案中,所述受试者患有r/r aml并且已接受至少1种但不超过2种先前标准抗白血病治疗线。在若干个实施方案中,所述受试者患有fms样酪氨酸激酶3(flt3)突变和/或异柠檬酸脱氢酶(idh)1/2突变的疾病,并且已接受至少1种但不超过3种先前治疗线。在一些实施方案中,所述受试者符合条件被分类为中、高或极高风险mds并且患有复发性和/或难治性mds。在若干个实施方案中,所述受试者已接受至少1种但不超过2种先前标准抗mds治疗线。在若干个实施方案中,受试者在血液样品中具有少于约5%的原始细胞。在若干个实施方案中,所述受试者的白细胞计数小于或等于25×109个wbc/l。在若干个实施方案中,所述受试者没有展现出白血病脑膜炎或已知的活动性中枢神经系统疾病的迹象和/或没有出现外周白细胞增多(具有大于或等于20,000个原始细胞/μl)。
24、在若干个实施方案中,本文提供的给药方案用于治疗癌症,如实体瘤。在若干个实施方案中,所述癌症是肝肿瘤,包括肝内胆管癌和作为来自结直肠癌的继发性转移的肝肿瘤。
25、在本文提供的给药方案的若干个实施方案中,工程化nk细胞相对于受试者是同种异体的。在若干个实施方案中,所述给药方案导致原始细胞计数减少、血小板计数增加和中性粒细胞计数增加中的一种或多种。
26、在若干个实施方案中,提供了用于治疗复发性/难治性(r/r)急性髓系白血病(aml)或高风险骨髓增生异常综合征(mds)的给药方案,所述给药方案至少包括第一给药周期、由至少第一给药周期组成、或基本上由至少第一给药周期组成,其中所述第一给药周期包括第一剂量的基因工程化自然杀伤(nk)细胞、第二剂量的基因工程化nk细胞和第三剂量的基因工程化nk细胞,其中在第一时间点将所述第一剂量施用于需要癌症免疫疗法的受试者,其中在第一时间点之后5-10天之间将所述第二剂量施用于受试者,其中在第二剂量之后5-10天之间将所述第三剂量施用于受试者,其中所述第一、第二和第三剂量中的每一个包含至少1.5×109个nk细胞,其中所述工程化nk细胞相对于所述受试者是同种异体的,并且被工程化为嵌合受体,所述嵌合受体结合自然杀伤细胞2族成员d(nkg2d)的配体并且与seq id no:34具有至少约80%序列同一性,并且其中第一给药周期在受试者已经接受至少三个剂量的阿糖胞苷(ara-c)和至少三个剂量的氟达拉滨之后开始,并且其中所述第一给药周期任选地之后是一个或多个另外的给药周期。
27、在若干个实施方案中,提供了用于治疗复发性/难治性(r/r)急性髓系白血病(aml)或高风险骨髓增生异常综合征(mds)的方法,所述方法包括:向患有r/r aml或mds的受试者施用至少三个剂量的阿糖胞苷(ara-c)和至少三个剂量的氟达拉滨,其中施用的ara-c的量的范围为约1至5g/m2/天,并且施用的氟达拉滨的量的范围为约20至40mg/m2/天;向受试者施用至少第一、第二和第三剂量的基因工程化nk细胞,其中在最后剂量的ara-c和氟达拉滨之后将所述第一剂量施用于受试者,其中在第一时间点之后6-8天之间将所述第二剂量施用于受试者,其中在第二剂量之后6-8天之间将所述第三剂量施用于受试者,其中所述第一、第二和第三剂量中的每一个包含至少1.5×109个nk细胞,其中所述工程化nk细胞相对于所述受试者是同种异体的,并且被工程化为嵌合受体,所述嵌合受体结合自然杀伤细胞2族成员d(nkg2d)的配体并且与seq id no:34具有至少约80%序列同一性,并且其中所述第一给药周期任选地之后是一个或多个另外的给药周期。
28、在若干个实施方案中,所述方法还包括评价与r/r aml或mds的状态的进展或消退相关的至少一种度量,以确定是否施用另外的给药周期。在若干个实施方案中,所述受试者患有复发性和/或难治性急性髓系白血病,并且已接受至少1种但不超过2种先前标准抗白血病治疗线。在若干个实施方案中,所述受试者患有fms样酪氨酸激酶3(flt3)突变和/或异柠檬酸脱氢酶(idh)1/2突变的疾病,并且已接受至少1种但不超过3种先前治疗线。在若干个实施方案中,所述受试者符合条件被分类为中、高或极高风险mds并且患有复发性和/或难治性mds。在若干个实施方案中,所述受试者已接受至少1种但不超过2种先前标准抗mds治疗线。在若干个实施方案中,所述受试者在血液样品中具有少于约5%的原始细胞,白细胞计数小于或等于25×109个wbc/l,和/或没有展现出白血病脑膜炎或已知的活动性中枢神经系统疾病的迹象和/或没有出现外周白细胞增多(具有大于或等于20,000个原始细胞/μl)
29、在若干个实施方案中,本文提供了用于癌症免疫疗法的给药方案,所述给药方案至少包括第一给药周期,其中所述第一给药周期由第一剂量的如本文提供的基因工程化自然杀伤(nk)细胞和第二剂量的基因工程化nk细胞构成,其中在第一时间点将所述第一剂量施用于需要癌症免疫疗法的受试者,其中在第一时间点之后5-10天之间将所述第二剂量施用于受试者,其中所述第一剂量和第二剂量中的每一个包含至少1.5×108个nk细胞(或对于低于50kg的受试者至少3×106/kg),其中所述第一给药周期在受试者已经经历用以减少天然免疫细胞数量的淋巴细胞清除过程之后开始,并且其中所述第一给药周期任选地之后是第二或更多的给药周期。
30、另外的实施方案提供了用于癌症免疫疗法的给药方案,所述给药方案至少包括第一给药周期,其中所述第一给药周期由第一剂量的基因工程化自然杀伤(nk)细胞和第二剂量的基因工程化nk细胞组成,其中在第一时间点将所述第一剂量施用于需要癌症免疫疗法的受试者,其中在第一时间点之后5-10天之间将所述第二剂量施用于受试者,其中所述第一剂量和第二剂量中的每一个包含至少1.5×108个nk细胞,其中所述第一给药周期在受试者已经经历用以减少天然免疫细胞数量的淋巴细胞清除过程之后开始,并且其中所述第一给药周期任选地之后是第二或更多的给药周期。
31、根据若干个实施方案,给药周期在约14天与约35天之间或更长,并且任选地在给药周期结束时或在更远的时间点(例如,持续地)评价受试者的癌症的至少一种度量,以确定是否应开始另外的给药周期。在若干个实施方案中,给药周期为约21天。在若干个实施方案中,给药周期为约28天。
32、根据若干个实施方案,在所述受试者的天然免疫细胞群从淋巴细胞清除过程中恢复之前,将所述第一和第二剂量的工程化nk细胞施用于受试者。基于受试者的天然免疫细胞计数尚未恢复并稀释工程化nk细胞的群体数量,这有利地允许更大的效应细胞:靶细胞比率。在若干个实施方案中,在第一时间点之后约14至21天内将所述第一和第二剂量的工程化nk细胞施用于受试者。在若干个实施方案中,在第一时间点之后约14天内将所述第一和第二剂量的工程化nk细胞施用于受试者。
33、在若干个实施方案中,提供了用于癌症免疫疗法的给药方案,所述给药方案至少包括第一给药周期,其中所述第一给药周期由第一剂量的基因工程化自然杀伤(nk)细胞和第二剂量的基因工程化nk细胞构成,其中在第一时间点将所述周期的第一剂量施用于需要癌症免疫疗法的受试者,其中在第一时间点之后5-10天之间将所述第二剂量施用于受试者,其中所述第一剂量和第二剂量中的每一个包含至少1.5×108个nk细胞(或对于低于50kg的受试者至少3×106/kg),其中所述第一给药周期在受试者已经经历用以减少天然免疫细胞数量的淋巴细胞清除过程之后开始,并且在受试者的天然免疫细胞群从淋巴细胞清除过程中恢复之前施用所述第一给药周期的第二剂量。
34、本文还提供了用于癌症免疫疗法的给药方案,所述给药方案至少包括第一给药周期,其中所述第一给药周期由第一剂量的基因工程化自然杀伤(nk)细胞和第二剂量的基因工程化nk细胞构成,其中在第一时间点将所述周期的第一剂量施用于需要癌症免疫疗法的受试者,其中在第一时间点之后5-10天之间将所述第二剂量施用于受试者,其中,第一剂量和第二剂量的组合导致施用约3亿与约30亿个之间的工程化nk细胞,其中第一给药周期在受试者已经经历用以减少天然免疫细胞数量的淋巴细胞清除过程之后开始,并且其中在第一时间点的约14至21天内施用所述第一给药周期的第二剂量。在若干个实施方案中,其中所述第一和第二剂量各自包含约1.5×108个nk细胞、其中所述第一和第二剂量各自包含约4.5×108个nk细胞,或其中所述第一和第二剂量各自包含约1.5×109个nk细胞。
35、在若干个实施方案中,所述淋巴细胞清除过程是标准化学疗法淋巴细胞清除过程。在若干个实施方案中,所述淋巴细胞清除过程包括至少两个剂量的环磷酰胺和至少两个剂量的氟达拉滨。在若干个实施方案中,所述淋巴细胞清除过程包括三个剂量的环磷酰胺和三个剂量的氟达拉滨,其中第一剂量的环磷酰胺和氟达拉滨在给药周期开始之前5天施用,其中第二剂量的环磷酰胺和氟达拉滨在给药周期开始之前4天施用,并且其中第三剂量的环磷酰胺和氟达拉滨在给药周期开始之前3天施用。在若干个实施方案中,在第三剂量的环磷酰胺和氟达拉滨与给药周期开始之间允许经过约两天时间。在若干个实施方案中,将环磷酰胺以约100与600mg/m2之间的量施用,并且将氟达拉滨以约10与60mg/m2之间的量施用。在若干个实施方案中,将环磷酰胺以约200与400mg/m2之间的量施用,并且将氟达拉滨以约20与40mg/m2之间的量施用。在若干个实施方案中,将环磷酰胺以约300mg/m2的量施用,并且将氟达拉滨以约30mg/m2的量施用。
36、根据本文提供的实施方案,所述给药方案提供为:工程化nk细胞的至少一部分被工程化以表达嵌合受体,所述嵌合受体包含结合自然杀伤细胞2族成员d(nkg2d)的配体的结构域、跨膜结构域和细胞毒性信号传导复合物。在若干个实施方案中,所述细胞毒性信号传导复合物包含ox40亚结构域和cd3ζ亚结构域。在若干个实施方案中,其中所述基因工程化nk细胞还表达膜结合的白介素15(mbil15)。
37、在若干个实施方案中,所述工程化nk细胞表达由与seq id no:33具有至少80%、85%、90%、95%、96%、97%、98%、99%或更高序列同一性的多核苷酸编码的嵌合受体。在若干个实施方案中,所述工程化nk细胞表达与seq id no:34具有至少80%、85%、90%、95%、96%、97%、98%、99%或更高序列同一性的嵌合受体。在若干个实施方案中,所述mbil15与seq id no:36和/或38具有至少80%、85%、90%、95%、96%、97%、98%、99%或更高序列同一性。
38、在若干个实施方案中,所述第一和第二剂量包含至少1.5×108个nk细胞,并且其中将所述第一和第二剂量间隔6-8天施用。在若干个实施方案中,所述第一和第二剂量包含1.5×108个nk细胞,并且其中将所述第一和第二剂量间隔约7天施用。在若干个实施方案中,所述第一和第二剂量包含至少4.5×108个nk细胞,并且其中将所述第一和第二剂量间隔6-8天施用。在若干个实施方案中,所述第一和第二剂量包含4.5×108个nk细胞,并且其中将所述第一和第二剂量间隔约7天施用。在若干个实施方案中,所述第一和第二剂量包含至少1.5×109个nk细胞,并且其中将所述第一和第二剂量间隔6-8天给药。在若干实施方案中,所述第一和第二剂量包含1.5×109个nk细胞,并且其中将所述第一和第二剂量间隔约7天施用。
39、在若干个实施方案中,所述给药方案被配置用于治疗血癌。在若干个实施方案中,所述血癌是复发性/难治性(r/r)急性髓系白血病(aml)或高风险骨髓增生异常综合征(mds)。
40、在若干个实施方案中,所述给药方案被配置用于治疗实体瘤。在若干个实施方案中,所述癌症是肝肿瘤。在若干个实施方案中,所述肝肿瘤是肝内胆管癌。在若干个实施方案中,所述肝肿瘤是来自结直肠癌的一个或多个继发性转移。
41、在若干个实施方案中,所述工程化nk细胞相对于受试者是同种异体的。在若干个实施方案中,所述给药方案导致原始细胞计数减少、血小板计数增加和中性粒细胞计数增加中的一种或多种。
42、在若干实施方案中,提供了用于癌症免疫疗法的给药方案,所述给药方案至少包括第一给药周期,其中所述第一给药周期由至少一个剂量的基因工程化自然杀伤(nk)细胞构成,其中在第一时间点将所述第一剂量施用于需要癌症免疫疗法的受试者,其中第一剂量包含至少1×108个nk细胞,或对于低于50kg的受试者为2×106/kg,其中工程化nk细胞的至少一部分被工程化以表达嵌合受体,所述嵌合受体包含结合自然杀伤细胞2族成员d(nkg2d)的配体的结构域、跨膜结构域和细胞毒性信号传导复合物,其中所述细胞毒性信号传导复合物包含ox40亚结构域和cd3ζ亚结构域,并且其中所述基因工程化nk细胞还表达膜结合的白介素15(mbil15),其中所述第一给药周期在所述受试者已经经历用以减少天然免疫细胞数量的淋巴细胞清除过程之后开始,并且其中所述第一给药周期任选地之后是随后的给药周期。
43、本文还提供了用于癌症免疫疗法的给药方案,所述给药方案包括:至少第一给药周期,其中所述第一给药周期由至少第一剂量的基因工程化自然杀伤(nk)细胞、第二剂量的基因工程化nk细胞、和第二剂量的基因工程化nk细胞构成,其中在第一时间点将所述第一剂量施用于需要癌症免疫疗法的受试者,其中在所述第一时间点之后5-10天之间将所述第二剂量施用于所述受试者,其中将所述第三剂量在第二时间点之后5-10天之间施用于所述受试者,其中所述第一、第二和第三剂量中的每一个包含至少1×108个nk细胞,或对于低于50kg的受试者至少2×106/kg,其中工程化nk细胞的至少一部分被工程化以表达嵌合受体,所述嵌合受体包含结合自然杀伤细胞2族成员d(nkg2d)的配体的结构域、跨膜结构域和细胞毒性信号传导复合物,其中所述细胞毒性信号传导复合物包含ox40亚结构域和cd3ζ亚结构域,并且其中所述基因工程化nk细胞还表达膜结合的白介素15(mbil15),其中所述第一给药周期在所述受试者已经经历用以减少天然免疫细胞数量的淋巴细胞清除过程之后开始,并且其中所述第一给药周期任选地之后是第二或更多的给药周期。
44、在若干个实施方案中,所述淋巴细胞清除过程是标准化学疗法淋巴细胞清除过程。在若干个实施方案中,所述淋巴细胞清除过程包括至少两个剂量的环磷酰胺和至少两个剂量的氟达拉滨。在若干个实施方案中,所述淋巴细胞清除过程包括三个剂量的环磷酰胺和三个剂量的氟达拉滨,其中第一剂量的环磷酰胺和氟达拉滨在给药周期开始之前5天施用,其中第二剂量的环磷酰胺和氟达拉滨在给药周期开始之前4天施用,并且其中第三剂量的环磷酰胺和氟达拉滨在给药周期开始之前3天施用。在若干个实施方案中,在第三剂量的环磷酰胺和氟达拉滨与给药周期开始之间允许经过约两天时间。在若干个实施方案中,将环磷酰胺以约100与600mg/m2之间的量施用,并且将氟达拉滨以约10与60mg/m2之间的量施用。在若干个实施方案中,将环磷酰胺以约200与400mg/m2之间的量施用,并且将氟达拉滨以约20与40mg/m2之间的量施用。在若干个实施方案中,将环磷酰胺以约300mg/m2的量施用,并且将氟达拉滨以约30mg/m2的量施用。
45、在若干个实施方案中,所述给药周期的范围为约14至约28天,并且任选地在给药周期结束时或结束后评价所述受试者的至少一种癌症度量,以确定是否需要另外的给药周期。
46、在若干个实施方案中,所述工程化nk细胞表达由与seq id no:33具有至少80%、85%、90%、95%、96%、97%、98%、99%或更高序列同一性的多核苷酸编码的嵌合受体。在若干个实施方案中,所述工程化nk细胞表达与seq id no:34具有至少80%、85%、90%、95%、96%、97%、98%、99%或更高序列同一性的嵌合受体。在若干个实施方案中,所述mbil15与seq id no:36和/或38具有至少80%、85%、90%、95%、96%、97%、98%、99%或更高序列同一性。
47、在若干个实施方案中,所述第一、第二和第三剂量是1.0×108个nk细胞,并且间隔6-8天施用。在若干个实施方案中,所述第一、第二和第三剂量是约1.0×108个nk细胞,并且间隔约7天施用。在若干个实施方案中,所述第一、第二和第三剂量是约3×108个nk细胞,并且间隔6-8天施用。在若干个实施方案中,所述第一、第二和第三剂量是约3×108个nk细胞,并且间隔约7天施用。在若干个实施方案中,所述第一、第二和第三剂量是约1×109个nk细胞,并且间隔6-8天施用。在若干个实施方案中,所述第一、第二和第三剂量是约1×109个nk细胞,并且间隔约7天施用。
48、在若干个实施方案中,所述给药方案用于治疗血癌。在若干个实施方案中,所述血癌是复发性/难治性(r/r)急性髓系白血病(aml)或高风险骨髓增生异常综合征(mds)。
49、在若干个实施方案中,所述给药方案用于治疗实体瘤。在若干个实施方案中,所述癌症是肝肿瘤。在若干个实施方案中,所述肝肿瘤是肝内胆管癌。在若干个实施方案中,所述肝肿瘤是来自结直肠癌的继发性转移。
- 还没有人留言评论。精彩留言会获得点赞!