包含兰尼定受体调节剂的药物组合物及其用途的制作方法
背景技术:
1、肌质网(sr)是细胞中的一种结构,其主要充当专门的细胞内钙(ca2+)储库。兰尼定受体(ryr)是sr中的通道,其打开和关闭以调节ca2+从sr释放到细胞的细胞内细胞质中。ca2+从sr释放到细胞质中增加了细胞质ca2+浓度。ryr的打开概率是指ryr在任何给定时刻打开并且因此能够将ca2+从sr释放到细胞质中的概率。已知三种ryr异形体。ryr1是在哺乳动物骨骼肌中表达的主要异形体,ryr2主要存在于心肌中,而ryr3在骨骼肌中的表达低。
2、ca2+从sr的释放通过若干种ryr结合蛋白来调节。钙稳定蛋白(calstabin)1(fkbp12)和钙稳定蛋白2(fkbp12.6)分别使ryr1和ryr2的关闭状态稳定。ryr1或ryr2中的突变的特征分别在于钙稳定蛋白1或钙稳定蛋白2的结合减少,以及与收缩信号不相关的不适当的通道打开。通过翻译后修饰,诸如ryr通道的pka-磷酸化、氧化或亚硝基化,进一步加剧了这种通道打开。由此产生的钙稳定蛋白解离可能导致通道渗漏,这在静息条件下表现出打开概率在病理上增加。sr ca2+渗漏导致sr ca2+含量降低,可供释放的ca2+较少并且因此导致肌肉收缩较弱。
技术实现思路
1、在一些实施方案中,本公开提供了一种药物组合物,其包含呈单位剂型的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其药学上可接受的盐以及药学上可接受的赋形剂,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中获得4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其药学上可接受的盐的延长释放。
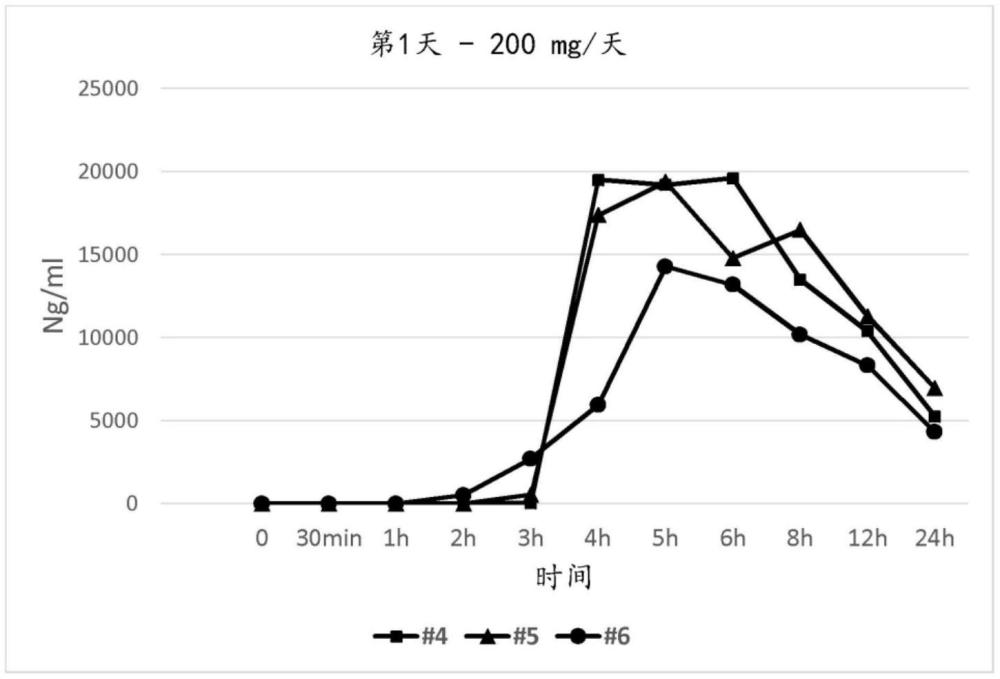
2、在一些实施方案中,本公开提供了一种药物组合物,其包含呈单位剂型的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其药学上可接受的盐以及药学上可接受的赋形剂,其中在对照研究中,如果向研究对象施用所述单位剂型,则在施用之后约2至约6小时之间的时间时在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其药学上可接受的盐或其药学上可接受的离子的最大血浆浓度。
3、在一些实施方案中,本公开提供了一种治疗病症的方法,其包括向有需要的对象施用治疗有效量的药物组合物,所述药物组合物包含呈单位剂型的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其药学上可接受的盐以及药学上可接受的赋形剂,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中获得4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其药学上可接受的盐的延长释放。
4、在一些实施方案中,本公开提供了一种片剂,其包含核心、基本上覆盖所述核心的底包衣(sub-coating)层以及基本上覆盖所述底包衣层的包衣层,其中
5、-所述核心包含4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐、甘露醇、微晶纤维素、交联羧甲基纤维素钠、硬脂酸镁、麦芽糖糊精、胶体无水二氧化硅和硬脂富马酸钠;
6、-所述底包衣层包含羟丙甲纤维素、微晶纤维素和硬脂酸;并且-所述包衣层包含醋酸羟丙甲纤维素琥珀酸酯、柠檬酸三乙酯、十二烷基硫酸钠和滑石。
7、在一些实施方案中,本公开提供了一种片剂,其包含核心、基本上覆盖所述核心的底包衣层以及基本上覆盖所述底包衣层的包衣层,其中在对照研究中,如果向研究对象施用所述单位剂型,则在施用之后约2至约6小时之间的时间时在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其药学上可接受的盐或其药学上可接受的离子的最大血浆浓度。在一些实施方案中,在施用之后约3至约4小时之间的时间时在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其药学上可接受的盐或其药学上可接受的离子的最大血浆浓度。
技术特征:
1.一种药物组合物,包含呈单位剂型的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其药学上可接受的盐以及药学上可接受的赋形剂,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中获得4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐的延长释放。
2.如权利要求1所述的药物组合物,包含所述药学上可接受的盐,其中所述药学上可接受的盐是半富马酸盐。
3.如权利要求1所述的药物组合物,其中所述延长释放是调释。
4.如权利要求1所述的药物组合物,其中所述延长释放是延续释放。
5.如权利要求1所述的药物组合物,其中所述延长释放是延迟释放。
6.如权利要求1所述的药物组合物,其中所述单位剂型适用于口服施用。
7.如权利要求1所述的药物组合物,其中所述单位剂型是固体剂型。
8.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则治疗有效量的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐在所述对象中存在一时间段,其中所述时间段在施用之后发生,其中所述时间段是至少约12小时。
9.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则治疗有效量的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐在所述对象中存在一时间段,其中所述时间段在施用之后发生,其中所述时间段是至少约24小时。
10.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则在施用之后约2至约6小时时在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的最大血浆浓度。
11.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则在施用之后约2至约4小时时在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的最大血浆浓度。
12.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则在施用之后约3至约4小时时在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的最大血浆浓度。
13.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中获得4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的约14至约21小时的体内半衰期。
14.如权利要求13所述的药物组合物,其中4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的所述半衰期是约14小时。
15.如权利要求13所述的药物组合物,其中4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的所述半衰期是约20小时。
16.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的在约1.4与约1.8之间的cmax的积累率,其中所述积累率计算为第28天的cmax/第1天的cmax的比率,其中cmax是最大观察血浆浓度。
17.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的在约1.4与约1.8之间的auc的积累率,其中所述auc的积累率计算为第28天的auctau/第1天的auc0-24的比率,
18.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的小于约35ug/ml的最大观察血浆浓度。
19.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则在单次施用120mg剂量之后,在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的约10至约15ng/ml的最大观察血浆浓度。
20.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则在14次每日一次施用120mg剂量之后,在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的约17至约21ng/ml的最大观察血浆浓度。
21.如权利要求1所述的药物组合物,其中在对照研究中,如果向研究对象施用所述单位剂型,则在初始施用之后约3至约7天的范围内在所述研究对象中发生4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的稳态血浆浓度。
22.如权利要求1所述的药物组合物,包含基于4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸的质量,约20至约200mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
23.如权利要求1所述的药物组合物,包含约23.5至约235mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
24.如权利要求1所述的药物组合物,包含基于4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸的质量,20mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
25.如权利要求1所述的药物组合物,包含23.5mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
26.如权利要求1所述的药物组合物,包含基于4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸的质量,50mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
27.如权利要求1所述的药物组合物,包含58.75mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
28.如权利要求1所述的药物组合物,包含基于4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸的质量,100mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
29.如权利要求1所述的药物组合物,包含117.5mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
30.如权利要求1所述的药物组合物,其中所述单位剂型是片剂。
31.如权利要求1所述的药物组合物,其中所述单位剂型是片剂,其中所述片剂通过湿法制粒工艺制备。
32.如权利要求1所述的药物组合物,其中所述单位剂型是片剂,其中所述片剂通过干法制粒工艺制备。
33.如权利要求1所述的药物组合物,其中所述单位剂型是胃耐受性片剂。
34.如权利要求33所述的药物组合物,其中所述胃耐受性片剂在处于或低于5.5的ph下基本上不崩解,其中崩解是通过测量所述胃耐受性片剂在具有处于或低于5.5的ph的介质中的溶出度来确定的。
35.如权利要求34所述的药物组合物,其中所述具有处于或低于5.5的ph的介质是具有1.2的ph的0.1n hcl溶液。
36.如权利要求33所述的药物组合物,其中所述胃耐受性片剂在至少约6.8的ph下基本上崩解,其中崩解是通过测量所述胃耐受性片剂在具有6.8的ph的介质中的溶出度来确定的。
37.如权利要求36所述的药物组合物,其中所述具有6.8的ph的介质是磷酸盐缓冲液。
38.如权利要求33所述的药物组合物,其中所述胃耐受性片剂在胃液中基本上不崩解。
39.如权利要求33所述的药物组合物,其中所述胃耐受性片剂在肠液中基本上崩解。
40.如权利要求1所述的药物组合物,其中所述单位剂型是胃耐受性片剂,其中所述胃耐受性片剂包含核心和基本上覆盖所述核心的包衣层。
41.如权利要求40所述的药物组合物,其中所述包衣层包含肠溶聚合物。
42.如权利要求41所述的药物组合物,其中所述肠溶聚合物是醋酸羟丙甲纤维素琥珀酸酯。
43.如权利要求40所述的药物组合物,其中所述包衣层是按质量计所述片剂的约20%。
44.如权利要求40所述的药物组合物,还包含在所述核心与所述包衣层之间的底包衣层。
45.如权利要求44所述的药物组合物,其中所述底包衣层包含聚合物。
46.如权利要求45所述的药物组合物,其中所述聚合物是羟丙甲纤维素。
47.如权利要求44所述的药物组合物,其中所述底包衣层是按质量计所述片剂的约3%。
48.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是粘合剂。
49.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是稀释剂。
50.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是崩解剂。
51.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是助流剂。
52.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是润滑剂。
53.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是表面活性剂。
54.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是甘露醇。
55.如权利要求54所述的药物组合物,其中所述甘露醇按质量计以所述组合物的约5%至约15%存在。
56.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是微晶纤维素。
57.如权利要求56所述的药物组合物,其中所述微晶纤维素按质量计以所述组合物的约10%至约20%存在。
58.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是交联羧甲基纤维素钠。
59.如权利要求58所述的药物组合物,其中所述交联羧甲基纤维素钠按质量计以所述组合物的约1%至约5%存在。
60.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是硬脂酸镁。
61.如权利要求60所述的药物组合物,其中所述硬脂酸镁按质量计以所述组合物的约0.5%至约2%存在。
62.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是麦芽糖糊精。
63.如权利要求62所述的药物组合物,其中所述麦芽糖糊精按质量计以所述组合物的约5%至约15%存在。
64.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是胶体无水二氧化硅。
65.如权利要求64所述的药物组合物,其中所述胶体无水二氧化硅按质量计以所述组合物的约0.1%至约0.5%存在。
66.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是硬脂富马酸钠。
67.如权利要求66所述的药物组合物,其中所述硬脂富马酸钠按质量计以所述组合物的约0.5%至约1%存在。
68.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是羟丙甲纤维素。
69.如权利要求68所述的药物组合物,其中所述羟丙甲纤维素按质量计以所述组合物的约1%至约5%存在。
70.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是硬脂酸。
71.如权利要求70所述的药物组合物,其中所述硬脂酸按质量计以所述组合物的约0.1%至约0.5%存在。
72.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是醋酸羟丙甲纤维素琥珀酸酯。
73.如权利要求72所述的药物组合物,其中所述醋酸羟丙甲纤维素琥珀酸酯按质量计以所述组合物的约5%至约15%存在。
74.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是柠檬酸三乙酯。
75.如权利要求74所述的药物组合物,其中所述柠檬酸三乙酯按质量计以所述组合物的约1%至约5%存在。
76.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是十二烷基硫酸钠。
77.如权利要求76所述的药物组合物,其中所述十二烷基硫酸钠按质量计以所述组合物的约0.1%至约0.5%存在。
78.如权利要求1所述的药物组合物,其中所述药学上可接受的赋形剂是滑石。
79.如权利要求78所述的药物组合物,其中所述滑石按质量计以所述组合物的约1%至约5%存在。
80.一种治疗病症的方法,包括向有需要的对象施用治疗有效量的药物组合物,所述药物组合物包含呈单位剂型的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其药学上可接受的盐以及药学上可接受的赋形剂,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中获得4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐的延长释放。
81.如权利要求80所述的方法,其中所述病症是心脏病症。
82.如权利要求81所述的方法,其中所述心脏病症的特征在于心律不齐。
83.如权利要求81所述的方法,其中所述心脏病症是儿茶酚胺敏感性多形性室性心动过速。
84.如权利要求81所述的方法,其中所述心脏病症是心力衰竭。
85.如权利要求84所述的方法,其中所述心力衰竭是充血性心力衰竭。
86.如权利要求84所述的方法,其中所述心力衰竭是慢性心力衰竭。
87.如权利要求84所述的方法,其中所述心力衰竭是射血分数降低的心力衰竭。
88.如权利要求84所述的方法,其中所述心力衰竭是射血分数保留的心力衰竭。
89.如权利要求84所述的方法,其中所述对象是具有植入型心律转复除颤器的心力衰竭患者,其中所述植入型心律转复除颤器植入在所述患者中。
90.如权利要求84所述的方法,其中所述心力衰竭是急性心力衰竭。
91.如权利要求84所述的方法,其中所述对象是在心肌梗死后需要保持心脏功能的心力衰竭患者。
92.如权利要求81所述的方法,其中所述心脏病症是心肌梗死。
93.如权利要求81所述的方法,其中所述心脏病症包括心脏缺血/再灌注损伤。
94.如权利要求80所述的方法,其中所述病症是肌肉骨骼病症。
95.如权利要求94所述的方法,其中所述肌肉骨骼病症是先天性肌病。
96.如权利要求80所述的方法,其中所述病症是ryr1相关肌病。
97.如权利要求94所述的方法,其中所述肌肉骨骼病症是肌营养不良。
98.如权利要求97所述的方法,其中所述肌营养不良是杜氏肌营养不良。
99.如权利要求94所述的方法,其中所述肌肉骨骼病症是肌少症。
100.如权利要求80所述的方法,其中所述病症是癌症相关的肌无力。
101.如权利要求100所述的方法,其中所述癌症相关的肌无力是癌症恶病质。
102.如权利要求101所述的方法,其中所述癌症恶病质是由于伴有骨转移的癌症。
103.如权利要求80所述的方法,其中所述病症是糖尿病。
104.如权利要求80所述的方法,其中所述病症是恶性高热。
105.如权利要求80所述的方法,其中所述治疗有效量是约100至约200mg/天。
106.如权利要求80所述的方法,其中所述治疗有效量是约120mg/天。
107.如权利要求80所述的方法,其中所述治疗有效量是约200mg/天。
108.如权利要求80所述的方法,其中所述施用是口服施用。
109.如权利要求80所述的方法,其中所述盐是半富马酸盐。
110.如权利要求80所述的方法,其中所述延长释放是调释。
111.如权利要求80所述的方法,其中所述延长释放是延续释放。
112.如权利要求80所述的方法,其中所述延长释放是延迟释放。
113.如权利要求80所述的方法,其中所述单位剂型是固体剂型。
114.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则治疗有效量的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐在所述对象中存在一时间段,其中所述时间段在施用之后发生,其中所述时间段是至少约12小时。
115.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则治疗有效量的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐在所述对象中存在一时间段,其中所述时间段在施用之后发生,其中所述时间段是至少约24小时。
116.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则在施用之后约2至约6小时在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的最大血浆浓度。
117.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则在施用之后约2至约4小时在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的最大血浆浓度。
118.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则在施用之后约3至约4小时在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的最大血浆浓度。
119.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中获得4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的约14至约21小时的体内半衰期。
120.如权利要求119所述的方法,其中4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的所述半衰期是约14小时。
121.如权利要求119所述的方法,其中4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的所述半衰期是约20小时。
122.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的在约1.4与约1.8之间的cmax的积累率,其中所述积累率计算为第28天的cmax/第1天的cmax的比率,其中cmax是最大观察血浆浓度。
123.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的在约1.4与约1.8之间的auc的积累率,其中所述auc的积累率计算为第28天的auctau/第1天的auc0-24的比率,
124.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的小于约35ug/ml的最大观察血浆浓度。
125.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则在单次施用120mg剂量之后,在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的约10至约15ng/ml的最大观察血浆浓度。
126.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则在14次每日一次施用120mg剂量之后,在所述对象中存在4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的约17至约21ng/ml的最大观察血浆浓度。
127.如权利要求80所述的方法,其中在对照研究中,如果向研究对象施用所述单位剂型,则在初始施用之后约3至约7天的范围内在所述研究对象中发生4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸或其所述药学上可接受的盐或其药学上可接受的离子的稳态血浆浓度。
128.如权利要求80所述的方法,其中所述单位剂型包含基于4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸的质量,约20至约200mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
129.如权利要求80所述的方法,其中所述单位剂型包含约23.5至约235mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
130.如权利要求80所述的方法,其中所述单位剂型包含基于4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸的质量,20mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
131.如权利要求80所述的方法,其中所述单位剂型包含23.5mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
132.如权利要求80所述的方法,其中所述单位剂型包含基于4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸的质量,50mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
133.如权利要求80所述的方法,其中所述单位剂型包含58.75mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
134.如权利要求80所述的方法,其中所述单位剂型包含基于4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸的质量,100mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
135.如权利要求80所述的方法,其中所述单位剂型包含117.5mg的4-[(7-甲氧基-2,3-二氢-1,4-苯并硫氮杂-4(5h)基)甲基]苯甲酸半富马酸盐。
136.如权利要求80所述的方法,其中所述单位剂型是片剂。
137.如权利要求80所述的方法,其中所述单位剂型是片剂,其中所述片剂通过湿法制粒工艺制备。
138.如权利要求80所述的方法,其中所述单位剂型是片剂,其中所述片剂通过干法制粒工艺制备。
139.如权利要求136所述的方法,其中所述单位剂型是胃耐受性片剂。
140.如权利要求139所述的方法,其中所述胃耐受性片剂在处于或低于5.5的ph下基本上不崩解,其中崩解是通过测量所述胃耐受性片剂在具有处于或低于5.5的ph的介质中的溶出度来确定的。
141.如权利要求140所述的方法,其中所述具有处于或低于5.5的ph的介质是具有1.2的ph的0.1n hcl溶液。
142.如权利要求139所述的方法,其中所述胃耐受性片剂在约6.8的ph下基本上崩解,其中崩解是通过测量所述胃耐受性片剂在具有6.8的ph的介质中的溶出度来确定的。
143.如权利要求142所述的方法,其中所述具有6.8的ph的介质是磷酸盐缓冲液。
144.如权利要求139所述的方法,其中胃耐受性片剂在胃液中基本上不崩解。
145.如权利要求139所述的方法,其中所述胃耐受性片剂在肠液中基本上崩解。
146.如权利要求80所述的方法,其中所述对象处于进食状态。
147.如权利要求80所述的方法,其中所述对象处于禁食状态。
148.如权利要求80所述的方法,还包括向所述对象施用治疗有效量的胃酸减少剂。
149.如权利要求148所述的方法,其中所述胃酸减少剂与所述药物组合物同时施用。
150.如权利要求148所述的方法,其中所述胃酸减少剂与所述药物组合物顺序地施用,在其之前或之后。
151.如权利要求148所述的方法,其中所述胃酸减少剂是质子泵抑制剂。
152.如权利要求148所述的方法,其中所述胃酸减少剂是抗酸药。
153.如权利要求148所述的方法,其中所述胃酸减少剂是组胺h2受体拮抗剂。
154.如权利要求80所述的方法,其中所述药物组合物在胃酸减少剂不存在的情况下施用。
155.如权利要求80所述的方法,其中所述单位剂型是胃耐受性片剂,其中所述胃耐受性片剂包含核心和基本上覆盖所述核心的包衣层。
156.如权利要求155所述的方法,其中所述包衣层包含肠溶聚合物。
157.如权利要求156所述的方法,其中所述肠溶聚合物是醋酸羟丙甲纤维素琥珀酸酯。
158.如权利要求155所述的方法,其中所述包衣层是按质量计所述片剂的约20%。
159.如权利要求155所述的方法,还包含在所述核心与所述包衣层之间的底包衣层。
160.如权利要求159所述的方法,其中所述底包衣层包含聚合物。
161.如权利要求160所述的方法,其中所述聚合物是羟丙甲纤维素。
162.如权利要求159所述的方法,其中所述底包衣层是按质量计所述片剂的约3%。
163.如权利要求80所述的方法,其中治疗增加所述对象的骨骼肌中的ryr1-钙稳定蛋白1结合。
164.如权利要求80所述的方法,其中治疗减少钙从所述对象的ryr1通道中渗漏。
165.一种片剂,包含核心、基本上覆盖所述核心的底包衣层以及基本上覆盖所述底包衣层的包衣层,其中
166.一种片剂,包含核心、基本上覆盖所述核心的底包衣层以及基本上覆盖所述底包衣层的包衣层,其中
167.一种片剂,包含:
技术总结
本公开提供了一种调释药物组合物,其包含4‑[(7‑甲氧基‑2,3‑二氢‑1,4‑苯并硫氮杂‑4(5H)基)甲基]苯甲酸半富马酸盐以及药学上可接受的赋形剂。本公开提供了治疗与RyR相关联的病症的方法,所述病症包括例如心脏病症或疾病、肌肉骨骼病症或疾病、癌症相关肌无力、恶性高热和糖尿病。
技术研发人员:尤金·E·马尔坎托尼奥,梅特·乌赫勒·安比,杰罗姆·比内
受保护的技术使用者:阿姆果制药有限公司
技术研发日:
技术公布日:2024/3/24
- 还没有人留言评论。精彩留言会获得点赞!