BMS-303141用于制备抗革兰氏阳性细菌感染药物中的应用
本发明属于医药,尤其涉及bms-303141用于制备抗革兰氏阳性细菌感染药物中的应用。
背景技术:
1、金黄色葡萄球菌、粪肠球菌和屎肠球菌等革兰氏阳性菌是社区感染和院内感染的常见的病原菌。其中金黄色葡萄球菌能产生血浆凝固酶,又称为血浆凝固酶阳性葡萄球菌,也是致病性最强的葡萄球菌之一。据2020年全国耐药监测报告显示,革兰阳性菌分离率排在首位的是:金葡萄(占革兰阳性菌32.6%),紧随其后的是屎肠球菌、粪肠球菌、表葡菌和肺炎链球菌等。金黄色葡萄球菌作为临床分离常见的病原菌,可引起多种临床感染,从轻微的皮肤感染,骨关节炎、感染性心内膜炎,假体装置感染,甚至到严重致命的组织感染和败血症,威胁着大众的健康。临床上根据金黄色葡萄球菌对甲氧西林的敏感性分为甲氧西林敏感金黄色葡萄球菌(mssa)以及耐甲氧西林金黄色葡萄球菌(mssa)两大类。2015年版《多重耐药菌医院感染预防与控制中国专家共识》提到,mrsa感染宜选的药物有糖肽类抗生素,如万古霉素、去甲万古霉素、替考拉宁,备选的药物还有达托霉素、利奈唑胺和替加环素等。尽管目前抗革兰氏阳性菌可选的抗菌药物较多,但是近年来,由于抗生素的广泛应用以及新型抗菌药物的研发过程漫长艰难,耐药菌株日益增多,尤其是mrsa已成为感染的重要致病菌之一。据报道,美国mrsa造成的死亡率仍然是任何抗生素耐药性病原体中最高的,2018年约为20,000人,2020年我国mrsa的全国平均检出率为29.4%。虽然抗生素可通过抑制/杀死细菌控制感染,但是,也导致获得突变的耐药菌株存活并传播,耐药细菌传播速度远超过了新抗菌药物的研发速度,一旦细菌对顶级抗生素产生耐药性,会给临床上治疗感染带来了更严峻挑战。传统的抗生素的作用是杀菌和抑菌,主要机制是通过影响细胞壁合成、阻止细菌dna复制、抑制生长所需的蛋白质等控制细菌生长。所以开发新靶点、具有广谱抗菌活性的抗菌药物可为临床治疗上提供更多的选择,也有利于抗菌药物的进一步开发。
2、除特异性抗生素耐药性外,生物膜形成的非特异性抗生素耐药性在许多与生物膜相关的金黄色葡萄球菌感染中也发挥作用。生物被膜形成是影响革兰阳性细菌抗感染疗效的难点问题之一。细菌生物被膜是一种具有独特三维立体结构的细菌聚集群,其由细菌及细菌分泌的多糖、纤维蛋白、脂蛋白等构成,一旦生物被膜形成,被膜里的细菌的生长代谢方式明显不同于浮游菌,被膜能够有效地阻止抗菌药物的扩散与渗透,从而使得细菌逃避抗菌药物的杀伤。此外,生物被膜内含大量持留菌,持留菌是具有耐药表型的小亚群,表现为临时的休眠或低代谢状态,也可耐受抗菌药物压力。细菌耐药、持留菌和生物被膜形成均可导致革兰阳性细菌(包括金黄色葡萄球菌、粪肠球菌、屎肠球菌等)感染持续时间延长,是感染治疗失败的重要因素,最终导致患者死亡风险升高。
3、当前临床使用的一线抗生素往往难以具备杀灭持留菌活性和清除细菌生物被膜双重活性,因此针对革兰阳性细菌开发新型抗菌药物,既能克服细菌耐药,又能强效杀灭持留菌和抑制生物被膜形成成为研究重难点。
技术实现思路
1、针对以上技术问题,本发明公开了bms-303141用于制备抗革兰氏阳性细菌感染药物中的应用,bms-303141具有高效的抗革兰氏阳性细菌生长和抗生物被膜的活性,并且可能靶向某些关键蛋白发挥抗菌活性。
2、对此,本发明采用的技术方案为:
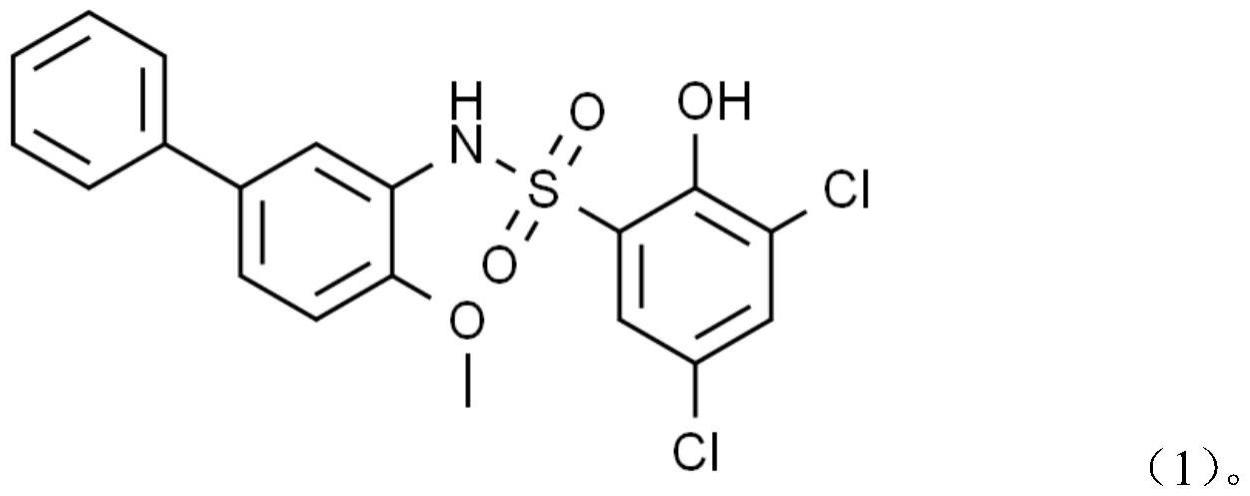
3、bms-303141用于制备抗革兰氏阳性细菌感染药物中的应用,所述bms-303141,cas编号为943962-47-8;所述bms-303141具有抑制革兰氏阳性菌的生长和生物被膜形成的作用。
4、其中,所述bms-303141的结构式如式(1)所示:
5、
6、bms-303141,其英文全称为:
7、3,5-dichloro-2-hydroxy-n-(4-methoxy[1,1'-biphenyl]-3-yl)-benzenesulfonamide,它是一种高效性和可渗透细胞的atp-柠檬酸裂解酶(atp-citratelyase,acl)抑制剂,ic50值为0.13μm。研究发现在hepg 2的细胞实验中,在没有产生细胞毒性的情况下,bms-303141抑制总脂合成的ic50为8μm。在小鼠的药代动力学模型中,bms-303141的口服生物利用度为55%,但半衰期相对较短,为2.1h;因此在james j.li研究中采用了将bms-303141掺入食物中的方法,在高脂肪喂养的小鼠中长期口服10mg/kg和100mg/kg bms-303141降低了血浆胆固醇、甘油三酯和葡萄糖,并抑制了体重增加。研究还发现在lps诱导的腹膜炎模型中,bms-303141治疗组小鼠,腹膜和血清中il-6和il-12p70的表达水平下降。这表明bms-303141能够改变局部和全身的炎症谱系。用bms-303141抑制acl,可消除cpg处理的巨噬细胞增强的肿瘤细胞吞噬功能。但是,至今未见bms-303141化合物在抗菌方面上的报道。
8、经过大量的实验研究,化合物bms-303141对多株金黄色葡萄球菌(mic:12.5μm)、表葡菌(mic:3.125-12.5μm)和粪肠球菌(mic:12.5-25μm)均具有较好的抑菌活性(表1);bms-303141在1×mic能够完全抑制金黄色葡萄球菌和粪肠球菌的生长,甚至有的在1/2×mic浓度下也可以抑制金黄色葡萄球菌和粪肠球菌的生长,并且能够显著抑制生物被膜的形成。同时与公认的常用抗生素对比,bms-303141对金黄色葡萄球菌及粪肠球菌具有较好的杀菌效果。
9、作为本发明的进一步改进,所述革兰氏阳性细菌为金黄色葡萄球菌、粪肠球菌、屎肠球菌、表皮葡萄球菌或肺炎链球菌中的至少一种。
10、作为本发明的进一步改进,所述bms-303141在处理体系中的浓度为不小于3.125μm(1.33μg/ml)。
11、作为本发明的进一步改进,所述药物为药物组合物或制剂。进一步的,所述药物为注射剂、片剂、丸剂、胶囊、悬浮剂、颗粒剂、喷剂或乳剂。
12、本发明还公开了bms-3031413用于制备抑制革兰氏阳性菌的涂料中的应用,所述涂料用于医疗器械的表面,所述bms-3031413的cas编号为943962-47-8,结构式如式(1)所示;所述bms-3031413具有抑制革兰氏阳性菌的生长和生物被膜形成的作用。
13、作为本发明的进一步改进,所述涂料中,所述bms-3031413的浓度为不小于3.125μm。
14、本发明还公开了bms-303141用于制备抗革兰氏阳性菌抗菌剂的应用,所述bms-303141的cas编号为943962-47-8,,结构式如式(1)所示;所述bms-303141具有抑制革兰氏阳性菌的生长和生物被膜形成的作用。
15、与现有技术相比,本发明的有益效果为:
16、本发明的技术方案公开了bms-303141的医药新用途,bms-303141对革兰氏阳性细菌具有强效抑制作用,可以抑制如金黄色葡萄球菌、粪肠球菌、表皮葡萄球菌等细菌的生长和生物被膜的形成,而且表现出一定的杀革兰氏阳性细菌中金黄色葡萄球菌和粪肠球菌的活性。其中化合物bms-303141对多株金黄色葡萄球菌(mic:12.5μm)、表葡菌(mic:3.125-12.5μm)和粪肠球菌(mic:12.5-25μm)均具有较好的抑菌活性;bms-303141在1×mic能够完全抑制金黄色葡萄球菌和粪肠球菌的生长,甚至有的在1/2×mic浓度下也可以抑制金黄色葡萄球菌和粪肠球菌的生长,并且能够显著抑制生物被膜的形成;同时,与公认的抗生素万古霉素和利奈唑胺对比,bms-303141对金黄色葡萄球菌及粪肠球菌具有更好的杀菌效果。在sa113菌株中,4×mic bms-303141杀菌效果与8×mic van相当,优于8×mic lzd;在yusa145中,8×mic bms-303141效果最佳,优于8×mic van和8×mic lzd;在ef16c166和16c51中,4×mic和8×mic bms-303141杀菌效果均优于8×mic van和8×mic lzd。体外毒性实验显示,bms-303141具有良好的安全性,不会造成溶血;而且在作用浓度对293t、huh7细胞没有毒性(图6-7)。经bms-303141处理三株金葡菌的差异蛋白分析,在上调和下调的蛋白中(图8仅列出三株菌共有的),chs101、sa113、yusa145三株金葡中均上调的基因有saouhsc_02658、saouhsc_02630、saouhsc_02629、sced、saouhsc_02373,均下调的基因有lip2、adh、sbi、saouhsc_02241和hld。综合来看,bms-303141具有克服耐甲氧西林金黄色葡萄球菌(mrsa)耐药问题的潜能(对16株mrsa和11株mssa的mic均为12.5μm),并能杀灭持留菌及抑制或清除生物被膜,有望开发成为高效、广谱的新型抗菌剂。
- 还没有人留言评论。精彩留言会获得点赞!