一种奈玛特韦利托那韦复方制剂及其制备方法与流程
本发明属于药物制剂领域,具体的涉及一种奈玛特韦利托那韦复方制剂及其制备方法。
背景技术:
1、新型冠状病毒感染,根据世界卫生组织统计数据,截至2022年2月15日,全球累计感染人数超过4亿人,死亡人数接近600万人。尤其是奥密克戎变异株已成为全球主要流行毒株,造成现有疫苗和抗体药物的疗效大幅下降。奈玛特韦片/利托那韦片组合包装(paxlovid)是辉瑞研发的一种口服用于治疗新冠病毒感染的新型复方抗病毒药物。其中奈玛特韦(nirmatrelvir,150mg)是其抗病毒的主要药物,是一种新冠病毒的3clpro蛋白酶的拟肽类抑制剂(3clpro蛋白酶是在冠状病毒复制过程中水解rna编码的多聚前体蛋白产生功能蛋白的关键蛋白酶,奈玛特韦通过抑制3clpro蛋白酶,可以阻止sars-cov-2冠状病毒复制),主要是通过cyp3a4酶进行代谢。利托那韦(ritonavir,100mg)对新冠病毒没有直接作用,但利托那韦是cyp3a4(细胞色素p4503a4酶)抑制剂。可以通过抑制cyp3a4介导的奈玛特韦代谢,从而升高奈玛特韦的血药浓度。paxlovid联合了两种药物,在临床研究中表现优秀,使新冠病毒感染患者的住院或死亡风险降低89%,同时具有不易耐药、对变异株有效等优势,被认为是改变目前疫情防控策略的治疗方法。
2、有调查显示我国老年人群吞咽困难的发病率为13.9%(一般社区)和26.4%(养护机构),而上市的paxlovid尺寸大、用药数量多,不便于患者特别是老年人及吞咽困难者使用。同时,新型冠状病毒感染具有低龄化趋势,目前缺乏儿童适宜的剂型。
3、奈玛特韦利托那韦制剂是奈玛特韦与利托那韦的复方制剂,设计的复方制剂为主药固定配比、单剂量包装的复方制剂,剂型包括颗粒剂、干混悬剂、散剂等,更适宜儿童、老年及吞咽困难患者服用,可有效避免患者用药不便,出现漏服、误服的用药安全性风险。
技术实现思路
1、针对现有技术的不足,本发明提供一种奈玛特韦利托那韦复方制剂,包括以下组分:奈玛特韦、利托那韦、矫味剂和包衣剂。
2、优选地,所述制剂包括以下组分:奈玛特韦、利托那韦、矫味剂、包衣剂、填充剂、粘合剂、载体聚合物、表面活性剂和助流剂。
3、优选地,所述制剂按重量份数计由50份~300份的奈玛特韦、100份利托那韦、800~1300份的填充剂、30~80份的粘合剂、0~75份的助悬剂、20~100的矫味剂、50~500份的包衣剂、420~600份的载体聚合物、60~90份的表面活性剂和5~15份的助流剂组成。
4、优选地,奈玛特韦利托那韦复方制剂,按重量份数计由100份~300份的奈玛特韦、100份的利托那韦、881~1188份的填充剂、30~75份的粘合剂、0~75份的助悬剂、20~95的矫味剂、188~300份的包衣剂、450~500份的载体聚合物、70~80份的表面活性剂和7~10份的助流剂组成
5、优选地,奈玛特韦利托那韦复方制剂包括颗粒剂、干混悬剂或散剂。
6、优选地,所述填充剂选自乳糖、甘露醇、微晶纤维素、预胶化淀粉、无水磷酸氢钙中的一种或多种。
7、优选地,所述矫味剂选自三氯蔗糖、糖精钠、阿司帕坦、安赛蜜、赤藓糖醇中的一种或多种。
8、优选地,所述助悬剂选自黄原胶或阿拉伯胶,优选为黄原胶。
9、优选地,所述包衣剂选自甲基丙烯酸烷胺酯共聚物、甲基丙烯酸和丙烯酸乙酯共聚物、甲基丙烯酸甲酯和二乙氨乙基甲基丙烯酸酯共聚物、十二烷基硫酸钠、硬脂酸和硬脂酸镁中的一种或多种,优选为甲基丙烯酸烷胺酯共聚物、十二烷基硫酸钠、硬脂酸和硬脂酸镁的混合物。
10、优选地,所述粘合剂选自聚乙烯吡咯烷酮、羟丙基纤维素、羟丙甲纤维素、甲基纤维素、羧甲基纤维素钠中的一种或多种。
11、优选地,所述载体聚合物选自共聚维酮、聚维酮、羟丙基纤维素中的一种或多种。
12、优选地,所述表面活性剂选自共吐温80、月桂山梨坦或十二烷基硫酸钠一种或多种,优选为月桂山梨坦。
13、优选地,所述助流剂选自胶态二氧化硅、滑石粉中的一种或多种,优选为胶态二氧化硅。
14、优选地,所述的奈玛特韦原料粒径d90小于50μm,更优选为奈玛特韦原料粒径d90小于30μm。
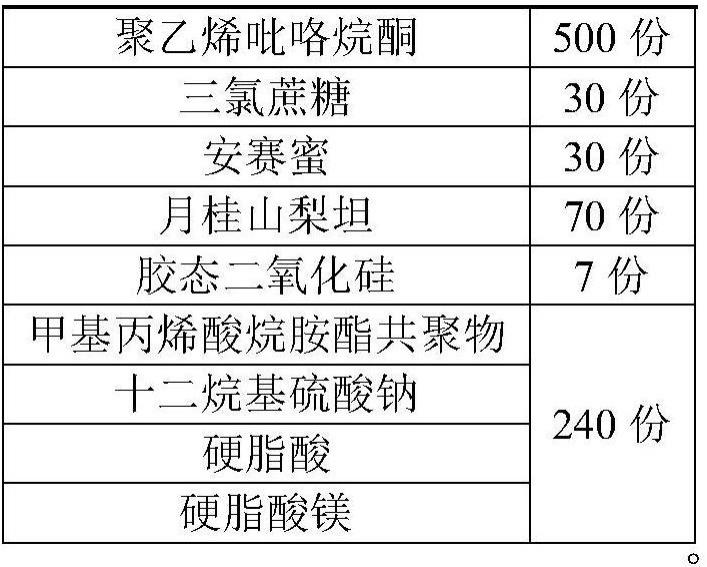
15、优选地,所述奈玛特韦利托那韦复方制剂按重量份数计由以下成分组成:
16、
17、
18、优选地,所述奈玛特韦利托那韦复方制剂按重量份数计由以下成分组成:
19、
20、优选地,所述奈玛特韦利托那韦复方制剂按重量份数计由以下成分组成:
21、
22、优选地,所述奈玛特韦利托那韦复方制剂按重量份数计由以下成分组成:
23、
24、
25、优选地,所述奈玛特韦利托那韦复方制剂按重量份数计由以下成分组成:
26、
27、另一方面,本发明提供了所述奈玛特韦利托那韦复方制剂的制备方法,包括以下步骤:
28、(1)利托那韦、载体共聚物、助流剂混合过筛得到混合物料;
29、(2)混合物料、表面活性剂加入到热熔挤出机中;挤出后的熔体冷却、粉碎;
30、(3)粉碎后的物料与填充剂混合,过干法制粒机进行制粒;
31、(4)奈玛特韦、填充剂、粘合剂和矫味剂过筛并混合;
32、(5)将(4)步骤得到的混合物料与(3)步骤得到的颗粒混合或者湿法制粒;
33、(6)包衣液的配制:配制固含量约为15%的包衣液,取85%的纯化水,按制剂处方中包衣液总量加入本领域常规用量的成膜材料、其他包衣剂组成,高速进行搅拌,过24目筛备用;
34、(7)采用流化床进行包衣,进风温度范围为30℃~50℃,物料温度范围为30℃~45℃;干燥温度为30℃~50℃,水分控制在0.5%~5%,得奈玛特韦利托那韦复方制剂。
35、本发明的有益效果:本发明提供一种奈玛特韦利托那韦复方制剂;该剂型包括颗粒剂、干混悬剂、散剂等;奈玛特韦制剂采用掩味技术并进行包衣。奈玛特韦利托那韦复方制剂生物利用度高、稳定性好、口感好,提高了患者特别是儿童、老人、吞咽困难病人的安全性、顺应性、便利性。
技术特征:
1.一种奈玛特韦利托那韦复方制剂,包括以下组分:奈玛特韦、利托那韦、矫味剂和包衣剂。
2.根据权利要求1所述的奈玛特韦利托那韦复方制剂,其特征在于,所述制剂包括以下组分:奈玛特韦、利托那韦、矫味剂、包衣剂、填充剂、粘合剂、载体聚合物、表面活性剂和助流剂。
3.根据权利要求1所述的奈玛特韦利托那韦复方制剂,其特征在于,所述制剂按重量份数计由50份~300份的奈玛特韦、100份利托那韦、800~1300份的填充剂、30~80份的粘合剂、0~75份的助悬剂、20~100的矫味剂、50~500份的包衣剂、420~600份的载体聚合物、60~90份的表面活性剂和5~15份的助流剂组成;优选地,所述制剂按重量份数计由100份~300份的奈玛特韦、100份的利托那韦、881~1188份的填充剂、30~75份的粘合剂、0~75份的助悬剂、20~95的矫味剂、188~300份的包衣剂、450~500份的载体聚合物、70~80份的表面活性剂和7~10份的助流剂组成;优选地,所述奈玛特韦利托那韦复方制剂剂型包括颗粒剂、干混悬剂或散剂;优选地,所述的奈玛特韦原料粒径d90小于50μm,优选为奈玛特韦原料粒径d90小于30μm。
4.根据权利要求1所述的奈玛特韦利托那韦复方制剂,其特征在于,所述填充剂选自乳糖、甘露醇、微晶纤维素、预胶化淀粉、无水磷酸氢钙中的一种或多种;优选地,所述矫味剂选自三氯蔗糖、糖精钠、阿司帕坦、安赛蜜、赤藓糖醇中的一种或多种;优选地,所述助悬剂选自黄原胶或阿拉伯胶,优选为黄原胶;优选地,所述包衣剂选自甲基丙烯酸烷胺酯共聚物、甲基丙烯酸和丙烯酸乙酯共聚物、甲基丙烯酸甲酯和二乙氨乙基甲基丙烯酸酯共聚物、十二烷基硫酸钠、硬脂酸和硬脂酸镁中的一种或多种,优选为甲基丙烯酸烷胺酯共聚物、十二烷基硫酸钠、硬脂酸和硬脂酸镁的混合物;优选地,所述粘合剂选自聚乙烯吡咯烷酮、羟丙基纤维素、羟丙甲纤维素、甲基纤维素、羧甲基纤维素钠中的一种或多种;优选地,所述载体聚合物选自共聚维酮、聚维酮、羟丙基纤维素中的一种或多种;优选地,所述表面活性剂选自共吐温80、月桂山梨坦或十二烷基硫酸钠一种或多种,优选为月桂山梨坦;优选地,所述助流剂选自胶态二氧化硅、滑石粉中的一种或多种,优选为胶态二氧化硅。
5.根据权利要求1所述的奈玛特韦利托那韦复方制剂,其特征在于,所述奈玛特韦利托那韦复方制剂按重量份数计由以下成分组成:
6.根据权利要求1所述的奈玛特韦利托那韦复方制剂,其特征在于,所述奈玛特韦利托那韦复方制剂按重量份数计由以下成分组成:
7.根据权利要求1所述的奈玛特韦利托那韦复方制剂,其特征在于,所述奈玛特韦利托那韦复方制剂按重量份数计由以下成分组成:
8.根据权利要求1所述的奈玛特韦利托那韦复方制剂,其特征在于,所述奈玛特韦利托那韦复方制剂按重量份数计由以下成分组成:
9.根据权利要求1所述的奈玛特韦利托那韦复方制剂,其特征在于,所述奈玛特韦利托那韦复方制剂按重量份数计由以下成分组成:
10.权利要求1所述奈玛特韦利托那韦复方制剂的制备方法,包括以下步骤:
技术总结
本发明提供了一种奈玛特韦利托那韦复方制剂及其制备方法,所述的奈玛特韦和利托那韦的一种复方制剂,剂型包括颗粒剂、干混悬剂、散剂等。复方制剂组分包括填充剂、矫味剂、粘合剂、载体聚合物、表面活性剂、助流剂、包衣剂等。本发明提供的奈玛特韦利托那韦复方制剂生物利用度高、稳定性好,同时口感好,提高了患者特别是儿童、老人、吞咽困难病人的安全性、顺应性、便利性。
技术研发人员:何广卫,苏峰,李颖,湛常娟,刘为中
受保护的技术使用者:合肥医工医药股份有限公司
技术研发日:
技术公布日:2024/1/13
- 还没有人留言评论。精彩留言会获得点赞!