抗前肌生成抑制蛋白/潜伏性肌生成抑制蛋白抗体用于治疗脊髓性肌萎缩的用途的制作方法
本披露涉及治疗人患者的脊髓性肌萎缩(sma)的治疗方法、用途、和包含抗前肌生成抑制蛋白/潜伏性肌生成抑制蛋白(pro/latent myostatin)抗体的组合物。
背景技术:
1、肌生成抑制蛋白(也称为生长分化因子8,缩写为gdf-8或gdf8)是肌肉稳态的调节剂。导致肌生成抑制蛋白损失的突变,以及肌生成抑制蛋白活性的药理学抑制,已经证明在包括人在内的许多物种中增加肌肉生长。在过去的15年里,至少有15种不同的肌生成抑制蛋白抑制剂候选药物(包括小分子和生物制品)已经在人患者中进行了评估,旨在治疗各种肌肉障碍,但迄今为止没有一个在临床上取得成功(hanna等人(2019)lancet neurol.[柳叶刀神经病学]18(9):834-844;rooks等人(2020)jama netw open.[jama网络开放]3(10):e2020836)。虽然许多候选药物能够在临床前模型中显示出疗效(例如,增加肌肉质量),但迄今为止没有成功地将该疗效转化为实现治疗人患者的肌肉障碍的临床益处。此外,这些抑制剂中的大多数缺乏选择性,因此会拮抗其他相关的生长因子(如活化素a),引起毒性问题。这些项目中的大多数现已停止。因此,在许多情况下,令人满意的临床前结果并未成功转化为安全有效的药物。
2、作为治疗肌肉疾病,尤其是sma的唯一靶标,肌生成抑制蛋白抑制受到了一定程度的怀疑。例如,已经提出sma患者的肌生成抑制蛋白表达降低,这表明肌生成抑制蛋白可能不是有效的治疗靶标(burch等人(2017)j neurol.[神经病学杂志]264(3):541-553;mariot等人(2017)nat commun.[自然通讯]8(1):1859)。latres等人(2017年4月)表明活化素a(而非肌生成抑制蛋白)是灵长类动物肌肉质量的主要调节剂,表明活化素a将是更好的治疗靶标。事实上,同一组尽管拥有肌生成抑制蛋白选择性抑制剂,但还是选择在ibm中使用肌生成抑制蛋白选择性抑制剂和活化素a抑制剂的组合进入临床。该项目后来停止了。
3、sma是罕见的常染色体隐性神经肌肉疾病,其特征在于脊髓前角的运动神经元退化,导致四肢和躯干的随意肌萎缩。sma直接由运动神经元存活(smn)蛋白水平降低引起,该蛋白水平降低是由染色体5q13.2上运动神经元存活1(smn1)基因内的纯合性缺失和不经常地突变引起的。smn蛋白的缺乏导致运动神经元功能失调,并最终导致死亡。
4、在一些国家,(努辛生(nusinersen))被批准用于治疗小儿和成人sma患者,并且(onasemnogene abeparvovec-xioi)被批准用于治疗具有smn1基因中双等位突变的2岁以下sma小儿患者。evrysditm(利司扑兰(risdiplam))(小分子smn疗法)也已在美国和欧洲获得批准。努辛生是smn2定向反义寡核苷酸(aso),其旨在治疗由导致smn蛋白缺陷的突变引起的sma。利司扑兰以类似的方式起作用,并且其是哒嗪衍生物,该哒嗪衍生物修饰smn2信使rna的剪接。onasemnogene abeparvovec-xioi是基于重组腺相关病毒载体9的基因疗法,其旨在递送编码人smn蛋白的基因的拷贝。
5、smn疗法(或smn定向疗法),如努辛生、利司扑兰、onasemnogene abeparvovec-xioi、以及其他正在开发的产品,主要作用于运动神经元以防止进一步丧失。与此观点一致,由扩展的smn定向疗法报告的临床数据表明,在用努辛生治疗的前15个月改善后,按hfmse评分相对于基线的平均变化衡量,其效果似乎趋于平稳,接近稳定状态。在接下来的三年或更长时间内观察到运动功能的有限的进一步增强(darras等人(2019)neurology[神经病学]92(21):e2492-e2506)。类似地,对利司扑兰的长期评估显示,12个月后主要和次要终点的情况仅有稳定化或轻微/可变的改善(oskoui等人“sunfish part 2:24-monthefficacy and safety of risdiplam in patients with type 2or non-ambulant type3spinal muscular atrophy(sma).[sunfish第2部分:利司扑兰在2型或非可走动型3型脊髓性肌萎缩(sma)患者中的24个月疗效和安全性]”发表于mda clinical and scientificconference 2021[2021年mda临床和科学会议];3月15日至18日.展板80)。因此,smn定向疗法可能有助于长期维持运动功能,但可能对运动功能提供的长期增强有限。因此,虽然已获批准的治疗显示年轻的sma患者的运动功能有所改善,特别是在治疗的早期阶段,但它们并没有直接作用于肌肉来主要解决患有症状性sma的患者已经存在的萎缩和运动功能性损伤。
6、本披露的申请人先前在选择肌生成抑制蛋白抑制可能特别有利的适应症时确定了至少三个标准:i)靶肌肉是合成代谢活跃的(例如,仍处于生长期);ii)运动单元(运动神经元和支配的靶肌肉)至少部分功能完好;以及,iii)靶肌肉最好依赖于快缩(ii型)纤维(参见wo 2017/218592)。基于这种认识,申请人在sma的临床前模型中证实了肌生成抑制蛋白的选择性抑制的治疗效果,其中通过同时进行的smn增强疗法(例如,smn上调剂/校正剂疗法)增强了运动单元功能,这解决了上述准则(ii),支持了以下观点:肌肉增强剂(如肌生成抑制蛋白抑制剂)可用于补充运动神经元增强剂(如smn上调剂/校正剂)的效果。
7、目前尚无经批准的肌肉定向疗法(例如,肌肉增强疗法)用于sma的治疗。因此,仍然需要可以解决sma患者的肌肉萎缩和运动功能性损伤的有效的肌肉定向疗法。
技术实现思路
1、本披露尤其包括使用肌肉增强剂(如阿匹格单抗(apitegromab),也称为srk-015)用于治疗sma患者的治疗方法、用途、和组合物。在不同实施例中,阿匹格单抗或包含阿匹格单抗的组合物用于在人受试者中作为单一疗法或作为运动神经元定向疗法的辅助剂(如smn上调剂/校正剂疗法(即smn疗法))治疗迟发性sma。本文提供的数据代表了通过选择性抑制肌生成抑制蛋白改善人患者运动功能的首次临床证明。因此,本披露涵盖sma患者或患者群体的鉴定和选择,其有可能对如本文所述的阿匹格单抗疗法有响应,或者否则将受益于如本文所述的阿匹格单抗疗法。接受阿匹格单抗疗法12个月的患有2型和3型sma的患者的数据表明,无论背景疗法(例如,smn上调剂/校正剂疗法)的持续时间(或接受的剂量数)如何,年轻患者群体的总体响应更强烈。这与我们先前的假说是一致的,即靶肌肉的合成代谢能力可能是决定对肌生成抑制蛋白抑制的反应性的重要因素(us 10,946,036,其内容以其全文并入本文)。
2、本文提供了用于治疗患有sma的受试者的阿匹格单抗疗法。根据本披露,包含阿匹格单抗的组合物用于在人患者中治疗迟发性sma。阿匹格单抗疗法包括以治疗剂量向患者静脉内施用组合物。治疗剂量是指对患者产生临床益处的阿匹格单抗的量。临床益处(例如,疗效)可以通过合适的临床终点(如本文所述的那些)来测量或评估。根据本文提供的数据,在一些实施例中,当每4周(即,q4w)或每月给药时,治疗剂量是大于2mg/kg并高达20mg/kg的阿匹格单抗。在一些实施例中,可以考虑小于20mg/kg(如5mg/kg、7.5mg/kg、10mg/kg、12mg/kg和15mg/kg)的治疗剂量。在一些实施例中,治疗剂量是10mg/kg。在一些实施例中,治疗剂量是20mg/kg。在一些实施例中,每4周一次(即,q4w)或每月一次施用时,治疗剂量是10mg/kg。在一些实施例中,每4周一次(即,q4w)或每月一次施用时,治疗剂量是20mg/kg。在不同实施例中,阿匹格单抗疗法可以改善患有迟发性sma的患者的运动功能。
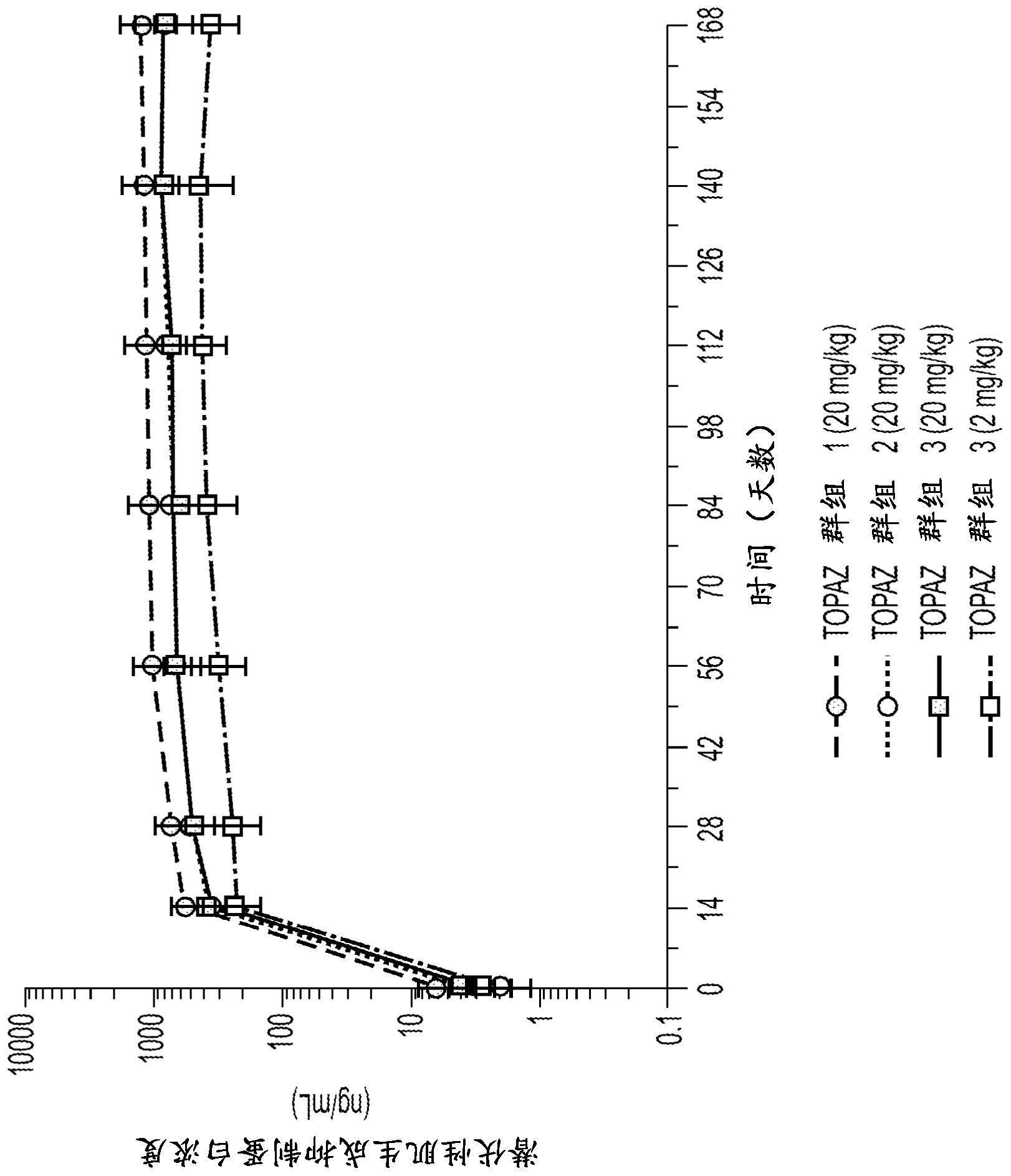
3、药代动力学(pk)分析提供了治疗剂的剂量(例如,治疗剂量)和生物利用度(血清暴露)之间的关系。在一些实施例中,治疗剂量是在稳定状态下在波谷(c波谷)测量阿匹格单抗的血清浓度时,达到或产生约25与250μg/ml之间的血清阿匹格单抗暴露的剂量。实现该结果的剂量可以通过任何合适的途径(例如,静脉内或皮下)施用。
4、在一些实施例中,治疗剂量是在施用(给药)的约两小时内,当在峰值(cmax)处测量阿匹格单抗的血清浓度时,达到或产生高达约1100μg/ml的血清暴露(例如,约25与1100μg/ml之间)的剂量。实现该结果的剂量可以通过任何合适的途径(例如,静脉内或皮下)施用。
5、药效动力学(pd)分析允许如通过潜伏性肌生成抑制蛋白(lm)的血清浓度测量来评估靶标接合。在一些实施例中,治疗剂量是优选地在稳定状态下(例如,施用阿匹格单抗后14天或更晚),达到或产生至少约100或优选地至少约250ng/ml的潜伏性肌生成抑制蛋白的血清浓度的剂量。实现该结果的剂量可以通过任何合适的途径(例如,静脉内或皮下)施用。例如,潜伏性肌生成抑制蛋白的血清浓度可以是约250ng/ml或以上、400ng/ml或550ng/ml以上或700ng/ml以上或950ng/ml以上或1100ng/ml以上等。
6、阿匹格单抗或另一个选择性肌生成抑制蛋白抑制剂可以单独(例如,单一疗法)或与另一个疗法(如smn定向疗法)结合(例如,附加/辅助疗法或组合疗法)用于治疗sma。在一些实施例中,用smn上调剂疗法治疗受试者。在一些实施例中,smn上调剂疗法是努辛生利司扑兰和/或onasemnogene abeparvovec-xioi在一些实施例中,smn调节剂疗法是努辛生。在一些实施例中,smn调节剂疗法是利司扑兰。在一些实施例中,smn调节剂疗法是onasemnogene abeparvovec-xioi。在一些实施例中,受试者在5岁或之后开始smn上调剂疗法。
7、在一些实施例中,smn定向疗法和阿匹格单抗疗法(例如,肌肉定向疗法)作为组合疗法使用。因此,smn校正剂和阿匹格单抗可用于在患者中治疗迟发性sma,其中该治疗包括以足以治疗sma的量施用smn校正剂和阿匹格单抗,其中阿匹格单抗疗法以大于2mg/kg并高达20mg/kg的量每4周或每月向静脉内施用至患者。在一些实施例中,smn校正剂是smn1定向基因疗法,其中任选地该smn1定向疗法是基因疗法。在一些实施例中,smn校正剂是smn2定向疗法,其中任选地该smn2定向疗法是剪接修饰剂。在一些实施例中,smn校正剂可以口服、鞘内或静脉内施用。在一些实施例中,患者患有迟发性sma。在一些实施例中,患者患有2型sma。在一些实施例中,患者患有非可走动3型sma。在一些实施例中,患者患有可走动3型sma。在一些实施例中,患者具有smn2基因的2个拷贝。在一些实施例中,患者具有smn2基因的3个拷贝。在一些实施例中,患者具有smn2基因的4个拷贝。在一些实施例中,患者具有smn2基因的5个拷贝。在一些实施例中,患者具有smn2基因的6个拷贝。在一些实施例中,患者在5岁之前开始组合疗法。在一些实施例中,患者在2岁之前开始组合疗法。在一些实施例中,患者在年龄为六周之前开始组合疗法。在一些实施例中,患者在5岁或更大时开始组合疗法。在一些实施例中,通过遗传筛选诊断出患者患有sma(例如,鉴定为smn1突变的携带者),其中任选地例如该遗传筛选是针对一个或多个smn1突变的新生儿筛选、子宫内筛选。在一些实施例中,患者在症状发生前。
8、在一些实施例中,阿匹格单抗疗法作为附加或辅助疗法用于治疗sma。因此,包含阿匹格单抗的组合物可用于在患者中治疗迟发性sma,其中该治疗包括静脉内施用包含治疗剂量的阿匹格单抗的组合物,其中该治疗剂量为每4周或每月大于2mg/kg并高达20mg/kg,并且其中用smn校正剂疗法治疗该患者。在一些实施例中,smn校正剂是smn1定向疗法,其中任选地该smn1定向疗法是基因疗法。在一些实施例中,smn校正剂是smn2定向疗法,其中任选地该smn2定向疗法是剪接修饰剂。在一些实施例中,smn校正剂中的任一种可以口服、鞘内或静脉内施用。在一些实施例中,患者患有2型sma。在一些实施例中,患者患有非可走动3型sma。在一些实施例中,患者患有可走动3型sma。在一些实施例中,患者具有smn2基因的2个拷贝。在一些实施例中,患者具有smn2基因的3个拷贝。在一些实施例中,患者具有smn2基因的4个拷贝。在一些实施例中,患者具有smn2基因的5个拷贝。在一些实施例中,患者具有smn2基因的6个拷贝。在一些实施例中,患者在5岁之前开始smn校正剂疗法。在一些实施例中,患者在5岁或更大时开始smn校正剂疗法。在一些实施例中,通过遗传筛选诊断出患者患有sma(例如,鉴定为smn1突变的载体),其中任选地例如该遗传筛选是新生儿筛选。在一些实施例中,患者在症状发生前。在一些实施例中,在阿匹格单抗疗法之前,用smn校正剂治疗患者。在一些实施例中,在接受smn校正剂疗法之前,用阿匹格单抗治疗患者。
9、可能受益于阿匹格单抗疗法的sma患者包括满足以下标准中的一个或多个的患者:在接受针对sma的疗法之前,具有5qsma和迟发性(和/或2型或3型)sma的记录诊断;根据who运动里程碑定义能独立坐的非可走动受试者;无需辅助即可在30秒或更短时间内独立走动超过10米的可走动受试者;具有修订的汉默史密斯量表(revised hammersmithscale)评分小于或等于63和/或汉默史密斯功能运动扩展量表(hammersmith functionalmotor scale expanded)评分为10或更高的受试者;未在治疗前两周内使用正压气管切开术或每天使用慢性日间无创通气支持大于16小时的受试者;在治疗前两周内未患任何干扰受试者健康的急性或共存病症的受试者;不具有严重脊柱侧弯或挛缩的受试者;和/或在60天内,除批准的smn定向疗法(例如,smn上调剂(也称为smn校正剂)疗法)外,未使用全身性皮质类固醇、丙戊酸、或具有潜在肌肉效应或神经肌肉效应的疗法的受试者。具有潜在肌肉效应或神经肌肉效应的疗法包括雄激素类、胰岛素样生长因子、生长激素、全身性β-激动剂、肉毒毒素、肌肉松弛剂、肌肉增强补充剂或乙酰胆碱酯酶抑制剂。在一些实施例中,患者在接受针对sma的疗法之前具有5q sma和迟发性(和/或2型或3型)sma的记录诊断,并且满足上表列出的另外的标准中的一个或多个。在不同实施例中,本文披露的方法包括例如根据本文披露的剂量或方案选择这样的患者或患者群体用于用阿匹格单抗治疗。
10、可能受益于阿匹格单抗疗法的sma患者包括满足以下标准中的一个或多个的患者:具有smn2基因的1、2、3或4个拷贝,并且根据世界卫生组织(who)运动发育量表,达到粗大运动里程碑中的一个或多个:1)无支撑坐直(例如,头直立至少10秒;不使用手臂或手来平衡);2)用手和膝盖爬行(例如,向同一个方向至少移动3次,并且肚子没有接触支撑表面);3)在帮助下站立(例如,使用双脚站立而不倚任何物体至少10秒);4)在帮助下行走(例如,扶着稳定的物体至少走5步);5)无支撑站立(例如,不接触人或物体站立至少10秒);以及,6)无支撑行走(例如,至少独立走5步)。
11、可能受益于阿匹格单抗疗法的sma患者包括满足以下标准中的一个或多个的患者:具有smn2基因的1、2、3或4个的拷贝,并且根据汉默史密斯功能运动扩展量表(hfmse),达到粗大运动里程碑中的一个或多个:1)颈部支撑(例如,俯卧时能抬头或支撑头部);2)翻身;3)以三脚架姿势坐(例如,坐着时用手支撑着自己);4)无支撑坐;5)有支撑站立;6)匍匐前进/爬行;7)拉至站位(例如,拉着站立并沿着家具缓慢行走);8)无支撑站立;9)独立走几步后跌倒;10)独立行走(例如,独立行走,无支撑行走);11)蹲下捡起物体(例如,玩具);12)行走/匍匐上下楼梯;13)跳;14)双脚交替上楼;15)单脚跳;16)双脚交替下楼。
12、在一些实施例中,用如本文披露的阿匹格单抗治疗的患者已经接受了smn疗法或正在用smn疗法(smn定向疗法),例如,smn上调剂(校正剂)疗法(如努辛生)治疗。在一些实施例中,患者在5岁之前开始smn上调剂(校正剂)疗法。在一些实施例中,患者在5岁或之后开始smn上调剂(校正剂)疗法。在一些实施例中,smn校正剂疗法是smn2上调剂疗法。在一些实施例中,smn校正剂疗法是smn1基因疗法。
13、在一些实施例中,患者以足以实现临床益处的治疗剂量接受阿匹格单抗疗法至少6个月(例如,6个月、12个月、或更长时间),该临床益处表征为运动功能改善、疾病稳定、或疾病进展延迟。
14、在一些实施例中,患者接受阿匹格单抗疗法可以得到运动功能的改善。运动功能改善可以对应于hfmse评分或rhs评分的增加。例如,患者在用阿匹格单抗(即,阿匹格单抗疗法)治疗6个月或12个月后,可能实现hfmse评分比基线增加至少1分、2分、3分、4分、5分或更多。在一些实施例中,在早期开始接受背景smn疗法的患者中,12个月的阿匹格单抗疗法可能使hfmse评分比基线增加3分或更多(例如,至少3分、至少5分、至少10分、高达约20分)。在一些实施例中,hfmse评分的改善是加和的,并且可能与背景疗法(例如,背景smn上调剂/校正剂疗法)具有协同作用。
15、在一些实施例中,接受阿匹格单抗疗法的患者可能疾病稳定。疾病稳定可以对应于hfmse评分或rhs评分较基线的净零变化(例如,至少无变化或增加)或近零变化。在一些实施例中,这是相比于未经治疗的患者群体(例如,天然病史)或用现有技术方法(例如,背景疗法)治疗的患者群体(其中预期运动功能逐渐下降)具有临床意义的结果。
16、在一些实施例中,接受阿匹格单抗疗法的患者可能疾病进展延迟。疾病进展延迟可以包括,例如,相比于合适对照(例如,表现出特定患者群体的天然病史的未经治疗的患者),hfmse评分随时间的降低速度较慢。在一些实施例中,延迟可以包括从可走动sma更晚过渡至非可走动sma。
17、在一些实施例中,相对于未接受阿匹格单抗的对照,阿匹格单抗能够提高患者群体的治疗应答率。
18、在任一实施例中,治疗有效量的阿匹格单抗在治疗十二个月后不会在患者中引起严重不良事件。
19、本披露至少部分基于以下发现:能够选择性抑制潜伏性肌生成抑制蛋白激活的抗前肌生成抑制蛋白/潜伏性肌生成抑制蛋白抗体可以改善患有sma的人患者(包括可以用或未用背景smn上调剂疗法(例如,努辛生)的sma患者)的肌肉功能,并且在一些情况下,在避免不良事件的同时,以在特定患者群体中通常无法预料或观察到的令人惊讶的程度进行改善(例如,与mercuri等人(2018)new england journal of medicine.[新英格兰医学杂志]378(7):625-635相比)。因此,本披露提供了用于在人受试者中治疗sma的方法、用途、和包含抗前肌生成抑制蛋白/潜伏性肌生成抑制蛋白抗体的组合物的各种实施例。此外,基于本文提供的证明选择性肌生成抑制蛋白抑制用于治疗神经肌肉疾病的临床益处的数据,本披露还涵盖也可以以类似方式使用其他选择性肌生成抑制蛋白抑制剂的概念。这些可能包括,例如,能够选择性抑制肌生成抑制蛋白的中和抗体(但不需要其他相关生长因子(如活化素a)),以及被工程化以优先结合肌生成抑制蛋白的配体陷阱。
20、在一些实施例中,大于2并高达20mg/kg的治疗有效量的阿匹格单抗在受试者中实现以下中的一项或多项:与对照中的下降相比保持运动功能、延迟疾病进展、延迟或防止可走动3型sma患者变为非可走动型、延迟或防止对呼吸辅助或干预的需要、降低与对照相比一个或多个运动功能评分的下降速率、和/或与基线相比在一个或多个运动功能评分中保持至少净零变化。在一些实施例中,该量是每4周或每月静脉内施用的大于2并高达20mg/kg的阿匹格单抗的剂量。在一些实施例中,在该患者群体中可以观察到相对于基线的平均下降,但大多数患者表现出疾病稳定(rhs没有变化或增加)。在一些实施例中,该患者群体的子集(例如,10%或更多,例如,15%或更多、20%更多)在用阿匹格单抗作为单一疗法治疗12个月后实现rhs增加3分或更多。
21、在一些实施例中,本披露提供了在人受试者中治疗sma的方法,该方法包括向该受试者施用包含阿匹格单抗的组合物和包含smn疗法(例如,smn上调剂)的组合物,其中通过静脉内输注,以大于2并高达20mg/kg的量,每4周或每月向该受试者施用阿匹格单抗至少6个月或12个月,该量足以产生汉默史密斯功能运动扩展量表(hfmse)评分相对于治疗前基线评分平均增加至少1分(例如,在至少14名受试者的群组中)。在一些实施例中,本披露提供了包含阿匹格单抗的组合物,该组合物用于在接受smn上调剂的人受试者中治疗sma中使用,其中通过静脉内输注,以大于2并高达20mg/kg的量,每4周或每月向该受试者施用阿匹格单抗至少6个月,该量足以产生hfmse评分相对于治疗前基线评分平均增加至少1分(例如,在至少14名受试者的群组中)。在一些实施例中,本披露提供了阿匹格单抗在制造组合物中的用途,该组合物用于在接受smn上调剂的人受试者中治疗sma,其中通过静脉内输注,以大于2mg/kg并高达20mg/kg的量(例如,10mg/kg或20mg/kg),每4周或每月向该受试者施用阿匹格单抗至少6个月,该量足以产生hfmse评分相对于治疗前基线评分平均增加至少1分(例如,在至少14名受试者的群组中)。
22、在一些实施例中,sma是迟发性sma。在一些实施例中,sma是2型sma。在一些实施例中,sma是非可走动3型sma。在一些实施例中,受试者为5岁至21岁。在一些实施例中,smn上调剂疗法是努辛生、利司扑兰、和/或onasemnogene abeparvovec。在一些实施例中,smn上调剂疗法是努辛生。在一些实施例中,足够量是大于2并高达20mg/kg,任选地约5、10、15、或20mg/kg的静脉内剂量。在一些实施例中,阿匹格单抗的治疗剂量足以使患者(例如,患者群体中的大多数(例如,超过50%,例如超过60%))的hfmse增加1分或更多分,和/或使患者(例如,患者群体中的至少20%(例如,至少25%))的hfmse增加3分或更多分。
23、在一些实施例中,sma是迟发性sma,其中该迟发性sma是2型sma,其中患者在早期(5岁之前)开始背景smn校正剂疗法。阿匹格单抗疗法在该患者群体中可实现显著的运动功能改善(例如,hfmse评分增加5分或更高)。在一些实施例中,患者在12个月的阿匹格单抗疗法后,hfmse比基线增加3+分、5+分、或10+分,其中该基线是在第一次施用阿匹格单抗之前或之时测量的。
24、在一些实施例中,基于who运动发展里程碑分类,受试者是在4-9个月大时没有获得无需帮助就能坐的能力的患者。在一些实施例中,受试者是在4-9个月大时具有无需帮助就能坐的能力的患者。在一些实施例中,受试者是在5-11个月大时没有获得无需帮助就能站立的能力的患者。在一些实施例中,受试者是在5-11个月大时具有无需帮助就能站立的能力的患者。在一些实施例中,受试者是在5-13个月大时没有获得用手和膝盖爬行的能力的患者。在一些实施例中,受试者是在5-13个月大时具有用手和膝盖爬行的能力的患者。在一些实施例中,受试者是在6-14个月大时没有获得无需帮助就能行走的能力的患者。在一些实施例中,受试者是在6-14个月大时具有无需帮助就能行走的能力的患者。在一些实施例中,受试者是在7-14个月大时没有获得独自站立的能力的患者。在一些实施例中,受试者是在7-14个月大时具有独自站立的能力的患者。在一些实施例中,受试者是在8-18个月大时没有获得独自行走的能力的患者。在一些实施例中,上述不能行走的患者中的任何一个也可以表征为患有2型sma或3型sma。在一些实施例中,上述能够行走(需要或无需帮助)的患者中的任何一个也可以表征为患有3型sma。在一些实施例中,受试者在5岁之前开始smn上调剂/校正剂疗法。在一些实施例中,受试者在5岁之后开始smn上调剂/校正剂疗法。在一些实施例中,根据who运动发展里程碑,用肌生成抑制蛋白抑制剂(例如,阿匹格单抗)治疗6-12个月后,上述患者中的任何一个可能获得一个或多个新里程碑。在一些实施例中,根据who运动发展里程碑,用肌生成抑制蛋白抑制剂(例如,阿匹格单抗)治疗6-12个月后,上述患者中的任何一个可能获得一个、两个、或三个新里程碑,例如,独立行走的能力、独立站立的能力、在帮助下站立的能力、用手和膝盖爬行的能力、和/或在帮助下行走的能力中的一种或多种。
25、在一些实施例中,使用阿匹格单抗治疗的目标患者群体包括在开始肌生成抑制蛋白抑制剂(例如,阿匹格单抗)疗法时年龄在12岁或更小的群体。在一些实施例中,目标患者群体包括2岁或更大的群体。在一些实施例中,目标患者群体包括2-12岁之间的群体。在一些实施例中,目标患者群体包括2-5岁之间的群体。
26、在一些实施例中,将阿匹格单抗作为单一疗法施用至sma患者,该患者不能接受smn上调剂疗法所需的鞘内注射(例如由于脊柱融合)或选择不接受治疗。
27、在一些实施例中,本披露提供了阿匹格单抗在制造用于在人受试者中治疗迟发性sma的药物组合物(例如,药物)中的用途。该药物旨在以超过2mg/kg并高达20mg/kg的阿匹格单抗的剂量每4周或每月向受试者施用,其中任选地该受试者在5岁前开始针对sma的运动神经元定向疗法,并且其中该运动神经元定向疗法增加smn1或smn2表达。制造方法可以包括提供细胞系,该细胞系包含一个或多个载体,这些载体具有阿匹格单抗免疫球蛋白多肽的重链和轻链的核酸序列,能够产生对应于阿匹格单抗或其抗原结合片段的重组抗体。此细胞系可用于在细胞培养物(如哺乳动物细胞培养物,例如,cho细胞)中产生阿匹格单抗。在一些实施例中,可采用大规模(例如,250l、1000l、2000l、3000、4000l等)生物反应器生产阿匹格单抗。然后可以从细胞培养物中纯化重组抗体分子,并将纯化的抗体配制成包含阿匹格单抗和一种或多种赋形剂的药物组合物。该方法典型地包括无菌过滤步骤。在一些实施例中,药物组合物是含有约50mg/ml阿匹格单抗的液体配制品,适用于静脉内施用。
28、在一些实施例中,阿匹格单抗包含在多剂量小瓶(如玻璃小瓶)中。在一些实施例中,含有阿匹格单抗的容器(如玻璃小瓶)是试剂盒的一部分。
- 还没有人留言评论。精彩留言会获得点赞!