干细胞在制备治疗脑白质病的制剂中的用途的制作方法
1.本发明属于医药技术领域,具体涉及干细胞在制备治疗脑白质病的制剂中的用途。
背景技术:
2.脑白质病是一组具体病因尚不明确的中枢神经系统脱髓鞘性疾病。细胞疗法是一种利用活性细胞对组织、器官进行修复的方法,用于细胞疗法的细胞主要有干细胞、成熟的功能细胞、本体细胞、异种细胞和转分化细胞,将干细胞体外定向分化为少突胶质前体细胞,并用于脑白质病的治疗,是相关领域技术人员的重点研究方向。少突胶质前体细胞(opcs)为中枢神经系统中少突胶质细胞的前体细胞,可在脑发育过程中增殖分化形成少突胶质细胞,后者在中枢神经系统中形成髓鞘,移植体外扩增培养的opcs给髓鞘再生带来了希望。
3.申请号为201310455895.3的专利提供了一种诱导神经干/祖细胞分化为少突胶质前体细胞的诱导培养基及其诱导方法和用途,该专利将人神经干/祖细胞经过预处理培养后,在诱导培养基的作用下分化为少突胶质前体细胞,其中诱导培养基的关键成分为bfgf、pdgf-aa及nt-3,按该专利所述方法制备得到的少突胶质前体细胞可应用于制备治疗神经系统损伤疾病的药物。细胞疗法一般都需要经过体内提取、体外活化培养、输入体内的过程,而细胞注射是将细胞输入患者体内的一种常用的方法,但在细胞注射的过程中存在一些缺陷,如细胞流失严重、细胞保留率低、有效细胞不足、细胞成活率不高,不仅浪费细胞源,而且影响注入体内的细胞的作用效果。申请号为202011505673.4的专利提供了一种细胞微载体基质及其应用,该专利以甲基丙烯酰化明胶为有效成分制备细胞微载体基质,并将细胞包裹其中,为细胞提供一个三维的支撑作用,避免细胞在注射和移植过程中受到损伤,还可以附带更多的生长因子,对细胞表达和释放有较好的促进作用,但动物试验证实尽管移植的opcs能够迁移至损伤区域并长期存活,但绝大多数细胞并不能分化为成熟少突胶质细胞,而是保持在前体细胞阶段,opcs移植到wmd模型大鼠脑内后分化与髓鞘再生困难严重限制了其应用。
4.因此,为了提高细胞注射的有效注入率,保证细胞完整性、成活率,促进opcs体内分化及髓鞘再生,寻找一种合适的细胞微载体或支架材料极具现实意义。
技术实现要素:
5.针对现有技术的不足,本发明的目的在于提供一种干细胞在制备治疗脑白质病的制剂中的用途。
6.本发明为实现上述目的所采取的技术方案为:干细胞在制备治疗脑白质病的制剂中的用途,将神经干细胞体外定向分化为少突胶质前体细胞,以水凝胶微球为载体负载少突胶质前体细胞,得到细胞微载体,细胞微载体与药学上可接受的辅料制备成可注射的制剂;其中所述水凝胶微球由明胶衍生物和羧甲基
壳聚糖制备而成,所述明胶衍生物的结构式为:,其中
ꢀꢀ
为明胶分子的主链。
7.所述明胶衍生物的制备方法为:s1、将明胶分散于去离子水中,于50-65℃搅拌溶解,冷却至35-45℃,加入高碘酸钾(kio4),避光反应5-8h,再加入乙二醇,继续搅拌0.5-1h,经透析、冷冻干燥,得到醛基化明胶;s2、咪康唑溶于n,n-二甲基甲酰胺,得到溶液1,反-3-氯丙烯酸溶于去离子水,得到溶液2,在氮气氛围下,向溶液1中滴加溶液2并进行搅拌,于0.5-1h滴加完毕,升温至30-35℃,继续搅拌7-9h,得到反应混合物,经旋蒸、萃取、浓缩、干燥,得到咪康唑衍生物;s3、将步骤s1所得醛基化明胶分散于去离子水中,升温至60-75℃,搅拌20-30min,再依次加入氢氧化钠、步骤s2所得咪康唑衍生物、苄基三乙基氯化铵,继续搅拌3-4h,用盐酸调节ph为6-7,经透析、冷冻干燥,得到明胶衍生物。
8.本发明所述明胶是胶原部分水解而得到的一类蛋白质,具有良好的生物降解性、生物相容性、组织相容性,具有可以连接其它配体的活性基团,可以用单凝聚、复凝聚等方法制备微囊或微球,还具有较大的包封率和载药量,有的载药微球可以长期贮存(25年以上)无明显变化。明胶具有许多优异的性质与性能,但也不可避免地具有一些不足之处,因而需要通过一定的手段来予以弥补和使之消除,或者使之具有新的性质与性能。对明胶进行化学改性,在明胶结构中引入醛基和咪康唑,为动态亚胺键的形成提供醛基反应位点。本发明以明胶为反应原料,以高碘酸钾为氧化剂,将明胶结构中的羟基氧化为醛基,得到醛基化明胶,咪康唑与反-3-氯丙烯酸反应得到咪康唑衍生物,醛基化明胶与咪康唑衍生物在氢氧化钠及苄基三乙基氯化铵催化作用下,进行n-烷基化反应,即得明胶衍生物。
9.为了得到醛基化明胶,步骤s1中所述明胶、去离子水、高碘酸钾、乙二醇的质量比为1:15-25:1.1-1.3:0.8-1.2;为了在明胶结构中引入咪康唑,并保证产物一致性,步骤s2中所述溶液1中咪康唑的质量浓度为0.16-0.20g/ml,溶液2中反-3-氯丙烯酸的质量浓度为
0.1-0.15g/ml,咪康唑与反-3-氯丙烯酸的摩尔比为1:0.6-0.9,旋蒸前向反应混合物中加入去离子水,使反应混合物中n,n-二甲基甲酰胺与去离子水的体积比为1:10-12;步骤s3中所述醛基化明胶、氢氧化钠、咪康唑衍生物、苄基三乙基氯化铵的质量比为20-25:1:8-10:0.9-1.0,所述去离子水中醛基化明胶的加入量为0.13-0.15g/ml。
10.所述细胞微载体的制备方法为:(1)将明胶衍生物、羧甲基壳聚糖分散于去离子水中,经高速均质处理、真空过滤灭菌后,加入含有少突胶质前体细胞的细胞悬液,吹打均匀,得到预制溶液,其中预制溶液中明胶衍生物的加入量为0.03-0.06g/ml,所述预制溶液中羧甲基壳聚糖的加入量为0.02-0.04g/ml,所述高速均质处理是于1000-1200r/min处理10-15s;(2)将步骤(1)所得预制溶液滴入无菌矿物油中,升温至36-38℃,保温10-12h,得到负载细胞的水凝胶微球,过滤收集,用无菌磷酸盐缓冲液(pbs)清洗,即得可注射的细胞微载体。
11.本发明所述羧甲基壳聚糖具有优良的水溶性、抗菌性、保湿性和抗氧化性,作为药物载体具有亲水性、胶凝性、促渗透性、生物相容性和可降解性等特点,能够延长药物在体内特定部位的滞留时间,提高药物的生物利用度,与其他材料复合后,可作为一种新型的注射性材料。动态共价化学是建立在动态共价键生成相互转换化合物的混合物基础之上,该混合物制备过程中涉及的可逆反应的速度非常快,对各种官能团具有耐受性,在温和条件下具有活性,动态共价化学中最常见的可逆反应包括亚胺交换反应、酯交换反应、缩醛交换反应等,基于动态共价化学概念构建的水凝胶材料具有优异的三维网络结构和自修复特性。本发明将明胶衍生物与羧甲基壳聚糖复合,以动态亚胺键结合的方式得到水凝胶材料,该水凝胶材料具有优异的三维网络结构、自修复功能、控缓释效果和抗形变能力,能为细胞提供三维支撑作用,避免细胞在注射或移植过程中受到损伤,当水凝胶材料受外力作用发生开裂时,也能在短时间内进行自我修复,保护细胞的完整性;明胶衍生物中的咪康唑结构还能与少突胶质前体细胞协同作用,促进少突胶质前体细胞发育成熟,提高其分化效率和髓鞘生成。
12.本发明具有如下有益效果:本发明对明胶进行化学改性,在明胶分子中引入醛基和咪康唑,得到明胶衍生物,该明胶衍生物具有良好的表面活性,能够与细胞、活性因子很好地相容;明胶衍生物与羧甲基壳聚糖以动态亚胺键结合的方式制备水凝胶微球,该水凝胶微球具有优异的三维网络结构、自修复功能、控缓释效果和抗形变能力;以水凝胶微球为载体负载少突胶质前体细胞,得到细胞微载体,该细胞微载体能够为细胞提供支撑保护作用,保证细胞的完整性,提高细胞有效注入率,同时还能促进少突胶质前体细胞发育成熟,提高其分化效率和髓鞘生成;将细胞微载体与药学上可接受的辅料制备成可注射的制剂,用于治疗脑白质病时表现出优异的髓鞘修复效果。
附图说明
13.图1是按照实施例2所述工艺制备的水凝胶材料自愈合性能测试图。
14.图2是按照实施例2所述工艺制备的水凝胶材料sem图。
15.图3是少突胶质前体细胞与细胞微载体体外实验髓鞘碱性蛋白表达。
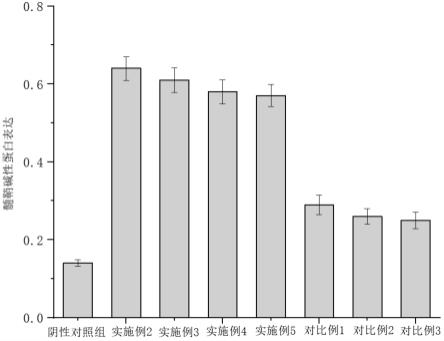
16.图4是少突胶质前体细胞与细胞微载体体内实验髓鞘碱性蛋白表达。
具体实施方式
17.下面将结合本技术实施例,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
18.下述实施例中所用原料均为普通市售产品。磷酸盐缓冲液(pbs),ph6.0,无菌,购自上海尚宝生物科技有限公司;杜氏磷酸缓冲液(dpbs,无钙镁),ph7.4,无菌,购自康迪斯化工(湖北)有限公司;明胶,药用级,型号cp2020,羧甲基壳聚糖,药用级,均购自山西锦洋药用辅料有限公司;咪康唑cas号22916-47-8;反-3-氯丙烯酸cas号2345-61-1;苄基三乙基氯化铵cas号56-37-1。
19.实施例1
20.培养基来源:cts stem pro medium:thermo fisher,cat.no.:a1033201;advanced dmem/f12:thermo fisher,cat.no.:12634028;neurobasal medium:thermo fisher,cat.no.:21103049;临床标准的生长因子:cts n2(thermo fisher,cat.no.:1370701)、cts b27(thermo fisher,cat.no.:1486701)、gmp bfgf(peprotech,cat.no.:gmp100-18b)和gmp pdgf-aa(peprotech,cat.no.:gmp100-13a);材料来源:骨髓来源于30日龄的清洁级小鼠(购自上海实验动物中心)。
21.少突胶质前体细胞的制备方法,包括以下步骤:s1、制备骨髓间充质干细胞:用9ml的cts stem pro medium稀释1ml清洁级小鼠骨髓,将稀释后的骨髓加入适合细胞贴壁培养的10cm细胞培养皿中培养,将骨髓进行贴壁培养之日定义为少突胶质前体细胞分化过程的首日(d0);48h后移除细胞培养皿中的培养基,用dpbs洗除未贴壁的细胞后,加入10ml cts stem pro medium,此后每隔72h更换一次cts stem pro medium继续培养;培养至d6-d7时,可在培养皿中观察到骨髓间充质干细胞(bmsc)克隆;培养至d8-d10时,吸除培养基并用3ml的dpbs冲洗培养皿中未贴壁的细胞,移除上述dpbs并向培养皿中加入1ml的cts tryple select,在37℃环境下孵育5min,收集消化后的细胞溶液并于室温条件下200g离心5min得到沉淀,用cts stem pro medium重悬上述离心沉淀;将上述细胞以4
×
104个细胞/cm2的密度接种至6cm或10cm的细胞培养皿,当培养皿中的bmsc达80-90%融合时,传代培养,其中bmsc传代培养不能超过10代;利用流式细胞技术检测如下三组标记物:a:bmsc标记物:stro-1、cd90和cd73;b:神经干细胞标记物:nestin;c:造血干细胞标记物:cd45;当培养皿中的细胞的a组标记物呈现高于90%阳性,b组标记物高于5%阳性且c组标记物低于1%时,培养皿中的细胞可用于进一步操作;s2、制备神经干细胞:配置含有终浓度为1%的glutamax、2%的b27、40ng/ml的bfgf、40ng/ml的egf、20ng/ml的igf-1和1%的p/s的advanced dmem/f12培养基作为神经干细胞培养基;在步骤s1 bmsc传至第3-10代之间时(优选d15),用cts tryple select消化bmsc,离心后用神经干细胞培养基重悬bmsc,并以1
×
104个细胞/cm2的密度接种于非贴壁培养6孔板中;每隔48h更换一次神经干细胞培养基,随着培养时间的增加,神经干细胞形成神经球悬浮于神经干细胞培养基中,非贴壁培养第5-7天时,将培养基于200g离心5min得到以神经球形式存在的神经干细胞;以骨髓间充质干细胞作为对照,将非贴壁培养第5天的神经球打散后,用免疫荧光技术检测神经球中阳性表达nestin和gfap的细胞含量并计数,神经
球中阳性表达nestin和gfap的细胞量高于75%。
22.s3、制备少突胶质前体细胞:用浓度为10μg/ml的多聚-l-鸟氨酸(plo)和人源层粘连蛋白包被6孔板,向6孔板中加入少突胶质前体细胞分化培养基后接种步骤s2所得神经干细胞,接种密度为4
×
104个细胞/cm2;接种后每隔48h更新少突胶质前体细胞分化培养基,自神经干细胞接种至含有第一组少突胶质前体细胞分化培养基之日第8天起,用cts tryple select消化并收集少突胶质前体细胞;其中少突胶质前体细胞分化培养基由advanced dmem/f12和neurobasal medium以体积比1:1混合而成,还加入终浓度为1%的glutamax、2%的b27、1%n2、10ng/ml的bfgf、10ng/ml的pdgf-aa、100ng/ml的β-hrg1、10μm的2-巯基乙醇以及1%的p/s;使用时,将少突胶质前体细胞分散于pbs中制成细胞悬液,细胞悬液中每μl pbs中含细胞105个。
23.实施例2
24.一种明胶衍生物的制备方法,包括以下步骤:s1、将明胶分散于去离子水中,于60℃搅拌溶解,冷却至35℃,加入高碘酸钾,避光反应6h,再加入乙二醇,继续搅拌0.5h,用截留分子量为8000-14000d的透析袋透析72h,每12小时更换一次去离子水,收集透析袋中的溶液并进行冷冻干燥,得到醛基化明胶,其中明胶、去离子水、高碘酸钾、乙二醇的质量比为1:20:1.2:0.9;s2、咪康唑溶于n,n-二甲基甲酰胺,得到溶液1,反-3-氯丙烯酸溶于去离子水,得到溶液2,在氮气氛围下,向溶液1中滴加溶液2并进行搅拌,于1h滴加完毕,升温至30℃,继续搅拌8h,得到反应混合物,向反应混合物中加入去离子水,使反应混合物中n,n-二甲基甲酰胺与去离子水的体积比为1:10,旋蒸除去n,n-二甲基甲酰胺,再用乙酸乙酯萃取,取水层浓缩、干燥,得到咪康唑衍生物,其中溶液1中咪康唑的质量浓度为0.20g/ml,溶液2中反-3-氯丙烯酸的质量浓度为0.15g/ml,咪康唑与反-3-氯丙烯酸的摩尔比为1:0.8;s3、将步骤s1所得醛基化明胶分散于去离子水中,升温至60℃,搅拌30min,再依次加入氢氧化钠、步骤s2所得咪康唑衍生物、苄基三乙基氯化铵,继续搅拌4h,用盐酸调节ph为6-7,用截留分子量为8000-14000d的透析袋透析72h,每12小时更换一次去离子水,收集透析袋中的溶液并进行冷冻干燥,得到明胶衍生物,其中醛基化明胶、氢氧化钠、咪康唑衍生物、苄基三乙基氯化铵的质量比为25:1:8:0.9,所述去离子水中醛基化明胶的加入量为0.15g/ml。
25.一种细胞微载体的制备方法,包括以下步骤:(1)将明胶衍生物、羧甲基壳聚糖分散于去离子水中,经高速均质处理、真空过滤灭菌后,加入含有少突胶质前体细胞的细胞悬液(实施例1所得),吹打均匀,得到预制溶液,其中预制溶液中明胶衍生物的加入量为0.035g/ml,预制溶液中羧甲基壳聚糖的加入量为0.035g/ml,所述高速均质处理是于1000r/min处理10s;(2)将步骤(1)所得预制溶液通过注射器滴入无菌矿物油中,升温至37℃,保温12h,得到负载细胞的水凝胶微球,过滤收集,用无菌磷酸盐缓冲液清洗,即得可注射的细胞微载体。
26.该实施例所制备的水凝胶微球的合成路线如下:
;;;
;其中
ꢀꢀ
为明胶分子的主链。
27.实施例3
28.一种明胶衍生物的制备方法,按照实施例2的方法制备,区别在于:步骤s1中冷却温度为40℃;一种细胞微载体的制备方法,按照实施例2的方法制备。
29.实施例4
30.一种明胶衍生物的制备方法,按照实施例2的方法制备,区别在于:步骤s1中冷却温度为45℃;一种细胞微载体的制备方法,按照实施例2的方法制备。
31.实施例5
32.一种明胶衍生物的制备方法,按照实施例2的方法制备,区别在于:步骤s3中继续搅拌时间为3h;一种细胞微载体的制备方法,按照实施例2的方法制备。
33.对比例1
34.一种明胶衍生物的制备方法,按照实施例2的方法制备,区别在于:省略步骤s2和s3;一种细胞微载体的制备方法,按照实施例2的方法制备。
35.对比例2
36.一种细胞微载体的制备方法,按照实施例2的方法制备,区别在于:将明胶衍生物替换为明胶。
37.对比例3
38.将实施例1所得含有少突胶质前体细胞的细胞悬液与药学上可接受的辅料(如生
理盐水)制备成可注射的制剂。
39.按照实施例2所述工艺制备得到水凝胶材料(将明胶衍生物、羧甲基壳聚糖分散于去离子水中,经高速均质处理,于37℃保温12h,即得),并对水凝胶材料进行自愈合性能测试,将两个体积形状相同的水凝胶材料一个用活性染料b染色,一个不染色,用刀片分别切成对称的两部分,再将两个不同颜色的水凝胶断面合并在一起,使断裂面相互接触,将拼接好的水凝胶样品放入聚乙烯培养皿中,在温度为36.5℃,湿度为80%的条件下进行自愈合测试,在预定的时间对其进行简单的拉伸实验,并记录水凝胶的愈合情况,结果如图1所示,0.5h后发现两个样品可以合并成一个单一的实体,且不需要任何外界刺激,不同颜色样品之间的边界变得模糊,可以清楚地观察到活性染料b从染色部分扩散到未染色部分,且进行简单的拉伸后,水凝胶保持完整,说明相邻水凝胶样品之间存在分子运动,不是简单的物理粘附。
40.按照实施例2所述工艺制备得到水凝胶材料(将明胶衍生物、羧甲基壳聚糖分散于去离子水中,经高速均质处理,于37℃保温12h,即得),对其进行冷冻干燥后,采用扫描电子显微镜(sem)对样品的微观形貌进行观察,观察前将样品在液氮环境中萃断,并对断面进行喷金处理,结果如图2所示,水凝胶材料具有较规则的孔径分布和厚壁,且多为贯穿孔,水凝胶材料的多孔性结构使其具有优异的渗透性能和较高的比表面积,对于负载细胞具有极大优势。
41.在水凝胶微球中加入环磷酰胺,以测试水凝胶微球的控缓释效果,制备方法为:将明胶衍生物、羧甲基壳聚糖、环磷酰胺分散于去离子水中,经高速均质处理,得到预制溶液,将预制溶液通过注射器滴入无菌矿物油中,于37℃保温12h,过滤收集,即得,其中预制溶液中明胶衍生物的加入量为0.035g/ml,预制溶液中羧甲基壳聚糖的加入量为0.035g/ml,预制溶液中环磷酰胺的加入量为0.02g/ml,高速均质处理是于1000r/min处理10s。将水凝胶微球配制成水溶液(质量分数为2%),以水(1l)为透析液,用8000-14000d的透析袋透析,并进行搅拌,在选定时间点(1h、2h、4h、8h、16h、24h)用钼蓝法测定透析液中磷含量,计算磷累计释放率,测试结果如表1所示,在0-4h水凝胶微球呈现快速释放现象,4-24h呈现缓释现象,且缓释阶段持续时间比较长,表现出较好的控缓释效能。
[0042][0043]
下面对实施例1所得少突胶质前体细胞和实施例2-5、对比例1-2所得细胞微载体进行体外实验。配置含有终浓度为1%的cts glutamax,2%的cts b27,10μm的2-巯基乙醇,1%的p/s以及终浓度为10μm的t3的cts neurobasal medium培养基,将实施例1所得少突胶质前体细胞和实施例2-5、对比例1-2所得细胞微载体与神经元在cts neurobasal medium培养基中共培养15天(少突胶质前体细胞终浓度为为4
×
104个细胞/ul),以不含有少突胶质前体细胞的培养基作为阴性对照组,通过western blot检测髓鞘碱性蛋白(mbp)表达量,结果如图3所示,mbp蛋白表达量(以目的条带和内参条带吸光度值比值表示)在8组间有显著差异,实施例2-5 mbp蛋白表达量明显高于实施例1、对比例1-2和阴性对照组,其中实施
例2的mbp蛋白表达量最高。
[0044]
将实施例2-5和对比例1-2所得细胞微载体与药学上可接受的辅料(如生理盐水)制备成可注射的制剂,对实施例2-5与对比例1-3所得制剂(少突胶质前体细胞终浓度为4
×
104个细胞/ul)进行体内实验。实验对象:清洁级shiverer新生鼠,由已孕母鼠在解放军海军总医院动物房产仔获得(北京维通利华提供),小鼠一经出生即进行基因型检测,选取shi-/-(mbp基因完全缺失)小鼠56只,作为脑白质病模型,平均分成8组,于出生后24h内分别向小鼠的中枢神经注射实施例2-5与对比例1-3所得制剂,以不含有少突胶质前体细胞的制剂作为阴性对照组,小鼠8周龄时,对小鼠脑组织进行western blot检测,检测髓鞘碱性蛋白(mbp)的阳性表达(以目的条带和内参条带吸光度值比值表示),结果如图4所示,实施例2-5 mbp蛋白表达量较高,均高于0.55,其中实施例2的mbp蛋白表达量最高,为0.64,对比例1-3的mbp蛋白表达量为0.25-0.30,阴性对照组的mbp蛋白表达量为0.14,上述数据表明,少突胶质前体细胞可增加shi-/-(mbp基因完全缺失)小鼠的mbp蛋白表达量,有助于改善脱髓鞘小鼠的脑白质髓鞘形成不良状况,但改善程度有限,而细胞微载体(即水凝胶微球与少突胶质前体细胞协同作用)能够显著改善脱髓鞘小鼠的脑白质髓鞘形成不良状况,极大地提高少突胶质前体细胞对髓鞘的修复效果。
[0045]
尽管已经示出和描述了本技术的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本技术的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本技术的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1