一种组合物及其制备方法和用途与流程
本发明涉及药物制剂领域,具体涉及一种组合物及其制备方法和用途。
背景技术:
1、新冠病毒是一种具有包膜的单链rna病毒,为β属冠状病毒。与sars和mers类似,sars-cov-2基因组编码非结构蛋白:3c样蛋白酶(3-chymotrypsin-like protease,3clpro)、木瓜蛋白酶样蛋白酶(papain-likeprotease,plpro)、解旋酶(helicase)和rna依赖rna聚合酶(rna-dependent rna polymerase,rdrp);结构蛋白:如棘突糖蛋白(spikeglycoprotein)和附属蛋白(accessory proteins)。新冠病毒的表面棘突糖蛋白与人体细胞表面血管紧张素转换酶(ace2)受体的结合从而感染人的呼吸道上皮细胞。病毒在进入宿主细胞后解体,将核衣壳和病毒rna释放到细胞质中,病毒rna5′末端开放阅读框(orf1a/b)将编码多聚蛋白质(pp1a和pp1ab),它们对病毒复制所需酶的加工、成熟起重要作用。pp1a和pp1ab可被木瓜蛋白酶样蛋白酶(plpro)和3c样蛋白酶(3clpro)裂解,产生非结构蛋白,包括rna依赖性rna聚合酶和解螺旋酶等,它们对于新冠病毒的转录和复制的起着关键的作用。目前,冠状病毒识别受体的表面棘突糖蛋白、参与复制及转录过程的重要蛋白3clpro、plpro与rdrp是四个十分具有抗病毒药物研发吸引力的靶点。
2、关于新冠疫苗的研发,12月2日,英国首先批准了辉瑞和biontech新冠疫苗的紧急使用权。一方面此款疫苗的普遍使用效果还未得知,另一方严格的低温保存要求对其广泛使用带来了极大的不便。
3、关于新冠药物研发,目前瑞德西韦是美国fda唯一批准的新冠用药。瑞德西韦(remdesivir)是一个腺苷类似物的单磷酸氨甲酯前药,起初为吉利德公司开发的抗埃博拉病毒药物。瑞德西韦作为rdrp抑制剂,在细胞层面表现出了抗新冠病毒的活性,但经临床试验表明,瑞德西韦在人体上并没有显著的降低死亡率。且由于临床使用剂量已接近安全剂量,一些明显的副作用不得不引起关注。
4、因此,仍需要有一种安全性好,稳定性好,生物利用度好的治疗新冠病毒的药物。
技术实现思路
1、发明概述
2、为解决上述问题,第一方面,本发明提供一种组合物,所述组合物包括atv014化合物和药学上可接受的辅料,
3、在一些实施例中,所述药学上可接受的辅料可以包括选自:稀释剂、崩解剂、粘合剂、润滑剂和其他辅料中的至少一种。在一些实施例中,所述稀释剂为微晶纤维素、甘露醇和预糊化淀粉中的至少一种。在一些实施例中,所述稀释剂为微晶纤维素和甘露醇。在一些实施例中,所述稀释剂为微晶纤维素或甘露醇。采用微晶纤维素或甘露醇作为稀释剂,更有利于提高原辅料相容性,优选为微晶纤维素或甘露醇作为稀释剂;更优选为微晶纤维素ph102或甘露醇50c作为稀释剂;最优选为甘露醇50c作为稀释剂。
4、第二方面,本发明提供一种前述组合物在制备用于预防、缓解或治疗冠状病毒感染或其同源变异病毒的复制或繁殖及其所产生的细胞病变效应的产品中的用途。
5、第三方面,本发明提供一种前述组合物的制备方法,所述制备方法采用研磨或粉碎atv014,降低atv014粒径的方法,有利于提高产品的溶出速度,还有利于在干法制粒过程中使颗粒硬度适中。所述制备方法采用研磨后的atv014进行干法制粒有利于得到硬度较好的颗粒。所述制备方法采用干法制粒,有利于提高产品的崩解速度。
6、发明详述
7、为解决上述问题,本发明提供一种组合物及其药物制剂、用途和制备方法。
8、第一方面,提供一种组合物。
9、一种组合物,其包括:atv014化合物和药学上可接受的辅料,
10、
11、在一些实施例中,所述药学上可接受的辅料可以包括选自:稀释剂、崩解剂、粘合剂、润滑剂和其他辅料中的至少一种。在一些实施例中,所述药学上可接受的辅料包括稀释剂、崩解剂、粘合剂和润滑剂。
12、在一些实施例中,所述稀释剂可以包括选自微晶纤维素、甘露醇、磷酸氢钙和预糊化淀粉中的至少一种。在一些实施例中,所述稀释剂为微晶纤维素、甘露醇和预糊化淀粉中的至少一种。在一些实施例中,所述稀释剂为微晶纤维素和甘露醇。在一些实施例中,所述稀释剂为微晶纤维素或甘露醇。采用微晶纤维素或甘露醇作为稀释剂,有利于提高原辅料相容性。在一些更有选的实施例中,所述稀释为微晶纤维素ph102或甘露醇50c,更有利于提高原辅料相容性。在一些最优选的实施例中,所述稀释剂为甘露醇50c,最有利于原辅料相容性。
13、在一些实施例中,所述崩解剂可以包括选自交联羧甲基纤维素钠、交联聚维酮、羧甲基淀粉钠和羟丙基纤维素中的至少一种。在一些实施例中,所述崩解剂为交联羧甲基纤维素钠。
14、在一些实施例中,所述粘合剂可以包括选自羟丙基纤维素、聚维酮和淀粉中的至少一种。在一些实施例中,所述粘合剂为羟丙基纤维素。
15、在一些实施例中,所述润滑剂可以包括选自硬脂酸镁、硬脂酸和硬脂富马酸钠中的至少一种。在一些实施例中,所述润滑剂为硬脂酸镁。
16、在一些实施例中,所述其他辅料可以包括选自助流剂。
17、在一些实施例中,所述助流剂可以包括选自胶态二氧化硅或滑石粉。
18、在一些实施例中,以所述组合物的总质量计算,所述atv014化合物的含量可以为15wt%-70wt%。在一些实施例中,以所述组合物的总质量计算,所述atv014化合物的含量为50wt%-60wt%。在一些实施例中,以所述组合物的总质量计算,所述atv014化合物的含量为15wt%、20wt%、25wt%、30wt%、35wt%、40wt%、45wt%、50wt%、55wt%、56wt%、60wt%、65wt%或70wt%。
19、在一些实施例中,以所述组合物的总质量计算,所述稀释剂的含量可以为20wt%-70wt%。在一些实施例中,以所述组合物的总质量计算,所述稀释剂的含量为30wt%-40wt%。在一些实施例中,以所述组合物的总质量计算,所述稀释剂的含量为20wt%、25wt%、30wt%、35wt%、36wt%、37wt%、40wt%、45wt%、50wt%、55wt%、60wt%、65wt%或70wt%。
20、在一些实施例中,以所述组合物的总质量计算,所述崩解剂的含量可以为1wt%-10wt%。在一些实施例中,以所述组合物的总质量计算,所述崩解剂的含量为2wt%-5wt%。在一些实施例中,以所述组合物的总质量计算,所述崩解剂的含量为1wt%、2wt%、3wt%、4wt%、5wt%、6wt%、7wt%、8wt%、9wt%或10wt%。
21、在一些实施例中,以所述组合物的总质量计算,所述粘合剂的含量可以为1wt%-10wt%。在一些实施例中,以所述组合物的总质量计算,所述粘合剂的含量为2wt%-5wt%。在一些实施例中,以所述组合物的总质量计算,所述粘合剂的含量为1wt%、2wt%、3wt%、4wt%、5wt%、6wt%、7wt%、8wt%、9wt%或10wt%。
22、在一些实施例中,以所述组合物的总质量计算,所述润滑剂的含量可以为0.5wt%-5wt%。在一些实施例中,以所述组合物的总质量计算,所述润滑剂的含量为1.5wt%-5wt%。在一些实施例中,以所述组合物的总质量计算,所述润滑剂的含量为0.5wt%、1wt%、1.5wt%、2wt%、3wt%、4wt%或5wt%。
23、在一些实施例中,所述组合物可以不包含表面活性剂。在一些实施例中,所述组合物可以不包含十二烷基硫酸钠。
24、在一些实施例中,所述组合物还可以包括外加润滑剂。
25、在一些实施例中,所述外加润滑剂包括选自硬脂酸镁、硬脂酸钠和硬脂富马酸钠中的至少一种。在一些实施例中,所述外加润滑剂为硬脂酸镁。
26、在一些实施例中,以所述组合物的总质量计算,所述外加润滑剂的含量为0.5wt%-5wt%。在一些实施例中,以所述组合物的总质量计算,所述外加润滑剂的含量为1.5wt%-5wt%。在一些实施例中,以所述组合物的总质量计算,所述外加润滑剂的含量为0.5wt%、1wt%、1.5wt%、2wt%、3wt%、4wt%或5wt%。
27、在本发明的一些实施方式中,一种组合物,其包括:atv014化合物和药学上可接受的辅料,所述药学上可接受的辅料包括选自:稀释剂、崩解剂、粘合剂、润滑剂和其他辅料中的至少一种,所述稀释剂包括选自微晶纤维素、甘露醇、磷酸氢钙和预糊化淀粉中的至少一种,所述崩解剂包括选自交联羧甲基纤维素钠、交联聚维酮、羧甲基淀粉钠和羟丙基纤维素中的至少一种,所述粘合剂包括选自羟丙基纤维素、聚维酮和淀粉中的至少一种,所述润滑剂包括选自硬脂酸镁、硬脂酸和硬脂富马酸钠中的至少一种,以所述组合物的总质量计算,所述atv014化合物的含量为15wt%-70wt%,所述稀释剂的含量为20wt%-70wt%,所述崩解剂的含量为1wt%-10wt%,所述粘合剂的含量为1wt%-10wt%,所述润滑剂的含量可以为0.5wt%-5wt%。
28、在本发明的一些实施方式中,一种组合物,其包括:atv014化合物和药学上可接受的辅料,所述药学上可接受的辅料包括选自:稀释剂、崩解剂、粘合剂、润滑剂和其他辅料中的至少一种,所述稀释剂包括选自微晶纤维素、甘露醇、磷酸氢钙和预糊化淀粉中的至少一种,所述崩解剂包括选自交联羧甲基纤维素钠、交联聚维酮、羧甲基淀粉钠和羟丙基纤维素中的至少一种,所述粘合剂包括选自羟丙基纤维素、聚维酮和淀粉中的至少一种,所述润滑剂包括选自硬脂酸镁、硬脂酸和硬脂富马酸钠中的至少一种,以所述组合物的总质量计算,所述atv014化合物的含量为50wt%-60wt%,所述稀释剂的含量为30wt%-40wt%,所述崩解剂的含量为2wt%-5wt%,所述粘合剂的含量为2wt%-5wt%,所述润滑剂的含量可以为1.5%-5wt%。
29、在本发明的一些实施方式中,一种组合物,其包括:atv014化合物和药学上可接受的辅料,所述药学上可接受的辅料包括选自:稀释剂、崩解剂、粘合剂、润滑剂和其他辅料中的至少一种,所述稀释剂包括选自微晶纤维素和甘露醇中的至少一种,所述崩解剂包括选自交联羧甲基纤维素钠,所述粘合剂包括选自羟丙基纤维素,所述润滑剂包括选自硬脂酸镁、硬脂酸和硬脂富马酸钠中的至少一种,以所述组合物的总质量计算,所述atv014化合物的含量为50wt%-60wt%,所述稀释剂的含量为30wt%-40wt%,所述崩解剂的含量为2wt%-5wt%,所述粘合剂的含量为2wt%-5wt%,所述润滑剂的含量可以为1.5%-5wt%。
30、在本发明的一些实施方式中,一种组合物,其包括:atv014化合物和药学上可接受的辅料,所述药学上可接受的辅料包括选自:稀释剂、崩解剂、粘合剂、润滑剂和其他辅料中的至少一种,所述稀释剂为微晶纤维素ph102或甘露醇50c,所述崩解剂包括选自交联羧甲基纤维素钠,所述粘合剂包括选自羟丙基纤维素,所述润滑剂包括选自硬脂酸镁、硬脂酸和硬脂富马酸钠中的至少一种,以所述组合物的总质量计算,所述atv014化合物的含量为50wt%-60wt%,所述稀释剂的含量为30wt%-40wt%,所述崩解剂的含量为2wt%-5wt%,所述粘合剂的含量为2wt%-5wt%,所述润滑剂的含量可以为1.5%-5wt%。
31、在本发明的一些实施方式中,一种组合物,其包括:atv014化合物和药学上可接受的辅料,所述药学上可接受的辅料包括选自:稀释剂、崩解剂、粘合剂、润滑剂和其他辅料中的至少一种,所述稀释剂为微晶纤维素ph102和甘露醇50c,所述崩解剂包括选自交联羧甲基纤维素钠,所述粘合剂包括选自羟丙基纤维素,所述润滑剂包括选自硬脂酸镁、硬脂酸和硬脂富马酸钠中的至少一种,以所述组合物的总质量计算,所述atv014化合物的含量为50wt%-60wt%,所述稀释剂的含量为30wt%-40wt%,所述崩解剂的含量为2wt%-5wt%,所述粘合剂的含量为2wt%-5wt%,所述润滑剂的含量可以为1.5%-5wt%。
32、在本发明的一些实施方式中,一种组合物,其包括:atv014化合物和药学上可接受的辅料,所述药学上可接受的辅料包括选自:稀释剂、崩解剂、粘合剂、润滑剂和其他辅料中的至少一种,所述稀释剂为甘露醇50c,所述崩解剂包括选自交联羧甲基纤维素钠,所述粘合剂包括选自羟丙基纤维素,所述润滑剂包括选自硬脂酸镁、硬脂酸和硬脂富马酸钠中的至少一种,以所述组合物的总质量计算,所述atv014化合物的含量为50wt%-60wt%,所述稀释剂的含量为30wt%-40wt%,所述崩解剂的含量为2wt%-5wt%,所述粘合剂的含量为2wt%-5wt%,所述润滑剂的含量可以为1.5%-5wt%。
33、在一些实施例中,所述组合物的剂型可以为口服固体制剂或注射剂。在一些实施例中,所述组合物的剂型为片剂、颗粒剂或胶囊剂。
34、在一些实施例中,所述剂型的规格可以为10mg-500mg(例如10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、100mg、150mg、200mg、250mg、300mg、350mg、400mg、450mg或500mg)。在一些实施例中,所述剂型的规格为15mg-300mg。在一些实施例中,所述剂型的规格为20mg-200mg。在一些实施例中,所述剂型的规格为50mg-200mg。在一些实施例中,所述剂型的规格为50mg。
35、第三方面,提供一种用途。
36、一种第一方面所述组合物在制备药物中的用途。
37、在一些实施方式中,一种第一方面所述组合物在制备用于预防、缓解或治疗冠状病毒感染或其同源变异病毒的复制或繁殖及其所产生的细胞病变效应的产品中的用途。
38、在一些实施例中,所述感染包括发热、咳嗽、咽痛、肺炎、急性呼吸道感染、严重急性呼吸道感染、低氧性呼吸衰竭及急性呼吸窘迫综合征、脓毒症或脓毒性休克。
39、在一些实施方式中,一种第一方面所述组合物在制备用于检测冠状病毒或其同源变异病毒的产品中的用途。
40、在一些实施例中,所述冠状病毒包括:mhv-a59、hcov-229e、hcov-oc43、hcov-nl63、hcov-hku1、sars-cov,mers-cov、sars-cov-2、小鼠肝炎病毒、猫传染性腹膜炎病毒、犬冠状病毒、牛冠状病毒、禽传染性支气管炎病毒或猪冠状病毒,优选地,所述sars-cov-2包括sars-cov-2的突变株或未突变株;更优选地,所述sars-cov-2的突变株包括sars-cov-2突变株b.1、sars-cov-2突变株b.1.351、sars-cov-2突变株b.1.617.2、sars-cov-2突变株c.37、sars-cov-2突变株p.1族谱、sars-cov-2突变株b.1.525、sars-cov-2突变株b.1.427或sars-cov-2突变株b.1.429。
41、在一些实施例中,所述组合物适用于人或动物。在一些实施例中,所述动物包括牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物、鸟类动物或鱼类动物。
42、第四方面,提供一种第一方面所述组合物的制备方法。
43、一种第一方面所述组合物的制备方法,其包括:将atv014化合物和药学上可接受的辅料混合,干法制粒,加入外加润滑剂,混合,压片或胶囊填充或装袋,得到所述组合物。
44、在本发明的一些实施方式中,一种第一方面所述组合物的制备方法,其包括:将atv014化合物和药学上可接受的辅料混合,湿法制粒,研磨,干燥,干磨,加入外加润滑剂,混合,压片或胶囊填充或装袋,得到所述组合物。
45、在本发明的一些实施方式中,一种第一方面所述组合物的制备方法,其包括:将atv014化合物研磨或粉碎后和药学上可接受的辅料混合,干法制粒,加入外加润滑剂,混合,压片或胶囊填充或装袋,得到所述组合物。
46、在本发明的一些实施方式中,一种第一方面所述组合物的制备方法,其包括:将atv014化合物研磨或粉碎后和药学上可接受的辅料混合,湿法制粒,研磨,干燥,干磨,加入外加润滑剂,混合,压片或胶囊填充或装袋,得到所述组合物。
47、在一些实施例中,所述atv014的粒径d90可以为≤500μm。在一些实施例中,所述atv014的粒径d90为≤300μm。在一些实施例中,所述atv014的粒径d90为≤200μm。在一些实施例中,所述atv014的粒径d90为≤100μm。在一些实施例中,所述atv014的粒径d90为≤50μm。在一些优选的实施例中,所述atv014的粒径d90为≤25μm。在一些优选的实施例中,所述atv014的粒径d90为≤20μm。在一些更优选的实施例中,所述atv014的粒径d90为≤10μm。
48、有益效果
49、相比现有技术,本发明的某一个实施例至少具有包括以下有益技术效果中的一种:
50、(1)采用本发明所采用的处方和处方比例,有利于提高溶出度,提高生物利用度。
51、(2)采用本发明所采用的处方和处方比例,有利于提高药物的高温、高湿、光照等条件的稳定性。
52、(3)采用本发明所采用的处方和处方比例,可用于预防、缓解或治疗冠状病毒感染或其同源变异病毒的复制或繁殖及其所产生的细胞病变效应。
53、(4)采用不加表面活性剂的方式,有利于提高产品的溶出速度。
54、(5)润滑剂(例如:硬脂酸镁)的含量优选为1.5%及以上,有利于干法制粒的颗粒硬度和光滑度。
55、(6)粘合剂(例如:羟丙基纤维素)的含量优选为3%及以上,有利于干法制粒的颗粒硬度和光滑度。
56、(7)粘合剂(例如:羟丙基纤维素)的含量优选约为3%,有利于产品的产品的溶出度。
57、(8)采用研磨或粉碎atv014,降低atv014粒径的方法,有利于提高产品的溶出速度,还有利于在干法制粒过程中使颗粒硬度适中。
58、(9)采用研磨后的atv014进行干法制粒有利于得到硬度较好的颗粒。
59、(10)采用干法制粒,有利于提高产品的崩解速度。
60、(11)相比其他稀释剂,采用微晶纤维素或甘露醇作为稀释剂,更有利于提高原辅料相容性,优选为微晶纤维素或甘露醇作为稀释剂,更优选为微晶纤维素ph102或甘露醇50c,最优选为甘露醇50c。
61、术语定义:
62、本发明中,“室温”表示环境温度,可以为20℃-30℃;在一些实施例中,为22℃-28℃;在一些实施例中,为24℃-26℃;在一些实施例中,为25℃。
63、在本发明的上文中,无论是否使用“大约”或“约”等字眼,所有在此公开了的数字均为近似值。基于公开的数字,每一个数字的数值有可能会出现±10%以下的差异或者本领域人员认为的合理的差异,如±1%、±2%、±3%、±4%或±5%的差异。
64、术语“任选”、“任选的”或“任选地”是指随后描述的事件或情形可以但不一定出现。例如,“任选的表面活性剂”是指表面活性剂可以存在或可以不存在。
65、术语“外加润滑剂”表示在制粒后加入的为降低制粒所得颗粒之间摩擦力、防止原辅料粘着冲头表面或降低药片与冲模孔壁之间摩擦力的物质。
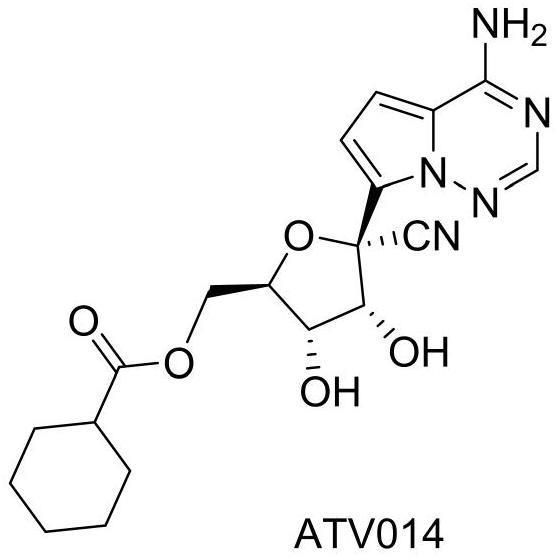
66、术语“规格”是指一个单位的制剂(单片或单颗胶囊)中活性成分的重量。
67、术语“重量百分比”或“以重量计的百分比”或“wt%”定义为组合物中单个组分的重量除以组合物所有组分的总重量然后乘以100。
68、术语“和/或”应理解为意指可选项中的任一项或可选项中的任意两项或多项的组合。
69、术语“wt%”表示质量百分比。
70、在本文中,术语“治疗”指意欲改变正在接受治疗的个体中疾病之天然过程的临床介入。想要的治疗效果包括但不限于防止疾病出现或复发、减轻症状、减小疾病的任何直接或间接病理学后果、防止转移、降低病情进展速率、改善或缓和疾病状态,以及缓解或改善预后。
71、在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
72、在本技术中,“组合物”可以方便地表现为单位剂量形式并且可以通过制药领域中熟知的方法的任何一种进行制备。所有的方法包括使活性成分与构成一种或多种附属成分的载体相结合的步骤。通常,通过均匀并充分地使活性化合物与液体载体、细碎固体载体或这两者相结合,制备组合物。
73、本发明中,一些化合物的缩写所表示的化合物结构:
74、
- 还没有人留言评论。精彩留言会获得点赞!