吡咯并嘧啶化合物的治疗用途及其固体药物组合物的制作方法
本技术属于医药化学领域,涉及吡咯并嘧啶化合物的治疗用途及其固体药物组合物。
背景技术:
1、两面神激酶(janus kinase,jak)是一类非受体型酪氨酸激酶(ptk),其存在于细胞内,通过jak-stat通路传导细胞因子刺激信号。jak-stat通路将细胞外的化学信号经细胞膜传导入位于细胞核内dna上的基因启动子上,最终影响细胞中dna转录与活性水平发生改变。jak-stat通路由三个主要部分组成:1)受体;2)两面神激酶(jak)和3)信号转导和转录激活蛋白(stat)。所述受体可由干扰素、白细胞介素、生长因子或其它化学信使激活,激活导致jak自身磷酸化;接下来stat蛋白与磷酸化受体结合,使得stat被jak磷酸化;然后磷酸化stat蛋白从受体上分离、二聚并易位到细胞核中,以结合到特异性dna位点并改变转录(scott,m.j.,c.j.godshall et al.(2002).“jaks,stats,cytokines,and sepsis”clindiagn lab immunol 9(6):1153-9)。
2、jak家族在涉及免疫应答的细胞增殖和功能性细胞因子依赖性调节中产生作用。目前,有四种已知的哺乳动物jak家族成员:jak1、jak2、jak3和tyk2(tyrosine kinase 2)。jak蛋白的大小范围在120-140kda,其包含7个保守的jak同源性(jh)结构域;其中之一为功能性催化激酶结构域,而另一个为假性激酶(pseudokinase)结构域,其有效地发挥调节功能和/或作为stat的停靠位点起作用(scott,godshall et al.2002,supra)。
3、骨髓增殖性肿瘤(myeloproliferative neoplasms,mpn)是细胞增殖为主要特征的克隆性造血干细胞疾病主要特征是骨髓一系或多系相对成熟的细胞过度增殖。骨髓增殖性肿瘤主要包括真性红细胞增多症(polycythemia vera,pv)、原发性血小板增多症(essential thrombocythemia,et)、原发性骨髓纤维化(primary myelofibrosis,pmf)。
技术实现思路
0、发明概述
1、本技术提供用于治疗骨髓增殖性肿瘤的式i化合物、其立体异构体、或其药学上可接受的盐:
2、
3、其中,所述r1和r2各自独立地选自h、c1~6烷基、c1~6烷基酰基或c1~6烷基磺酰基;所述r3和r4各自独立地选自h、羟基或氧代。
4、另一方面,本技术提供用于治疗骨髓增殖性肿瘤的药物组合物,所述药物组合物包括如上所述的式i化合物、其立体异构体、或其药学上可接受的盐。
5、另一方面,本技术提供用于治疗骨髓增殖性肿瘤的方法,其包括向所述受试者给予有效量的如上所述的式i化合物、其立体异构体、或其药学上可接受的盐、或其药物组合物。
6、另一方面,本技术提供如上所述的式i化合物、其立体异构体、或其药学上可接受的盐、或其药物组合物在制备治疗骨髓增殖性肿瘤药物中的用途。
7、另一方面,本技术提供如上所述的式i化合物、其立体异构体、或其药学上可接受的盐、或其药物组合物在治疗骨髓增殖性肿瘤中的用途。
8、又一方面,本技术提供一种固体药物组合物,其包括式i化合物、其立体异构体、或其药学上可接受的盐,以及稀释剂、黏合剂、润湿剂和崩解剂。
9、又一方面,本技术提供用于治疗两面神激酶介导的疾病的上述固体药物组合物。
10、又一方面,本技术提供上述固体药物组合物在制备治疗两面神激酶介导的疾病的药物中的用途。
11、又一方面,本技术提供治疗两面神激酶介导的疾病的方法,所述方法包括给予受试者有效量的上述固体药物组合物。
12、又一方面,本技术提供上述固体药物组合物在治疗两面神激酶介导的疾病中的用途。
13、发明详述
14、本技术提供用于治疗骨髓增殖性肿瘤的式i化合物、其立体异构体、或其药学上可接受的盐:
15、
16、其中,所述r1和r2各自独立地选自h、c1~6烷基、c1~6烷基酰基或c1~6烷基磺酰基;所述r3和r4各自独立地选自h、羟基或氧代。
17、另一方面,本技术提供用于治疗骨髓增殖性肿瘤的药物组合物,所述药物组合物包括如上所述的式i化合物、其立体异构体、或其药学上可接受的盐。
18、另一方面,本技术提供用于治疗骨髓增殖性肿瘤的方法,其包括向所述受试者给予有效量的如上所述的式i化合物、其立体异构体、或其药学上可接受的盐、或其药物组合物。
19、另一方面,本技术提供如上所述的式i化合物、其立体异构体、或其药学上可接受的盐、或其药物组合物在制备治疗骨髓增殖性肿瘤药物中的用途。
20、另一方面,本技术提供如上所述的式i化合物、其立体异构体、或其药学上可接受的盐、或其药物组合物在治疗骨髓增殖性肿瘤中的用途。
21、在本技术的部分实施方案中,所述药物组合物包含如上所述的式i化合物、其立体异构体、或其药学上可接受的盐。
22、在本技术的部分实施方案中,所述r1和r2各自独立地选自h、甲基、乙基、丙基、丁基、戊基、己基、甲酰基、乙酰基、丙酰基、丁酰基、戊酰基、己酰基、甲磺酰基、乙磺酰基、丙磺酰基、丁磺酰基、戊磺酰基或己磺酰基。
23、在本技术的部分实施方案中,所述r1选自h,所述r2选自甲基、乙基、丙基、丁基、戊基、己基、甲酰基、乙酰基、丙酰基、丁酰基、戊酰基、己酰基、甲磺酰基、乙磺酰基、丙磺酰基、丁磺酰基、戊磺酰基或己磺酰基。
24、在本技术的部分实施方案中,所示式i化合物具有如下式所示构型:
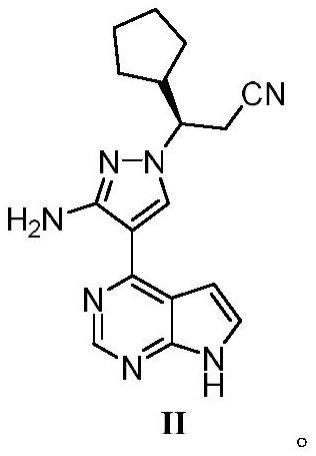
25、
26、在本技术的部分实施方案中,式i化合物、其立体异构体、或其药学上可接受的盐选自:
27、
28、在本技术的部分实施方案中,式i化合物、其立体异构体、或其药学上可接受的盐优选自:
29、
30、在本技术的部分实施方案中,优选式i的盐酸盐。在本技术的部分实施方案中,优选式i的一盐酸盐。在本技术的部分实施方案中,优选式i的一盐酸盐的结晶。
31、在本技术的部分实施方案中,优选式i的自由碱。在本技术的部分实施方案中,优选式i的自由碱的结晶。
32、在本技术的部分实施方案中,所述式i化合物为式ii化合物
33、在本技术的部分实施方案中,提供用于治疗真性红细胞增多症的式ii化合物、或其药学上可接受的盐。
34、在本技术的部分实施方案中,提供用于治疗血小板增多症的式ii化合物、或其药学上可接受的盐。
35、在本技术的部分实施方案中,提供用于治疗骨髓纤维化的式ii化合物、或其药学上可接受的盐。
36、在本技术的部分实施方案中,提供用于治疗真性红细胞增多症的药物组合物,所述药物组合物包括如上所述的式ii化合物、或其药学上可接受的盐。
37、在本技术的部分实施方案中,提供用于治疗血小板增多症的药物组合物,所述药物组合物包括如上所述的式ii化合物、或其药学上可接受的盐。
38、在本技术的部分实施方案中,提供用于治疗骨髓纤维化的药物组合物,所述药物组合物包括如上所述的式ii化合物、或其药学上可接受的盐。
39、在本技术的部分实施方案中,本技术提供用于治疗真性红细胞增多症的方法,其包括向所述受试者给予有效量的如上所述的式ii化合物、或其药学上可接受的盐、或其药物组合物。
40、在本技术的部分实施方案中,本技术提供用于治疗血小板增多症的方法,其包括向所述受试者给予有效量的如上所述的式ii化合物、或其药学上可接受的盐、或其药物组合物。
41、在本技术的部分实施方案中,本技术提供用于治疗骨髓纤维化的方法,其包括向所述受试者给予有效量的如上所述的式ii化合物、或其药学上可接受的盐、或其药物组合物。
42、在本技术的部分实施方案中,本技术提供式ii化合物、或其药学上可接受的盐、或其药物组合物在制备治疗真性红细胞增多症药物中的用途。
43、在本技术的部分实施方案中,本技术提供式ii化合物、或其药学上可接受的盐、或其药物组合物在制备治疗血小板增多症药物中的用途。
44、在本技术的部分实施方案中,本技术提供式ii化合物、或其药学上可接受的盐、或其药物组合物在制备治疗骨髓纤维化药物中的用途。
45、在本技术的部分实施方案中,本技术式ii化合物、或其药学上可接受的盐、或其药物组合物在治疗真性红细胞增多症中的用途。
46、在本技术的部分实施方案中,本技术式ii化合物、或其药学上可接受的盐、或其药物组合物在治疗血小板增多症中的用途。
47、在本技术的部分实施方案中,本技术式ii化合物、或其药学上可接受的盐、或其药物组合物在治疗骨髓纤维化中的用途。
48、本技术的药物组合物可通过将本技术的化合物与适宜的药学上可接受的辅料组合而制备,例如可配制成固态、半固态、液态或气态制剂,如片剂、丸剂、胶囊剂、粉剂、颗粒剂、膏剂、乳剂、悬浮剂、栓剂、注射剂、吸入剂、凝胶剂、微球及气溶胶等。本技术的药物组合物可以采用本领域众所周知的方法制造,如常规的混合法、溶解法、制粒法、制糖衣药丸法、磨细法、乳化法、冷冻干燥法等。适合的辅料包括但不限于:黏合剂、稀释剂、润湿剂、崩解剂、润滑剂、助流剂、甜味剂或矫味剂等。
49、在本技术的部分方案中,所述的药物组合物是适于口服的制剂,包括片剂、胶囊剂、粉剂、颗粒剂、滴丸、糊剂、散剂等,优选片剂和胶囊剂。所述的口服制剂可使用本领域公知的药学上可接受的载体通过常规方法制得。药学上可接受的载体包括稀释剂、黏合剂、润湿剂、崩解剂、润滑剂等。稀释剂包括微晶纤维素、甘露醇、乳糖、蔗糖、淀粉、预胶化淀粉、糊精或其混合物等;黏合剂包括羟丙甲纤维素、羧甲基纤维素、羧甲基纤维素钠、乙基纤维素、甲基纤维素、羟丙基纤维素、低取代羟丙基纤维素、明胶、聚乙烯吡咯烷酮、淀粉、蔗糖、葡萄糖、明胶或其混合物等;润湿剂包括硬脂酸镁、滑石粉、聚乙二醇、十二烷基硫酸钠、微粉硅胶、滑石粉或其混合物等;崩解剂包括羧甲基淀粉钠、干淀粉、微晶纤维素、羟乙基甲基纤维素、羧甲基纤维素钠、羧甲基纤维素钙、交联羧甲基纤维素钠、低取代羟丙甲基纤维素或交联聚维酮或其混合物等;润滑剂包括硬脂酸镁、胶体二氧化硅、滑石粉、聚乙二醇、硬脂酸、硬脂富马酸钠或其混合物等。药用辅料还包括着色剂、甜味剂、包衣剂等。
50、在本技术的部分方案中,所述的药物组合物为单剂量药物组合物。在部分实施方案中,所述药物组合物含有1mg至50mg的本技术的化合物、其立体异构体、或其药学上可接受的盐。在部分实施方案中,所述药物组合物含有1mg、2mg、5mg、8mg、10mg、12mg、15mg、18mg、20mg、22mg、25mg、28mg、30mg、32mg、35mg、38mg、40mg、42mg、45mg、48mg或50mg、或者任意前述值作为端点构成的范围或其中的任意值的本技术的化合物、其立体异构体、或其药学上可接受的盐,例如2mg至50mg、10mg至40mg、5mg至30mg、5mg至20mg等。
51、固体药物组合物
52、本技术提供一种固体药物组合物,其包括本技术所述式i化合物或式ii化合物、其立体异构体或其药学上可接受的盐,以及稀释剂、黏合剂、润湿剂和崩解剂。
53、在本技术的部分实施方案中,所述固体药物组合物包括式i化合物或式ii化合物、稀释剂、黏合剂、润湿剂和崩解剂。
54、在本技术的一些实施方案中,所述固体药物组合物进一步包含润滑剂。在本技术的部分实施方案中,所述式i化合物或式ii化合物的量选自1~30%wt,优选1~25%wt、1~20%wt、2~20%wt、2~15%wt、2~10%wt、3~10%wt或2~8%wt,更优选3~8%wt,进一步优选3.5~6%wt;或者一些实施方案中,式i化合物或式ii化合物的量选自1%wt、1.2%wt、1.4%wt、1.6%wt、1.8%wt、2%wt、2.2%wt、2.4%wt、2.6%wt、2.8%wt、3%wt、3.2%wt、3.4%wt、3.6%wt、3.8%wt、4%wt、4.2%wt、4.4%wt、4.6%wt、4.8%wt、5%wt、5.2%wt、5.4%wt、5.6%wt、5.8%wt、6%wt、6.2%wt、6.4%wt、6.6%wt、6.8%wt、7%wt、7.2%wt、7.4%wt、7.6%wt、7.8%wt、8%wt、8.2%wt、8.4%wt、8.6%wt、8.8%wt、9%wt、9.2%wt、9.4%wt、9.6%wt、9.8%wt、10%wt、10.5%wt、11%wt、11.5%wt、12%wt、12.5%wt、13%wt、13.5%wt、14%wt、14.5%wt、15%wt、15.5%wt、16%wt、16.5%wt、17%wt、17.5%wt、18%wt、18.5%wt、19%wt、19.5%wt、20%wt、21%wt、22%wt、23%wt、24%wt、25%wt、26%wt、27%wt、28%wt、29%wt或30%wt,或者任意前述值作为端点构成的范围或其中的任意值。
55、在本技术的部分实施方案中,所述稀释剂选自微晶纤维素、甘露醇、乳糖、蔗糖、淀粉、预胶化淀粉、糊精或其混合物;优选微晶纤维素、甘露醇、乳糖、预胶化淀粉或其混合物;更优选微晶纤维素、甘露醇或其混合物。
56、在本技术的部分实施方案中,所述稀释剂的量选自50~95%wt,优选60~95%wt、65~95%wt、70~95%wt、75~95%wt、80~95%wt、80~90%wt或85~95%wt,更优选85~90%wt;或者一些实施方案中,所述稀释剂的量选自55%wt、60%wt、65%wt、70%wt、75%wt、80%wt、85%wt、90%wt或95%wt,或者任意前述值作为端点构成的范围或其中的任意值。
57、在本技术的部分实施方案中,所述黏合剂选自羟丙甲纤维素(hpmc)、羧甲基纤维素(cmc)、羧甲基纤维素钠(cmc-na)、乙基纤维素(ec)、甲基纤维素(mc)、羟丙基纤维素(hpc)、低取代羟丙基纤维素(l-hpc)、明胶、聚乙烯吡咯烷酮(pvp)、部分水解的淀粉、淀粉、预胶化淀粉、蔗糖、葡萄糖、明胶、聚乙二醇(peg)、聚乙烯醇或其混合物;优选羟丙甲纤维素(hpmc)、羧甲基纤维素(cmc)、羧甲基纤维素钠(cmc-na)、乙基纤维素(ec)、甲基纤维素(mc)、羟丙基纤维素(hpc)、低取代羟丙基纤维素(l-hpc)、聚乙烯吡咯烷酮或其混合物;更优选羟丙基纤维素、聚乙烯吡咯烷酮或其混合物。
58、在本技术的部分实施方案中,所述黏合剂的量选自1.0%~10%wt,优选1.0%~8.0%wt、1.0%~6.0%wt或1.0%~5.0%wt,更优选2.0~4.0%wt;或者一些实施方案中,所述黏合剂的量选自1.0%wt、1.5%wt、2.0%wt、2.5%wt、3.0%wt、3.5%wt、4.0%wt、4.5%wt、5.0%wt、5.5%wt、6.0%wt、6.5%wt、7.0%wt、7.5%wt、8.0%wt、8.5%wt、9.0%wt、9.5%wt或10%wt,或者任意前述值作为端点构成的范围或其中的任意值。
59、在本技术的部分实施方案中,所述润湿剂选自十二烷基苯磺酸钠、十二烷基苯磺酸镁、十四烷基苯磺酸钠、十六烷基苯磺酸钠、十八烷基苯磺酸钠、十二烷基磺酸钠、十二烷基磺酸镁、十四烷基磺酸钠、十六烷基磺酸钠、十八烷基磺酸钠、十二烷基硫酸钠、十二烷基硫酸镁、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠、月桂酰肌氨酸钠、乳酸钠、棕榈酸钠、月桂酸异丙醇酰胺、月桂酸二乙醇酰胺、乳酸十四烷基酯、乳酸十六基酯、聚山梨酯20、聚山梨酯40、聚山梨酯60、聚山梨酯65、聚山梨酯80、聚山梨酯85、聚氧乙烯十二烷基醚、聚氧乙烯十六烷基醚、聚氧乙烯山梨醇四油基醚、聚氧乙烯硬脂酸酯、聚氧乙烯蓖麻油或聚氧乙烯氢化蓖麻油或其混合物;优选地,本技术所述润湿剂选自十二烷基磺酸钠、十二烷基磺酸镁、十四烷基磺酸钠、十二烷基硫酸钠、十二烷基硫酸镁、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠或月桂酰肌氨酸钠或其混合物;更优选地,本技术所述润湿剂选自十二烷基硫酸钠或十二烷基硫酸镁或其混合物。
60、在本技术的部分实施方案中,所述润湿剂的量选自0.01~5.0%wt,优选0.01~4.0%wt、0.01~3.0%wt、0.02~2.5%wt、0.02~2.0%wt,更优选0.03~2.0%wt,进一步优选0.05~1.0%wt,更进一步优选0.1~0.5%wt;或者一些实施方案中,所述润滑剂的量选自0.01%wt、0.02%wt、0.03%wt、0.04%wt、0.05%wt、0.06%wt、0.07%wt、0.08%wt、0.09%wt、0.1%wt、0.2%wt、0.3%wt、0.4%wt、0.5%wt、0.6%wt、0.7%wt、0.8%wt、0.9%wt、1.0%wt、1.1%wt、1.2%wt、1.3%wt、1.4%wt、1.5%wt、1.6%wt、1.7%wt、1.8%wt、1.9%wt、2.0%wt、2.1%wt、2.2%wt、2.3%wt、2.4%wt、2.5%wt、2.6%wt、2.7%wt、2.8%wt、2.9%wt、3.0%wt、3.2%wt、3.4%wt、3.6%wt、3.8%wt、4.0%wt、4.2%wt、4.4%wt、4.6%wt、4.8%wt或5.0%wt,或者任意前述值作为端点构成的范围或其中的任意值。
61、在本技术的部分实施方案中,所述崩解剂选自羧甲基淀粉钠、干淀粉、微晶纤维素、羟乙基甲基纤维素、羧甲基纤维素钠、羧甲基纤维素钙、交联羧甲基纤维素钠、低取代羟丙甲基纤维素或交联聚维酮、十二烷基硫酸钠或十二烷基硫酸镁或其混合物;优选羧甲基淀粉钠、交联羧甲基纤维素钠或其混合物。
62、在本技术的部分实施方案中,所述崩解剂的量选自1.0~7.0%wt,优选1.0~6.5%wt、1.0~6.5%wt、1.0~6.0%wt、1.5~5.5%wt、1.5~5.0%wt或1.5~4.5%wt,更优选2.0~4.0%wt;或者一些实施方案中,所述崩解剂的量选自1.0%wt、1.5%wt、2.0%wt、2.5%wt、3.0%wt、3.5%wt、4.0%wt、4.5%wt、5.0%wt、5.5%wt、6.0%wt、6.5%wt、或者7.0%wt,或者任意前述值作为端点构成的范围或其中的任意值。
63、在本技术的部分实施方案中,所述润滑剂选自硬脂酸镁、胶体二氧化硅、滑石粉、聚乙二醇4000、聚乙二醇6000、硬脂酸、硬脂富马酸钠或十二烷基硫酸钠或其混合物,优选硬脂酸镁、胶体二氧化硅或其混合物。
64、在本技术的部分实施方案中,所述润滑剂的量选自0.1~3%wt,优选0.2~2.5%wt、0.3~2.0%wt或0.4~1.5%wt,更优选0.5~1%wt;或者一些实施方案中,所述润滑剂的量选自0.1%wt、0.2%wt、0.3%wt、0.4%wt、0.5%wt、0.6%wt、0.7%wt、0.8%wt、0.9%wt、1.0%wt、1.1%wt、1.2%wt、1.3%wt、1.4%wt、1.5%wt、1.6%wt、1.7%wt、1.8%wt、1.9%wt、2.0%wt、2.1%wt、2.2%wt、2.3%wt、2.4%wt、2.5%wt、2.6%wt、2.7%wt、2.8%wt、2.9%wt或3.0%wt,或者任意前述值作为端点构成的范围或其中的任意值。
65、在本技术的部分实施方案中,所述固体药物组合物包括50~95%wt的微晶纤维素、甘露醇、乳糖、预胶化淀粉或其混合物;优选包括60~95%wt、65~95%wt、70~95%wt、75~95%wt、80~95%wt、80~90%wt或85~95%wt的微晶纤维素、甘露醇、乳糖、预胶化淀粉或其混合物;更优选包括85~90%wt微晶纤维素、甘露醇、乳糖、预胶化淀粉或其混合物;进一步优选包括85~90%wt微晶纤维素、甘露醇或其混合物。在部分优选方案中,所述稀释剂选自微晶纤维素和甘露醇的混合物,其中微晶纤维素和甘露醇的重量比选自1:1~5:1,优选自1:1~4:1、1.2:1~3.5:1或1.2:1~3:1,更优选1.5:1~2.5:1;或者微晶纤维素和甘露醇的重量比选自1:1、1.2:1、1.5:1、1.8:1、1.9:1、2:1、2.2:1、2.5:1、2.8:1、3:1、3.2:1、3.5:1、3.8:1、4:1、4.2:1、4.5:1、4.8:1或5:1。
66、在本技术的部分实施方案中,基于固体药物组合物的量,所述固体药物组合物中稀释剂选自50~70%wt微晶纤维素和20~40%wt甘露醇,或者优选52~68%wt微晶纤维素和22~38%wt甘露醇、54~66%wt微晶纤维素和24~36%wt甘露醇、54~64%wt微晶纤维素和24~34%wt甘露醇、56~62%wt微晶纤维素和26~32%wt甘露醇,更优选56~60%wt微晶纤维素和26~30%wt甘露醇,进一步优选58.3%wt微晶纤维素和29.4%wt甘露醇。
67、在本技术的部分实施方案中,所述固体药物组合物包括1.0%~10%wt的羟丙甲纤维素(hpmc)、羧甲基纤维素(cmc)、羧甲基纤维素钠(cmc-na)、乙基纤维素(ec)、甲基纤维素(mc)、羟丙基纤维素(hpc)、l-hpc、聚乙烯吡咯烷酮或其混合物;优选包括1.0%~8.0%wt、1.0%~6.0%wt或1.0%~5.0%wt的羟丙甲纤维素(hpmc)、羧甲基纤维素(cmc)、羧甲基纤维素钠(cmc-na)、乙基纤维素(ec)、甲基纤维素(mc)、羟丙基纤维素(hpc)、l-hpc、聚乙烯吡咯烷酮或其混合物;更优选包括2.0~4.0%wt的羟丙甲纤维素(hpmc)、羧甲基纤维素(cmc)、羧甲基纤维素钠(cmc-na)、乙基纤维素(ec)、甲基纤维素(mc)、羟丙基纤维素(hpc)、l-hpc或其混合物;进一步优选包括2.0~4.0%wt的羟丙基纤维素、聚乙烯吡咯烷酮或其混合物。
68、在本技术的部分实施方案中,所述固体药物组合物包括0.01~5.0%wt的十二烷基磺酸钠、十二烷基磺酸镁、十四烷基磺酸钠、十二烷基硫酸钠、十二烷基硫酸镁、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠或月桂酰肌氨酸钠或其混合物;优选包括0.01~4.0%wt、0.01~3.0%wt、0.02~2.5%wt、0.02~2.0%wt的十二烷基磺酸钠、十二烷基磺酸镁、十四烷基磺酸钠、十二烷基硫酸钠、十二烷基硫酸镁、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠或月桂酰肌氨酸钠或其混合物;更优选包括0.03~2.0%wt的十二烷基磺酸钠、十二烷基磺酸镁、十四烷基磺酸钠、十二烷基硫酸钠、十二烷基硫酸镁、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠或月桂酰肌氨酸钠或其混合物;进一步优选包括0.03~2.0%wt的十二烷基硫酸钠或十二烷基硫酸镁或其混合物;进一步优选包括0.1~0.5%wt的十二烷基硫酸钠或十二烷基硫酸镁或其混合物。
69、在本技术的部分实施方案中,所述固体药物组合物包括1.0~7.0%wt的羧甲基淀粉钠或交联羧甲基纤维素钠或其混合物;优选包括1.0~6.5%wt、1.0~6.5%wt、1.0~6.0%wt、1.5~5.5%wt、1.5~5.0%wt或1.5~4.5%wt的羧甲基淀粉钠、交联羧甲基纤维素钠或其混合物;更优选包括2.0~4.0%wt的羧甲基淀粉钠、交联羧甲基纤维素钠或其混合物。
70、在本技术的部分实施方案中,所述固体药物组合物包括0.1~3%wt的硬脂酸镁、胶体二氧化硅或其混合物;优选0.2~2.5%wt、0.3~2.0%wt或0.4~1.5%wt的硬脂酸镁、胶体二氧化硅或其混合物;更优选0.5~1%wt的硬脂酸镁、胶体二氧化硅或其混合物。
71、在本技术的部分实施方案中,本技术所述固体药物组合物包括:
72、a)1~30%wt的式i化合物或式ii化合物;
73、50~95%wt的微晶纤维素、甘露醇、乳糖、预胶化淀粉或其混合物;
74、1.0%~10%wt的羟丙甲纤维素(hpmc)、羧甲基纤维素(cmc)、羧甲基纤维素钠(cmc-na)、乙基纤维素(ec)、甲基纤维素(mc)、羟丙基纤维素(hpc)、l-hpc、聚乙烯吡咯烷酮或其混合物;
75、0.01~5.0%wt的十二烷基磺酸钠、十二烷基磺酸镁、十四烷基磺酸钠、十二烷基硫酸钠、十二烷基硫酸镁、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠或月桂酰肌氨酸钠或其混合物;
76、1.0~7.0%wt的羧甲基淀粉钠或交联羧甲基纤维素钠或其混合物;
77、任选的0.1~3%wt的硬脂酸镁、胶体二氧化硅或其混合物;或
78、b)2~10%wt的式i化合物或式ii化合物;
79、75~95%wt的微晶纤维素、甘露醇或其混合物,其中微晶纤维素和甘露醇的混合物中微晶纤维素和甘露醇的重量比选自1.2:1~3.5:1;
80、1.0~6.0%wt羟丙基纤维素、聚乙烯吡咯烷酮或其混合物;
81、0.01~3.0%wt的十二烷基磺酸钠、十二烷基磺酸镁、十四烷基磺酸钠、十二烷基硫酸钠、十二烷基硫酸镁、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠或月桂酰肌氨酸钠或其混合物;
82、1.0~6.0%wt的羧甲基淀粉钠或交联羧甲基纤维素钠或其混合物;
83、任选的0.3~2.0%wt的硬脂酸镁、胶体二氧化硅或其混合物;或
84、c)3~8%wt的式i化合物或式ii化合物;
85、85~90%wt的微晶纤维素、甘露醇或其混合物,其中微晶纤维素和甘露醇的混合物中微晶纤维素和甘露醇的重量比选自1.5:1~2.5:1;
86、2.0~4.0%wt的羟丙基纤维素、聚乙烯吡咯烷酮或其混合物;
87、0.03~2.0%wt的十二烷基硫酸钠或十二烷基硫酸镁或其混合物;
88、2.0~4.0%wt的羧甲基淀粉钠、交联羧甲基纤维素钠或其混合物;
89、任选的0.5~1%wt的硬脂酸镁、胶体二氧化硅或其混合物;或
90、d)3.0~5.0%wt的式i化合物或式ii化合物;
91、50~70%wt的微晶纤维素;
92、20~40%wt的甘露醇;
93、2.0~6.0%wt的羟丙基纤维素;
94、0.05~0.2%wt的十二烷基硫酸钠;
95、2.0~6.0%wt的交联羧甲基纤维素钠;
96、任选的0.5~2%wt的硬脂酸镁;或
97、e)3.4~4.6%wt的式i化合物或式ii化合物;
98、55~60%wt的微晶纤维素;
99、26~32%wt的甘露醇;
100、2.0~4.0%wt的羟丙基纤维素;
101、0.1~0.5%wt的十二烷基硫酸钠;
102、2.0~4.0%wt的交联羧甲基纤维素钠;
103、任选的0.5~1%wt的硬脂酸镁;或
104、f)4.2%wt的式i化合物或式ii化合物;
105、58.3%wt的微晶纤维素;
106、29.4%wt的甘露醇;
107、4.0%wt的羟丙基纤维素;
108、0.1%wt的十二烷基硫酸钠;
109、3.0%wt的交联羧甲基纤维素钠;和
110、任选的1.0%wt的硬脂酸镁。
111、在本技术的一些实施方案中,所述式i化合物或式ii化合物以游离碱或盐酸盐形式存在。在本技术的一些典型的实施方案中,所述式i化合物或式ii化合物以游离碱形式存在。在本技术的一些典型的实施方案中,所述式i化合物或式ii化合物以一盐酸盐形式存在。
112、在本技术的一些实施方案中,所述固体药物组合物进一步包括包衣剂。在部分实施方案中,从水性膜包衣组合物形成包衣剂,其中水性膜包衣组合物包含成膜聚合物、作为载体的水和/或醇以及可选的一种或多种助剂,如膜包衣领域已知的助剂。在部分实施方案中,所述包衣剂选自由羟丙基甲基纤维素、羟丙基纤维素、甲基纤维素、乙基纤维素、羟乙基纤维素、醋酸邻苯二甲酸醋酸纤维素、乙基纤维素硫酸钠、羧甲基纤维素、聚乙烯吡咯烷酮、玉米蛋白和丙烯酸聚合物(例如,甲基丙烯酸/甲基丙烯酸酯共聚物,如甲基丙烯酸/甲基丙烯酸甲酯共聚物等),以及聚乙烯醇组成的组。在一些典型的实施方案中,包衣剂包含聚乙烯醇。
113、在本技术的一些实施方案中,所述固体药物组合物在30分钟内的溶出度不小于标示量的60%。在本技术的一些实施方案中,所述固体药物组合物在30分钟内的溶出度不小于标示量的80%。在本技术的一些实施方案中,所述固体药物组合物在ph1.0盐酸溶液、ph4.5醋酸盐缓冲液、ph6.8磷酸盐缓冲液或纯化水中,在30分钟内的溶出度不小于标示量的80%,优选不小于标示量的85%。在本技术的一些实施方案中,所述固体药物组合物在纯化水中,在30分钟内的溶出度不小于标示量的80%,优选不小于标示量的85%,进一步优选不小于标示量的90%。在本技术的一些典型的实施方案中,所述固体药物组合物在纯化水中,在15分钟内的溶出度不小于标示量的85%。
114、在本技术的一些实施方案中,所述固体药物组合物的剂型可选自散剂、颗粒剂、片剂、胶囊、丸剂、微丸剂、分散体或可吸入粉末剂,优选片剂或胶囊,进一步优选片剂。
115、在本技术的一些实施方案中,所述固体药物组合物为单位剂量药物组合物,并且每个单位剂量的组合物中式i化合物或式ii化合物的量为5mg~20mg。在本技术的一些实施方案中,每个单位剂量的组合物中式i化合物或式ii化合物的量为5mg、8mg、10mg、12mg、15mg、18mg或20mg,或者任意前述值作为端点构成的范围或其中的任意值。
116、另一方面,本技术提供一种式i化合物或式ii化合物的固体药物组合物的制备方法。本技术可采用湿法制粒制备固体颗粒。湿法制粒过程中视需要添加与式i化合物或式ii化合物相容性良好的其他辅料,其中湿法制粒可选择在湿法制粒机(混合制粒)或者流化床(流化床制粒)中进行,优选流化床制粒。在湿法制粒时,式i化合物或式ii化合物可以作为固体添加物与其他添加物一起加入到预混物中或者制备成溶液(混悬液或溶清溶液)供制粒使用。优选制备成混悬液在制粒阶段引入到颗粒中。
117、在本技术的一些实施方案中,式i化合物或式ii化合物的固体药物组合物的制备方法包括以下步骤:
118、1)将稀释剂、崩解剂混合,所得混合物备用;将式i化合物或式ii化合物、黏合剂、润湿剂与水混合,得到混合溶液;
119、2)将步骤1)所得混合溶液喷雾到步骤1)所得混合物上,并经流化床制粒,烘干,整粒,得到整粒后的干颗粒;
120、3)任选地,将整粒后的干颗粒、润滑剂混合,压片;
121、所述步骤1)的混合溶液为混悬液或溶清溶液,优选混悬液;
122、所述稀释剂、黏合剂、润湿剂、崩解剂和润滑剂如前所述。
123、在本技术的一些实施方案中,所述步骤2)中,进风温度选自35~90℃,优选45~85℃,更优选55~80℃。在本技术的一些实施方案中,所述步骤2)中,雾化压力选自400~1200mbar,优选500~1100mbar,更优选600~1000mbar。在本技术的一些实施方案中,所述步骤2)中,物料温度选自20~40℃,优选25~35℃。在本技术的一些实施方案中,所述步骤2)中,整粒筛网孔径φ0.4~1.5mm,优选0.5~1.4mm,更优选0.6~1.2mm。
124、另一方面,本技术提供所述式i化合物或式ii化合物的固体药物组合物在制备治疗两面神激酶介导的疾病的药物中的用途。
125、另一方面,本技术提供用于治疗两面神激酶介导的疾病的所述式i化合物或式ii化合物的固体药物组合物。
126、另一方面,本技术提供所述式i化合物或式ii化合物的固体药物组合物在治疗两面神激酶介导的疾病的用途。
127、另一方面,本技术提供治疗两面神激酶介导的疾病的方法,所述方法包括给予受试者治疗有效量的所述式i化合物或式ii化合物的固体药物组合物。
128、在本技术的一些实施方案中,所述两面神激酶介导的疾病包括但不限于肿瘤。在一些实施方案中,本技术所述肿瘤为淋巴瘤或白血病。本技术所述的淋巴瘤包括但不限于霍奇金病(hodgkins disease)或非霍奇金淋巴瘤(non-hodgkins lymphoma),所述非霍奇金淋巴瘤包括但不限于b-细胞淋巴瘤(b-cell lymphoma)或t-细胞淋巴瘤(t-celllymphoma)。本技术所述的白血病包括但不限于急性淋巴细胞白血病(acutelymphoblastic leukemia)、慢性淋巴细胞白血病(chronic lymphocyticleukemia)、急性粒细胞白血病(acute myeloid leukemia)、慢性粒细胞白血病(chronic myelocyticleukemia)。
129、在本技术的一些实施方案中,所述两面神激酶介导的疾病为骨髓增殖性肿瘤。
130、在本技术的部分实施方案中,所述骨髓增殖性肿瘤包括真性红细胞增多症、血小板增多症、或骨髓纤维化。其中,所述真红细胞增多症包括对羟基脲和/或干扰素耐药和/或不耐受的真性红细胞增多症。所述血小板增多症包括原发性血小板增多症、对羟基脲和/或干扰素耐药和/或不耐受的原发性血小板增多症。所述骨髓纤维化包括原发性骨髓纤维化、真性红细胞增多症后骨髓纤维化(post-polycythemia vera myelofibrosis,ppv-mf)、原发性血小板增多症后骨髓纤维化(post-essential thrombocythemia myelofibrosis,pet-mf)。
131、在本技术的部分实施方案中,所述骨髓增殖性肿瘤及其包括的疾病包括低危、中危、高危骨髓增殖性肿瘤。例如,真性红细胞增多症可分为低危、高危真性红细胞增多症;血小板增多症可分为极低危、低危、中危、高危血小板增多症;骨髓纤维化可分为低危、中危和/或高危骨髓纤维化。在一些实施方案中,所述真性红细胞增多症为中危和/或高危真性红细胞增多症,所述血小板增多症为中危和/或高危血小板增多症,所述骨髓纤维化为中危和/或高危骨髓纤维化,所述原发性血小板增多症为中危和/或高危原发性血小板增多症。例如,所述原发性骨髓纤维化、真性红细胞增多症后骨髓纤维化、原发性血小板增多症后骨髓纤维化都属于相应的中高危骨髓纤维化。本技术中,所述骨髓增殖性肿瘤的诊断标准和风险分级(risk stratification,例如极低危、低危、中危、高危)可参考本领域通用的原则,可参考“nccn guidelines version 2.2019 myeloproliferative neoplasms”,例如可参照动态国际预后评分系统(dipss,dynamic international prognostic scoringsystem)进行评估。在一些实施方案中,采用who 2016标准和iwg-mrt标准作为诊断依据标准。
132、本技术中,所述的骨髓增殖性肿瘤包括基因突变的骨髓增殖性肿瘤,所述的突变型基因包括但不限于jak2(例如jak2 v617f)、mpl、calr、asxl1/srsf2/idh1/21、jak2exon12、tp53、sh2b3/idh2/u2af1/sf3b1/ezh2/tp53、mpl w515l/k、calr type 1/type 1-like、三阴性(jak2、mpl、和calr无突变)、asxl1、ezh2、idh1/2、srsf2、sf3b1、calr/asxl1、tp53、或u2af1 q157。
133、在本技术的部分实施方案中,式i化合物或式ii化合物以自由碱形式给药。在本技术的部分实施方案中,式i化合物或式ii化合物以自由碱的结晶形式给药。在本技术的部分方案中,式ii化合物的自由碱结晶可选自wo2017215630公开的晶型a或晶型b。
134、在本技术的部分实施方案中,式ii化合物以盐酸盐形式给药。在本技术的部分实施方案中,式ii化合物的盐酸盐可选自wo2017101777公开的盐酸盐。
135、本技术的化合物、其立体异构体、或其药学上可接受的盐可通过多种途径给药,所述途径包括但不限于以下途径:口服、胃肠外、腹膜内、静脉内、动脉内、透皮、舌下、肌内、直肠、透颊、鼻内、经吸入、阴道、眼内、经局部给药、皮下、脂肪内、关节内或鞘内。在一个特定的方案中,通过口服给药。
136、本技术的化合物、其立体异构体、或其药学上可接受的盐、或其固体药物组合物的量可根据疾病的严重程度、疾病的响应、任何治疗相关的毒性、受试者的年龄和健康状态确定,例如可以根据受试者血常规化验结果确定,所述血常规化验结果包括血小板计数、中性粒细胞计数、或血红蛋白浓度等。在部分实施方案中,给予本技术的化合物、其立体异构体、或其药学上可接受的盐、或其固体药物组合物的日剂量为1mg至100mg。在部分实施方案中,给予本技术的化合物、其立体异构体、或其药学上可接受的盐、或其固体药物组合物的日剂量可选自1mg、5mg、10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、或100mg,或者任意前述值作为端点构成的范围或其中的任意值,例如1mg至90mg、5mg至80mg、10mg至70mg、15mg至60mg、20mg至50mg等。在部分特定实施方案中,给予本技术的化合物、其立体异构体、或其药学上可接受的盐、或其固体药物组合物的日剂量可选自1mg至50mg、5mg至50mg、5mg至45mg、5mg至40mg、10mg至35mg、10mg至30mg。在部分特定实施方案中,给予本技术的化合物、其立体异构体、或其药学上可接受的盐、或其固体药物组合物的日剂量可选自1mg、2mg、5mg、8mg、10mg、12mg、15mg、18mg、20mg、22mg、25mg、28mg、30mg、32mg、35mg、38mg、40mg、42mg、45mg、48mg或50mg,或者任意前述值作为端点构成的范围或其中的任意值,例如2mg至50mg、10mg至40mg、5mg至30mg、5mg至20mg等。
137、给予本技术的化合物、其立体异构体、或其药学上可接受的盐、或其固体药物组合物可以每日施用一次或多次。在部分实施方案中,每天一次或两次给予本技术的化合物、其立体异构体、或其药学上可接受的盐、或其固体药物组合物。给予本技术的化合物、其立体异构体、或其药学上可接受的盐也可以单剂量形式给药。在一个实施方案中,以单剂量每天给药一次或两次。在一个实施方案中,以单剂量的口服固体制剂每天给药一次或两次。
138、给药的方法可根据药物的活性、毒性以及受试者的耐受性等因素综合确定。在部分实施方案中,以间隔给药的方式给予本技术的化合物、其立体异构体、或其药学上可接受的盐。
139、给予本技术的化合物、其立体异构体、或其药学上可接受的盐、或其固体药物组合物可以采用间隔给药。所述间隔给药包括给药期和停药期,在给药其内可以每天一次、两次或多次给予本技术的化合物、其立体异构体、或其药学上可接受的盐、或其固体药物组合物。间隔给药可以根据疾病的严重程度、疾病的响应、任何治疗相关的毒性、受试者的年龄和健康状态确定,例如可以根据受试者/受试者血常规化验结果确定,所述血常规化验结果包括血小板计数、中性粒细胞计数、或血红蛋白浓度等。
140、技术效果
141、本技术所述化合物可有效缩小受试者脾脏。本技术所述化合物对骨髓增殖性肿瘤具有良好的治疗效果,并且具有更优良的安全性。
142、本技术所述的固体药物组合物具有优良的稳定性和溶出性质,适合临床使用。进一步地,本技术的片剂固体药物组合物具有快速释放的性质,其30分钟内的溶出度不小于标示量的80%。
143、定义和说明
144、除非另有说明,本技术中所用的术语具有下列含义。一个特定的术语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照本领域普通的含义去理解。当本技术中出现商品名时,意在指代其对应的商品或其活性成分。
145、术语“药学上可接受的”,是针对那些化合物、材料、组合物和/或剂型而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
146、术语“药学上可接受的盐”,包括碱根离子与自由酸形成的盐或酸根离子与自由碱形成的盐,例如包括盐酸盐、氢溴酸盐、硝酸盐、硫酸盐、磷酸盐、甲酸盐、乙酸盐、三氟乙酸盐、富马酸盐、草酸盐、马来酸盐、柠檬酸盐、琥珀酸盐、甲磺酸盐、苯磺酸盐或对甲基苯磺酸盐,优选盐酸盐、氢溴酸盐、硫酸盐、甲酸盐、乙酸盐、三氟乙酸盐、富马酸盐、马来酸盐、甲磺酸盐、对甲基苯磺酸盐、钠盐、钾盐、铵盐、氨基酸盐等。本技术中,当形成药学上可接受的盐时,所述自由酸与碱根离子的摩尔量之比为约1:0.5~1:5,优选1:0.5、1:1、1:2、1:3、1:4、1:5、1:6、1:7或1:8。本技术中,当形成药学上可接受的盐时,所述自由碱与酸根离子的摩尔量之比为约1:0.5~1:5,优选1:0.5、1:1、1:2、1:3、1:4、1:5、1:6、1:7或1:8。
147、如本技术所用,本技术式i化合物或者式ii化合物如果具有例如至少一个碱性中心,则其可以形成酸加成盐。如果需要的话,还可以形成具有另外存在的碱性中心的相应的酸加成盐。具有至少一个酸性基团(例如cooh)的化合物还可以与碱形成盐。如果化合物例如既包含羧基又包含氨基,则还可以形成相应的内盐。
148、本技术化合物可以是不对称的,例如,具有一个或多个立体异构体。除非另有说明,所有立体异构体都包括,如对映异构体和非对映异构体。本技术的含有不对称碳原子的化合物可以以光学活性纯的形式或外消旋形式被分离出来。光学活性纯的形式可以从外消旋混合物拆分,或通过使用手性原料或手性试剂合成。
149、术语“受试者”是哺乳动物。在部分实施方案中,所述受试者是人。
150、术语“药物组合物”是指一种或多种本技术的化合物或其盐与药学上可接受的辅料组成的混合物。药物组合物的目的是有利于对受试者给予本技术的化合物。
151、术语“治疗”意为将本技术所述化合物或药物组合物进行给药以改善或消除疾病或与所述疾病相关的一个或多个症状,且包括:
152、(i)抑制疾病或疾病状态,即遏制其发展;
153、(ii)缓解疾病或疾病状态,即使该疾病或疾病状态消退。
154、术语“有效量”意指(i)治疗特定疾病、病况或障碍,(ii)减轻、改善或消除特定疾病、病况或障碍的一种或多种症状,或(iii)预防或延迟本文中所述的特定疾病、病况或障碍的一种或多种症状发作的本技术化合物的用量。构成“治疗有效量”的本技术化合物的量取决于该化合物、疾病状态及其严重性、给药方式以及待被治疗的哺乳动物的年龄而改变,但可例行性地由本领域技术人员根据其自身的知识及本公开内容而确定。
155、本技术中,所述“药学上可接受的盐”包括但不限于与无机酸例如盐酸、氢溴酸、硫酸、硝酸或磷酸形成的酸加成盐;或者与有机酸例如甲酸、乙酸、三氟乙酸、琥珀酸、苹果酸、马来酸、富马酸、草酸、酒石酸、柠檬酸、甲磺酸、苯磺酸、对甲或苯磺酸等形成的酸加成盐;或者与酸性氨基酸例如天冬氨酸或谷氨酸形成的酸加成盐。所述溶剂合物包括但不限于水合物形式。
156、本技术中,所述药物组合物中的式i化合物式ii化合物的含量以其游离碱(freebase)形式计算。
157、本技术所述稀释剂亦可称为填充剂,主要分为水溶性稀释剂、水不溶性稀释剂、直接压片用稀释剂等几类,包括但不限于淀粉、蔗糖、糊精、乳糖、预胶化淀粉微晶纤维素、无机盐类和/或糖醇类。所述乳糖包括但不限于无水乳糖、一水乳糖或其混合物。
158、本技术所述黏合剂按照来源可以分为天然黏合剂和合成黏合剂。黏合剂按照用法可以分为做成水溶液或胶浆才具黏性的黏合剂、干燥状态下也具有黏性的干燥粘合剂和经非水溶剂溶解或湿润后具有黏性的黏合剂。黏合剂包括但不限于淀粉浆、纤维素衍生物、聚维酮、明胶、聚乙二醇、蔗糖溶液和/或海藻酸钠溶液。
159、本技术所述润湿剂为表面张力小能与水混溶的液体和/或表面活性剂,所述表面活性剂包括阴离子表面活性剂、阳离子表面活性剂、两性离子表面活性剂和/或非离子型表面活性剂。所述阴离子表面活性剂包括但不限于烷基苯磺酸盐、烷基磺酸酯盐、烷基磺酸盐、烷基硫酸盐、含氟脂肪酸盐、聚硅氧烷和/或脂肪醇硫酸盐。所述阳离子表面活性剂包括但不限于季铵化物、烷基吡啶盐和/或胺盐。所述两性离子表面活性剂包括但不限于卵磷脂、氨基酸型和/或甜菜碱型,所述非离子表面活性剂包括但不限于烷基葡糖苷(apg)、脂肪酸甘油酯、脂肪酸山梨坦(司盘)、聚山梨酯(吐温)、聚氧乙烯类和/或泊洛沙姆。
160、本技术所述崩解剂包括但不限于淀粉及其衍生物、纤维素类、表面活性剂、泡腾崩解剂、胶类、海藻酸盐类和/或离子交换树脂类。
161、本技术所述润滑剂广义上包括三种辅料:润滑剂(狭义)、助流剂和抗黏剂。本技术所述润滑剂包括但不限于硬脂酸类、胶体二氧化硅、滑石粉、氢化植物油和/或聚乙二醇类。
162、本技术所述某种成分(包括活性物质或辅料)的量“%wt”指该成分的重量占固体药物组合物总重量(其中式i化合物式ii化合物的重量以其游离碱形式计)的百分比。所述固体药物组合物的总重量不包括包衣剂的重量。
163、本技术所述的固体药组合物或相应剂型的制备方法可依据本领域公知的方法进行。具体制备方法可包括粉碎、混合、筛分、制粒、填充、压片等步骤,根据实际情况选择所需步骤,以及实施具体步骤的方法或设备。例如,粉碎步骤可采用研钵、球磨机、滚压机、冲击式粉碎机、锤击式粉碎机和/或气流粉碎机进行;混合步骤可采用搅拌混合、研磨混合和/或过筛混合;过筛步骤可采用摇动筛和/或振荡筛。或可参见崔福德等主编的《药剂学》(第6版或第7版,人民卫生出版社)。
164、术语“或其混合物”意指“两种以上的混合物”,例如“所述稀释剂选自微晶纤维素、甘露醇、乳糖、蔗糖、淀粉、预胶化淀粉、糊精或其混合物”即“所述稀释剂选自微晶纤维素、甘露醇、乳糖、蔗糖、淀粉、预胶化淀粉、糊精中的一种或两种以上的混合物”。
165、术语“标示量”在药物组合物领域,指该单位剂量的制剂中规定的主药含量。
166、本技术的式i化合物和式ii化合物可以参照wo2016095805或wo2017215627中的制备方法制备得到。
- 还没有人留言评论。精彩留言会获得点赞!