一种多肽类药物口服递送组合物的制作方法
本发明涉及多肽及其口服递送,尤其涉及一种多肽类药物口服递送组合物,特别是一种适用于glp-1受体激动剂、glp-1受体相关多靶点共激动剂的口服递送药物组合物。
背景技术:
1、现代社会生活中,糖尿病及其并发症逐渐成为继心脑血管疾病和癌症之后又一具有严重危害的慢性非传染性疾病。糖尿病主要分为i型糖尿病、ii型糖尿病和其他特殊类型的糖尿病。患者所分泌的胰岛素不能有效发挥作用为ii型糖尿病的致病原因,且ii型糖尿病所占患病比例最高,达90%以上。
2、目前,临床上使用的治疗ii型糖尿病的药物主要有双胍类、磺酰脲类、噻唑烷二酮类、dpp-4受体抑制剂、sglt-2受体抑制剂和长效胰高血糖样肽-1衍生物(glp-1衍生物)。而其中,glp-1衍生物由于具有与胰岛素类似的降糖效果,且同时几乎无低血糖风险、兼具减重效果和心血管保护功能,正逐渐成为ii型糖尿病的主要治疗药物和研究热点。
3、索马鲁肽(semaglutide)是由诺和诺德公司研发的长效glp-1衍生物,该药物只需要进行每周一次的皮下注射给药,目前已在多国获批上市。从结构上看,索马鲁肽是将glp-1(7-37)链上第26位lys接上aeea、谷氨酸和十八烷脂肪二酸侧链,并将其中第8位氨基酸采用非天然氨基酸氨基异丁酸(aib)取代原ala,34位的lys替换成arg所得。与利拉鲁肽相比,索马鲁肽的脂肪链更长,疏水性增加,但是索马鲁肽经过短链的aeea修饰,亲水性大大增强。aeea修饰后不但可以与白蛋白紧密结合,掩盖dpp-4酶水解位点,还能降低肾排泄,延长生物半衰期,达到长循环的效果。索马鲁肽在多个临床试验研究已经证明联合不同的口服降糖药可以有效控制血糖,并能够使患者减轻体重、减少收缩压及改善胰岛β细胞功能。
4、目前,索马鲁肽药物的剂型有两种,分别为注射液和口服剂,注射液为每周皮下注射一次,这对于需要长期治疗甚至终身治疗的糖尿病患者来说是个痛苦,不仅顺应性差,还容易导致感染,给患者带来身体和心理上的负担。相较于注射剂,口服剂型的疗效、安全性、适用人群、药物相互作用方面均有较大优势,会大大增加患者的依从性。但是,从结构上看,索马鲁肽是glp-1(7-37)链上8位的ala替换成aib,34位的lys替换成arg,26位的lys接上十八烷酸脂肪链,即索马鲁肽的结构内存在较长的脂肪链,疏水性增加,口服给药的溶出行为难以得到保证。
5、cn201611150925.x公开了一种含索马鲁肽的口服缓释制剂及其制备方法,所述药物活性成分为glp-1类似物索马鲁肽,另外还包括与索马鲁肽具有协同作用的磺脲类、双胍类或噻唑烷二酮类降糖药物,将此药物活性成分包裹到缓释载体材料中,制备成缓释微球,然后与药学上可接受的辅料混合压制成具有一定形状的药片,供口服使用,从而起到长效缓释作用。其不足之处在于,索马鲁肽后续服用过程中容易被过早分解,其稳定性难以保证,极易造成索马鲁肽浪费。
6、索马鲁肽具有低口服生物利用度,在口服给药后,只能在血液中检测到极少量甚至无法检测到,因此需要一种优化的用于口服给药的药物组合物,使索马鲁肽具有较优的口服生物利用度。
技术实现思路
1、为了解决上述技术问题,本发明提供了一种多肽类药物口服递送组合物。本发明提供的口服递送组合物具备优异的口服生物利用度,应用前景广阔。
2、本发明中,术语“glp-1受体激动剂”可被定义为与受体结合并引发天然配体典型的响应的化合物。完全激动剂可被定义为引发与天然配体相同量级的响应的激动剂(参见,例如,“principles of biochemistry”,al lehninger,dl nelson,mmcox,第二版,worthpublishers,1993,第763页)。因此,例如,“glp-1受体激动剂”可被定义为能够与glp-1受体结合并能够将其活化的化合物。
3、本发明中,术语snac指n-[8-(2-羟基苯甲酰基)氨基]辛酸钠(sodium n-[8-(2-hydroxybenzoyl)amino]caprylate),是一种低毒性口服渗透促进剂。
4、本发明中,术语“索马鲁肽”指的是n-ε26-[2-(2-{2-[2-(2-{2-[(s)-4-羧基-4-(17-羧基十七酰基氨基)丁酰基氨基]乙氧基}乙氧基)乙酰基氨基]乙氧基}乙氧基)乙酰基][aib8arg34]glp-1(7-37)。
5、本发明中,有关肽(例如glp-1或胰岛素)的术语“衍生物”表示经化学修饰(如共价修饰等)的肽或其类似物。典型的修饰是酰胺、糖类、烷基、酰基、酯等。glp-1(7-37)衍生物的实例是n-ε26-((4s)-4-(十六烷酰基氨基)-羧基-丁酰基)[arg34lys26]glp-1-(7-37)。
6、本发明中,术语“辅料”宽泛地指除活性治疗成分(在本领域中也称为原料药或活性药物成分)以外的任何组分。辅料可以是惰性物质,就本身基本上不具有任何治疗和/或预防作用的意义而言。辅料可为多种不同的用途,例如,作为增强剂、吸收增强剂、媒介物、填充剂(也称为稀释剂)、粘合剂、润滑剂、助流剂、崩解剂、结晶阻滞剂、酸化剂、碱化剂、防腐剂、抗氧化剂、缓冲剂、螯合剂、络合剂、表面活性剂、乳化剂和/或增溶剂、甜味剂、润湿剂、稳定剂、着色剂、调味剂,和/或改善活性物质的给药和/或吸收。
7、本发明中,术语“润滑剂”是指如硬脂酸、硬脂酸镁、硬脂酸钙或其它硬脂酸金属盐、滑石、蜡、甘油酯、轻质矿物油、山萮酸甘油酯、氢化植物油、硬脂酰富马酸钠、聚乙二醇、烷基硫酸盐或苯甲酸钠。
8、本发明中,术语“填充剂”,如乳糖(例如喷雾干燥的乳糖、α-乳糖、β-乳糖、各种等级的)、微晶纤维素(各种等级的)、其它纤维素衍生物、蔗糖、山梨醇、甘露醇、糊精、葡聚糖、麦芽糖糊精、右旋糖、果糖、高岭土、甘露糖醇、山梨糖醇、蔗糖、糖、淀粉或改性淀粉(包括马铃薯淀粉、玉米淀粉和大米淀粉)、磷酸钙(例如碱性磷酸钙、磷酸氢钙、水合磷酸二钙)、硫酸钙、碳酸钙或藻酸钠。
9、本发明中,术语“粘合剂”,如乳糖(例如喷雾干燥的乳糖、α-乳糖、β-乳糖、各种等级的)、微晶纤维素(各种等级的)、羟丙基纤维素、l-羟丙基纤维素(低取代的)、羟丙甲纤维素(hpmc,例如methocel e、f和k,shin-etsu,ltd的metolose sh,例如4,000cps等级的methocel e和metolose 60sh,4,000cps等级的methocel f和metolose 65sh,4,000、15,000和100,000cps等级的methocel k;以及4,000、15,000、39,000和100,000等级的metolose 90sh)、甲基纤维素聚合物(例如methocel a、methocel a4c、methocel a15c、methocel a4m)、羟乙基纤维素、乙基纤维素、羧甲基纤维素钠、其它纤维素衍生物、蔗糖、糊精、麦芽糖糊精、淀粉或变性淀粉(包括马铃薯淀粉、玉米淀粉和大米淀粉)、乳酸钙、碳酸钙、阿拉伯胶、藻酸钠、琼脂、角叉菜胶、明胶、瓜尔胶、果胶、peg或聚维酮。
10、本发明中,术语“生物利用度”是指原料药(如glp-1肽或其衍生物)的施用剂量中到达体循环保持不变的比例。按照定义,当静脉内施用原料药时,其生物利用度为100%。但是,当通过其它途径(如口服)施用原料药时,其生物利用度会下降(由于降解和/或不完全吸收和首过代谢)。在计算用于原料药非静脉内给药途径的剂量时,关于生物利用度的知识非常重要。在口服和静脉内给药后,绘制血浆浓度对时间的曲线图。绝对生物利用度是(auc-口服除以剂量)除以(auc-静脉内除以剂量)。
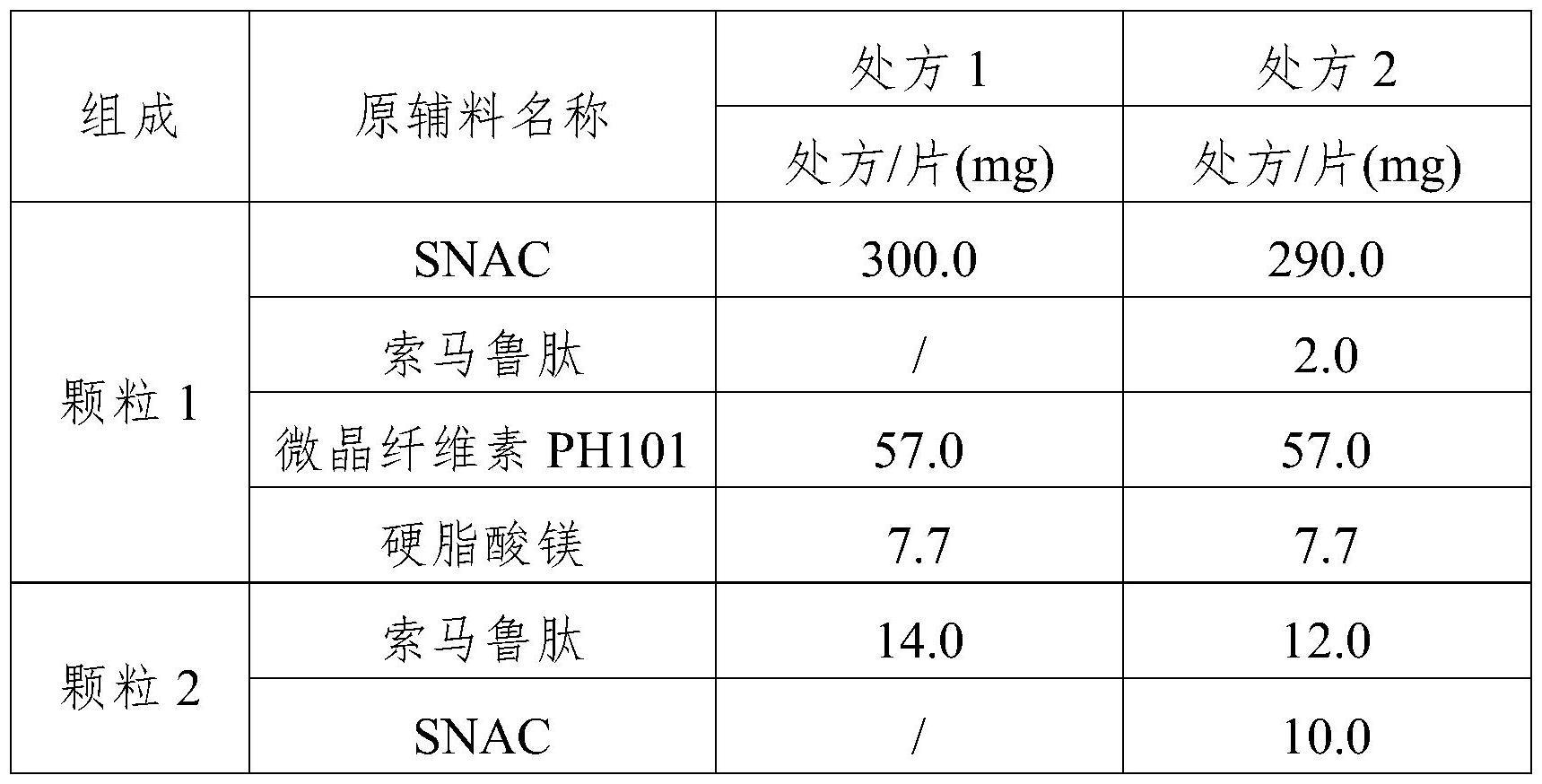
11、第一方面,本发明提供了一种glp-1受体激动剂的口服给药的固体组合物,所述固体组合物的组成成分包括第一类型颗粒和第二类型颗粒,进一步地,所述组合物还包括上述颗粒外添加的药学上可接受的辅料,所述辅料优选为硬脂酸镁,其中,所述颗粒可以为:
12、(1)第一类型颗粒包含280-300mg的snac和5-20%的glp-1受体激动剂,所述第二类型颗粒包含80-95%的glp-1受体激动剂和5-20mg的snac;所述glp-1受体激动剂的总量为2-25mg,优选为2-20mg、3-20mg、3-15mg、2mg、3mg、5mg、7mg、9mg、12mg、14mg、15mg、20mg。
13、优选地,所述第一类型颗粒中glp-1受体激动剂占多肽总量的5-20%,5-15%或10-15%;所述第二类型颗粒中glp-1受体激动剂占总量的80-95%,85-95%或85-90%。或,所述第一类型颗粒中glp-1受体激动剂占多肽总量的5-15%,所述第二类型颗粒中glp-1受体激动剂占总量的85-95%;或所述第一类型颗粒中glp-1受体激动剂占多肽总量的10-15%,所述第二类型颗粒中glp-1受体激动剂占总量的85-90%。
14、进一步地,所述第一类型颗粒中snac的含量为290mg或300mg;所述第二类型颗粒中snac的含量为10mg或20mg。优选地,所述第一类型颗粒中snac的含量为290mg;所述第二类型颗粒中snac的含量为10mg。或者,所述第一类型颗粒中snac的含量为300mg;所述第二类型颗粒中所述snac的含量为20mg。
15、进一步地,所述第一类型颗粒中snac的含量为290mg,glp-1激动剂的含量为0.5mg;所述第二类型颗粒中snac的含量为10mg,glp-1激动剂的含量为2.5mg。优选地,所述第一类型颗粒中snac的含量为290mg,glp-1激动剂的含量为1mg;所述第二类型颗粒中snac的含量为10mg,glp-1激动剂的含量为6mg。或者,所述第一类型颗粒中snac的含量为290mg,glp-1激动剂的含量为2mg;所述第二类型颗粒中snac的含量为10mg,glp-1激动剂的含量为12mg。
16、优选地,所述第一类型颗粒进一步包含润滑剂,例如硬脂酸镁;和/或填充剂,例如微晶纤维素。所述第二类型颗粒进一步包含填充剂,如微晶纤维素;和/或粘合剂,例如聚维酮。进一步地,除上述第一类型颗粒和第二类型颗粒外,所述组合物还包含颗粒外添加的硬脂酸镁。优选地,本部分中所述的组合物中,所述第一类型颗粒进一步包含硬脂酸镁和微晶纤维素;所述第二类型颗粒进一步包含微晶纤维素和聚维酮。优选地,微晶纤维素为微晶纤维素ph101,聚维酮为聚维酮k90。
17、优选地,所述第一类型颗粒中微晶纤维素ph101的含量为20-60mg,所述硬脂酸镁的含量为5-10mg;所述第二类型颗粒中所述微晶纤维素ph101含量为5-30mg,所述聚维酮k90含量为5-10mg;所述颗粒外硬脂酸镁量为1-5mg。优选地,所述第一类型颗粒中微晶纤维素ph101的含量为57mg,所述硬脂酸镁的含量为7.7mg;所述第二类型颗粒中所述微晶纤维素ph101含量为23mg,所述聚维酮k90含量为8mg;所述颗粒外硬脂酸镁量为2mg。或者,优选地,所述第一类型颗粒中微晶纤维素ph101的含量为37mg,所述硬脂酸镁的含量为7.7mg;所述第二类型颗粒中所述微晶纤维素ph101含量为13mg,所述聚维酮k90含量为8mg;所述颗粒外硬脂酸镁量为2mg。
18、第二方面,本发明提供了第一方面所述的口服给药固体组合物的制备方法,所述制备方法包括:
19、(1)将配方量的glp-1受体激动剂和snac与任选的润滑剂和填充剂混合并制粒,得到第一类型颗粒;
20、(2)将配方量的glp-1受体激动剂和snac与任选的填充剂和粘合剂混合并制粒,得到第二类型颗粒;
21、(3)将步骤(1)、(2)得到的颗粒以及任选的润滑剂混合,得到所述口服给药固体组合物。
22、优选地,所述步骤(1)为:硬脂酸镁和snac利用等量递增法混合得到第一混合物;索马鲁肽与微晶纤维素混合后过筛,并与微晶纤维素等体积的第一混合物混合后再与剩余量的第一混合物混合,制粒,得到所述第一类型颗粒。
23、优选地,所述步骤(2)为:索马鲁肽和聚维酮分别过筛,然后将索马鲁肽、聚维酮、snac和微晶纤维素混合、压片、粉碎、过筛,得到所述第二类型颗粒。
24、优选地,所述步骤(3)为:将步骤(1)、(2)得到的颗粒混合后再与硬脂酸镁混合,压片,得到所述口服给药固体组合物。
25、本发明实施例提供的技术方案与现有技术相比具有如下优点:
26、本发明的口服递送药物组合物能够更加有效的口服递送glp-1衍生物或glp-1相关的多靶点激动剂,具备优异的口服生物利用度,应用前景广阔。
- 还没有人留言评论。精彩留言会获得点赞!